基于DCE-MRI与DWI评估直肠癌局部浸润、淋巴结转移和环周切缘的价值研究
杨华林,汪飞,刘骏,杨擎
(安庆市立医院医学影像科磁共振室,安徽 安庆 246003)
直肠癌是一种以血便、局限性腹痛腹泻等为主要症状的消化道恶性肿瘤,在我国发病率和病死率较高,外科手术切除是临床根治直肠癌的重要治疗方法[1]。术前对患者的局部浸润、淋巴结转移(LNM)及环周切缘(CRM)状态进行准确评估,有利于改善患者预后,提高长期生存率[2]。MRI是临床常用的影像学检查手段,动态增强MRI(DCE-MRI)可评估组织血流动力学特征,对恶性肿瘤的鉴别及诊断具有积极作用;扩散加权成像(DWI)可反映肿瘤微环境,提高恶性肿瘤的诊断准确性[3-4]。目前有关DCE-MRI、DWI在直肠癌诊断中的应用多集中于临床分期、LNM等[5],有关二者在评估直肠癌CRM中的应用价值尚未达成一致。本研究旨在通过DCE-MRI、DWI对直肠癌局部浸润、LNM和CRM进行评价。
1 资料与方法
1.1 一般资料
选取2019年1月至2023年1月安庆市立医院经病理确诊的62例直肠癌患者为研究对象。纳入标准:(1)符合直肠癌的相关诊断标准[6];(2)均接受肿瘤根治性切除治疗,术后经病理检查确诊;(3)术前1周完成MRI检查,影像学资料完整;(4)MRI检查前未接受放化疗、免疫治疗。排除标准:(1)合并其他恶性肿瘤者;(2)存在MRI检查禁忌症者;(3)合并严重肝肾功能障碍者;(4)临床资料不完整者;(5)存在盆腔手术史者。患者男性35例,女性27例,年龄(65.34±10.61)岁;腺癌43例,黏液腺癌16例,腺癌合并黏液腺癌3例;肿瘤最大径(3.45±1.13)cm。
1.2 方法
1.2.1 MRI检查 检查前嘱咐患者排空大小便,常规禁食禁水6 h以上;检查时取仰卧位,头先进,扫描过程中嘱患者自然呼吸。采用skyra MRI 3.0T磁共振扫描仪,腹、盆腔专用8通道体部相控阵线圈,行常规序列轴位、矢状位及冠状位平扫,DCE序列和DWI序列扫描。扫描序列参数:(1)T1WI:TR 600 ms,TE 19 ms,层厚4.0 mm,FOV 240×240。(2)T2WI:TR 5 000 ms,TE 84 ms,层厚4.0 mm,FOV 240×240。(3)DCE-MRI(正交轴位):采用T1-vibe序列3D双翻转角扫描(2、15°的翻转角),扫描参数:TR 3.8 ms,TE 1.1 ms,层厚4.0 mm,层间距0 mm,矩阵260×260,激励次数1;第5个时相扫描时注射对比剂(钆喷酸葡胺注射液,0.2 mmol/kg),注射速度3 mL/s;共扫描40个时相,单个时相扫描时间8 s,采集时间共320 s。(4)DWI:采用EPI序列,扫描参数:TR 5 000 ms,TE 68 ms,FOV 380×240,层厚5.0 mm,层间距1.0 mm,弥散敏感系数b值为50、1 000 s/mm2。
1.2.2 图像分析 扫描完成后将初始图像传输至syngo MR后处理工作站,采用Tissue 4D磁共振后处理软件及Tofts模型进行处理分析。同层面图像校准后,在对比剂强化区画出ROI区,面积约为20 mm2,生成时间-信号强度(TIC)曲线;匹配软件内的动脉输入函数模型,获取容积转移常数(Ktrans)、血管外细胞外空间容积分数(Ve)和速率常数(Kep);在DWI/ADC图上测量表观扩散系数(ADC)值,连续测量3次,取平均值为最终结果。见图1。
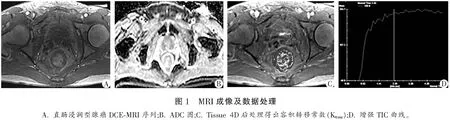
1.2.3 诊断标准 (1)局部浸润:参考美国癌症联合会2017年发布的《AJCC癌症分期手册(第8版)》[6]对直肠癌术后病理T分期进行评估;(2)LNM:MRI判断LNM标准:淋巴结边缘呈不规则毛刺样、内部信号混杂为LNM阳性;淋巴结边界清楚、内部信号均匀为LNM阴性。DWI判断LNM标准:b值为1 000 s/mm2的图像上,至少发现1个表现为不均匀高信号或内部信号不一致的淋巴结为LNM阳性,未发现任何高信号淋巴结或内部信号均匀为LNM阴性。(3)CRM:MRI判断CRM标准:MRI图像上肿瘤外缘与直肠系膜筋膜间的距离<1 mm为CRM阳性,反之为CRM阴性。DWI判断CRM标准:DWI图像上肿瘤外缘与直肠系膜筋膜间的距离<5 mm为CRM阳性,反之为CRM阴性。
1.3 观察指标
(1)对比不同T分期、LNM、CRM患者DCE-MRI定量参数和ADC值;(2)以病理检查结果为“金标准”,比较DCE-MRI、DWI诊断T分期、LNM、CRM的准确率、敏感度和特异度。
1.4 统计学分析
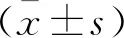
2 结果
2.1 直肠癌患者病理检查结果分析
62例直肠癌患者中,手术病理检查证实T1-2期35例,T3-4期27例;经手术共清扫85枚淋巴结,其中转移淋巴结64枚,非转移淋巴结21枚;19例术后病理诊断为CRM阳性,43例为CRM阴性。
2.2 不同T分期患者DCE-MRI参数、ADC值比较
T1-2期患者Ktrans低于T3-4期患者,ADC值高于T3-4期患者(P<0.05)。两组患者Ve和Kep比较,差异均无统计学意义(P>0.05)。见表1。

表1 不同T分期患者DCE-MRI参数、ADC值比较
2.3 LNM阳性患者与LNM阴性患者DCE-MRI参数、ADC值比较
LNM阳性患者Ktrans高于LNM阴性患者,ADC值低于LNM阴性患者(P<0.05)。两组患者Ve和Kep比较,差异均无统计学意义(P>0.05)。见表2。

表2 LNM阳性患者与LNM阴性患者DCE-MRI参数、ADC值比较
2.4 CRM阳性患者与CRM阴性患者DCE-MRI参数、ADC值比较
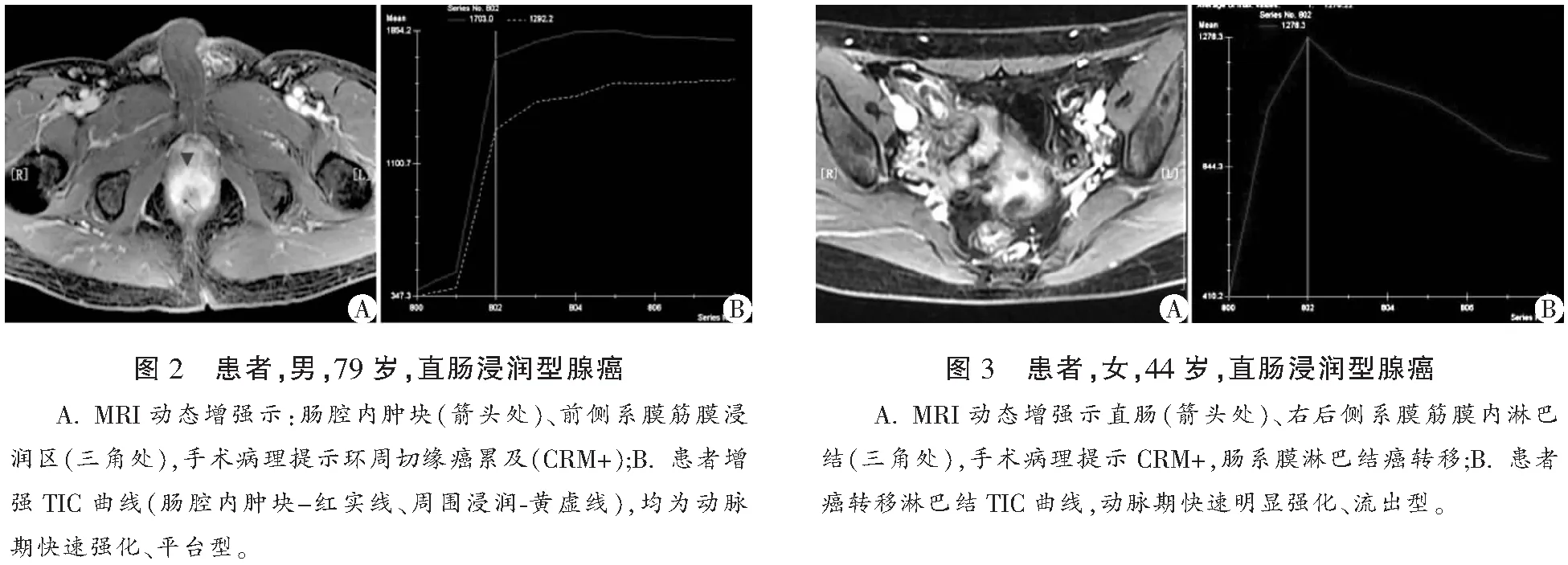
CRM阳性患者Ktrans高于CRM阴性患者,ADC值低于CRM阴性患者(P<0.05)。两组患者Ve和Kep比较,差异均无统计学意义(P>0.05)。见表3、图2及图3。

表3 CRM阳性患者与CRM阴性患者DCE-MRI参数、ADC值比较
2.5 DCE-MRI、DWI诊断T分期、LNM、CRM的诊断价值比较
DWI诊断LNM的准确率高于DCE-MRI(P<0.05),DCE-MRI诊断CRM的准确率高于DWI(P<0.05)。两种诊断方法对直肠癌患者T分期诊断的准确率、敏感度和特异度比较,差异均无统计学意义(P>0.05)。见表4。
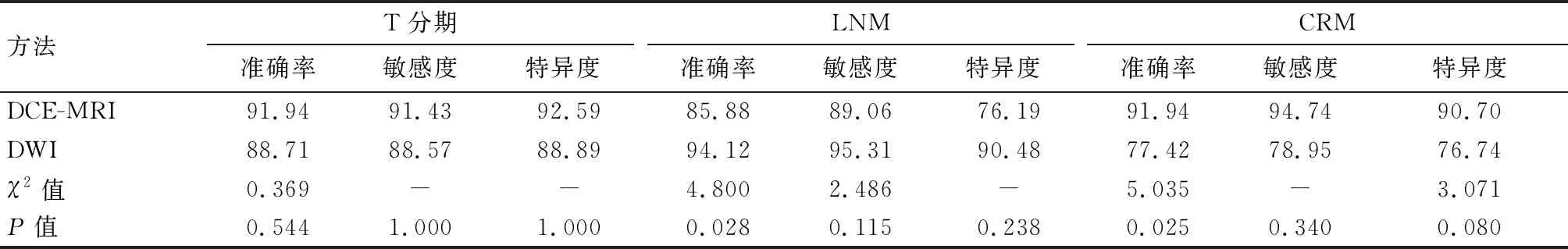
表4 DCE-MRI、DWI诊断T分期、LNM、CRM的诊断价值比较(%)
3 讨论
尽早对直肠癌进行诊断分期,并给予积极的治疗,是提高直肠癌患者预后质量的重要举措。常规MRI诊断直肠癌多基于主观性观察,无法进行定量分析,诊断准确率较低;DCE-MRI可根据对比剂的浓度变化,量化分析肿瘤组织血流动力学,从而对肿瘤疾病进行鉴别诊断[7]。DWI主要依据水分子的扩散情况间接反映肿瘤恶性程度,在肿瘤的病理分型方面应用价值较高[8]。
本研究分析了DCE-MRI、DWI评估直肠癌局部浸润、LNM和CRM的应用价值,发现不同T分期患者、LNM与非LNM患者Ktrans、ADC值比较均存在明显差异。相关细胞实验[9]表明,肿瘤细胞生长过程中,新生血管数量及血管密度增加、血管内皮生长因子过表达、慢性炎症刺激等因素会影响血管通透性,导致血管渗漏的发生。直肠癌患者由于肿瘤细胞异常增殖,其血流灌注水平随着肿瘤直径与局部浸润深度的增加逐渐升高,会增加血管与细胞间隙的对比剂浓度差,从而使Ktrans值升高[10]。此外,随着肿瘤细胞数量的增多,会持续积压了细胞外空间,导致肿瘤组织内水分子运动受限,从而使DWI扫描时ADC值偏低[11]。邢士军等[12]的研究也发现,直肠癌合并LNM患者的Ktrans值较非LNM显著升高,DCE-MRI显示肿瘤微观组织学变化,尤其是血流灌注特征方面,具有较好的应用价值。肿瘤细胞可替代转移淋巴结内正常的细胞,具有更大的微血管表面积和更严重的增殖、坏死状态,易导致对比剂漏出增加,Ktrans值增加;而肿瘤细胞的增殖会使淋巴结由正常扁平形态发生改变,影响水分子的弥散过程,使ADC值明显减小[13]。既往研究[14]证实,肿瘤分化程度与CRM阳性有关,分化程度越低,突破直肠壁向外浸润的可能性越大。本研究中,与CRM阴性患者相比,CRM阳性患者Ktrans值更大、ADC值更小,考虑与肿瘤突破浆膜层时,肿瘤细胞扩散、淋巴转移有关。本研究未观察到不同T分期患者、LNM与非LNM患者、CRM阳性与CRM阴性患者Kep和Ve值的差异,考虑与细胞外间隙是滋养肿瘤的主要微环境,血管内向肿瘤灌注能力的差异更明显有关。
进一步研究发现,DWI诊断LNM的准确率高于DCE-MRI,DCE-MRI诊断CRM的准确率高于DWI,提示DCE-MRI、DWI诊断直肠癌各具有优势。分析原因可能是:(1)DWI增加了图像对比度,有助于检出更多的淋巴结;(2)DWI信噪比较MRI图像更差,对细微结构判断的敏感度低于MRI,导致DWI诊断CRM的准确率偏低[15]。
综上,DCE-MRI、DWI对直肠癌局部浸润、LNM、CRM均具有较好的诊断价值,DCE-MRI评估LNM的诊断价值优于DWI,DWI评估CRM的诊断价值优于DCE-MRI,临床可考虑联合两种检查方法,以提高直肠癌术前诊断效能。

