EBER原位杂交手工检测常见问题与对策
施 洋
EB病毒(Epstein-Barr virus, EBV)属于疱疹病毒,在人群中普遍存在感染,一旦原发感染康复后会转变为终身潜伏状态。随着对EBV的深入研究,我们发现它与许多肿瘤的发生有关[1]。原位杂交检测可在分子层面上确认EBV与肿瘤之间的关联,是检测EBV相关肿瘤的金标准。目前,多数大型医院EBER原位杂交检测已使用全自动免疫组化染色仪,鉴于中小型医院受场所、资金、人员等因素的限制,手工操作方法依然是首选。本科室根据实际工作对EBER原位杂交(EBER试剂盒购自北京中杉金桥公司)手工检测过程中出现的问题、原因及应对措施进行详细分析,取得良好效果,现报道如下。
1 酶消化前
1.1 组织固定不良
1.1.1组织轻度固定不良导致信号定位不准确 原因:离体组织经充分及时地固定能够最大限度的保存细胞内核酸的完整性,保持mRNA的稳定性。有时候因固定温度、时间、试剂浓度、组织大小等因素的影响,导致组织出现轻度固定不良的现象,使组织细胞核结构松散,原本定位细胞核内的mRNA在细胞内出现弥散,导致信号定位不准确影响最终判读(图1)。对策:离体组织需在室温环境下30 min内进行固定,固定液建议使用10%中性缓冲福尔马林(pH 7.2~7.4)。活检组织固定时间4~6 h,大组织固定时间8~12 h,一般建议不超过24 h,长时间甲醛固定组织对核酸会有较大的破坏作用,同时也会产生甲醛色素干扰最终结果判读。
1.1.2组织严重固定不良导致无信号表达 原因:严重固定不良的组织发生自溶,组织结构完全破坏,细胞核碎裂溶解,DNA和RNA丢失殆尽,无法进行EBER检测。这一情况大多数是人为造成的,如组织未添加固定液或用错试剂配置甲醛固定液等。对策:加强人员岗位技能培训,制定完善的科室管理制度,建设科室质量安全管理团队[2];配置试剂时,“取、配、弃”三个环节要做到三核查,可以最大限度避免配错试剂的可能。
1.2 组织脱蜡不干净导致信号表达强度下降甚至假阴性原因:组织脱蜡不干净会较大程度的影响酶组织消化效果,同时也会造成探针的穿透结合效率下降,导致最终信号表达减弱或不表达。对策:EBER检测要单独使用二甲苯脱蜡,脱蜡时间控制为10~15 min。脱蜡液要根据实际工作定量、定期更换以保证脱蜡质量,通常情况下脱蜡超过80张切片或使用3天就要进行脱蜡液更换,尤其在南方地区湿度较大,更换需更加频繁。
1.3 酶消化前组织干燥不彻底导致信号表达强度下降原因:首先,胃蛋白酶消化对pH值的变化较为敏感,它需在pH 1.5~5.0才具有较高的活性,而干燥不充分会导致残留的水分改变了消化环境的pH值,在滴加胃蛋白酶后影响酶活性,造成组织消化不彻底;其次,由于胃蛋白酶的空间结构使其在一定程度上表现有疏水特性,在组织含有水分的情况下影响酶的穿透与消化能力,也会造成组织消化不完全。对策:每次实验前更换无水乙醇保证其纯度,并且多次浸泡切片达到充分脱水的要求;延长组织干燥时间,通常在空气中放置10 min就能达到较好的干燥效果。
2 杂交前
2.1 蛋白酶消化不足导致信号表达减弱原因:蛋白酶消化效果受众多因素的影响,如蛋白酶种类选择不当、消化时间过短、消化温度过低、切片偏厚等均会导致蛋白酶不能完全消除靶核酸周围的杂蛋白,将其核酸序列完全暴露出来,影响了组织的通透性,不利于探针渗透并进行充分杂交(图2)。对策:采用胃蛋白酶在37 ℃恒温环境下3 μm厚组织切片消化10 min,组织厚度每增加1 μm消化时间增加5 min。由于组织过厚会导致消化时间难以控制,组织消化不充分,且组织细胞大量重叠会影响阳性定位判读,一般建议组织厚度不超过5 μm。
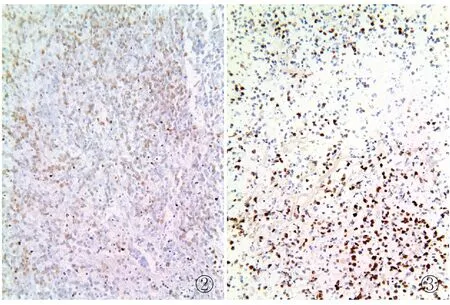
图2 蛋白酶消化不足导致信号表达减弱 图3 消化过度造成组织松散信号分布不均
2.2 蛋白酶消化过度导致组织结构松散信号分布不均原因:过度消化一般是在消化温度和时间上把控不好造成的,这种情况往往在使用蛋白酶K后时有发生。蛋白酶K是一种强力蛋白溶解酶,在55 ℃使用时要严格控制消化时间,操作过程中稍有不慎就会导致消化过度(图3)。对策:建议使用消化能力相对稳定平和的胃蛋白酶,在操作过程中控制好消化时间。最新文献报道改良EBER检测方法中使用EDTA代替蛋白酶K,也取得了较好的消化效果,并且可以提高杂交信号[3]。
2.3 杂交前组织干燥不彻底导致杂交信号减弱原因:组织干燥不彻底,组织内含有的水分会稀释了滴加微量的探针浓度,往往会导致杂交率下降。对策:同前一次组织干燥方法。
3 杂交中
3.1 探针效价下降造成信号减弱或无信号原因:探针效价下降往往是因为保存条件不符合要求造成的,或探针超过有效期限。对策:工作液保存在4 ℃冰箱,使用时要即拿即放,减少在外界停留时间;对于浓缩液需分装置于-20 ℃保存,用多少取多少,避免反复冻融。存放探针的冰箱要建立冷链系统,严格监控冰箱温度;同时要建立完善的试剂管理体系,做到专人专管,并记录好试剂到货、使用、过期的时间,在试剂上贴有相应时间标识,避免试剂过期使用。
3.2 杂交条件选择不恰当导致信号表达不稳定原因:原位杂交的过程就是带有标志物的探针与靶序列按照碱基配对互补的原则进行特异性杂交过程,其受很多因素的影响,尤其是组织层面。杂交前不同组织的状态是不一致的,不同组织细胞核内病毒拷贝数也不确定,杂交时间达不到要求往往会导致信号强度下降;不稳定的温度、湿度也会使杂交率发生波动,造成不稳定的结果。对策:采用原位杂交仪37 ℃杂交12~16 h,充足的杂交时间能够满足不同病毒拷贝数的组织,另一方面原位杂交仪的使用可为杂交过程提供稳定的环境,同时操作简单,与恒温培养箱相比具有明显的优势。
3.3 盖玻片封片时有气泡造成局部组织无信号表达原因:组织表面有杂质,盖玻片表面有异物,探针滴加过少,这些原因都是导致气泡处探针无法进入细胞核内并与靶序列杂交(图4)。对策:PBS充分洗涤去除组织表面杂质;盖玻片选择硅化处理过的,提高表面清洁度;探针滴加量根据组织大小来适当增减。
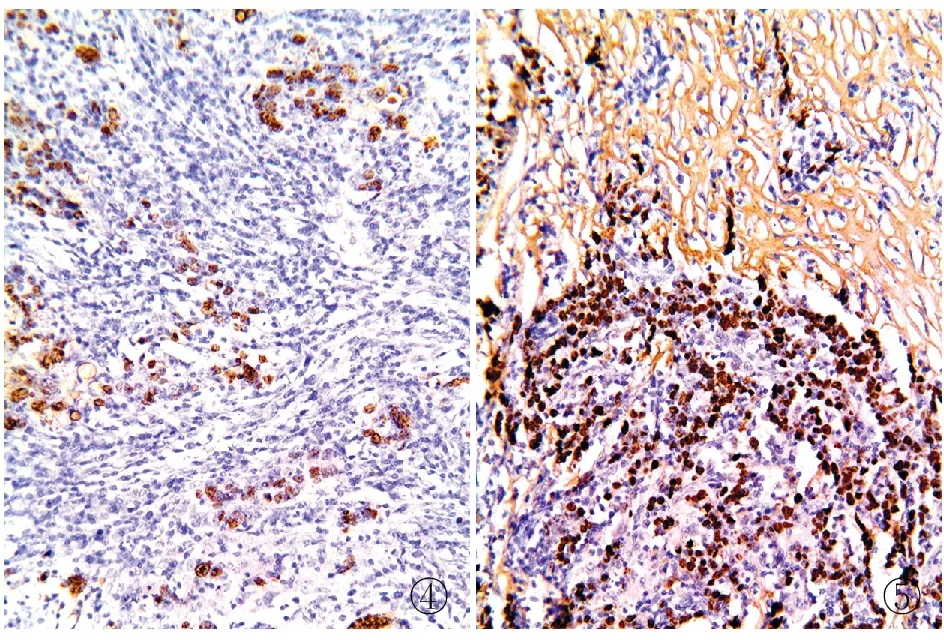
图4 杂交时探针分布不均导致信号杂乱,部分组织不表达 图5 探针干燥后出现局灶性强背景
3.4 橡胶水泥封边不到位导致非特异性背景原因:橡胶水泥封边不全会造成杂交过程中探针干燥,与组织发生非特异性结合,在PBS冲洗中很难洗脱而造成背景染色(图5)。对策:橡胶水泥封边后将玻片放在37 ℃原位杂交仪上晾干,待橡胶水泥彻底干燥后仔细观察封边情况,如有遗漏可进一步添加补充。
4 杂交后
PBS缓冲液洗涤不彻底导致非特异性染色:组织切片洗涤不充分会造成探针、抗体在组织内部残留,形成非特异性结合而造成背景着色(图6)。对策:延长每一步PBS洗涤时间至10 min,同时PBS缓冲液每次使用前需重新配制,加入0.01%Tween-20。我们发现加入Tween-20可以有效地降低载玻片的表面张力,有利于试剂在组织上延展;有利于洗脱未结合的探针、抗体等[4]减少非特异性背景产生;实验中我们还发现它还可以在一定程度上增加组织的通透性,有利于探针的穿透杂交。
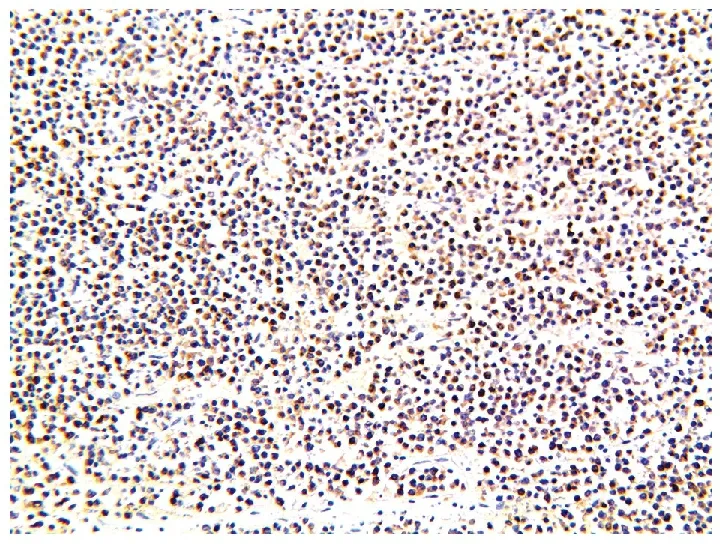
图6 冲洗不足导致非特异性背景
5 实验对照的设立
为确保实验结果的可靠性,在操作过程中需要设立实验对照,这也是EBER检测实验室质量控制的重要手段。根据操作规范要求,每次检测EBER时均需设立阴、阳性对照,对试剂造成一定的浪费。手工操作的影响因素是针对每一张组织切片,因此利用组织芯片技术可以最大限度的满足EBER检测实验对照的需求。通常我们在每张组织切片充分烤片后将多余的组织擦掉,然后在近靶目标侧裱上芯片组织再次烤片。有文献报道,利用对照组织制作组织切片匀浆液也能达到较好的对照效果,且该方法制作简单,组织用量少,阳性信号稳定[5]。
综上所述,EBER手工检测影响因素众多,为此需要建立一套完整并符合规范的操作制度和操作流程以保证实验室质量安全,同时实验室工作人员还需要经过专业的培训,操作时认真负责,严格遵循操作规范,得到安全可靠的EBER实验室结果。

