7 种杀菌剂对藜麦叶斑病菌的室内毒力测定及其分生孢子萌发形态的影响
吕 红,秦 楠,田 淼,彭玉飞,任 璐,殷 辉,赵晓军
(山西农业大学 植物保护学院,山西 太原 030031)
藜麦(Chenopodium quinoaWilld.)是苋科藜属1 年生双子叶草本植物,原产于安第斯山脉,在玻利维亚和秘鲁已有5 000~7 000 a 的栽培历史,是印第安人的传统食物,因其具有独特的营养价值,被印第安人称为“粮食之母”[1-3]。近年来,藜麦已发展成为杂粮“新宠”[4]。
我国藜麦种植与产业发展开始于20 世纪90 年代,目前我国藜麦产区分布在内蒙古、西藏、青海、河北、甘肃、山西、吉林、四川、北京等20 余省,2020 年我国藜麦种植面积约20 000 hm2,总产量约2.88 万t,种植面积和产量已跃居世界第3 位[5-6]。2008 年藜麦在山西省静乐县引种成功,自试种成功以来,藜麦种植面积逐年扩大,当前山西省藜麦种植面积超过4 000 hm2[7],主要集中在忻州市静乐县、五台县、原平县、繁峙县、岢岚县等。静乐县是山西省主要藜麦产区,2022 年静乐县藜麦种植面积约3 300 hm2。目前藜麦产业市场广阔、发展势头强劲[8]。
链格孢叶斑病菌(Alternaria alternata)引起的链格孢叶斑病是藜麦常见的一种病害,在我国内蒙古自治区、西藏自治区和山西省藜麦种植区均有发生,严重影响藜麦种植的经济效益[9-11]。该病害于6 月至8 月上旬发病,在叶片上形成黄绿或黄棕色近圆形病斑,表面附着黄绿色霉层,且多个病斑易连接成片,导致叶片枯裂易脱落。目前,主要通过化学药剂来防治链格孢引起的植物病害,如陶航等[12]研究表明,嘧菌酯和吡唑醚菌酯乳油对芍药黑斑病菌(A.alternata)的抑制作用较强;刘俏等[13]对樱桃叶斑病菌(A.alternata)进行室内毒力测定,结果发现,250 g/L 嘧菌酯悬浮剂抑菌效果最好,其EC50值为1.26 μg/mL。目前仍未见使用登记的农药来防治藜麦病害,因此,对链格孢叶斑病的防治存在一定的盲目性。
本研究测定了7 种杀菌剂对藜麦链格孢叶斑病菌(A.alternata)的室内毒力,以期为该病害的防治药剂筛选奠定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株 于山西省忻州市藜麦种植区(38.466 9°N,112.725 1°E)采集藜麦叶斑病叶片,经前期分离鉴定确定该致病菌为链格孢叶斑病菌(Alternaria alternata)[11]。
1.1.2 供试药剂 97.2% 咪鲜胺(Prochloraz)原药,山东潍坊润丰化工有限公司;96.8%苯醚甲环唑(Difenoconazole)原药,杭州大阳化工有限公司;98.4% 甲基硫菌灵(Thiophanate-methyl)原药,山东西亚化学工业有限公司;95%腈菌唑(Myclobutanil)原药,浙江禾本科技股份有限公司;95%丙环唑(Propiconazole)原药,青岛恒宁生物科技有限公司;97%啶酰菌胺(Boscalid)原药,陕西美邦药业集团股份有限公司;92%吡唑萘菌胺(Isopyrazam)原药,瑞士先正达作物保护有限公司。以上原药均用丙酮配制成10 000 μg/mL 的母液,4 ℃冰箱保存备用。
1.1.3 培养基、仪器和设备 马铃薯葡萄糖琼脂(PDA)培养基1 000 mL:马铃薯浸粉6.0 g、琼脂20.0 g、葡萄糖20.0 g(上述试剂为索莱宝公司,北京)。121 ℃高压蒸气灭菌20~30 min。试验主要仪器和设备为超净工作台、灭菌锅和恒温培养箱等。
1.2 试验方法
1.2.1 7 种杀菌剂对病原菌菌丝生长的毒力测定采用菌丝生长速率法测定杀菌剂对病原菌菌丝生长的室内毒力[14]。将A.alternata置于PDA 培养基上25 ℃培养7 d,取菌饼(5 mm)备用;将灭菌后的PDA 培养基冷却至50 ℃左右备用。用无菌水将7种杀菌剂母液分别稀释成5 个质量浓度梯度,以药剂∶PDA 体积比为1∶9 制备成含药平板,含药平板最终药剂质量浓度如表1 所示,在PDA 中加入相同体积的丙酮作为对照。25 ℃恒温培养箱培养,重复3 次。培养7 d 后用十字交叉法测定菌落直径,计算菌丝生长抑制率。将菌饼接种到含有不同质量浓度杀菌剂的PDA 培养基上,置于25 ℃恒温培养箱中培养7 d 后,用十字交叉法测定菌落直径,并计算各个质量浓度药剂对代表性菌株的菌丝生长抑制率。

表1 7 种杀菌剂的药剂质量浓度Tab.1 Concentrations of the seven fungicides μg/mL
1.2.2 7 种杀菌剂对病原菌分生孢子萌发的室内毒力测定 采用孢子萌发法测定杀菌剂对病原菌分生孢子萌发的室内毒力[15]。收集A.alternata在PDA上培养7 d 的分生孢子于1.5 mL 无菌离心管中,加入无菌水配成孢悬液(1.0×105个/mL)。采用涂片法,将含药PDA均匀涂布于无菌载玻片(大小约2.5 cm×4.0 cm,厚度约1 mm)上,滴加孢悬液至上述涂片,并将涂片置于铺有湿润滤纸的无菌培养皿内进行保湿,含药涂片最终药剂质量浓度如表1所示。最后将培养皿置于25 ℃培养箱,重复3 次;6 h 后镜检500 个分生孢子的萌发情况,计算分生孢子萌发抑制率。
1.3 数据处理
以各处理杀菌剂质量浓度的对数值为自变量(x),相对应的菌丝生长或孢子萌发抑制率的概率值为因变量(y),作毒力回归直线得到回归方程,求出有效抑制中浓度EC50值。
2 结果与分析
2.1 7 种杀菌剂在不同质量浓度下A. alternata 菌丝生长的抑制率
7 种杀菌剂在不同质量浓度下对A.alternata菌丝生长抑制率的影响如表2所示。

表2 7 种杀菌剂在不同质量浓度下对A. alternata 菌丝生长抑制率的影响Tab.2 Effects of 7 fungicides on inhibition rates of mycelial growth of A. alternata at different mass concentrations
研究结果表明,7 种杀菌剂对病原菌菌丝的生长都有不同程度的抑制作用,且抑制率与质量浓度呈正相关(表2)。7 种供试药剂中抑制作用最差的是甲基硫菌灵,最高质量浓度下抑制率仅为45.5%;其余6 种杀菌剂对病原菌均有较好的抑制效果,其中腈菌唑抑菌效果最好,最高质量浓度下抑制率达82.2%,其次依次为啶酰菌胺和苯醚甲环唑,最高质量浓度下抑制率分别为81.6%和81.4%。
2.2 7 种杀菌剂对A. alternata 菌丝生长室内毒力的影响
研究结果表明,7 种供试杀菌剂对病原菌菌丝生长抑制效果存在差异(表3),EC50值为0.1~1.0 μg/mL 的杀菌剂有5 种,分别为咪鲜胺、苯醚甲环唑、丙环唑、啶酰菌胺、腈菌唑,其对应的EC50值分别为0.19、0.26、0.47、0.67、0.68 μg/mL;EC50值为1~10 μg/mL 的杀菌剂有1 种,为吡唑萘菌胺,其EC50值为1.08 μg/mL;EC50值在100 μg/mL 以上的杀菌剂有1种,为甲基硫菌灵,其EC50值为245.45 μg/mL。结果表明,咪鲜胺和苯醚甲环唑对病原菌菌丝的毒力最强;甲基硫菌灵对菌丝的毒力最弱。

表3 7 种杀菌剂对A. alternata 菌丝生长室内毒力的影响Tab.3 Effects of 7 fungicides on toxicity of mycelial growth of A. alternata
2.3 7 种杀菌剂在不同质量浓度下A. alternata 分生孢子萌发的抑制率
研究结果表明,7 种杀菌剂对病原菌分生孢子的萌发都有不同程度的抑制作用,且抑制率与质量浓度呈正相关(表4)。7 种供试药剂中抑制作用最差的是甲基硫菌灵,当抑制率为72.3%时,质量浓度已达800 μg/mL;其余6 种杀菌剂对病原菌均有较好的抑制效果,其中吡唑萘菌胺的抑菌效果最好,质量浓度为1 μg/mL 时,抑制率可达76.9%。
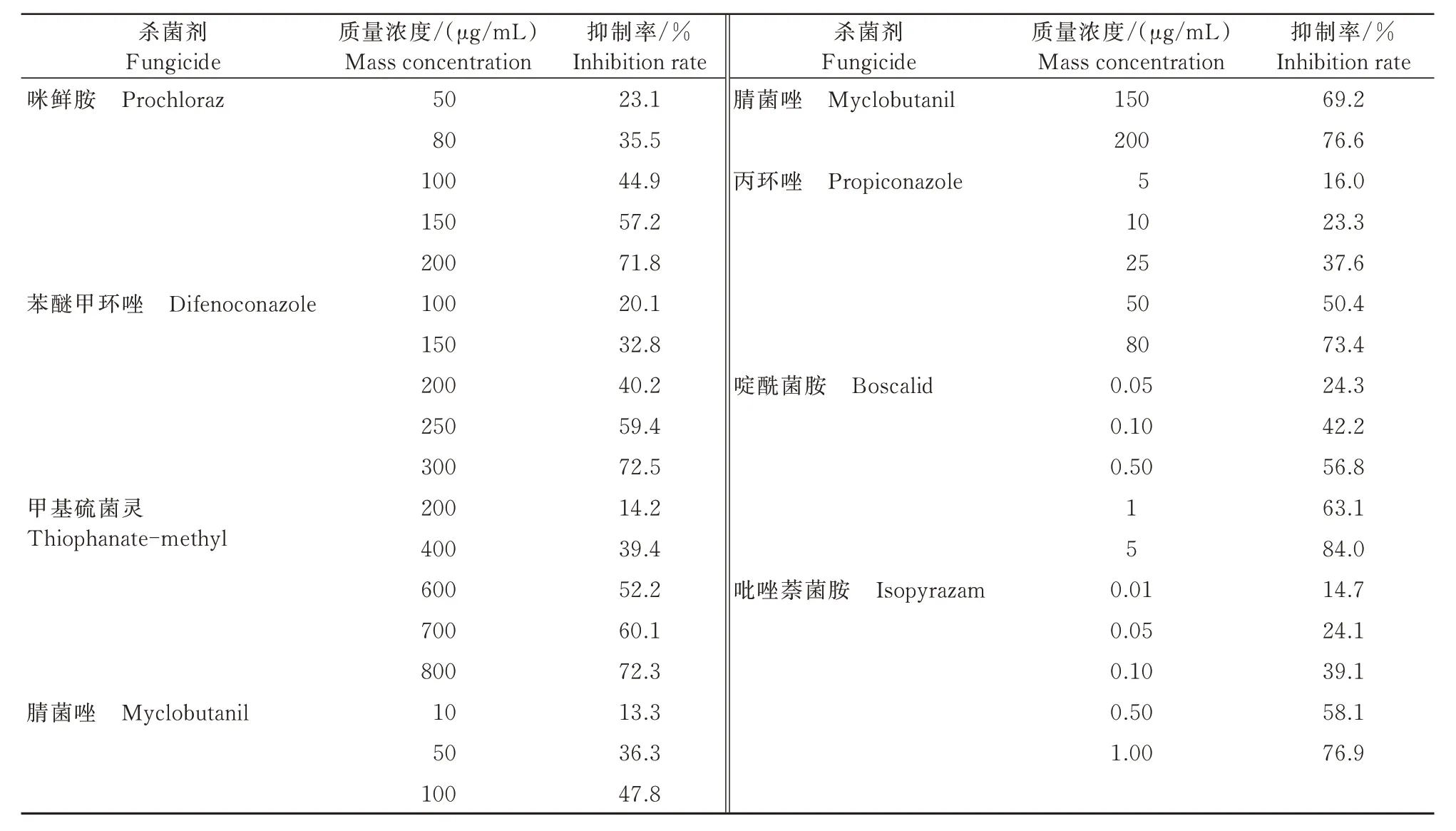
表4 7 种杀菌剂在不同质量浓度下对A. alternata 分生孢子萌发抑制率的影响Tab.4 Effects of 7 fungicides on inhibition rates of conidial germination of A. alternate at different mass concentrations
2.4 7 种杀菌剂对A. alternata 分生孢子萌发的室内毒力及其萌发形态的影响
在供试药剂质量浓度范围内,分生孢子的萌发率随不同杀菌剂质量浓度的升高而降低(表5),其中,EC50值为0.1~1.0 μg/mL 的杀菌剂有吡唑萘菌胺和啶酰菌胺,其EC50值分别为0.21、0.29 μg/mL;EC50值为10~100 μg/mL 的杀菌剂有丙环唑和腈菌唑,其EC50值分别为36.63、75.46 μg/mL;EC50值为100~500 μg/mL 的杀菌剂有咪鲜胺和苯醚甲环唑2种;其EC50值分别115.03、207.75 μg/mL;EC50值在500 μg/mL 以上的杀菌剂有甲基硫菌灵1 种,其EC50值为524.69 μg/mL。结果表明,吡唑萘菌胺和啶酰菌胺对病原菌分生孢子的毒力最强,甲基硫菌灵对病原菌分生孢子的毒力最弱。

表5 7 种杀菌剂对A. alternata 分生孢子萌发室内毒力的影响Tab.5 Effects of 7 fungicides on toxicity of conidial germination of A. alternate
不同药剂对病原菌分生孢子的萌发具有不同影响。在对照培养基上分生孢子从两端或中间萌发,芽管形态正常,极少产生分枝(图1-A)。在含咪鲜胺、啶酰菌胺和吡唑萘菌胺3 种药剂培养基上培养6 h,发现病原菌的分生孢子萌发后芽管顶端膨大且分枝增多(图1-B、G、H);在苯醚甲环唑、甲基硫菌灵、腈菌唑和丙环唑4 种含药培养基上培养6 h,发现分生孢子芽管稍粗大、分枝稍增多(图1-C~F)。

图1 7 种不同质量浓度杀菌剂处理病原菌6 h 后分生孢子和芽管的形态Fig.1 Morphology of conidia and germ tubes of the pathogen treated with different mass concentrations of seven fungicides for 6 h
3 结论与讨论
多项研究表明,植物病原真菌直接或间接侵入寄主并在寄主内定殖生长是病害发生和扩展的先决条件[16]。菌丝是病原菌侵染的关键,DAI 等[17]观察粉红单端孢Trichothecium roseum在苹果上的侵染特性,发现其菌丝通过苹果花柱缝隙侵入,最终引起果肉中心发病;同样,分生孢子在病原菌的侵染与传播过程中也扮演着重要的角色;丁正[18]研究发现,苹果树轮纹病病原Botryosphaeria dothidea最先通过分生孢子在苹果枝条表面萌发进行侵入。因此,研究药剂对病原菌菌丝和分生孢子的室内毒力能为田间化学药剂的合理使用提供参考,且对病害的防治具有重要意义。咪鲜胺、苯醚甲环唑、腈菌唑和丙环唑是一类对子囊菌具有较高活性的具有保护和铲除效果的杀菌剂[19-20];啶酰菌胺和吡唑萘菌胺是一类抑制真菌孢子萌发和芽管伸长的保护治疗性杀菌剂[21]。
本研究药剂对病原菌的室内毒力测定结果表明,不同杀菌剂对病原菌菌丝生长与分生孢子萌发的抑制效果不同。7 种杀菌剂对病原菌菌丝的毒力大小依次为咪鲜胺>苯醚甲环唑>丙环唑>啶酰菌胺>腈菌唑>吡唑萘菌胺>甲基硫菌灵,研究表明,咪鲜胺、苯醚甲环唑和丙环唑对藜麦链格孢叶斑病菌菌丝生长的抑制效果最好,EC50值均在0.50 μg/mL 以下。段慧[9]对内蒙古自治区藜麦叶片上的A.alternata进行室内药剂毒力测定发现,10%的苯醚甲环唑的EC50为0.27 μg/mL,本研究测得苯醚甲环唑的EC50为0.26 μg/mL,表明不同地区链格孢叶斑病菌A.alternata对苯醚甲环唑的室内毒力差异不明显。
7 种杀菌剂对链格孢叶斑病菌分生孢子的毒力大小依次为吡唑萘菌胺>啶酰菌胺>丙环唑>腈菌唑>咪鲜胺>苯醚甲环唑>甲基硫菌灵,研究表明,吡唑萘菌胺和啶酰菌胺对分生孢子萌发的抑制效果最好,EC50值均在0.50 μg/mL 以下,显著高于其他杀菌剂,此外,这2 种药剂可以导致病原菌分生孢子畸形萌发。对病原菌菌丝与分生孢子的毒力研究发现,甲基硫菌灵在抑制病原生长方面效果最差。
药剂对病原菌的室内毒力测定表明,不同药剂对病原菌的作用机理不同[22],如吡唑萘菌胺、啶酰菌胺对病原菌的分生孢子萌发具有较好的抑制作用,苯醚甲环唑和咪鲜胺对病原菌的菌丝生长具有较好的抑制作用。因此,在田间防治过程中不同发病阶段要针对性用药。但药剂毒力测定是药剂与病原菌直接接触而产生的效果,而药剂在田间的防治效果还受到寄主植物、病原菌和所处环境条件的综合影响,因此,需要衡量其实际防治效果,还需开展进一步田间试验。

