斯钙素2在舒芬太尼联合丙泊酚麻醉过程中诱导神经细胞凋亡的作用研究
周海斌,王 婷,李福彬,吴 鹏
(简阳市中医医院麻醉科,四川 简阳 641400)
麻醉是手术中必不可少的一种医学技术,以药物或其他方式使患者失去意识和运动能力,达到在手术等操作过程中进行无痛治疗的目的。麻醉存在一定的风险,常见的不良反应包括过敏反应、呼吸困难、心律不齐、术后恶心、呕吐等,因此手术治疗过程中,为有效降低患者术中应激,保证手术效果与手术顺利实施,选择合适的麻醉药物和方式已成为麻醉医师十分重要的工作[1]。
临床上,丙泊酚联合舒芬太尼(SF+PP)是常用的麻醉手段。丙泊酚属常见烷基酚类短小静脉麻醉药品,且代谢迅速,无体内蓄积[2]。通过静脉注入机体后可快速均匀分布全身,使得患者在短时间内进入睡眠状态[3]。舒芬太尼主要作用于μ阿片受体,是传统的麻醉镇痛药物,能够通过血脑屏障与血浆蛋白结合达到较好镇痛效果。研究发现,与芬太尼相比,舒芬太尼持续镇痛时间可达其2倍以上,具有呼吸抑制弱且术后苏醒更快、血液稳定性更好、应激反应更小,更容易透过血脑屏障等优势[4]。有研究证实舒芬太尼发挥细胞保护作用的机制可能与激活磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)信号通路,抑制线粒体通透膜转化孔的开放相关[5]。当丙泊酚与舒芬太尼联合使用时具有更强的协同作用,实现更好的麻醉诱导、麻醉维持作用,且有临床用药研究证实,以舒芬太尼用量在0.5 mg/ml基础上调整丙泊酚至有效剂量,临床效果最佳[6]。
斯钙素2(Stanniocalcin 2,STC2)属于斯钙素家族基因,可调节钙和磷酸盐稳态[7],协调细胞应对各种刺激[8]。目前,已经发现STC1和STC2在哺乳动物的心脏、肾脏以及大脑内广泛表达[9]。更重要的是,据报道STC2蛋白参与许多癌症的发生和发展,促进肿瘤细胞增殖。有研究指出,STC2通过激活PI3K/AKT信号通路促进结直肠癌的发生进展[10]。沉默STC2后,促进了毒胡萝卜素诱导的小鼠脑神经细胞瘤细胞(Mouse neuroblastoma Neuro-2a cells,N2a)的凋亡[11]。但是,STC2对细胞凋亡的分子机制仍然知之甚少。目前尚不清楚STC2如何介导麻醉过程中对神经细胞凋亡的调控。因此,本研究以此为出发点,旨在探索STC2对舒芬太尼联合丙泊酚在麻醉过程中诱导的神经细胞凋亡中的作用,以期为临床应用提供参考。
1 材料与方法
1.1 材料与试剂 舒芬太尼注射液,规格100 μg/2 ml,即2 ml注射液中含舒芬太尼100 μg(中国);丙泊酚(美国,Sigma-Aldrich);人神经母细胞瘤SH-SY5Y细胞(中国,南京科佰生物科技有限公司);胎牛血清(以色列,Biological Industries),PBS缓冲液(中国,大连美伦);RPMI 1640培养基(中国,大连美伦);0.25%胰酶消化液(中国,大连美伦);CCK-8试剂盒(中国,北京索莱宝),TUNEL凋亡检测试剂盒(中国,上海碧云天);DAPI染色液(中国,上海碧云天);抗荧光淬灭封片液(中国,上海碧云天);Trizol试剂(美国,Thermo Fisher公司)、反转录与荧光定量PCR试剂盒(中国,北京全式金生物);蛋白酶抑制剂、BCA蛋白定量试剂盒(中国,上海碧云天);ECL超敏显色液(美国,Millpore);PI3 Kinase p85 alpha Rabbit pAb(中国,武汉爱博泰克);Phospho-PI3 Kinase p85(美国,Cell Signaling Technology);Pan-AKT Rabbit pAb(中国,武汉爱博泰克);Phospho-AKT1-S473 Rabbit mAb(中国,武汉爱博泰克);STC2(美国,Santa Cruz)。
1.2 实验方法
1.2.1 细胞培养及分组:SH-SY5Y细胞于包含10%胎牛血清、青霉素及链霉素的RPMI 1640培养基,置于 37 ℃、5% CO2恒温培养箱内培养,待细胞生长密度达到90%左右时进行传代。细胞接种24 h后,以给予1 mmol/L舒芬太尼联合不同浓度梯度的丙泊酚(0.2、0.4、0.8、1.6、3.2 mmol/L)处理SH-SY5Y细胞24 h为造模方法进行实验。
1.2.2 CCK-8试剂盒检测细胞存活率:按每孔8×104个细胞铺于96孔细胞培养板。待细胞贴壁后,按不同条件进行干预并设置正常培养的对照组。之后吸取孔中培养液,并加入10 μl CCK-8工作液放入培养箱孵育1 h,用酶标仪检测各孔在450 mol/L 波长的吸光度(OD 值)。按以下公式计算细胞活力:细胞存活率=(药物组OD值÷对照组 OD 值)×100%。实验均重复3次。
1.2.3 TUNEL法检测细胞凋亡:为了量化实验条件下的细胞凋亡情况,将SH-SY5Y细胞(4×104/孔)接种在 96 孔细胞培养板上,根据制造商的说明进行末端脱氧核苷酸转移酶dUTP缺口末端标记 (TdT-mediated dUTP Nick-End Labeling,TUNEL) 检测,DNaseI (100 U/ml) 处理细胞作为阳性对照。通过荧光显微镜进行观察,利用 Image J 软件对获取的荧光图像进行分析。
1.2.4 实时荧光定量PCR检测PI3K/AKT信号通路mRNA表达:利用Trizol提取细胞RNA,无RNA酶水 20 μl对RNA进行溶解,得到总RNA。通过分光光度计来定量RNA,-80 ℃保存。根据cDNA合成试剂盒逆转录,用2 μg总RNA合成cDNA,无酶水稀释后-20 ℃保存。qPCR系统使用Trans Start Tip Green qPCR Supermix试剂盒。由上海捷瑞生物工程有限公司合成STC2、PI3K、AKT引物,STC2引物序列Forward:5’-CTGAACTTCGGGGTGATCGG-3’,Reverse:5’-GGCTTGTCACTCGAATTTTGAGA-3’;PI3K引物序列Forward:5’-TCCAGTGCTGTGTCAGGTCA-3’,Reverse:5’-GGTGGGCAGTACGAACTCAA-3’;AKT引物序列Forward:5’-AAGGACCCTACACAGAGGCT-3’,Reverse:5’-AAGGTGGGCTCAGCTTCTTC-3’。结果判读以β-actin作为内参基因,以Control组的样本作为对照组,采用2-ΔΔCt法进行相对定量。
1.2.5 蛋白免疫印迹法检测PI3K/AKT信号通路蛋白表达:收集培养的细胞,然后在含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液中进行裂解。等量蛋白质(50 μg)裂解物在10%SDS-PAGE凝胶上电泳分离蛋白质,然后将其转移到PVDF膜上。在室温下用含有 0.1% Tween-20的Tris缓冲液(TBST)配制的5%BSA封闭2 h后,与一抗在4 ℃下孵育过夜。3次洗涤后,将二抗在室温下孵育2 h。使用增强型化学发光底物在Gel Doc 2000成像系统(美国Bio-Rad)观察蛋白条带。使用Image J软件进行分析。
1.3 统计学方法 使用SPSS 19.0统计学软件进行数据处理,GraphPad Prism 8.0软件进行统计图绘制。符合正态分布的计量资料以“均数±标准差”表示,多组间比较采用单因素方差分析,根据方差齐性采用Tukey多重比较及DunnettT3进行组间多重比较;P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度SF+PP对SH-SY5Y细胞存活率的影响 使用1 nmol/L舒芬太尼联合不同浓度梯度的丙泊酚(0.2、0.4、0.8、1.6、3.2 mmol/L)处理SH-SY5Y细胞24 h,CCK-8法检测细胞活力。结果显示,与不给予药物处理的Control组相比,1 nmol/L舒芬太尼联合0.4~3.2 mmol/L丙泊酚均可显著抑制人神经母细胞瘤细胞SH-SY5Y的生长(P<0.01)。见表 1。

表1 不同浓度SF+PP处理24 h后SH-SY5Y细胞存活率(%)
2.2 不同浓度SF+PP处理后对SH-SY5Y细胞凋亡情况的影响 选择1 nmol/L SF+0.2 mmol/L PP,1 nmol/L SF+0.4 mmol/L PP,1 nmol/L SF+0.8 mmol/L PP的联合用药浓度进行后续实验。用以上3个浓度处理SH-SY5Y细胞24 h,通过TUNEL染色反应来观察各组细胞凋亡情况,计算各组细胞的凋亡率,与Control组相比, SF+ PP处理后细胞凋亡率显著上升,且凋亡率随丙泊酚浓度升高而增加,其中1 nmol/L SF+0.8 mmol/L PP组细胞凋亡率最高(P<0.01)。见表2。
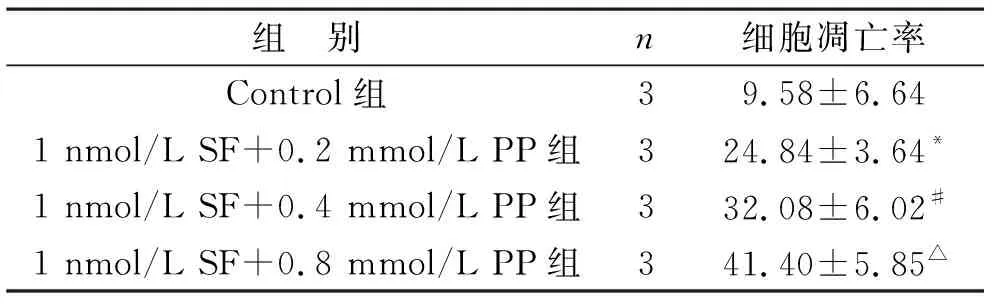
表2 不同浓度SF+PP处理后各组细胞凋亡率(%)
2.3 不同浓度SF+PP处理后各组细胞STC2的mRNA及蛋白表达比较 qRT-PCR结果显示,与对照组比较,SF+PP处理24 h后,SH-SY5Y细胞中STC2的mRNA表达显著上调且随着SF+PP处理浓度的增加而升高(P<0.01)。 SF+PP处理后SH-SY5Y细胞中STC2蛋白表达水平呈浓度依赖性增加(P<0.05)。见表3。

表3 不同浓度SF+PP处理后各组细胞STC2的mRNA及蛋白表达比较
2.4 不同浓度SF+PP处理后对PI3K/AKT信号通路表达的影响 见表4、5。通过qRT-PCR和Western blot实验检测PI3K/AKT信号通路的表达变化,与对照组比较,SF+PP处理24 h后,SH-SY5Y细胞中PI3K、AKT的mRNA表达显著上调(均P<0.01)。 Western blot实验结果显示,相比于对照组,PI3K、AKT磷酸化蛋白表达水平增加,差异有统计学意义(P<0.05)。

表4 不同浓度SF+PP处理后各组细胞PI3K、AKT的mRNA表达比较

表5 不同浓度SF+PP处理后各组细胞PI3K/AKT通路的蛋白表达比较
3 讨 论
患者的麻醉安全性是临床麻醉工作中的重要内容[12]。丙泊酚在危重症患者手术麻醉维持中应用十分广泛,作为新型烷基酚速效、短效镇静药物,丙泊酚具有在连续注入后无蓄积,患者不良反应少,起效迅速,麻醉过程平稳的特性。舒芬太尼属传统麻醉镇痛药物,镇痛效果快速、明显,因此其在外科手术中出现频率更高。为提高临床手术效率、效果,本研究结合临床效果最佳的临床麻醉用药经验,以衍生于人的神经母细胞瘤细胞系SK2N2SH的SHSY5Y细胞作为研究对象进行舒芬太尼和丙泊酚的联合用药,通过使两者之间具有更强的协同作用,观察到其能够影响神经母细胞瘤细胞的凋亡。接着我们初步明确STC2在SF+PP诱导的细胞凋亡中的作用。研究表明,STC2除了作为钙和磷酸盐调节剂,STC2还表现出有效的生长抑制特性,并参与骨发育[13]。这些研究显示STC2在不同环境背景下扮演者不同的角色。目前已有研究表明,STC2发挥作用的分子机制可能与PI3K/AKT信号通路有关[14]。因此,在上述实验结果的基础上我们检测了PI3K/AKT信号通路相关蛋白表达水平。
事实上,作为细胞内信号传导通路之一的PI3K/AKT信号通路在多种疾病中对细胞的存活、凋亡和转移过程中都起着关键的调控作用[15]。PI3K作为一种胞内磷脂酰肌醇激酶是主导PI3K/AKT信号通路的启动系统[16]。多种神经营养因子都能启始PI3K的激活过程,这些生长因子与其跨膜受体的胞外结构域相结合后,受体自身发生磷酸化,随后PI3K进一步激活下游AKT信号分子,便激活启动了PI3K/AKT通路[17]。AKT是AGC激酶家族最关键的一种胞内丝氨酸/苏氨酸蛋白激酶[18]。无论是PI3K/AKT通路的激活,还是通路成员AKT的持续性激活,都与多种类型的肿瘤、炎症、代谢的发生相关[19],广泛存在于各种神经细胞中,调控着神经元的存活或者凋亡、自噬、神经元增殖分化以及突触可塑性等过程[20]。我们的研究结果提示PI3K/AKT信号通路参与STC2对SF+PP处理后细胞凋亡的调控。
目前,很多研究都解释了PI3K/AKT信号通路在脑神经相关疾病发生发展过程中的作用。但其机制仍未有一个明确的阐释,本研究以人的神经母细胞瘤细胞为对象,阐明了STC2可以促进SF+PP诱导的细胞凋亡发生,提示STC2在神经细胞损伤中具有重要作用,本研究加深了对SF+PP神经毒性机制的理解,为STC2作为SF+PP在麻醉过程中对神经细胞凋亡的调控的潜在靶点提供理论依据。未来还需继续中枢神经系统与STC2及PI3K/AKT信号通路各靶点联系的深入研究,为该通路成为神经疾病的机制研究和治疗提供新的潜在作用靶点。

