脑钠肽通过环磷酸鸟苷/蛋白激酶G信号通路对高血压降压效果及左心室肥厚逆转作用的机制研究
马宏恩,王 鑫,季朝红,张 圆,魏文扬
(西安市第九医院心血管内科,陕西 西安710054)
高血压(Hypertension,HTN)是最常见的慢性心血管疾病之一,严重危害着人民的生命健康,同时造成了巨大的社会经济负担[1-2]。高血压可由多种因素诱发,如遗传、超重和肥胖、高钠低钾、长期精神紧张等均是导致高血压的主要危险因素[3-4],而高血压又可引起中风、心肌梗死、心力衰竭和慢性肾病等严重并发症,其中在高血压介导的器官损伤中,心肌肥厚对高血压患者的病死率有着极其重要的影响[5-6]。持续高血压可引起左心室肥厚、心肌纤维化等心肌损害,并导致恶性心律失常、心梗、心衰、猝死等心血管事件。目前临床上主要通过血管紧张素Ⅱ受体拮抗剂、β受体拮抗剂、利尿剂等药物治疗高血压及其并发症,但即便如此我国高血压引发的心血管疾病仍依然呈不断上升的趋势[7]。近些年越来越多的研究发现脑钠肽在治疗心血管疾病中具有独特的疗效。马计等[8]在研究中发现脑钠肽对高血脂大鼠心肌缺血再灌注损伤具有明显的保护作用。然而到目前为止,脑钠肽对高血压左心室肥厚的作用还不明确。本研究通过构建高血压左心室肥厚大鼠模型,并应用外源性脑钠肽干预,检测干预前、后心肌肥厚相关评价指标及心肌肥厚信号转导通路中关键调控因子水平变化,旨在探讨脑钠肽对高血压左心室肥厚是否具有保护作用及其作用机制,以期为高血压左心室肥厚的临床治疗提供全新的思路和方法。
1 材料与方法
1.1 材 料
1.1.1 主要试剂与仪器:重组人脑利钠肽购自成都诺迪康生物制药有限公司;蛋白激酶(PKG)抑制剂KT5823购自上海源叶生物科技有限公司;组织裂解液购自北京百奥莱博科技有限公司;蛋白激酶Ⅰ(PKG-Ⅰ)抗体、转化生长因子β1(TGF-β1)抗体、β-actin购自英国Abcam公司;辣根过氧化物酶标记的二抗购自北京博尔西科技有限公司;血管紧张素Ⅱ(AngⅡ)检测试剂盒、Smad家族成员3(Smad3)检测试剂盒、Ⅲ型胶原检测试剂盒、活性氧(ROS)检测试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒均购自上海酶联生物科技有限公司。MK3/Multiskan Sky GO酶标仪购自美国赛默飞世尔雷勃公司;LW500T生物显微镜购自中国上海光电公司;生理检测仪(MK-200ST)购自香港生科仪有限公司。
1.1.2 实验动物:50只健康的清洁级雄性SD大鼠,体质量为220~260 g,年龄为8周龄,购买于江苏艾菱菲生物科技有限公司。将所有大鼠常规饲养在动物房中,自由饮食饮水,并适应性饲养1周后进行后续实验。
1.2 实验方法
1.2.1 动物模型构建:随机抽取10只大鼠作为对照组,除对照组外,其余组大鼠均参考文献[9]采用腹主动脉缩窄法进行高血压左心室肥厚大鼠模型构建:大鼠腹部注射戊巴比妥钠全身麻醉后在无菌条件下沿腹部白线开腹,在双肾动脉上方约5 mm处将7号针头(直径约0.7 mm)与腹主动脉共同结扎,抽出针头,使腹主动脉缩窄约70%,缝合腹腔。观察大鼠状态,并于造模术后2周使用血压计测量模型组大鼠收缩压,与造模前比较,收缩压上升20 mmHg以上,同时收缩压高于135 mmHg即为造模成功。
1.2.2 药物处理与分组:将所有实验大鼠分为对照组、模型组、脑钠肽组、脑钠肽+PKG抑制剂(KT5823)组,每组10只,除对照组外,其余组均按照1.2.1高血压左心室肥厚大鼠模型构建方法:对照组仅进行大鼠腹主动脉分离,不予结扎。所有大鼠术后连续3 d给予青霉素20万单位腹腔注射抗感染,造模术后即开始给药干预。脑钠肽组每天通过微型泵以0.05 μg/(kg·min)的速率连续静脉输注脑钠肽;脑钠肽+KT5823组通过微型泵输注相同剂量脑钠肽的同时以0.01 μg/(kg·min)的速率连续静脉输注PKG抑制剂KT5823。造模(给药)后2周测量各组血压,造模(给药)后4周处死各组大鼠,分离心肌组织。
1.2.3 各组大鼠收缩压的测定:分别在各组大鼠造模前、造模(给药)后2、4周采用尾袖法检测其在安静、清醒状态下的收缩压水平。
1.2.4 Western blot检测各组大鼠心肌组织PKG-Ⅰ、TGF-β1蛋白表达情况:收集各组大鼠心肌组织,加入组织裂解液,裂解各组大鼠组织,并进行匀浆。4 ℃条件下离心(12000 r/min,5 min)后收集上清,提取总蛋白。并使用BCA法对提取的蛋白进行定量。取50 μg蛋白进行SDS-PAGE电泳分离蛋白,转膜后使用5%的脱脂奶粉在室温下进行封闭,2 h后加入一抗稀释液(1∶1000),并在4 ℃条件下进行孵育过夜,第二天使用TBS进行清洗,然后加入IgG二抗稀释液(稀释比例为1∶2000),室温下继续孵育2 h后进行TBS清洗,显色后观察各组PKG-Ⅰ、TGF-β1蛋白表达水平。
1.2.5 各组大鼠LVW/TL比值的测量:收集各组大鼠心脏,取左心室及室间隔部分,用滤纸吸干水分后称取左心室质量(LVW),同时分离各组大鼠左胫骨并测量其长度(TL),最后计算LVW/TL比值。
1.2.6 各组大鼠心肌组织血管紧张素Ⅱ(AngⅡ)、Smad3、Ⅲ型胶原含量的检测:取各组大鼠心肌组织,制备组织匀浆后进行离心(3000 r/min,20 min),收集上清,然后分别使用AngⅡ、Smad3、Ⅲ型胶原检测试剂盒,严格按照操作说明检测各组大鼠心肌组织中AngⅡ、Smad3、Ⅲ型胶原的含量。
1.2.7 ELISA检测各组大鼠心肌组织ROS、MDA和SOD含量:取各组大鼠心肌组织,制备组织匀浆后进行离心(3000 r/min,10 min),收集上清,然后分别使用ROS、MDA、SOD检测试剂盒,严格按照操作说明检测各组大鼠心肌组织中ROS、MDA、SOD的含量。
1.2.8 MASSON法检测各组大鼠心肌组织形态学:收集心肌组织,使用4%的多聚甲醛进行固定,然后进行常规石蜡切片(将固定组织脱水后进行石蜡包埋,制备5 μm切片),最后进行MASSON染色,观察各组大鼠心肌组织纤维化程度。

2 结 果
2.1 脑钠肽对各组大鼠心肌组织中cGMP/PKG信号通路的比较 由表1(图1)可见,与对照组比较,模型组大鼠心肌组织中TGF-β1蛋白表达量显著增加(P<0.05),而PKG-Ⅰ蛋白表达水平显著降低(P<0.05);与模型组比较,脑钠肽组大鼠心肌组织TGF-β1蛋白表达水平显著降低(P<0.05),而PKG-Ⅰ蛋白表达水平显著升高(P<0.05);与脑钠肽组比较,脑钠肽+KT5823组大鼠心肌组织TGF-β1蛋白表达水平显著增加(P<0.05),而PKG-Ⅰ蛋白表达水平显著降低(P<0.05)。

图1 各组大鼠心肌组织中cGMP/PKG信号通路相关蛋白表达的比较

表1 各组大鼠心肌组织中cGMP/PKG信号通路相关蛋白表达量的比较
2.2 脑钠肽对各组大鼠收缩压的比较 由表2可见,各组大鼠之间造模前收缩压均无统计学差异(均P>0.05);与对照组比较,模型组大鼠造模(给药)后2、4周的收缩压显著上升(均P<0.05);与模型组比较,脑钠肽组大鼠造模(给药)后2、4周的收缩压均显著降低(均P<0.05);与脑钠肽组大鼠比较,脑钠肽+KT5823组大鼠造模(给药)后2、4周的收缩压显著回升(均P<0.05)。
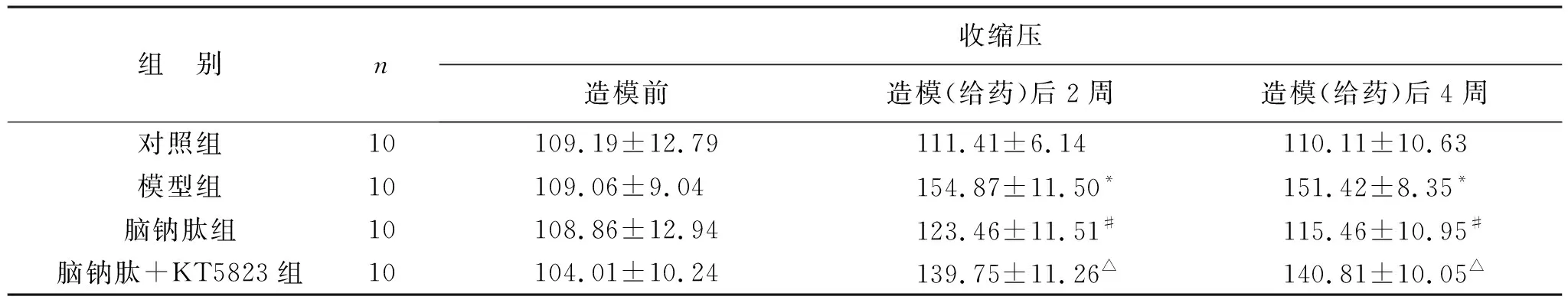
表2 脑钠肽对各组大鼠收缩压的比较(mmHg)
2.3 脑钠肽对各组大鼠左心室LVW/TL以及心肌组织AngⅡ、Smad3、Ⅲ型胶原含量的比较 由表3可见,与对照组比较,模型组大鼠LVW/TL比值、Ang Ⅱ、Smad3、Ⅲ型胶原含量显著增加(均P<0.05);与模型组比较,脑钠肽组大鼠LVW/TL比值、Ang Ⅱ、Smad3、Ⅲ型胶原含量显著降低(均P<0.05);与脑钠肽组比较,脑钠肽+KT5823组大鼠VW/TL比值、Ang Ⅱ、Smad3、Ⅲ型胶原含量显著回升(均P<0.05)。

表3 各组大鼠LVW/TL以及心肌组织AngⅡ、Smad3、Ⅲ型胶原含量比较
2.4 脑钠肽对各组大鼠氧化应激相关指标的比较 由表4可见,与对照组比较,模型组大鼠ROS水平和MDA含量显著增加(均P<0.05),而SOD水平明显降低(P<0.05);与模型组比较,脑钠肽组大鼠心肌组织ROS水平和MDA含量显著降低(均P<0.05),而SOD水平明显增加(P<0.05);与脑钠肽组比较,脑钠肽+KT5823组大鼠心肌组织ROS水平和MDA含量显著增加(均P<0.05),而SOD水平明显降低(P<0.05)。

表4 各组大鼠心肌组织ROS、MDA及SOD水平比较
2.5 脑钠肽对各组大鼠心肌组织纤维化的比较 MASSON实验检测各组大鼠心肌组织纤维化情况显示,与对照组比较,模型组大鼠心肌组织发生明显纤维化改变,脑钠肽干预后,大鼠心肌纤维化有所改善,而KT5823逆转了脑钠肽对心肌纤维化的改善作用(图2)。

图2 MASSON实验检测各组大鼠心肌组织纤维化情况(MASSON染色,×300)
3 讨 论
脑钠肽与其受体结合后可激活细胞内鸟苷酸环化酶,使三磷酸鸟苷(GTP)转变为环磷酸鸟苷(cGMP),进而激活PKG。哺乳动物细胞中存在PKG-Ⅰ和PKG-Ⅱ两种同功异构体。其中PKG-Ⅰ主要表达在心脏、肾血管、肺等组织中,它对心血管系统具有多种调节作用,cGMP正是通过激活PKG-Ⅰ调控大量目的蛋白发挥生物学功能[10]。胡军等[11]研究表明,cGMP/PKG信号通路的激活可对吗啡处理后的大鼠具有心肌保护作用。且已有研究证实脑钠肽可通过激活cGMP/PKG信号通路保护心肌组织[12]。本研究发现:模型大鼠心肌组织中cGMP/PKG信号通路相关蛋白PKG-Ⅰ和心肌肥厚相关蛋白TGF-β1表达水平分别显著下调和上调,而脑钠肽治疗后,模型大鼠心肌组织中PKG-Ⅰ和TGF-β1表达水平分别明显回升和回落,提示脑钠肽可能通过调节cGMP/PKG信号通路对高血压左心室肥厚大鼠发挥保护作用。
收缩压是心脏收缩时血液对血管内壁的压力,是反映机体高血压的一个重要指标。本研究中我们发现:模型大鼠的收缩压显著升高,且收缩压高于135 mmHg,而脑钠肽治疗后,模型大鼠的收缩压显著降低,提示脑钠肽对高血压具有一定的降压疗效。研究还发现:应用cGMP/PKG信号通路的抑制剂KT5823处理模型大鼠后,可逆转脑钠肽对高血压大鼠的降压作用,说明脑钠肽对模型大鼠血压的调节作用是通过cGMP/PKG信号通路实现的。
心室肥厚是高血压导致心脏损伤的一种主要表现,研究已经证实在心脏受损时,AngⅡ、Smad3和Ⅲ型胶原均被激活,并诱导胶原蛋白加速合成,诱发心脏纤维化和心肌肥厚[13-14]。在本研究中,模型组大鼠LVW/TL比值明显增加,同时大鼠心肌组织中AngⅡ、Smad3、Ⅲ型胶原水平均显著上升,心肌组织可见纤维化改变,提示模型大鼠发生明显的心肌肥厚;而脑钠肽治疗后,大鼠LVW/TL比值以及心肌组织中AngⅡ、Smad3、Ⅲ型胶原水平均显著降低,心肌纤维化有所改善,提示脑钠肽可抑制高血压诱发的心肌肥厚。本研究还发现:KT5823逆转了脑钠肽对LVW/TL比值以及AngⅡ、Smad3、Ⅲ型胶原水平的影响,同时逆转了脑钠肽对模型大鼠心肌纤维化的改善作用,这些结果均表明脑钠肽可通过调控cGMP/PKG信号通路影响高血压左心室肥厚的进展。
氧化应激在整个高血压病程中都扮演着重要的角色,氧化应激是指当机体受到损伤时,会产生过多的ROS,ROS如果过量或不能及时清除会发生氧化反应,导致细胞损伤。氧化应激发生时,将产生过多的有害物质,如MDA,它是ROS攻击体内脂肪所产生的氧化物,可以引起蛋白质、核酸等生命大分子的交联聚合,引起DNA损伤,具有一定的细胞毒性,其含量的多少常被作为评价氧化损伤程度的指标。SOD能清除体内有害的ROS,从而减轻ROS对机体造成的损害,对抗氧化应激反应。大鼠体内实验已经证实,当合并高血压时,大鼠会发生血管氧化应激反应,这表明氧化应激与高血压紧密相关[15-17]。而心肌肥厚所导致的缺血缺氧同样可促使心肌细胞发生氧化应激反应,产生更多的ROS,从而引起心肌纤维化和心室肥厚的进一步加重[18-20],并不断重复上述过程形成恶性循环。我们的研究发现:模型大鼠心肌组织中ROS和MDA水平显著增加,而SOD水平明显降低,提示模型大鼠发生严重的氧化应激反应,而脑钠肽治疗后,其ROS和MDA水平均明显回落,且SOD水平显著回升,提示脑钠肽可抑制高血压和心肌肥厚所诱发的氧化应激反应。同时本研究还发现KT5823削弱了脑钠肽对模型大鼠心肌组织中氧化应激指标的影响,这表明脑钠肽可通过调控cGMP/PKG信号通路影响高血压左心室肥厚所产生的氧化应激水平。
综上所述,脑钠肽可通过调控cGMP/PKG信号通路降低高血压左心室肥厚大鼠血压,减轻其氧化应激水平,同时改善其左心室肥厚程度。

