基因工程重组大肠杆菌发酵生物量产出的影响因素评估
郑婷婷,田竣元,黄娟,吴鸿雪,蔡映芸,吴玉水
·技术与方法·
基因工程重组大肠杆菌发酵生物量产出的影响因素评估
郑婷婷,田竣元,黄娟,吴鸿雪,蔡映芸,吴玉水
351100 莆田,福建基诺厚普生物科技有限公司
大肠杆菌因为生长速度快,易于培养,代谢可塑性强,拥有丰富的遗传和基因工程工具,成为代谢工程和合成生物学的最佳宿主之一[1]。利用重组大肠杆菌的高密度发酵,可以获得较高的生物量和显著提高目的基因表达产物的浓度[2]。但在工业发酵过程中,影响生物量产出的因素非常多,比如培养基的成分(细菌生长所需的营养物质)、发酵过程中生长抑制物的积累、溶氧浓度、培养温度、发酵液的 pH 值、补料方式以及发酵液流变学特性等[3]。近几年国内有关大肠杆菌高密度培养的文献报道表明,发酵32 h 内的菌体密度大概在600为 79 ~ 125[4-6]。
在构建重组大肠杆菌进行高密度发酵生产目的蛋白时,适宜的发酵种龄能缩短发酵的周期[7],为后期工业化的生产奠定基础。微量元素的添加有利于发酵[8],测试三氯化铁六水合物物料投入对发酵生物量产出是否有着差异,选择合适的供应商有利于后续发酵的工业化生产。大肠杆菌高密度培养过程,葡萄糖是碳源中最易利用的糖,但很容易产生乙酸并在超过一定浓度之后影响生长和表达[9]。所以在发酵过程中,进行补料流加时,要时刻监测发酵罐中的残糖量,将其控制在一定水平[10]。
本文应用比浊法[11],在适宜重组大肠杆菌的发酵条件下测定发酵生物量,探究种龄、微量元素、残糖含量对重组大肠杆菌菌株 pET(UB41-Smoc)/BL21(DE3) 的发酵生物量的影响。评估重组大肠杆菌高密度发酵生物量产出的影响因素,有利于提高发酵工艺水平以及重组目的蛋白的产出量,为实现重组菌发酵的工业化生产奠定基础。
1 材料与方法
1.1 材料及仪器
NVT6200ZH 电子天平购自奥豪斯国际贸易(上海)有限公司;涡旋振荡仪、磁力搅拌器和迷你型离心机购自美国精骐有限公司;A2S-20-CE-T 超纯水机购自美国艾科浦公司;台式高速冷冻离心机和超大容量冷冻离心机购自长沙湘智离心机仪器有限公司;LDZM-80L-II 立式压力蒸汽灭菌锅购自上海申安医疗器械厂;BLBIO-7GJ 发酵罐购自上海百仑生物科技有限公司;IS-A 叠加式恒温振荡器购自苏州捷美电子有限公司;721G紫外-可见分光光度计购自上海仪电;GA-3 血糖仪购自三诺生物传感股份有限公司。
重组大肠杆菌菌株 pET(UB41-Smoc)/BL21(DE3) 由福建基诺厚普生物科技有限公司构建并保存,表达产品为一种生物类似药(产品代码 Smoc);三氯化铁六水合物分别为安徽A 公司以及南京 B 公司产品。
1.2 方法
1.2.1 各种培养基与料液的配制 摇瓶 TB 培养基(g/L):磷酸氢二钾 12.5,磷酸二氢钾 2.3,大豆蛋白胨12,酵母浸粉 24,20% 葡萄糖 10,灭菌后补加 1 ml 的50 mg/ml 硫酸卡那霉素溶液。
发酵盐类配方(g/L):一水柠檬酸 30,磷酸氢二钠 94.3,硫酸铵 40,磷酸二氢钾 80,无水葡萄糖100。
100 × 微量元素浓缩液(g/L):四水合二氯化锰 1.5,三氯化铁六水合物 30,二水氯化钙 5.36,氯化锌 6.75,硫酸铜 3.0,硼酸 0.69,氯化钴六水合物 1.14,钼酸钠 0.3。
发酵培养基(g/L):酵母浸粉 30,灭菌后补加槽体盐类配方 100,50 mg/ml 硫酸卡那霉素溶液 1,消泡剂 0.1,50% 七水硫酸镁溶液 2,100 × 微量元素浓缩液 10。
发酵罐补料(g/L):无水葡萄糖 500,灭菌后补加 20% 盐酸硫胺溶液 10,50% 硫酸镁溶液 21,16% 硫酸铵溶液 50,100 × 微量元素浓缩液 10。
以上各种培养基采用立式压力蒸汽灭菌锅 121 ℃高温灭菌 30 min。
1.2.2 生物量测定 采用操作简单、误差概率低的比浊法进行检测。用紫外-可见分光光度计测量600值,用600值表示样品菌液浓度。接菌前的发酵培养基作为空白溶液调节透光度 T = 100%。将发酵培养液作适当倍数稀释后,使其在紫外-可见分光光度计波长 600 nm 处测得的吸光度值在 0.1 ~ 1.0 内(较好的检测线性范围)。将测量值与稀释倍数相乘即为菌体密度600值。
1.2.3 残糖测定 将发酵培养液作适当倍数稀释后,以10 μl 的进液量在血糖仪上检测。将测量值乘以稀释倍数即为发酵槽体中的残糖量(血糖仪检测单位为 mmol/L,依据 2 g/L = 11.2 mmol/L 换算)。
1.2.4 种龄对发酵生物量产出的影响
高压灭菌:50% 硫酸镁溶液、20% 葡萄糖溶液、摇瓶 TB 培养基、发酵培养基、发酵罐补料进行121 ℃高温灭菌 30 min。采用 0.22 μm 滤膜除菌过滤发酵盐类配方:盐酸硫胺溶液、硫酸铵溶液、50 mg/ml 硫酸卡那霉素溶液、1 mmol/L IPTG 溶液、100 × 微量元素浓缩液。
种子液制备:从–80 ℃冰箱中取出菌种在生物安全柜中接入装有 TB 液体培养基的具挡板摇瓶中。于恒温振荡器中37 ℃、150 r/min 条件下培养 15 h。
进行 3 瓶摇瓶平行实验,菌体明显增长后,每小时取样一次,测量并记录600值与 pH 值,监测菌体生长情况并绘制生长曲线。设置两组不同种龄的菌体进行发酵罐培养。
发酵罐培养:种子液以 4% 的接种量接种于装有 2.7 L 初始发酵培养基的 7 L 发酵罐中培养。系统控制发酵罐恒温 37 ℃,通过调节搅拌转速和空气流速使溶氧百分数不低于 40。通过系统自动流加氨水,维持培养体系 pH 值在 7.0 左右。当菌体量快速增长,发酵培养基中的葡萄糖无法满足菌体生长需要时,变指数-恒 pH 流加补料[12]。通过每小时取样检测菌体量与残糖含量,反馈调节补料速度控制发酵液中残糖含量在较低水平。在菌体生长中后期降温至 25 ℃,加入 IPTG 至终浓度为 1 mmol/L 进行诱导。此时的菌体生长速度减慢,相应的降低补料速度。
菌体收集:当一段时间内的菌体量不再增加,停止发酵。收集发酵液用超大容量冷冻离心机进行离心,弃去上清液后保存在–80 ℃冰箱中。
1.2.5 微量元素差异对发酵生物量产出的影响 高压灭菌、发酵罐培养以及菌体收集等方法同 1.2.4。种子液制备中,选择培养时间 6 h。选择安徽 A 公司吸潮和干燥批次以及南京 B 公司的三氯化铁六水合物配制发酵培养基所需的 100 × 微量元素浓缩液,分别加入发酵罐培养。
1.2.6 发酵液残糖含量对发酵生物量产出的影响 高压灭菌和菌体收集等方法同 1.2.4。种子液制备中,选择培养时间 6 h。接种入发酵罐发酵培养 9 h,600值达到 60 左右。进行降温 IPTG 诱导后,根据残糖的含量和菌体量,控制补料的流加速度。调节控制一组发酵罐发酵液的残糖含量处于低水平(≤11.2 mmol/L),另一组发酵罐发酵液的残糖含量处于高水平(≥ 11.2 mmol/L)[13]。
2 结果
2.1 种龄与菌体浓度的影响
进行 3 组摇瓶培养 15 h,3 h 后每小时取样测定菌体生长浓度并绘制生长曲线(图1)。从生长曲线可见,培养3 ~ 5 h 菌体生长快速,属于对数生长期。培养 5 h 的600值均达到 3.0 左右。第 6 个小时开始,到培养结束阶段的生长速度减慢。故选择相同菌种分别摇瓶活化培养 6 h 与 12 h 后接入发酵罐进行发酵培养,每小时取样测量600值,进行菌体生长情况监测,绘制生长曲线。
菌体摇瓶活化培养 12 h,接菌时菌体浓度600值为 3.8,菌体摇瓶活化培养 6 h,接菌时菌体浓度600值为 3.1。将此不同种子液接入发酵罐培养,所测菌体生物量产出有明显差异。第 2 和 3 小时时,种龄为 6 h 的发酵生物量产出几乎是种龄为 12 h 的两倍。第 3 小时以后的生物量产出仍存在差距,但差距在减小。到 9 h,种龄为 12 h 的发酵600值达到 55.8,种龄为 6 h 的重组大肠杆菌发酵600值达到 64.4,差异较大。进行降温 IPTG 诱导后,两发酵罐均培养 29 h,种龄为 12 h 的发酵收菌600值为 137.6,种龄为 6 h 的发酵收菌600值达到 161.8,差异较大(图2)。
2.2 微量元素差异的影响
为测试发生吸潮现象的三氯化铁六水合物对重组大肠杆菌发酵生物量的产出是否有影响,选择安徽A 公司从外观性状上观测发生吸潮现象的 2021 年批次三氯化铁六水合物和 2022 年批次的干燥三氯化铁六水合物。将这两批次的三氯化铁六水合物分别配制发酵培养基,进行发酵罐发酵并绘制生长曲线(图3A、3B)。为测试不同厂家的三氯化铁六水合物对重组大肠杆菌发酵生物量的产出是否有影响,另选择南京 B 公司的三氯化铁六水合物配制发酵培养基,进行发酵罐发酵并绘制生长曲线(图3C)。
三组氯化铁六水合物配制时,溶解后从颜色外观上观测,无明显差异。进行 0.22 μm 滤膜过滤时,用吸潮的三氯化铁六水合物所配制的溶液,滤膜上过滤出更多的红褐色杂质。过滤后的颜色外观不存在明显差异。
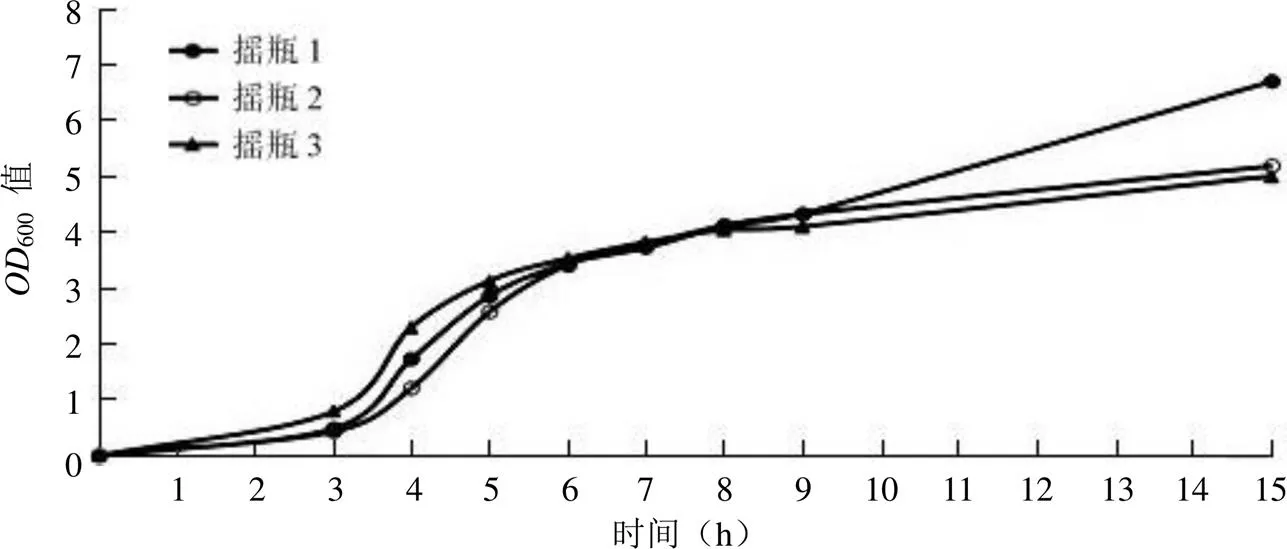
图1 摇瓶培养重组大肠杆菌生长曲线

图2 接种种龄分别为 12 h(A)和 6 h(B)的重组大肠杆菌发酵的生长曲线
三组发酵的生长曲线对比,每小时的生物量产出差距不大。培养 9 h,用吸潮批次发酵的600值达到 67,用干燥批次发酵的600值产出达到 64.4,用南京 B 公司批次发酵的600值达到 65,差距不大。IPTG 诱导后,吸潮批次的发酵收菌600值为 162.8,干燥批次的发酵收菌600值为 161.8。南京 B 公司批次的发酵收菌600值达到 184.8,高于安徽 A 公司的吸潮和干燥批次发酵600值。
2.3 发酵液残糖含量的影响
调节控制一组发酵罐发酵液的残糖含量处于低水平,另一组发酵罐发酵液的残糖含量处于高水平。发酵结束,进行数据收集并绘制生长曲线(图4)。
低水平和高水平残糖含量的发酵生长曲线比对,两者培养到 9 h 阶段的生物量产出相近。第 9 小时,低水平组的发酵液600值为 59.8,高水平组的发酵液600值达到 59.9。
IPTG 诱导后根据残糖的含量和菌体量,控制补料的流加速度。调节控制一组发酵液的残糖含量处于较低的水平,另一组发酵液的残糖含量处于较高的水平。发酵结束时,低水平组(≤ 11.2 mmol/L)收菌600值达到 141.4,高水平组(≥ 11.2 mmol/L)收菌600值为 84,差异较大。
3 讨论
冀成法等[3]优化发酵工艺后发酵结果的稳定性和重复性较好,最终菌体密度600值均能达 79 以上。晏星辰等[5]采用变指数-恒 pH 法的策略发酵重组大肠杆菌,600值达到 97。迟雷等[6]基于人工神经网络和遗传算法,对重组大肠杆菌高密度发酵工艺进行优化,600值达到 125。本研究探究种龄、微量元素、残糖含量 3 种因素对重组大肠杆菌发酵生物量产出的影响。
发酵前对种子预培养是为了获得大量活力旺盛的对数生长期重组菌以缩短发酵延滞期,增加生产强度,并且可确立重组菌的生长优势以减少染菌的可能性[14]。适宜的种龄应是菌体处于对数生长期的中后期[15]。将对数生长中后期的种子培养液接入发酵培养基可以保持很高的细胞活力,缩短发酵时间,并减少染菌的可能性。分析菌体摇瓶活化培养 15 h 绘制的生长曲线,第 6 小时是菌体生长的对数中后期,是所测菌体适宜的种龄。在发酵罐培养中,种龄为 12 h 和种龄为 6 h 的重组大肠杆菌生长速度差异明显。在发酵周期为 29 h,收菌时菌体生物量600值差距 20 左右。在不存在发酵中其他未知影响因素干扰,通过实验发酵对比,种龄对于发酵生物量产出存在影响,选择合适的菌体活化时间有利于发酵生物量的提高。
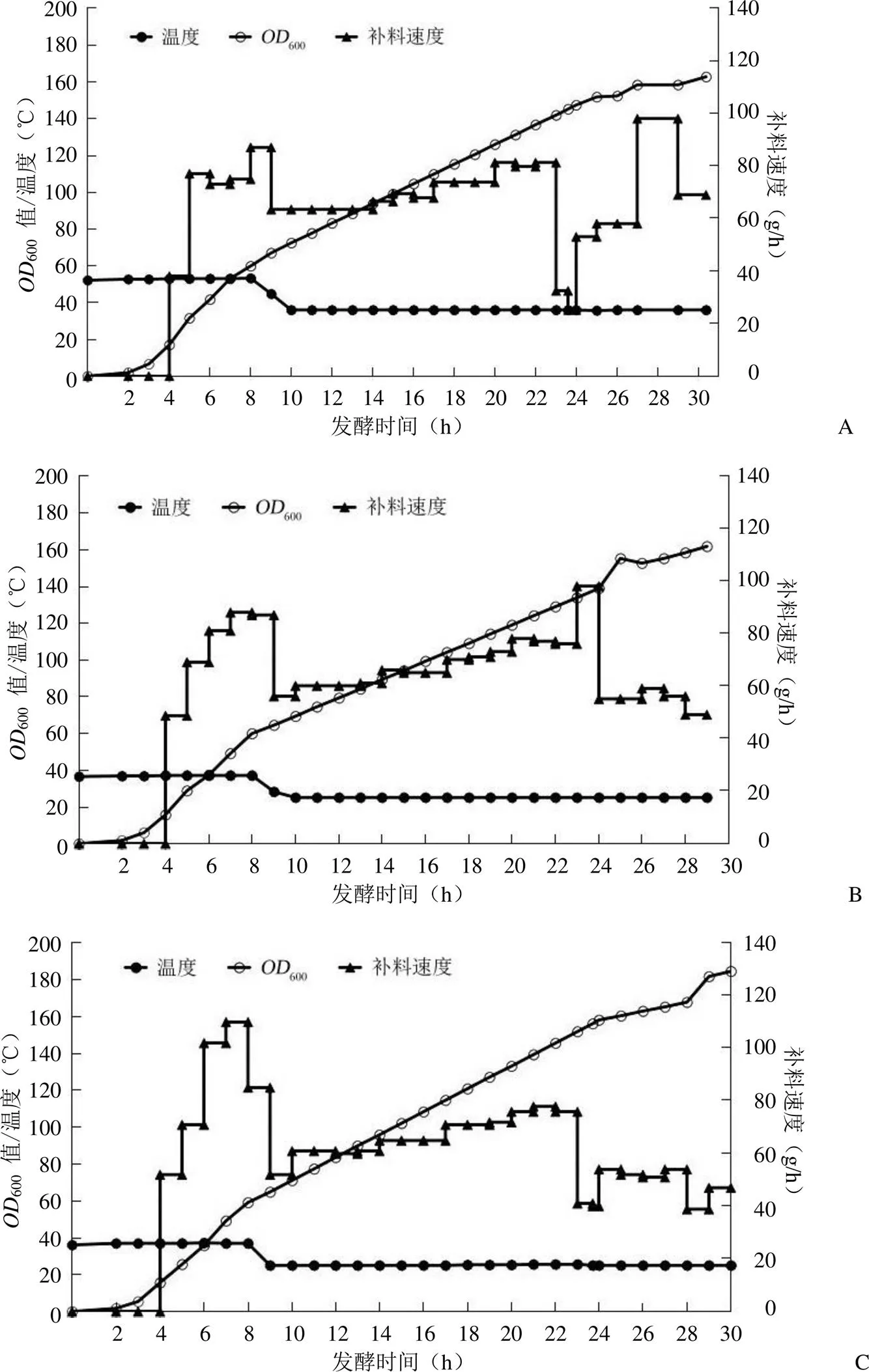
图3 不同三氯化铁六水合物配制发酵培养基的重组大肠杆菌发酵的生长曲线(A:安徽 A 公司吸潮批次;B:安徽 A 公司干燥批次;C:南京 B 公司干燥批次)
大肠杆菌高密度发酵需要添加能促进重组菌生长及代谢产物形成的物质,三氯化铁六水合物是发酵培养基中需要加入的微量元素[16]。测试三氯化铁六水合物物料投入对发酵生物量产出是否有差异,选择合适的供应商有利于后续发酵的工业化生产。吸潮批次的三氯化铁六水合物所配制的溶液,滤膜上过滤出更多的红褐色杂质。但与同厂家的该物料干燥批次所配制的发酵液比较,其每小时以及最终收菌时的生物量产出均差异不大(600值达到 160 左右)。选择不同厂家的该微量元素所配制的发酵液,IPTG 诱导前菌体的生长曲线相似,每小时的生物量产出差距不大。但是,诱导后的生长曲线开始出现差距,在发酵收菌时南京 B 公司的微量元素组批次的发酵收菌600值达到 184.8,比安徽 A 公司的吸潮和干燥批次发酵600值高 20 左右。虽然本次发酵实验中吸潮与干燥的三氯化铁六水合物投入发酵的生物量产出没有差距,但在药品工艺中,吸潮问题仍是物料质量控制问题。在物料供应商的选择时应注意物料批次间的稳定性,避免因物料吸潮的质量问题影响发酵结果[17]。不同厂家的三氯化铁六水合物的质量存在差异,对发酵的生物量产出有一定的影响,选择合适厂家的物料有利于后续发酵的工业化生产。
乙酸对细胞的生长和蛋白的表达有很大影响,超过一定浓度之后会抑制重组菌的生长,影响生物量产出和目的蛋白表达[18]。当发酵液残糖含量长时间大于 11.2 mmol/L 时,菌体的生长速度较正常发酵速度慢,且最终收菌时生物量600值只达到 84,与正常发酵600值 141.4 存在较大差距。本研究对比发酵实验表明,残糖抑制作用会影响发酵生物量的产出,保证发酵液中残糖含量处于低水平的状态(≤ 11.2 mmol/L)有利于生物量的产出。

图4 发酵液残糖含量控制在不同水平的重组大肠杆菌发酵的生长曲线(A:残糖含量控制在低水平,≤ 11.2 mmol/L;B:残糖含量控制在高水平,≥ 11.2 mmol/L)
通过研究种龄、微量元素、残糖含量 3 种因素对重组大肠杆菌发酵生物量产出的影响,优化小试工艺后的结果表明重组菌发酵周期 30 h 的600值可达到 160 左右。所以,改善影响条件和优化工艺后可显著提高工程菌发酵的生物量产出,对将来提高生物类似药产品的生产效率和经济效益具有重要的实用价值。
[1] Zhang YH, Gao XL, Huang K, et al. Research progress in fermentation expression and metabolic regulation of recombinant. Food Drug, 2021, 23(1):85-91. (in Chinese)
张言慧, 高先岭, 黄魁, 等. 重组大肠杆菌发酵表达及代谢调控研究进展. 食品与药品, 2021, 23(1):85-91.
[2] Cheng JW, Wang SY, Yang Z, et al. Construction of N-acetylglucosamine-producing fermentation engineering bacteria based on Red homologous recombination technology. Pharm Biotechnol, 2020, 27(3):195-200. (in Chinese)
成珺玮, 王苏妍, 杨哲, 等. 基于Red同源重组技术构建N-乙酰葡萄糖胺发酵工程菌. 药物生物技术, 2020, 27(3):195-200.
[3] Ji CF, Ma LN, Liu CQ, et al. High cell density fermentation of engineered E.coli expressing recombinant neutrophil inhibitory factor and hirulog hybrid. Chin J Bioprocess Eng, 2021, 19(3):250-255. (in Chinese)
冀成法, 马鲁南, 柳常青, 等. 重组白细胞抑制因子和水蛭肽嵌合蛋白工程菌的高密度发酵. 生物加工过程, 2021, 19(3):250-255.
[4] Zhang H, Lin JL, Hu DX, et al. High-density fermentation ofto express 4-hydroxyphenylacetate 3-hydroxylase and efficient biosynthesis of caffeic acid. Chin J Biotechnol, 2022, 38(9): 3466-3477. (in Chinese)
张红, 林金连, 胡定行, 等. 大肠杆菌高密度发酵表达4-羟基苯乙酸酯3-羟化酶及咖啡酸的高效生物合成. 生物工程学报, 2022, 38(9):3466-3477.
[5] Yan XC, Huang P, Wang XY, et al. High cell density cultivation offor the production of trehalose synthase. Chin J Bioprocess Eng, 2019, 17(4):385-391. (in Chinese)
晏星辰, 黄璞, 王鑫沂, 等. 高密度发酵重组大肠杆菌产海藻糖合成酶. 生物加工过程, 2019, 17(4):385-391.
[6] Chi L, Wang JY, Hou JC, et al. Artificial neural network-genetic algorithm-based optimization of high cell density cultivation of recombinantfor producing pullulanase. Food Sci, 2021, 42(10):73-78. (in Chinese)
迟雷, 王静雨, 侯俊超, 等. 基于人工神经网络和遗传算法的普鲁兰酶重组大肠杆菌高密度发酵工艺优化. 食品科学, 2021, 42(10): 73-78.
[7] Chen WJ. Preliminary report on screening of liquid strain culture medium of lentinus edodes and its suitable inoculation period. Edible Fungi, 2020, 42(3):29-30, 55. (in Chinese)
陈文杰. 香菇液体菌种培养基筛选及适宜接种期试验初报. 食用菌, 2020, 42(3):29-30, 55.
[8] Jagadabhi PS, Kaparaju P, Väisänen A, et al. Effect of macro- and micro-nutrients addition during anaerobic mono-digestion of grass silage in leach-bed reactors. Environ Technol, 2019, 40(4):418-429.
[9] Wu SB. Study on the control method of acetic acid in the fermentation process of recombinant. Electronic J Clin Med Lit, 2019, 6(31):197. (in Chinese)
吴首标. 重组大肠杆菌发酵过程中乙酸的控制方法研究. 临床医药文献电子杂志, 2019, 6(31):197.
[10] Kole MM, Ward D, Gerson DF. Simultaneous control of ammonium and glucose concentrations infermentation.J Fermentation Technol, 1986, 64(3):233-238.
[11] Dorofeev DA, Artemenko EN, Devyatkina GA. Optimizing the method of determining Fusarium spp. biomass based on ergosterol content. Russian Agric Sci, 2002, (1):10-13.
[12] Yuan XF. Production of astaxanthin by high density fermentation of. Baoding: Hebei University, 2020. (in Chinese)
袁雪峰. 大肠杆菌工程菌高密度发酵生产虾青素. 保定: 河北大学, 2020.
[13] Meng G, Wei AY, Jia HP, et al. Construction of a tdcD gene deletion strain ofand the study of its application in L-tryptophan fermentation process with high glucose tolerance. Bull Fermentation Sci Technol, 2015, 44(2):12-16. (in Chinese)
孟刚, 魏爱英, 贾慧萍, 等. 大肠杆菌tdcD基因缺失株的构建及其用于耐高糖L-色氨酸发酵的研究. 发酵科技通讯, 2015, 44(2):12-16.
[14] Cao XZ, Zhao YQ, Yang JG, et al. Screening of inoculum age and fermentation dynamics analysis of Agaricus blazei Murill. China Brewing, 2017, 36(4):114-117. (in Chinese)
曹新志, 赵迎庆, 杨建刚, 等. 姬松茸发酵种龄筛选及发酵动力学分析. 中国酿造, 2017, 36(4):114-117.
[15] Zhu XW, Wang ZJ, Li L, et al. Optimization of medium and feeding process for L-tryptophan production fermented by. Sci Technol Food Industry, 2020, 41(2):146-153. (in Chinese)
朱晓雯, 王泽建, 黎亮, 等. 大肠杆菌发酵产L-色氨酸培养基及补料优化. 食品工业科技, 2020, 41(2):146-153.
[16] Chen ZC, Wang JD, Xu QY, et al. Effects of trace elements and growth factors on L-phenylalanine fermentation. Food Fermentation Industries, 2022, 48(8):82-89. (in Chinese)
陈志超, 王金多, 徐庆阳, 等. 微量元素与生长因子对L-苯丙氨酸发酵的影响. 食品与发酵工业, 2022, 48(8):82-89.
[17] Sun XJ. Practice and improvement of API raw materials in drug registration. Chem Eng Des Commun, 2020, 46(7):212-213. (in Chinese)
孙小杰. 原料药起始物料在药品注册中的实践与改进. 化工设计通讯, 2020, 46(7):212-213.
[18] Noguer MC, Escudié R, Bernet N, et al. Populational and metabolic shifts induced by acetate, butyrate and lactate in dark fermentation. Int J Hydrogen Energy, 2022, 47(66):28385-28398.
10.3969/j.issn.1673-713X.2023.05.012
吴玉水,Email:yswu@genohopebio.com
2023-02-27

