第二代人乳头瘤病毒全基因组分型国家参考品的研制
田亚宾,沈舒,周海卫,许四宏
·技术与方法·
第二代人乳头瘤病毒全基因组分型国家参考品的研制
田亚宾,沈舒,周海卫,许四宏
100050 北京,中国食品药品检定研究院传染病诊断试剂二室
人乳头瘤病毒(human papillomavirus,HPV)是一个小的环状双链-DNA 病毒,属于乳头瘤病毒家族。主要感染皮肤、生殖器和上呼吸道的表皮细胞。目前,大约 200 多种 HPV 型别被鉴定发现[1]。HPV 的基因组长约为 8000 bp,主要分为三个区:早期基因、晚期基因和长调控区。早期基因编码 6 个早期蛋白,包括 E1、E2、E4、E5、E6 和 E7,主要负责病毒的转录和复制。其中,E6 和 E7基因编码与细胞癌变转化相关的蛋白。晚期基因 L1 和 L2 主要负责编码衣壳蛋白[2]。根据其与癌症的相关性,分为高危型 HPV(HR-HPV)和低危型 HPV(LR-HPV)。目前,将 14 种 HPV 型别(16、18、31、33、35、39、45、51、52、56、58、59、66、68)定为 HR-HPV,4 种 HPV 型别(26、53、73、82)列为潜在 HR-HPV。HR-HPV的持续性感染是造成宫颈癌及多种生殖道癌症的主要病原体。在中国,69.1% 的宫颈癌病例为 HPV16 和 HPV18 感染,14.7% 为 HPV31、33、52、58 和 59。HPV39、45 和 56 占宫颈癌的 4.5%,剩余的病例是比较少见的其他型别,如 HPV66[3]。
由于 HPV 在体外无法分离培养,血清学方法检测 HPV 的灵敏度较低。在临床上,主要通过检测核酸诊断 HPV 感染。国内外已有众多商品化 HPV 核酸检测试剂,这些试剂采用的方法学繁多,包括 PCR 荧光法、PCR 反向杂交法、基因芯片法、恒温扩增法、杂交捕获法、测序法等[4-5]。大多数试剂基于高度保守的 L1 区,还有少数试剂集中于 E1、E2、E6、E7 区。目前,国内已研制成功人乳头瘤病毒全基因组分型国家参考品,由于 HPV DNA 的量值为参考范围(106~ 107copy/ml)且未覆盖 HPV51、HPV53 和 HPV56 高危型别样本,故在实际应用中存在一定的局限。本研究旨在更新和完善人乳头瘤病毒全基因组分型国家参考品,更好地适用于该类试剂的质量控制和评价。
1 材料与方法
1.1 材料
23 种不同型别的 HPV 全基因组质粒由亚能生物技术(深圳)有限公司提供;5 株 HPV 阴性的病原体分别为巨细胞病毒(CMV)、单纯疱疹病毒1 型(HSV-1)、沙眼衣原体(CT)、B 族链球菌(GBS)和解脲脲原体(UU),来源于本实验室;人乳头瘤病毒 16 型 DNA 国际标准品购自英国国家生物制品检定所(NIBSC,编号:06/202),为冻干样品,5´106IU/支或 5´106Geq/支。将样品平衡至室温,加入 500 μl 无 DNase/RNase 去离子水溶解,得到终浓度为 107IU/ml 的 HPV16 DNA 国际标准品。
1.2 方法
1.2.1 病毒株的鉴定和复核 所有样品使用亚能生物技术(深圳)有限公司、湖南圣湘科技有限公司、江苏硕世生物科技有限公司、艾康生物技术(杭州)有限公司、凯普生物科技有限公司的 HPV 核酸(分型)检测试剂进行复核检测,验证不同样品是否存在交叉污染。严格按照各企业的产品说明书进行操作和结果判定。
1.2.2 样品的分装 使用 Qubit ds DNA HS 分析试剂盒对高浓度的样品进行初步的定量,然后将各 HPV 样品使用含 2 ng/μl 的人基因组 TE 溶液稀释分装,每支 100 μl。5 种 HPV 阴性的不同病原体用 2 ng/μl 的人基因组 TE 溶液稀释分装至 500 μl/支。
1.2.3 不同型别 HPV DNA 的溯源赋值 通过设计针对质粒通用区段基因的引物和探针,采用荧光 PCR 法检测,并使用双平行线法分析数据,将候选样品溯源至 HPV16 DNA 国际标准品赋值[6]。具体步骤如下:将 WHO HPV16 DNA 标准品分别稀释至 8´104、4´105、2´106IU/ml,将不同型别 HPV 参考品同步系列稀释 5、25、125 倍。采用 QuantiTect® Probe PCR 试剂检测,每个样本设置 3 个复孔,检测后获得标准曲线和测试曲线,采用 Stats模型进行双平行线分析拟合。在 3 个不同的实验室分别进行 5 次标定。检验分析两条直线的斜率在统计学上有无差异,是否平行。若平行,计算出各测试样本的检测值。通过 5 次独立的检测,计算每个样品的均值,确定为最终的浓度值。
1.2.4 协作标定研究 经验证分装后,将参考盘分发不同的实验室进行协作标定研究。各实验室按照各自企业生产的 HPV 核酸(分型)检测试剂说明书和(或)协作标定方案检测复溶后的样本。各实验室将检测结果汇总,依据各试剂盒的检测范围评价符合率和检测限。其中检测限性能指标参照行业标准,评估单个反应中检出的最小样品量(即 IU/反应)。
1.2.5 稳定性研究 将参考盘中的 14 种 HR-HPV 样本按照以下条件处理:于室温(20 ~ 27 ℃)放置 1 d 和反复冻融 5 次。然后系列稀释 10、100 倍,使用商品化的人乳头瘤病毒核酸检测试剂(荧光 PCR 法)、HPV 分型(25)检测试剂(PCR-反向点杂交法)检测原倍、10 倍、100 倍稀释后样本,使用高危型人乳头瘤病毒检测试剂盒(杂交捕获二代法)(即 HC2)和 Care HPV 核酸检测试剂检测原倍样本,结果与存放于–20 ℃条件下的参考品比较,以考核参考品的加速稳定性和冻融稳定性。
2 结果
2.1 参考品的组成
本参考品含 23 种不同型别的 HPV 全基因组 DNA,所有样品经测序确认后,采用商品化 HPV 核酸检测试剂(荧光 PCR 法)进行复核测定。结果符合预期型别,且不同样本间无交叉污染,表明可作为新一代国家参考品的候选样本。为了评价试剂的特异性,本研究选取了 5 种经性传播的 HPV 阴性病原体,分别为 CMV、HSV-1、CT、GBS 和 UU。将上述 5 个 HPV 阴性样本和 23 种不同型别 HPV 质粒组成新一代国家参考品。
2.2 不同型别 HPV DNA 的溯源赋值
对 23 种不同型别的 HPV DNA 进行溯源赋值。以 HPV16 型别为例,HPV16 型国际参考品和 HPV16 国家参考品系列稀释后检测,获得国际标准品曲线和测试曲线。结果显示(图1),两条曲线的线性符合要求,且两条曲线平行(> 0.01,= 1.08),双平行线法赋值得到该型别 HPV DNA 含量为 1889748.693 IU/ml。平行 5 次实验测定 HPV DNA 含量分别为 3472702.503、2956621.885、1842298.508、4737508.297、1889748.693 IU/ml,计算均值后乘以稀释倍数 5,即HPV16 DNA 终浓度为 1.49´107IU/ml。按照以上分析计算,所有 23 种不同型别的 HPV 参考品溯源赋值结果(表1)显示,HPV DNA 的含量在6.59 ~ 7.17 Log10IU/ml。5 次检测结果的标准差(SD)均不高于 0.27 Log10,变异系数(CV)≤ 4.1%。
2.3 协作标定结果
汇总来自不同实验室的 37 种 HPV 核酸检测试剂的结果,大多数试剂能够准确地检出各试剂检测范围内的相应型别,与预期的结果一致。极少数试剂在检测中存在漏检 HPV52 型或假阳性结果,可能与分析灵敏度低或实验室污染有关。对于各试剂的检测范围外的型别,高危型人乳头瘤病毒检测试剂盒(杂交捕获二代法)在检测 HPV43、HPV66、HPV82 出现交叉反应,其余试剂的检测结果均为阴性,不存在交叉反应。在检测 5 份 HPV 阴性病原体,与预期结果一致,均为阴性。此外,通过系列稀释不同型别 HPV 分析了不同检测试剂的最低检测限。由于不同试剂覆盖的检测范围内的型别不同,故本研究集中分析汇总不同试剂检测 14 种 HR-HPV 的最低检测限。结果发现不同试剂的最低检测限存在较大差异。各试剂的检测限范围为1 ~ 1.9 × 105IU/反应。大多数基于 PCR-荧光法或 PCR-杂交法的试剂的检测低于 104IU/反应,3 种基于杂交捕获法的 HPV 核酸试剂的检测限在 104IU/反应上下波动。结果表明这些试剂由于不同的引物体系、样本处理及灵敏度的差异,造成最低检测限的差异也较大。

图1 HPV16 型国家参考品与 HPV16 国际参考品的标定

表1 23 种不同 HPV 型别全基因组质粒的量值结果
注:HPV 参考品量值使用 IU/ml 表示,等同于 Geq/ml 和 copy/ml。
2.4 稳定性研究
14 种不同型别 HR-HPV 参考品放置于不同条件后,HPV 核酸分型检测试剂(PCR-反向点杂交法)的检测结果显示,原倍、10 倍和 100 倍稀释的样品在 3 种条件下均符合预期结果,且显色均匀较一致。HPV 核酸分型检测试剂(荧光 PCR 法)的结果显示,不同的稀释梯度 HPV样品在 3 种条件下,结果一致且 Ct 值相近(△Ct ≤ 1,图2)。上述结果显示基于荧光 PCR 和 PCR 反向杂交法试剂检测均表明该参考品比较稳定。然而,基于杂交捕获法的试剂检测结果显示,各个型别在不同的条件下,存在一定的差异,且没有一定的规律性(图3)。这种差异可能与杂交捕获法是基于信号放大的原理有关。

图2 HPV 核酸检测试剂(荧光 PCR 法)评价国家参考品的稳定性
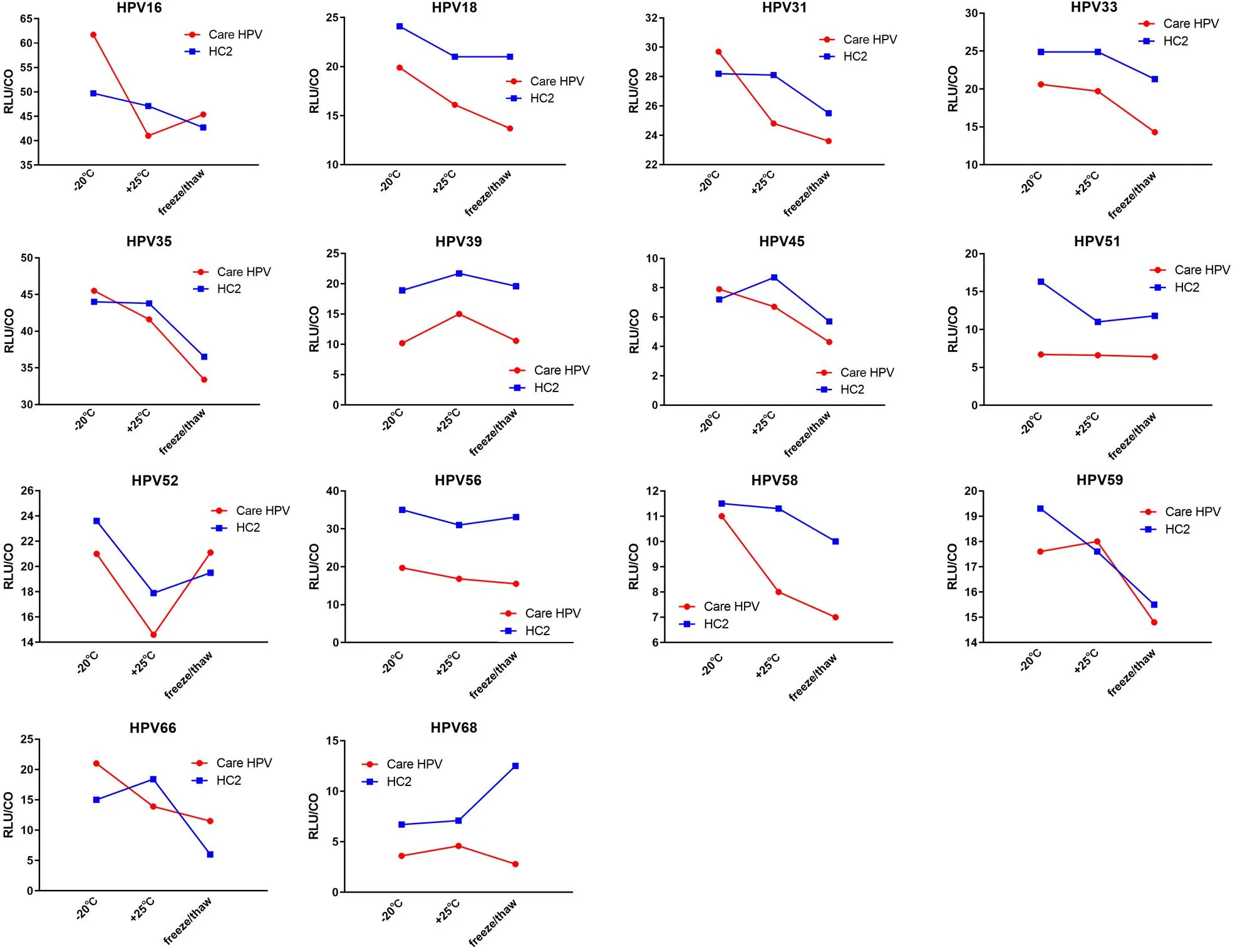
图3 HPV核酸检测试剂(杂交捕获法)评价国家参考品的稳定性
2.5 质量标准的确定
结合协作标定和稳定性研究的结果,参考上一代国家参考品的质量标准,确定了新一代国家参考品质量标准。第二代国家参考品主要适用于荧光 PCR 法、PCR-杂交法、测序法等靶向扩增法试剂的质量评价,检测结果应满足:①准确性:检测试剂盒检测范围内人乳头瘤病毒不同型别国家分型参考品,结果应均为相应型别阳性;②特异性:检测 5 份 HPV 阴性参考品,结果应均为阴性且检测不同型别的 HPV 参考品,要求高危型别 HPV 应不得出现交叉反应,低危型别 HPV 交叉反应率应不高于 10.0%;③精密度:检测试剂盒检测范围内 HPV 型别参考品,重复检测10 次,要求检测结果均为相应型别阳性,且Ct 值的变异系数不大于 5.0%;④最低检测限:应不高于104IU/反应。
3 讨论
HPV 核酸检测对于宫颈癌筛查具有重要的临床意义,通过检测 HPV 的感染状态筛出宫颈癌前病变和宫颈癌的风险人群并及时进行治疗,能够有效预防或降低宫颈癌的患病风险。此外,HPV 核酸检测对于 HPV 流行病学调查和 HPV 疫苗的效力评价具有重要的意义。目前,市场上有大量商品化核酸检测试剂,大多数试剂能够检测 14 种高危型别,还有一部分试剂主要用于多种高、低危型别的分型检测[3]。为了提高和规范这类试剂的质量,本研究在延续上一代国家参考品的基础上,研制了新一代 HPV 全基因组分型国家参考品。由于 HPV 不同于其他病原体,无法获得病毒培养物。尽管临床样本容易收集,但无法满足大量试剂的评价使用,且在量值的确定上也存在一定困难。新一代参考品延续上一代参考品,合成模拟的全基因组质粒样本用于评价试剂,这与 WHO 国际标准品的性质一致[7]。不同于上一代参考品覆盖的型别,本参考品覆盖了所有的高危型和潜在高危型型别样本,能够更好地评价目前市场上不同 HPV 核酸检测试剂的性能,如准确性、特异性和检出限等。
为了保证不同检测试剂的溯源和结果的可比,本研究对每种样品进行了一一标定。传统上,质粒样品可通过分子量换算确定拷贝数,然而,对于不同仪器不同批次间存在一定的差异。最近,WHO 在原有 HPV16 和 HPV18 DNA 国际标准品的基础上,增加了 HPV31、HPV33、HPV45、HPV52、HPV58、HPV6 和 HPV11 等 7 种型别国际标准品,覆盖的型别依然有限。本研究参考了 WHO 协作标定的方法,以保证不同代次间的差异[6]。针对质粒通用区段设计引物和探针,采用荧光 PCR 方法将 23 种不同样品溯源至 WHO HPV16 DNA 国际标准品。对于上述样品的赋值,提高了不同试剂间分析灵敏度可比性。
此外,本套参考品发放至不同实验室进行了适应性验证。对于不同方法学的检测试剂进行了验证,比如高通量测序、杂交捕获法、酶切信号放大法等。结果发现基于杂交捕获法在检测HPV43、HPV66 和 HPV82 存在一定的交叉反应,与之前的报道一致[8-9]。对于样品的稳定性采用基于杂交捕获法的试剂进行了评价,结果发现检测结果不稳定,这可能是由于杂交捕获类的检测类试剂是基于信号放大的原理,其分析灵敏度较 PCR 方法低[10]。样品接近试剂的检测限,重复性较差,故不适用于该类试剂的性能评价。
总之,本研究建立了第二代 HPV 全基因组分型国家参考品,并制订了相应的质量标准。此参考品主要适用于基于 PCR-荧光探针法、PCR-反向杂交法、基因芯片法、恒温扩增法、测序法等靶向扩增方法学原理的 HPV核酸(分型)检测试剂的质量评价。该参考盘的建立有助于评价该类试剂,以保证在不同实验室和不同试剂盒检测获得有意义且可比的结果。
[1] Bzhalava D, Eklund C, Dillner J, et al. International standardization and classification of human papillomavirus types. Virology, 2015, 476(476):341-344.
[2] Sichero L, Picconi MA, Villa LL, et al. The contribution of Latin American research to HPV epidemiology and natural history knowledge. Braz J Med Biol Res, 2020, 53(2):e9560.
[3] ICO/IARC Information Centre on HPV and Cancer (HPV Information Centre). Human papillomavirus and related diseases in China. (2023-05-10) [2023-09-22]. https://www.hpvcentre.net.
[4] Tian YB, Zhang CT. Molecular detection and genotyping of human papillomavirus. Chin J Oncol, 2018, 40(10):729-735. (in Chinese)
田亚宾, 张春涛. 人乳头状瘤病毒核酸分型检测试剂的研究进展. 中华肿瘤杂志, 2018, 40(10):729-735.
[5] Tsakogiannis D, Gartzonika C, Levidiotou-Stefanou S, et al. Molecular approaches for HPV genotyping and HPV-DNA physical status. Expert Rev Mol Med, 2017, 19:e1.
[6] Expert Committee on Biological Standardization, World Health Organization. WHO international standards for human papillomavirus (HPV) DNA for low-risk types HPV6 & HPV11 and high-risk types HPV31, HPV33, HPV45, HPV52 & HPV58. Geneva: WHO, 2019. https://www.who.int/publications/m/item/WHO-BS-2019.2360.
[7] Wilkinson DE, Baylis SA, Padley D, et al. Establishment of the 1st World Health Organization international standards for human papillomavirus type 16 DNA and type 18 DNA. Int J Cancer, 2010, 126(12):2969-2983.
[8] Castle PE, Schiffman M, Burk RD, et al. Restricted cross-reactivity of hybrid capture 2 with nononcogenic human papillomavirus types. Cancer Epidemiol Biomarkers Prev, 2002, 11(11):1394-1399.
[9] Dong L, Feng RM, Zhang L, et al. Prospective comparison of hybrid capture 2 and SPF-LiPA for carcinogenic human papillomavirus detection and risk prediction of cervical cancer: a population-based cohort study in China. J Gynecol Oncol, 2017, 28(5):e66.
[10] van Doorn LJ, Kleter B, Quint WG. Molecular detection and genotyping of human papillomavirus. Expert Rev Mol Diagn, 2001, 1(4):394-402.
10.3969/j.issn.1673-713X.2023.05.011
许四宏,Email:xushong@nifdc.org.cn
2023-05-12

