以TROP2为靶点的抗体偶联药物相关研究进展
孙丽平,苗庆芳
·综述·
以TROP2为靶点的抗体偶联药物相关研究进展
孙丽平,苗庆芳
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所国家卫生健康委员会抗生素生物工程重点实验室/肿瘤室
滋养层细胞表面抗原 2(trophoblast cell surface antigen 2,TROP2)是一种 I 型跨膜细胞表面糖蛋白,最初被认为是滋养层细胞的表面标志物,但后来发现它在许多实体肿瘤中表达量增加,而在正常组织中表达量较少,这样的表达差异使 TROP2 成为肿瘤治疗的潜在靶标。2020 年 4 月首个靶向 TROP2 抗体药物偶联物(ADC)IMMU-132 成功获批上市,使得 TROP2 成为肿瘤靶向治疗的明星靶标,并引发了以其为靶点的 ADC 研发热潮。目前,已有多个以 TROP2 为靶点的新型 ADC 药物进入临床研究阶段。本文将针对 TROP2 的结构和功能、在实体瘤中的表达以及 TROP2 靶向 ADC 药物的最新研究进展进行综述。
1 TROP2 的结构和功能
TROP2 又名肿瘤相关钙信号转导子 2(tumor-associated calcium signal transducer 2,TACSTD-2),是由2 基因编码的一种 I 型跨膜细胞表面糖蛋白[1]。TROP2 分子由 323 个氨基酸组成,分子量为 36 kD,根据不同氨基酸所在位置和功能分为疏水前导肽(第 1 ~ 26 位氨基酸)、胞外区(第 27 ~ 274 位氨基酸)、跨膜区(第275 ~ 297 位氨基酸)和细胞质尾部(第 298 ~ 323 位氨基酸)[2]。TROP2 蛋白的 N 端是一个胞外区(ECD),它通过与胞内区(ICD)相连的单向跨膜螺旋(TM)固定在细胞膜上。TROP2-ICD 结合序列磷脂酰肌醇-4,5-二磷酸(PIP2)高度保守,在 TROP2 信号传导中起调节作用。TROP2-ICD 除 PIP2 结合基序外,还包含一个保守的丝氨酸(S303)磷酸化位点,其磷酸化状态影响细胞周期进程[2]。研究发现,TROP2 在不同肿瘤细胞的增殖和迁移中发挥着重要作用:其可能通过激活磷酸肌醇3-激酶/蛋白激酶 B(PI3K/Akt)信号通路促进骨肉瘤细胞和胆囊癌细胞的增殖和迁移[3-4];另外,TROP2 可能通过 EGFR/Akt 和 DSG2/PG/β-catenin 途径降低桥粒芯糖蛋白 2(desmoglein 2,Dsg2)的表达,促进胃癌细胞的侵袭和迁移[5]。然而,也有证据表明,TROP2 在某些癌症类型中具有相互矛盾的生物学作用,可能作为肿瘤抑制因子或激活因子发挥作用[6]。
2 TROP2 在实体瘤中的表达
TROP2 已被证实在多种癌症类型中高表达,如乳腺癌、宫颈癌、结肠癌和胃癌等[7-8]。我们利用 GEPIA 数据库比较了 TROP2 在部分肿瘤组织和相应正常组织中的表达情况。从图1 可以看出,TROP2 在宫颈鳞癌和腺癌(CESC)、结肠癌(COAD)、卵巢癌(OV)、胃癌(STAD)和甲状腺癌(THCA)等癌症类型中的表达均与正常组织存在显著差异。值得注意的是,在乳腺浸润癌(BRCA)中,并未观察到肿瘤组织与正常组织的表达有显著差异,可能是因为 TROP2 主要在三阴性乳腺癌(TNBC)高表达,而 TNBC 在所有类型的乳腺癌中仅占 15% ~ 20%[9]。同时,我们还发现与乳腺癌相比,TROP2 在宫颈癌及其相关正常组织中表达差异更加显著。其他学者的研究结果也证实,TROP2 在宫颈癌中的表达率(88.7%)高于 TNBC 中的表达率(78.1%)[10-11]。因此,鉴于靶向 TROP2 的 ADC 治疗 TNBC 的成功,推测其在宫颈癌中也可能会有较好的疗效。另外,TROP2 也是多种癌症类型的预后标志物。例如,有研究表明 TROP2 过度表达是卵巢癌总生存率的一个独立预后因素[12]。从 GEPIA 数据库也可以得知,TROP2 的表达与卵巢癌患者的生存率有关,与 TROP2 低表达相比,TROP2 高表达的患者的生存率更低[13]。随着对不同癌症类型的 TROP2 生物学认识的提高,人们发现了其在乳腺癌以外的其他实体肿瘤的临床价值。
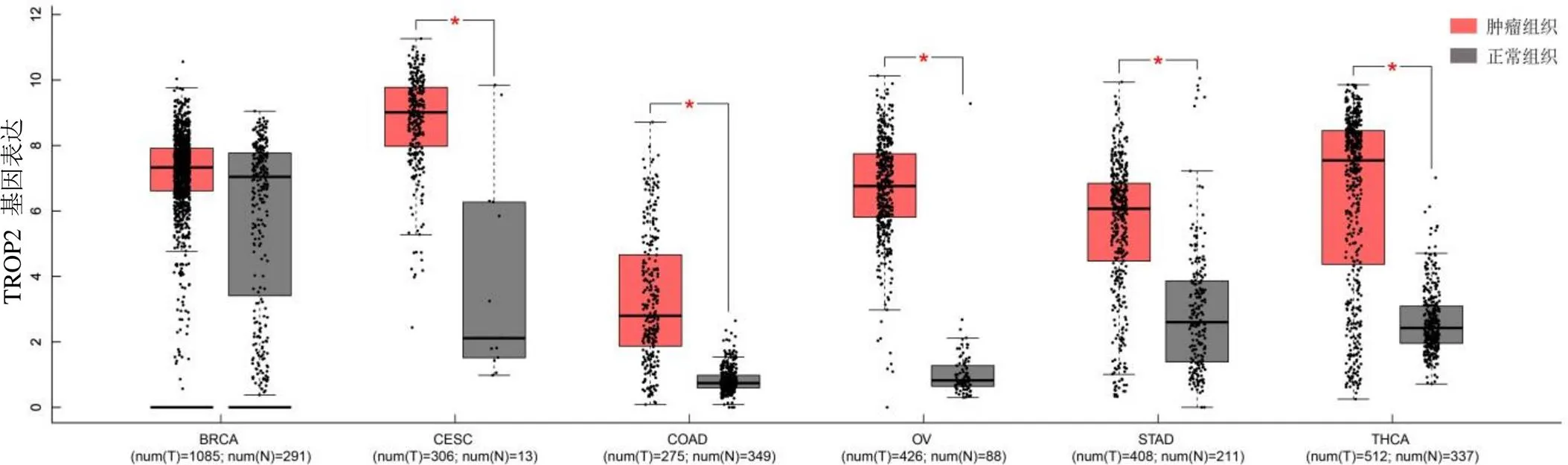
图1 TROP2 蛋白在肿瘤组织(红色柱形图)和正常组织(灰色柱形图)中的表达情况(BRCA:乳腺浸润癌;CESC:宫颈鳞癌和腺癌;COAD:结肠癌;OV:卵巢癌;STAD:胃癌;THCA:甲状腺癌)(来源于 GEPIA 数据库 http://gepia. cancer-pku.cn)
3 TROP2 靶向 ADC 药物的最新研究进展
目前,除了已被美国 FDA 批准上市的用于治疗 TNBC 的 IMMU-132,还有几种新型TROP2 靶向 ADC 药物进入临床研究,如 DS-1062、SKB264、ESG-401、JS-108 和 FDA018等,用于治疗乳腺癌、非小细胞肺癌(NSCLC)和膀胱癌等实体肿瘤,我们在表1 中对这些药物的临床进展阶段、适应证、用药方案及临床试验编号进行了总结。下面对 TROP2 靶向 ADC 药物的构成、弹头分子类型以及最新临床试验方案及相关研究进展等方面进行概述。

表1 TROP2 靶向 ADC 药物及其临床研究项目
3.1 Sacituzumab govitecan(IMMU-132)
IMMU-132 是首个被批上市的靶向 TROP2 的 ADC,主要用于转移性 TNBC 及其他实体肿瘤的治疗。其由伊立替康的活性代谢产物 SN-38 通过可裂解连接子(CL2A)与人源化 IgG1 单抗 HRS7 偶联而成[14-16]。SN-38 是一种拓扑异构酶抑制剂,通过抑制拓扑异构酶 I 造成 DNA 损伤,其细胞毒性是伊立替康的100 ~ 1000 倍[17-18]。与其他常用的高细胞毒性弹头分子(IC50为亚纳摩尔水平)相比,SN-38 属中等毒性的细胞毒分子(IC50为纳摩尔到几十纳摩尔水平)[19],因此一个抗体分子上可以连接更多的 SN-38 分子。CL2A 连接子含有短的不可裂解的亲水性聚乙二醇片段,该片段的存在使得每个抗体分子可以通过还原的二硫键连接 8 个疏水性 SN-38 分子而不产生聚集[20]。此外,CL2A 为 pH 敏感型连接子,在酸性肿瘤环境中通过碳酸苄酯键水解释放 SN-38[20]。IMMU-132 分子中一个抗体平均连接 7.6 个 SN-38 分子,与之前报道的平均连接 4 个弹头分子的 ADC 相比,载药量更高、分子均一性也更好(平均载药量接近最大载药量 8)。临床试验中发现,除了 TNBC,IMMU-132 对晚期或转移性 NSCLC、复发性胶质母细胞瘤、浸润性膀胱癌以及转移性尿路上皮癌等患者的治疗也有良好的效果。
在 I/II 期临床试验(NCT01631552)中,I 期试验主要评估 IMMU-132 单药用于先前接受过治疗的晚期上皮性癌症患者的安全性和耐受性;II 期试验主要目标是评估 IMMU-132 在采用 I 期临床试验选择的剂量、治疗周期为 21 d 情况下的安全性和有效性。在 I 期临床试验中,接受 IMMU-132 治疗的 25 名患者(包括 TNBC、NSCLC 和其他癌症)中有 2 名获得部分缓解(PR),16 名患者病情稳定(SD)。其中仅报告乏力 3 例,中性粒细胞减少 2 例,腹泻 1 例,白细胞减少 1 例[21]。在 II 期临床试验的剂量扩展部分,给与178 名晚期实体肿瘤患者 8 或 10 mg/kg 的 IMMU-132 用于治疗[22]。结果表明,10 mg/kg 剂量组的客观缓解率(ORR)和临床获益率(CBR)均高于 8 mg/kg 剂量组。因此,10 mg/kg 被选择作为 III 期临床试验的治疗剂量。
在 III 期临床试验(NCT02574455)中,仅在难治或复发的转移性 TNBC 患者中进行,这些患者先前至少接受过两种化疗方案。该研究共有 529 名 TNBC 患者,其中在脑转移阴性的 468 例患者中,共有 146 名在初次诊断时没有 TNBC。这项临床方案的主要目的是比较 IMMU-132 与医生选择治疗(TPC)的疗效,其中包括卡培他滨、吉西他滨、长春瑞滨和艾日布林。与先前报道的实验结果相似[23],与 TPC 组相比,IMMU-132 组疗效结果持续改善。在最初诊断时没有 TNBC 的患者中,IMMU-132 组的 ORR 为 31%,而 TPC 组为 4%。在 IMMU-132 组中,1 名患者(1%)有完全缓解(CR);21 名患者(30%)有 PR。在 TPC 组中,1 名患者(1%)有 CR,2 名患者(3%)有 PR。在 IMMU-132 组和 TPC 组中,CBR 分别为 44% 和 7%,中位缓解持续时间(DOR)分别为 5.6 个月和 3.5 个月。在初次诊断为 TNBC 的患者中,得到了与上述相似的结果:在 IMMU-132 组与 TPC 组中,9 名患者(5%)与 1 名患者(1%)获得了 CR,51 名患者(31%)与 7 名患者(4%)获得了 PR。
在初诊时无 TNBC 的患者中,IMMU-132 组和 TPC 组均有 2 名患者(各3%)出现≥ III 级的治疗相关发热性中性粒细胞减少症;在初诊时有 TNBC 的患者中,IMMU-132 组和 TPC 组出现上述不良反应的患者数分别为 13(7%)和 3(2%)。在初诊时无 TNBC 的患者中,IMMU-132 和 TPC 组分别有 16% 和 25% 的患者因治疗相关不良事件(TRAE)而减量;减量的最常见原因是中性粒细胞减少(9% vs 25%)和腹泻(4% vs 0%)。IMMU-132 和 TPC 因治疗突发不良事件(AE)而停药的比例很低(5% vs 7%),并且这个亚组中的两个治疗组都没有发生治疗相关的死亡。在初诊为 TNBC 患者中,IMMU-132 组与 TPC 组因 TRAE 而减少剂量的频率相似(21% vs 22%);减少剂量的最常见原因是中性粒细胞减少(11% vs 17%,包括中性粒细胞减少和发热性中性粒细胞减少)。在这个亚组中,两组因治疗突发 AE 而停药的比例都很低(两组均为 4%),但 TPC 组发生了一起治疗相关的死亡。总之,与 TPC 组相比,接受 IMMU-132 治疗的患者有更明显的生存益处,且安全性是可接受的[24]。根据这些试验结果,FDA 批准 IMMU-132 用于先前接受过两种或两种以上系统治疗的不可切除的局部晚期或转移性 TNBC 患者。
在美国,HR+/HER2-乳腺癌约占所有乳腺癌亚型的 70%[25],且一旦发生转移,五年生存期以上的患者只有 24%[26-27]。TROPiCS-02(NCT03901339)是一项正在进行的 III 期临床试验,主要针对之前接受过 2 ~ 4 次化疗的 HR+/HER2-转移性乳腺癌(MBC)患者。根据实体瘤的疗效评价标准(RECIST 1.1)进行评估,试验结果显示,IMMU-132 单药治疗显示出显著的临床活性,治疗人群的 ORR 为 31%,患者的 CBR 为 48%,中位 DOR 为 7.4 个月(95% CI:4.4 ~ 18.3),中位无进展生存期(PFS)为6.8 个月(95% CI:4.6 ~ 8.9)[28]。另外,IMMU-132 表现出可控的安全性,在有可用数据的 50 名患者中,III/IV 级发热性中性粒细胞减少症(4%)和腹泻(2%)的发生率较低[28]。治疗期间没有发现间质性肺病、皮疹及严重的治疗相关神经病变或心脏不良事件的病例,也没有治疗相关死亡的报告。这些数据证明了 IMMU-132 单药治疗的有效性和安全性,并为评估 IMMU-132 治疗 HR+/HER2-乳腺癌提供了依据。
目前,IMMU-132 在临床试验中显示出良好的抗肿瘤效果,但其潜在的毒副作用不容小觑,弹头分子 SN-38 最常见的副作用是血液毒性(中性粒细胞减少症、发热性中性粒细胞降低症)和非血液毒性(如恶心、嗜睡和延迟性腹泻),后者是 SN-38 的主要毒性[29-30]。另外,由于 TROP2 可在一些正常细胞或组织表达,造成抗体的脱靶效应,IMMU-132 可能会引起间质性肺病(ILD)[31],未来还需要进行更多的临床研究以确定 IMMU-132 在治疗 TNBC 以外的其他癌症时的副作用是否可控。截至 2023 年 5 月,近 60 项临床研究正在进行评估中,例如 IMMU-132 与多西他赛(NCT05089734)联合或与派姆单抗/铂类联合(NCT05186974 和NCT05186974)作为晚期或转移性 NSCLC 患者的一线治疗、以及单独用药治疗复发性胶质母细胞瘤的 II 期临床试验(NCT04559230)和治疗浸润性膀胱癌的II 期临床试验(NCT05581589)等。在不久的将来,将确定这些除 TNBC 以外的其他肿瘤类型患者是否能从 IMMU-132 治疗中受益。
3.2 Datopotamab deruxtecan(DS-1062)
DS-1062 是由 Daiichi Sankyo 和阿斯利康合作开发的以 TROP2 为靶点的 ADC,用于治疗转移性 TNBC 和晚期或转移性 NSCLC。DS-1062 由人源化抗 TROP2 的 IgG1 单抗通过可酶切的四肽 GGFG(GlyGlyPheGly)连接子与 DXd(依沙替康衍生物)偶联而成[32]。GGFG 连接子减少 ADC 的疏水性和聚集性,使其具有更高的稳定性和更慢的清除率,并且该连接子只能被溶酶体酶切割,在一定程度上有助于克服药物早期释放造成的系统毒性[33]。IMMU-132 的抗体 hRS-7 的D值为 0.3 nmol/L,而 DS-1062 的抗体的D值为 27 nmol/L,推测 DS-1062 采用较低亲和力的抗体来降低其在正常组织中的毒性。DXd 是一种高膜渗透性拓扑异构酶 I 抑制剂,通过抑制 DNA 拓扑异构酶进而诱导 DNA 损伤来杀伤肿瘤细胞[32]。DXd 作为依沙替康的衍生物,虽然与伊立替康具有相同的细胞毒作用机制,但是它的抗癌活性却是伊立替康的活性代谢产物 SN-38 的 9 倍[33]。此外,DXd 为脂溶性分子,具有“旁观者效应”[34],且在血液中的半衰期较短,动物实验显示,其在循环系统中半衰期只有 1.37 h[35]。据报道,DXd 在各种肿瘤异种移植瘤模型(包括伊立替康耐药模型)中比伊立替康具有更好的治疗效果[36]。DS-1062 的平均药物-抗体比(drug-to-antibody ratio,DAR)为 4,其选用的抗体、连接子和细胞毒药物都经过精心设计,可望有更好的安全性和疗效。
目前,针对 DS-1062 的临床试验正在几种不同的实体瘤中进行。TROPION-PanTumor01 的 I 期临床试验(NCT03401385)结果显示,DS-1062 的 ORR 为 32%,包括 1 例 CR、13 例 PR 和 18 例 SD。在一个由 27 名以前未接受过弹头分子为拓扑异构酶 I 抑制剂的 ADC 治疗的患者组成的亚组中,ORR 为 44%,包括 1 例 CR,11 例 PR 和 10 例 SD。在整体队列中,DS-1062 的中位 PFS 为 4.3 个月(95% CI,3.0 ~ 7.3),中位总生存期(OS)为 12.9 个月(95% CI,10.1 ~ 14.7)。在先前未用拓扑异构酶 I 抑制剂治疗的患者亚组中,中位 PFS 和 OS 分别为 7.3 个月(95% CI,3.0 ~ 18.0)和 14.3 个月(95% CI,10.5 ~ NE)。疾病控制率(DCR)在整体队列和先前未治疗的亚组中是一致的,分别为 80% 和 81%。在治疗中发现,有 98%(任何等级)和 41%(等级≥ III 级)的患者观察到治疗期出现的不良事件(TEAE)。其中最常见的 TEAE(任何等级,等级≥ III 级)是口腔炎(80%,10%)、恶心(56%,0%)、疲劳(46%,2%)和脱发(37%,0%)[37]。
虽然 DS-1062 在 NCT03401385 中具有出色的临床表现,但是仍需要更多的临床试验确认其安全性和有效性,以进一步拓宽适应证并为上市提供依据。例如:I 期临床试验 NCT04612751,旨在评估 DS-1062 与德瓦鲁单抗联合(不联合)卡铂治疗晚期或转移性 NSCLC 患者的安全性和耐受性;I 期临床试验 NCT04526691,旨在测试 DS-1062 与派姆单抗联合治疗晚期或转移性 NSCLC 的安全性和疗效;III 期临床试验 NCT05104866,旨在评估 DS-1062 在曾接受过一种或两种系统化疗的不可手术或转移性 HR+/HER2-乳腺癌患者中的安全性和有效性;III 期多中心临床研究 NCT05374512,旨在评估 DS-1062 与研究人员选择的化疗相比,对不适合 PD-1/PD-L1 抑制剂治疗的局部复发无法手术或转移的 TNBC 患者的疗效和安全性。
3.3 SKB264
SKB264 是四川科伦药业有限公司开发的一种新型 TROP2 靶向 ADC,其抗体部分采用人源化抗体 HRS7(与 IMMU-132 相同),弹头部分是新型拓扑异构酶 I 抑制剂贝洛替康的衍生物 KL610023(也称 T030),两者通过含2-(甲基磺酰基)嘧啶接头的连接子(酶可裂解连接子)连接[38-39]。KL610023 是一种新的喜树碱类似物,在临床前研究中,与包括拓扑替康在内的其他喜树碱制剂相比,贝洛替康具有更强的抗肿瘤活性[40]。SKB264 的连接子是在 CL2A 的基础上进行修饰的,其结构与 CL2A 高度相似。SKB264 的 DAR 为 7.4,与 IMMU-132(DAR 为 7.6)相近,但 SKB264 的偶联方式采用的是甲磺酸与硫醇通过亲核芳香取代机制进行反应,所以 SKB264 不会像其他含有硫醇-马来酰亚胺(如 IMMU-132 采用的 CL2A 连接子)的连接子一样,易和带有巯基的白蛋白反应导致 linker-payload 脱落,因而更加稳定,减少了毒副作用[38, 41]。临床前研究显示,SKB264 在荷瘤小鼠模型中的半衰期约为 57 h,而 IMMU-132 在同一模型中的半衰期为 14 h,说明,SKB264 在体内比 IMMU-132 具有更高的稳定性[21, 42]。另外,SKB264 还具有更强的靶向作用和强效的抗肿瘤活性[42]。目前,SKB264 正在进行多项临床试验,包括 NCT04152499 的 I/II 期临床试验,针对现有标准疗法无效的局部晚期不可切除(转移性)实体肿瘤患者。该研究包括 I 期剂量递增和 II 期剂量扩展,试验结果显示,5 例 TNBC 患者中2 例获得 PR(ORR 40%),5 例卵巢癌患者中 3 例获得 PR(ORR 60%),1 例 HER2 阳性乳腺癌患者获得 PR(1/1)。另外,SKB264 最常见的 I ~ II 级 TEAE 是恶心(72.2%)和脱发(66.7%)。最常见的≥ III 级的 TEAE 是中性粒细胞减少(5/18)、白细胞减少(4/18)和贫血(3/18)。不过,上述 TEAE 经治疗后均可恢复正常,并且在这项研究中没有 TEAE 导致的死亡事件。初步临床结果表明,SKB264 对晚期 TNBC 患者有明显疗效,对其他表达 TROP2 的晚期或转移性实体瘤也有较好疗效并且具有可控的副作用。
目前,SKB264 治疗晚期或转移性 NSCLC 的临床试验共有两项被批准。其中,2022 年 4 月,一项 II 期临床试验(NCT05351788)被批准用于评估 SKB264 联合 KL-A167 治疗晚期或转移性 NSCLC 的安全性、耐受性和初步抗肿瘤活性;2023 年 4 月,一项 II 期临床试验(NCT05816252)被批准用于评估 SKB264 作为单一疗法或联合疗法治疗晚期或转移性 NSCLC 的安全性、耐受性和客观反应率。
3.4 ESG-401
ESG-401 由 Escugen Biotechnology 有限公司和 Sorrento 的子公司 Levena Biopharma 有限公司共同开发。ESG-401 由人源化抗TROP2 单克隆抗体通过创新型的、高度稳定的和可裂解的连接子偶联 SN-38 组成。ESG-401 在安全性、有效性和工艺稳定性方面具有显著的优势,具有治疗包括 TNBC 和尿路上皮癌等 TROP2 过度表达的实体瘤的潜力。在临床前研究中,ESG-401 表现出非常好的安全性,在非人灵长类试验中,高剂量及重复给药未观察到脱靶(off-target)或脱肿瘤(off-tumor)毒性。此外,ESG-401 还在一系列 TROP2 阳性的肿瘤模型中表现出显著的抗肿瘤活性,并且具有低有效剂量及长抑制时间的特点。目前,有一项关于 ESG-401 的 I/II 期临床试验(NCT04892342)正在进行中,其中 I 期临床试验的主要目标是评估 ESG-401 作为单药在晚期上皮癌患者中以 21 d 为一个治疗周期的安全性和耐受性。II 期临床试验的主要目标是评估 ESG-401 以 I 期临床试验选定的剂量按 21 d 治疗周期给药的安全性和疗效。
3.5 JS-108(DAC-002)
JS-108 是由杭州 DAC 生物科技有限公司和上海君实生物科技有限公司开发,是一种新型靶向 TROP2 的 ADC,由抗TROP2 的重组人源化单克隆抗体通过 2,3-二取代的长侧链不可裂解智能连接子与微管溶菌素(tubulysin B)类似物 Tub196 偶联组成。Tub196 是一种微管蛋白抑制剂,通过抑制微管蛋白聚合从而诱导细胞凋亡,因此其抗瘤谱可扩展至对拓扑异构酶抑制剂耐药的肿瘤。此外,JS-108 使用非裂解性连接子,其在溶酶体内不会断裂释放游离药物,因此不会产生“旁观者效应”,从而避免对非靶细胞的毒性。NCT04601285 是一项关于 JS-108 首次人体 I 期临床试验研究,旨在评估 JS-108 对晚期实体肿瘤患者的安全性、耐受性、PK 谱和疗效。
3.6 FDA018
FDA018 是由上海复旦张江生物制药有限公司开发的靶向 TROP2 的抗肿瘤 ADC,其有效载荷和连接物未公开。国家药品监督管理局(NMPA)已允许 FDA018 进入I 期临床试验(NCT05174637),旨在评估 FDA018 对晚期(转移性)实体瘤患者的安全性、耐受性、药代动力学和疗效。
3.7 GQ1003
GQ1003 是 Gene Quantum Healthcare 公司基于其专有技术平台[智能连接酶催化偶联(ILDC)研发平台]开发的 TROP2 靶向 ADC 药物,三星生物负责该候选药物的生产工艺技术开发服务。目前,GQ1003 处于临床 IND 阶段,用于治疗 NSCLC、TNBC 以及其他实体肿瘤。
4 展望
总之,目前虽然首个靶向 TROP2 的 first-in-class 药物 IMMU-132 已获批上市,但其他以 TROP2 为靶点的新型 ADC 的研究依然如火如荼,并且这些 ADC 在抗体及载荷的选择及连接子设计等方面均有差异化的创新和不同程度的超越,以求达到更好的安全性和治疗效果。这些 ADC 的研发也为 TNBC、NSCLC 以及其他 TROP2 高表达的实体肿瘤的患者带来了希望的曙光,但具体哪些品种在安全性、疗效及适应证等方面会比 IMMU-132 有所超越或能够脱颖而出,还需等待进一步临床试验结果。未来的研究首先需要确定 TROP2 在不同癌症类型中不同的表达水平以及致癌潜力,同时,揭示 TROP2 在肿瘤发展中的复杂生物学功能将有助于合理设计 TROP2 靶向策略。虽然靶向 TROP2 的 ADC 在临床试验中显示出良好的治疗效果,但是其带来的毒副作用依然不可忽视。例如,DS-1062 的有效载荷依喜替康衍生物 DXd 比伊立替康的活性代谢物 SN-38 具有更强的破坏 DNA 的能力,与此同时 DXd 带来的细胞毒性风险也就越大。由于脱靶效应,DS-1062 可能会使患者产生 ILD。所以,在 TROP2 靶向 ADC 的开发中,有效载荷的选择至关重要。另外,连接子的稳定性和疏水性对 ADC 药效的影响极大:提高连接子亲水性可以提高药物在水中的溶解度,可能有助于抗耐药性;连接子适宜的稳定性可以保证药物的缓慢释放,有助于提高疗效和改善耐受性。实际上,目前 TROP2 靶向 ADC 的开发处于相对成熟的阶段,开发和优化新型 ADC 以及如何进行药物联合应用将是未来的研究重点。
[1] Peng J, Ou Q, Deng Y, et al. TROP2 overexpression in colorectal liver oligometastases is associated with poor prognosis after liver resection. Ther Adv Med Oncol, 2019, 11:1758835919897543.
[2] Cubas R, Li M, Chen C, et al. Trop2: a possible therapeutic target for late stage epithelial carcinomas. Biochim Biophys Acta, 2009, 1796(2):309-314.
[3] Li X, Teng S, Zhang Y, et al. TROP2 promotes proliferation, migration and metastasis of gallbladder cancer cells by regulating PI3K/AKT pathway and inducing EMT. Oncotarget, 2017, 8(29): 47052-47063.
[4] Gu QZ, Nijiati A, Gao X, et al. TROP2 promotes cell proliferation and migration in osteosarcoma through PI3K/AKT signaling. Mol Med Rep, 2018, 18(2):1782-1788.
[5] Yang T, Jia L, Bian S, et al. TROP2 down-regulated DSG2 to promote gastric cancer cell invasion and migration by EGFR/AKT and DSG2/PG/β-catenin pathways. Curr Cancer Drug Targets, 2022, 22(8):691-702.
[6] Zimmers SM, Browne EP, Williams KE, et al. TROP2 methylation and expression in tamoxifen-resistant breast cancer. Cancer Cell Int, 2018, 18:94.
[7] Stepan LP, Trueblood ES, Hale K, et al. Expression of Trop2 cell surface glycoprotein in normal and tumor tissues: potential implications as a cancer therapeutic target. J Histochem Cytochem, 2011, 59(7):701-710.
[8] Trerotola M, Cantanelli P, Guerra E, et al. Upregulation of Trop-2 quantitatively stimulates human cancer growth. Oncogene, 2013, 32(2):222-233.
[9] Zagami P, Carey LA. Triple negative breast cancer: Pitfalls and progress. NPJ Breast Cancer, 2022, 8(1):95.
[10] Liu T, Liu Y, Bao X, et al. Overexpression of TROP2 predicts poor prognosis of patients with cervical cancer and promotes the proliferation and invasion of cervical cancer cells by regulating ERK signaling pathway. PLoS One, 2013, 8(9):e75864.
[11] Zhao W, Kuai X, Zhou X, et al. Trop2 is a potential biomarker for the promotion of EMT in human breast cancer. Oncol Rep, 2018, 40(2):759-766.
[12] Wen Y, Ouyang D, Zou Q, et al. A literature review of the promising future of TROP2: a potential drug therapy target. Ann Transl Med, 2022, 10(24):1403.
[13] Bignotti E, Todeschini P, Calza S, et al. Trop-2 overexpression as an independent marker for poor overall survival in ovarian carcinoma patients. Eur J Cancer, 2010, 46(5):944-953.
[14] Goldenberg DM, Cardillo TM, Govindan SV, et al. Trop-2 is a novel target for solid cancer therapy with sacituzumab govitecan (IMMU-132), an antibody-drug conjugate (ADC). Oncotarget, 2015, 6(26):22496-22512.
[15] Cardillo TM, Govindan SV, Sharkey RM, et al. Sacituzumab govitecan (IMMU-132), an anti-Trop-2/SN-38 antibody-drug conjugate: characterization and efficacy in pancreatic, gastric, and other cancers. Bioconjug Chem, 2015, 26(5):919-931.
[16] Cardillo TM, Govindan SV, Sharkey RM, et al. Humanized anti-Trop-2 IgG-SN-38 conjugate for effective treatment of diverse epithelial cancers: preclinical studies in human cancer xenograft models and monkeys. Clin Cancer Res, 2011, 17(10):3157-3169.
[17] Rivory LP, Robert J. Molecular, cellular, and clinical aspects of the pharmacology of 20(S)camptothecin and its derivatives. Pharmacol Ther, 1995, 68(2):269-296.
[18] de Man FM, Goey AKL, van Schaik RHN, et al. Individualization of irinotecan treatment: a review of pharmacokinetics, pharmacodynamics, and pharmacogenetics. Clin Pharmacokinet, 2018, 57(10):1229-1254.
[19] Moon SJ, Govindan SV, Cardillo TM, et al. Antibody conjugates of 7-ethyl-10-hydroxycamptothecin (SN-38) for targeted cancer chemotherapy. J Med Chem, 2008, 51(21):6916-6926.
[20] Goldenberg DM, Sharkey RM. Antibody-drug conjugates targeting TROP-2 and incorporating SN-38: a case study of anti-TROP-2 sacituzumab govitecan. MAbs, 2019, 11(6):987-995.
[21] Starodub AN, Ocean AJ, Shah MA, et al. First-in-human trial of a novel anti-Trop-2 antibody-SN-38 conjugate, sacituzumab govitecan, for the treatment of diverse metastatic solid tumors. Clin Cancer Res, 2015, 21(17):3870-3878.
[22] Ocean AJ, Starodub AN, Bardia A, et al. Sacituzumab govitecan (IMMU-132), an anti-Trop-2-SN-38 antibody-drug conjugate for the treatment of diverse epithelial cancers: Safety and pharmacokinetics. Cancer, 2017, 123(19):3843-3854.
[23] Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med, 2021, 384(16): 1529-1541.
[24] Bardia A, Tolaney SM, Punie K, et al. Biomarker analyses in the phase III ASCENT study of sacituzumab govitecan versus chemotherapy in patients with metastatic triple-negative breast cancer. Ann Oncol, 2021, 32(9):1148-1156.
[25] Howlader N, Altekruse SF, Li CI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst, 2014, 106(5):dju055.
[26] Harb WA. Management of patients with hormone receptor-positive breast cancer with visceral disease: challenges and treatment options. Cancer Manag Res, 2015, 7:37-46.
[27] Colleoni M, Sun Z, Price KN, et al. Annual hazard rates of recurrence for breast cancer during 24 years of follow-up: results from the international breast cancer study group trials I to V. J Clin Oncol, 2016, 34(9):927-935.
[28] Rugo HS, Bardia A, Tolaney SM, et al. TROPiCS-02: a phase III study investigating sacituzumab govitecan in the treatment of HR+/HER2- metastatic breast cancer. Future Oncol, 2020, 16(12): 705-715.
[29] Vanhoefer U, Harstrick A, Achterrath W, et al. Irinotecan in the treatment of colorectal cancer: clinical overview. J Clin Oncol, 2001, 19(5):1501-1518.
[30] Araki E, Ishikawa M, Iigo M, et al. Relationship between development of diarrhea and the concentration of SN-38, an active metabolite of CPT-11, in the intestine and the blood plasma of athymic mice following intraperitoneal administration of CPT-11. Jpn J Cancer Res, 1993, 84(6):697-702.
[31] Shaffer C. Trop2 deal heats up antibody-drug conjugate space in cancer. Nat Biotechnol, 2021, 39(2):128-130.
[32] Okajima D, Yasuda S, Maejima T, et al. Datopotamab deruxtecan, a novel TROP2-directed antibody-drug conjugate, demonstrates potent antitumor activity by efficient drug delivery to tumor cells. Mol Cancer Ther, 2021, 20(12):2329-2340.
[33] Ogitani Y, Aida T, Hagihara K, et al. DS-8201a, a novel HER2-targeting ADC with a novel DNA topoisomerase I inhibitor, demonstrates a promising antitumor efficacy with differentiation from T-DM1. Clin Cancer Res, 2016, 22(20):5097-5108.
[34] Ogitani Y, Hagihara K, Oitate M, et al. Bystander killing effect of DS-8201a, a novel anti-human epidermal growth factor receptor 2 antibody-drug conjugate, in tumors with human epidermal growth factor receptor 2 heterogeneity. Cancer Sci, 2016, 107(7):1039-1046.
[35] Nagai Y, Oitate M, Shiozawa H, et al. Comprehensive preclinical pharmacokinetic evaluations of trastuzumab deruxtecan (DS-8201a), a HER2-targeting antibody-drug conjugate, in cynomolgus monkeys. Xenobiotica, 2019, 49(9):1086-1096.
[36] Kumazawa E, Jimbo T, Ochi Y, et al. Potent and broad antitumor effects of DX-8951f, a water-soluble camptothecin derivative, against various human tumors xenografted in nude mice. Cancer Chemother Pharmacol, 1998, 42(3):210-220.
[37] Garon E, Johnson M, Lisberg A, et al. MA03.02 TROPION- PanTumor01: Updated results from the NSCLC cohort of the phase 1 study of datopotamab deruxtecan in solid tumors. J Thorac Oncol, 2021, 16(10):S892-S893.
[38] Liu Y, Lian W, Zhao X, et al. SKB264 ADC: A first-in-human study of SKB264 in patients with locally advanced unresectable/metastatic solid tumors who are refractory to available standard therapies. J Clin Oncol, 2020, 38(15_suppl):TPS3659.
[39] Lee JH, Lee JM, Kim JK, et al. Antitumor activity of 7-[2-(N-isopropylamino)ethyl]-(20S)-camptothecin, CKD602, as a potent DNA topoisomerase I inhibitor. Arch Pharmacal Res, 1998, 21(5):581-590.
[40] Kim GM, Kim YS, Ae KY, et al. Efficacy and toxicity of belotecan for relapsed or refractory small cell lung cancer patients. J Thorac Oncol, 2012, 7(4):731-736.
[41] Wang Y, Xie F, Liu L, et al. Development of applicable thiol-linked antibody-drug conjugates with improved stability and therapeutic index. Drug Deliv, 2022, 29(1):754-766.
[42] Cheng Y, Yuan X, Tian Q, et al. Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Front Oncol, 2022, 12:951589.
10.3969/j.issn.1673-713X.2023.05.006
中国医学科学院医学与健康科技创新工程(2021-I2M-1- 026);国家自然科学基金(82104052)
苗庆芳,Email:miaoqf@imb.pumc.edu.cn
2023-05-09

