蒺藜苜蓿生物钟基因MtTOC1a 的克隆及功能验证
段婷婷 ,杨明康,黄 可,黄 巍,2
(1 华南农业大学 生命科学学院, 广东 广州 510642; 2 广东省农业生物蛋白质功能与调控重点实验室/岭南现代农业科学与技术广东省实验室, 广东 广州 510642)
植物为了适应地球自转造成的环境周期性变化,产生了近24 h 周期的节律性自我调节机制,这种内源性的机制被称为生物钟[1]。生物钟参与调控植物几乎全部的生长发育和新陈代谢过程,包括开花时间、下胚轴伸长、激素信号转导等[2]。CAB 时间表达1(Timing of cab expression 1,TOC1)也被称为伪应答调节因子(Pseudo-response regulator 1,PRR1)基因,是从短周期的拟南芥突变体中克隆到的第1 个植物生物钟基因,属于PRR转录因子家族[3]。TOC1的表达以近24 h 为周期呈现节律性的振荡,在黎明时表达量最低,并在傍晚达到表达量的峰值。TOC1在中央振荡器的核心回路中发挥着重要作用:在傍晚时刻,TOC1 通过直接结合Circadian clock associated 1(CCA1)和晚长下胚轴1(Late elongated hypocotyl,LHY)的启动子抑制二者的转录活性;而在黎明时分,CCA1/LHY 能够反向抑制TOC1的表达,构成了生物钟的核心反馈回路[4-6]。除此以外,TOC1 还能够调控绝大部分生物钟基因的表达,其中包括PRR9、PRR7、PRR5和GIGANTEA(GI),因此TOC1被认为是植物生物钟的核心基因之一[6]。
TOC1 被发现参与调控植物许多生理活动:例如TOC1 能够抑制光敏色素抑制因子(Phytochromeinteracting factors 4,PIF4)和PIF5 的表达,抑制植株下胚轴过度伸长[7-8];TOC1 通过抑制脱落酸相关基因(ABA-related gene,ABAR),调控植物ABA 激素信号,从而影响植物的抗旱反应[9];TOC1 通过促进防御化合物的合成促进植物抵抗昆虫取食[10];TOC1 还能够抑制细胞分化控制6(Cell division control 6,CDC6)的表达从而影响细胞的分裂周期[11]。
蒺藜苜蓿Medicagotruncatula因其具有基因组小、自花授粉、生长周期短、结实多等优点,是豆科Leguminosae 苜蓿属Medicago的模式植物[12]。然而,蒺藜苜蓿生物钟基因的结构和功能与拟南芥的同源基因是否存在差异,目前还鲜有报道。本研究以生物钟核心基因TOC1为切入点,鉴定蒺藜苜蓿中TOC1的同源基因MtTOC1a和MtTOC1b,构建MtTOC1a的表达载体,以获得拟南芥异源转化植株并进行表型分析,旨在为TOC1基因在苜蓿植物以及其他作物中的应用提供参考。
1 材料与方法
1.1 试验材料与培养
本试验所用的蒺藜苜蓿生态型为A17。拟南芥Arabidopsisthaliana野生型为Columbia(Col)生态型。TOC1功能丧失突变体toc1-2、荧光素酶报告基因株系CAB::LUC为华南农业大学植物生物钟实验室留种。培养箱生长条件:22 ℃,12 h 光照/12 h 黑暗,光照强度为150 μmol·m-2·s-1。
1.2 蒺藜苜蓿TOC1 基因的鉴定与结构分析
以拟南芥PRR家族基因的编码序列(Coding sequence,CDS)(https://www.arabidopsis.org/)为索引,使用BioEdit 软件对蒺藜苜蓿Mt5.0 基因组CDS序列(https://medicago.toulouse.inra.fr/Mtrun A17r5.0-ANR/)做本地Blast 分析,以e-value 大于10-5的序列为候选的MtPRR家族基因。使用NCBI-CDD 在线网站(https://www.ncbi.nlm.nih.gov/Stru cture/cdd/wrpsb.cgi)分析候选基因的保守结构域,并利用MEGA11.0 软件构建拟南芥和蒺藜苜蓿PRR家族基因的系统发育树。在Unipro 数据库(https://www.uniprot.org/)检索AlphaFold 项目组所预测的MtTOC1 蛋白三维结构。
1.3 蒺藜苜蓿MtTOC1a 表达载体的构建
根据NCBI 数据库中MtTOC1a基因的CDS 序列,设计扩增引物MtTOC1a-F/R (表1),利用TRIZOL 法提取蒺藜苜蓿叶片的总RNA,反转录合成c D N A,以c D N A 为模板进行P C R 扩增MtTOC1a的CDS 片段。再利用AtTOC1pro-F/R 引物,以拟南芥DNA 为模板扩增AtTOC1的启动子片段。PCR 产物经10 g/L 的琼脂糖凝胶电泳后,利用DNA 凝胶电泳回收试剂盒对目的条带进行切胶回收,纯化后用重组酶组装至克隆载体pCambia1300。然后将连接产物转化进感受态DH5α,在含有卡那霉素抗性的LB 平板上筛选阳性菌落,并送至北京擎科生物科技有限公司进行测序,测序结果比对成功后,即得到通过无缝克隆法构建的双元表达载体AtTOC1pro::MtTOC1a。
1.4 拟南芥的遗传转化
将重组表达载体AtTOC1pro::MtTOC1a转化至GV3101 农杆菌中,使用浸花法转化Col、toc1-2、CAB::LUC和CAB::LUC/toc1-2等植株。收获T0 代种子后,在含有潮霉素抗性1/2MS 平板筛选阳性转化植株。每个基因型的转化植株至少获得5 个独立株系,经PCR 鉴定后,挑选有代表性的株系做表型试验。
1.5 拟南芥下胚轴长度测量和开花时间观察
拟南芥种子经氯气消毒后均匀撒在1/2MS 平板上,于4 ℃低温处理3 d 后转移至植物房,在短日照(8 h 光照/16 h 黑暗)22 ℃条件下生长。下胚轴测量:将生长7 d 的拟南芥幼苗铺展在平板上,拍照后使用ImageJ 软件测量幼苗的下胚轴长度。开花时间分析:将生长7 d 的拟南芥幼苗移栽到培养土中继续生长,在植株抽薹时统计莲座叶的数量。
1.6 荧光素酶活性和节律周期检测
拟南芥种子经氯气消毒后均匀撒在1/2MS 平板上,于4 板低温处理3 d 后,转移至光照培养箱(12 h 光照/12 h 黑暗,22 ℃)。幼苗生长6 d 后移入装有170 μL 1/2MS 培养基的96 孔酶标板上。在酶标板的孔中添加2.5 mmol/L 的D-Luciferin 30 μL ,于化学发光检测仪(LB942S,Berthold)中检测发光强度,每个孔读数2 s。植株培养条件包括1 d 光暗交替条件,和6 d 持续光照条件。将持续光照下0~96 h 测得的植株荧光强度数据导入https://biodare2.ed.ac.uk/网站中进行节律周期分析。
1.7 数据统计分析
试验所得数据使用统计软件SPSS 19.0 进行分析,其中下胚轴长度数据n≥30,莲座叶数量数据n≥15,生物发光数据n≥16,样品之间差异采用单因素方差分析和LSD 多重比较方法进行统计检验,数据用平均值±标准差表示。
2 结果与分析
2.1 蒺藜苜蓿MtTOC1 基因的鉴定
利用拟南芥AtTOC1基因的CDS,对蒺藜苜蓿全基因组进行Blast 比对。鉴定结果显示,蒺藜苜蓿中有8 个PRR家族的基因,其中最接近AtTOC1的同源基因有2 个,分别命名为MtTOC1a(M t r u n A 1 7 C h r 3 g 0 0 9 1 6 4 1) 和MtTOC1b(MtrunA17Chr4g0061021),其与AtTOC1的序列相似性分别为79%和77%。系统发育树分析表明,在PRR基因家族中,MtTOC1a、MtTOC1b和AtTOC1(也称为AtPRR1)聚集成一枝;同时MtTOC1a、MtTOC1b 和AtTOC1 都具有典型的P R R 结构域和C C T 结构域(图1)。利用UNIPROT 数据库检索AlphaFold 所预测的蛋白结构,分析发现MtTOC1a、MtTOC1b 和AtTOC1 蛋白具有相似的三维结构。如图2 所示,可以看到CCT 结构域折叠成两条α螺旋,并形成一个剪刀状的结构;而PR 结构域则由若干α螺旋和β折叠共同形成一个保守的桶状结构。以上结果说明TOC1作为生物钟的核心基因,在植物演化过程中受到了选择压力,从而使不同物种中的TOC1 蛋白序列高度保守。

图1 蒺藜苜蓿和拟南芥PRR 家族基因的系统发育树分析和保守结构域预测Fig. 1 Phylogenetic tree analysis and domain prediction of PRR family genes in Arabidopsis thaliana and Medicago truncatula

图2 AlphaFold 项目所预测的MtTOC1a、MtTOC1b 和AtTOC1 的蛋白三维结构Fig. 2 3D protein structures of MtTOC1a, MtTOC1b and AtTOC1 predicted by the AlphaFold project
2.2 MtTOC1a 基因的克隆和表达载体构建
由于MtTOC1a与拟南芥AtTOC1的序列相似性最高,本研究选择对MtTOC1a基因进行功能验证。根据MtTOC1a基因的CDS 序列,设计一对引物MtTOC1a-F/R,以蒺藜苜蓿A17 生态型的cDNA 为模板进行PCR 扩增。PCR 产物经琼脂糖凝胶电泳后得到略小于2 000 bp 的条带,和1 758 bp 的MtTOC1a编码序列长度基本符合,初步认为成功获得目的基因片段(图3B)。将MtTOC1a基因片段和拟南芥AtTOC1的启动子、NOS 终止子连接,使用无缝克隆方法组装到pCambia1300 表达载体上,构建得到AtTOC1pro::MtTOC1a双元表达载体(图3A、3C)。
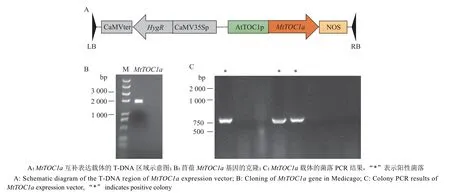
图3 MtTOC1a 表达载体的构建Fig. 3 Construction of MtTOC1a expression vector
2.3 MtTOC1a 恢复拟南芥toc1-2 突变体的表型
将AtTOC1pro::MtTOC1a载体分别转化到拟南芥野生型Col 和toc1-2突变体中,筛选获得MtTOC1a植株和MtTOC1a/toc1-2互补植株。对上述植株的表型进行分析发现,在短日照条件下,toc1-2突变体的下胚轴长度比野生型更长,但转基因植株MtTOC1a、MtTOC1a/toc1-2的下胚轴长度和野生型相比没有显著差异(图4A、5A)。该结果说明MtTOC1a的功能与AtTOC1相似,MtTOC1a能够挽救toc1-2突变体的下胚轴过度伸长表型。开花时间也是生物钟所调控的重要性状,在短日照生长条件下,拟南芥toc1-2突变体的开花时间与野生型相比提前。但值得注意的是MtTOC1a/toc1-2植株的开花时间仍然与toc1-2突变体相似,没有恢复到野生型的水平。另外MtTOC1a植株的开花时间和野生型接近,也没有表现出明显的开花时间调控效应(图4B、5B)。该结果说明MtTOC1a和AtTOC1的功能仍存在差异性,在拟南芥中MtTOC1a对开花时间的影响较小。

图4 MtTOC1a 相关转基因植株表型Fig. 4 Phenotypes of transgenic plants with MtTOC1a

图5 MtTOC1a 相关转基因植株的表型量化分析Fig. 5 Quantification analysis of the phenotypes of transgenic plants with MtTOC1a
2.4 MtTOC1a 基因部分恢复拟南芥toc1-2 的节律周期
CAB::LUC荧光素酶报告基因能够反映植株的近日节律周期,将AtTOC1pro::MtTOC1a转基因植株与CAB::LUC和CAB::LUC/toc1-2植株杂交,分离后获得MtTOC1a/CAB::LUC和MtTOC1a/toc1-2/CAB::LUC报告株系。在持续光照条件下检测报告基因的发光强度,研究发现toc1-2突变体和野生型相比近日周期缩短了大约3.0 h;MtTOC1a/toc1-2异源互补植株的近日周期比toc1-2突变体延长了约1.6 h,但没有完全恢复至野生型水平;而MtTOC1a植株和野生型相比近日周期也轻微延长了约0.4 h(图6A)。虽然4 种植株的周期存在差异,但它们的相对振幅误差均较小,说明TOC1基因不会影响拟南芥植株的节律稳健性(图6B)。综上所述,本研究结果表明蒺藜苜蓿MtTOC1a能够部分弥补拟南芥AtTOC1基因在生物钟节律调控上的功能。
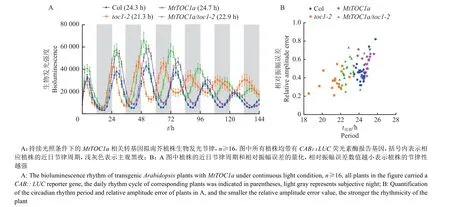
图6 MtTOC1a 相关转基因植株的近日节律周期分析Fig. 6 Circadian rhythm analysis of transgenic plants with MtTOC1a
3 讨论与结论
在拟南芥中,包括TOC1在内的PRR家族基因都参与生物钟节律的调控[13]。本研究在蒺藜苜蓿中一共鉴定到8 个PRR家族的同源基因,除了因提前终止而截短的MtTOC1t以外,其他PRR基因都具有2 个典型的保守结构域,即N 末端的PR 结构域和C 末端的CCT 结构域。和其他PRR家族成员不同的是,TOC1 的PR 结构域和CCT 结构域之间的IR(Intermediate region)区域不存在转录抑制基序,这可能是TOC1的功能独立于其他PPR基因的原因之一[14]。目前对PRR基因的三维结构研究还很少,本研究通过对三维结构的预测发现,TOC1 的CCT 结构域倾向于形成剪刀状结构,PR 结构域倾向于形成桶状结构,而其他非保守区主要由无规卷曲所构成。TOC1 是植物特有的转录因子,CCT 结构与DNA 分子结合,PR 结构域具有转录调节活性[14],这些结构域的细微差异可能与不同物种中TOC1功能的特异性有关。
TOC1的功能在不同植物中既存在保守性也存在特异性。TOC1是起源最古老的生物钟核心基因之一,在藻类、苔藓植物、被子植物中都能够找到TOC1的同源基因[15]。即使在较原始的植物金牛鸵球藻Ostreococcustauri中,OtTOC1仍然对近日节律有明显调控作用,说明TOC1的生物钟功能在植物界中是高度保守的[14]。然而,不同植物的TOC1的功能也存在特殊性,例如拟南芥的TOC1突变体具有抗旱性增强表型,然而在烟草中敲低TOC1的表达量则导致植株对干旱更加敏感[9,16]。本研究通过将蒺藜苜蓿MtTOC1a异源转化拟南芥toc1-2突变体,直接比较了MtTOC1a和AtTOC1功能的差异,结果发现MtTOC1a能够完全恢复toc1-2的下胚轴伸长表型,但却对开花时间没有影响,另外,对近日节律周期分析发现MtTOC1a仅能够部分弥补AtTOC1的功能。蒺藜苜蓿中除了MtTOC1a以外,还存在另一个TOC1的同源基因MtTOC1b,MtTOC1b可能对MtTOC1a的功能有补充和增强的作用。该结果说明,MtTOC1a和AtTOC1在植物演化过程中出现了一定程度的功能分化,不能简单地将拟南芥的研究成果套用到蒺藜苜蓿研究当中。
生物钟基因调控植物众多农艺性状,例如植株分蘖数、开花时间、抗逆性等[17]。最近研究发现,生物钟对苜蓿的生长发育十分重要,MtLHY能够促进苜蓿根系与根瘤菌的互作,增加根瘤的数量,从而使植株生物量提高[18]。生物钟夜间复合体基因MtLUX直接抑制转录因子MtTB1,调控苜蓿的分枝和株形,同时对开花时间、根瘤也有重要调控作用[19-20]。苜蓿和拟南芥相比,具有共生固氮等豆科植物特有的性状,这可能是苜蓿生物钟基因拷贝数增加,功能出现更多分化的原因。TOC1能够直接抑制LHY和LUX的表达[6],由此推测MtTOC1可能通过MtLHY和MtLUX来间接影响根瘤共生、分枝数等性状。因此,探究MtTOC1在苜蓿农艺性状的调控中扮演的角色,是今后研究中需要重点关注的问题。

