OsRAC3 调控水稻籽粒性状的功能分析
刘慧丽 ,郭子鸣,程泰然,张志成
(华南农业大学 生命科学学院, 广东 广州 510642)
水稻OryzasativaL.作为最重要的粮食作物之一,是世界上一半以上人口的主要食物来源[1]。为了满足日益增长的粮食需求,缓解农业生产面临的巨大压力,利用生物技术高效育种来提高作物产量至关重要[2]。水稻产量与3 个性状密切相关:株穗数、穗粒数和粒质量[3]。穗粒数和粒质量主要在穗的分化与发育过程中受影响,与花序分生组织的活性密切相关[4-7]。研究表明,在水稻生长发育过程中,分生组织活性下降会导致穗分支数和籽粒数减少[8-10]。一些与高产相关的基因如Gn1a、PROG1、DEP1、APO1、IPA1等被证明能够增强花序分生组织活性[11-18]。
RAC/ROPs (Rac GTPase protein/Rho-ofplant)是植物特有的一个Rho GTPase 亚家族,作为分子开关广泛参与植物生长发育、激素信号转导以及响应环境刺激等多种生理过程[19-24]。植物中小G 蛋白RAC/ROPs 通常在与GDP 结合的非活性形式和与GTP 结合的活性形式之间相互转换。GTP 结合状态的RAC/ROPs 与效应蛋白相互作用,调控下游的信号转导[25]。RAC/ROPs 活性与非活性形式之间的转换,受到鸟苷酸交换因子(Guanine nucleotide exchange factors,GEFs)、GTPase 活化蛋白(GTPase-activating proteins,GAPs)和鸟苷酸水解阻遏因子(Guanine nucleotide dissociation inhibitors,GDIs) 的调控。GEFs 可以促进与RAC/ROPs 结合的GDP 与GTP 发生交换,从而激活RAC/ROPs。GAPs 的作用是激活RAC/ROPs 的GTP 酶活性,使与RAC/ROPs 结合的GTP 水解。GDIs 可以抑制与RAC/ROPs 结合的GDP 的解离和GTP 的水解[26]。拟南芥中RAC/ROPs 参与调节生长发育的多个过程和对环境刺激作出应答[27-34]。有研究表明,在拟南芥中,Rop1参与调控花粉管的极性生长[27-29,34],Rop2、Rop4、Rop6参与根毛发育的调控[30-31],Rop2、Rop4参与叶片表皮发育[32],Rop9、Rop10参与脱落酸和生长素诱导的根的发育和种子的萌发[33]。水稻中RAC/ROPs 共有7 个成员,其中,OsRac4、OsRacD和OsRacB作为负调控因子参与水稻病害应答的调控[35-37]。研究发现水稻中RAC/ROP 家族的OsRAC1同样能使水稻籽粒变大,产量提高;OsRAC1通过与OsMAPK6 相互作用提高后者的磷酸化水平,从而促进颖壳细胞分裂,增加细胞数量,导致水稻籽粒变大[38]。目前鲜见有关于其他的RAC/ROPs 影响水稻产量性状的报道。
本研究将探究OsRAC3在水稻幼穗和花器官中的表达情况,并进一步了解其在水稻产量性状方面的作用。通过持续激活型突变体(Constitutively activated,CA)CA-osrac3和显性失活型突变体(Dominant negative,DN)DN-osrac3与野生型的比较,揭示OsRAC3对水稻籽粒大小、千粒质量等产量性状的影响,证实其在水稻籽粒发育过程中的重要作用;这将有助于加深我们对水稻产量的调控机制的理解,并为水稻育种和农业生产提供改良策略。
1 材料与方法
1.1 试验材料
本研究所用的野生型水稻品种为粳稻‘中花11’(ZH11),生长周期为80~90 d;基于ZH11 构建的外源导入点突变转基因植株为CA-osrac3和DNosrac3。材料种植于广东省广州市华南农业大学增城基地。
1.2 试验方法
1.2.1 材料的获取 使用RAC/ROPs 功能获得性突变体(Gain of function mutant)进行分析。通过基因点突变的方法替换特定的氨基酸,使得RAC/ROPs 蛋白一直处于与GTP 结合的持续活性状态,即持续激活型;或一直处于与GDP 结合的非活性状态,即显性失活型。本研究通过点突变将OsRAC3中距离ATG 的第50 个碱基发生突变,使甘氨酸G 替换成缬氨酸V,转化水稻构建OsRAC3持续激活型突变体;在第65 个碱基处将胞嘧啶突变为腺嘌呤,实现苏氨酸T 替换成天冬酰胺N(图1),转化水稻获得显性失活型突变体。载体构建参照Liu 等[39]的方法。

图1 突变体CA-osrac3、DN-osrac3 的突变位点Fig. 1 Mutation site of mutant CA-osrac3, DN-osrac3
1.2.2 qRT-PCR 本研究采用AceQ®qPCR SYBR®Green Master Mix 试剂盒进行qRT-PCR。采用Trizol 法提取水稻不同时期的总RNA,进行RTPCR 反转录得到cDNA。利用设计好的引物进行qPCR 定量分析,反应体系(10 μL):5 μL 2× SYBR Premix Ex Taq、1 μL cDNA 模板、0.5 μL 上游引物、0.5 μL 下游引物以及3 μL ddH2O。挑选其中表达量较高的植株作进一步分析。qRT-PCR 所用试剂购于诺唯赞公司,上游引物序列为5′-GTGGTGATCAT GTCGTCGGA-3′,下游引物序列为5′-ATCTGA TACGGCTGCAGAGC-3′。
1.2.3 GUS 组织化学染色 取转基因植株花序组织,用适量的GUS 染液(pH 为7.0 的0.1 mol/L 磷酸钠缓冲液、10 mmol/L Na2EDTA、2 mmol/L K4Fe(CN)6·3H2O、2 mmol/L K3[Fe(CN)6]、1 mg/mL X-gluc)处理,在37 ℃条件下避光染色过夜。镜检观察到出现蓝色后除去GUS 染液,加入70%(φ)乙醇溶液洗脱2~3 次后,使用Retiga 2000R 数码相机在Olympus BX51 显微镜下拍照。
1.2.4 水稻穗与籽粒表型性状的观察与统计 在水稻的成熟期,挑选野生型ZH11 和突变体CAosrac3、DN-osrac3植株主穗,测量籽粒长、宽等农艺性状。每种材料随机挑取30 粒种子,使用游标卡尺测量籽粒长、宽。随机挑选至少1 000 粒饱满籽粒称量千粒质量。种子挑选过程中避免刻意挑取肥大或者瘦小的种子,以保证取样的随机性。各项数据统计均重复3 次,采用GraphPad Prism 9.3.0 软件对数据进行统计分析。
2 结果与分析
2.1 OsRAC3 在水稻中的表达模式分析
本研究前期获得了OsRAC3promoter::GUS转基因植株,发现OsRAC3在幼苗的根尖和冠根原基表达[39]。我们通过对转基因植株的花序组织进行GUS 染色,观察到OsRAC3在幼穗的花序分生组织中强烈表达(图2A),在花器官中包括颖壳(图2B)和雄蕊、雌蕊(图2C)中均有较强的表达,这些结果暗示OsRAC3可能在小穗发育和种子发育过程中发挥作用。

图2 OsRAC3 在水稻中的表达模式Fig. 2 Expression profiles of OsRAC3 in rice
2.2 野生型ZH11 以及突变体CA-osrac3、DNosrac3 的穗表型特征
本研究前期获得了在ZH11 背景中过量表达、持续性激活和显性失活的转基因植株-CAosrac3和DN-osrac3,CA-osrac3对GTPase 激活蛋白不敏感,可以持续与GTP 结合,因而持续保持激活状态;DN-osrac3持续处于结合GDP 或者不结合核苷酸的状态,故而持续处于失活状态,在细胞中过表达时通过竞争GEFs 抑制其他ROP 的激活[40]。我们首先利用qPCR 对CA-osrac3和DN-osrac3突变体株系进行检测,发现CA-osrac3L11、L32 以及DN-osrac3L20 和L15 转基因株系中CA-osrac3以及DN-osrac3的表达上调(图3A),后续选用这些株系进行表型分析。与野生型植株相比,生殖期DNosrac3株系穗直挺(图4A),分枝数少,结实率降低;而CA-osrac3株系穗粒数减少(图3B),籽粒饱满(图4B)。这些结果暗示OsRAC3影响稻穗的发育过程。
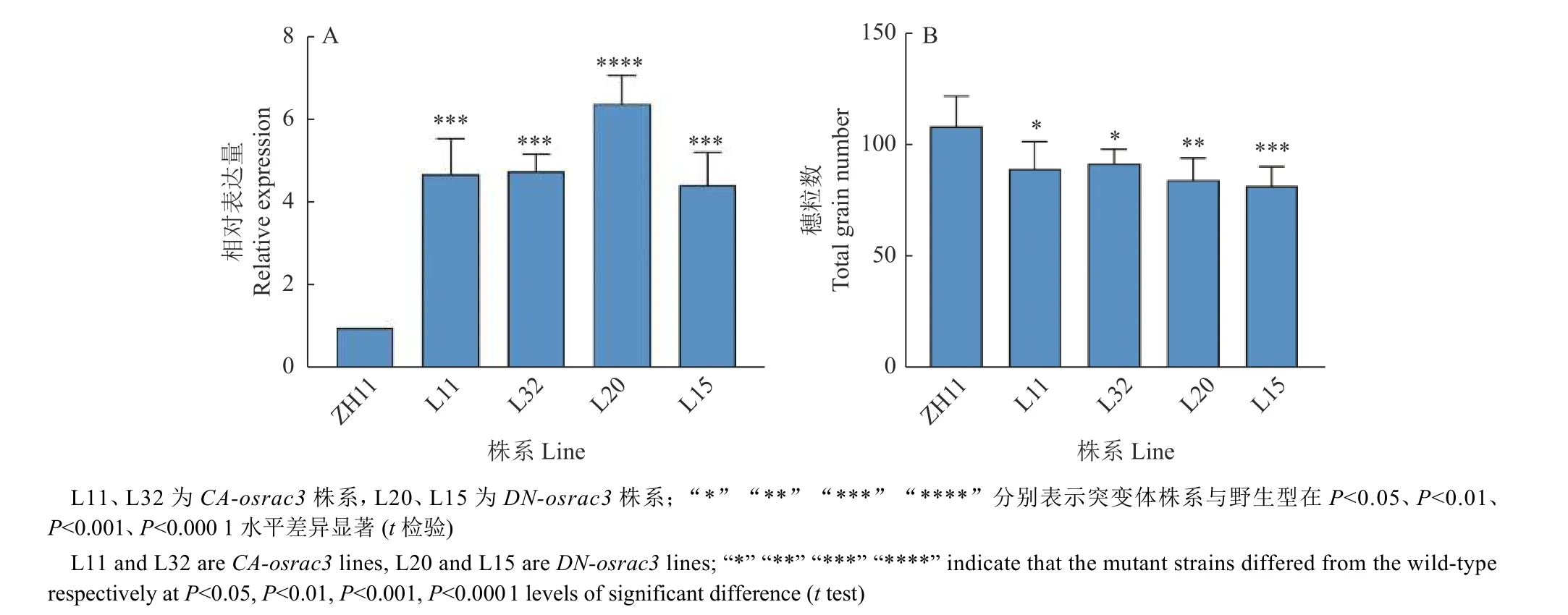
图3 CA-osrac3、DN-osrac3 在野生型ZH11 以及突变体CA-osrac3、DN-osrac3 中的表达情况Fig. 3 Expression of CA-osrac3, DN-osrac3 in wild-type ZH11 and mutant lines CA-osrac3, DN-osrac3

图4 野生型ZH11 以及突变体CA-osrac3、DN-osrac3 的表型特征Fig. 4 Phenotypic characterization of wild-type ZH11 and mutant lines CA-osrac3, DN-osrac3
2.3 野生型ZH11 以及突变体CA-osrac3、DNosrac3 籽粒大小等表型性状的鉴定
以野生型ZH11 为对照,利用上述突变体材料,对籽粒长度、籽粒宽度以及千粒质量等重要农艺性状进行测量。发现CA-osrac3各株系籽粒的粒宽和粒长均显著大于野生型的,DN-osrac3各株系籽粒的粒宽和粒长则显著小于野生型的(图5A、5B)。在千粒质量方面同样发现,CA-osrac3株系均显著高于野生型的而DN-osrac3株系均显著低于野生型的(图5C)。观察籽粒表型也发现,CA-osrac3籽粒较野生型的更大,而突变体DN-osrac3籽粒则较小(图6)。这些结果说明持续性激活OsRAC3能促进水稻籽粒的生长,提高粒质量,正调控水稻籽粒的大小。
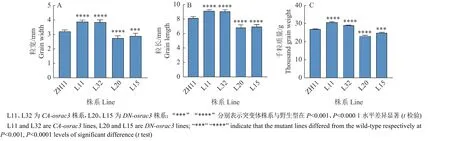
图5 野生型ZH11 以及突变体CA-osrac3、DN-osrac3 籽粒特征分析Fig. 5 Grain analysis of wild-type ZH11 and mutant lines CA-osrac3, DN-osrac3

图6 野生型ZH11 以及突变体CA-osrac3、DN-osrac3 籽粒的表型特征Fig. 6 Phenotypic characteristics of grain in wild-type ZH11 and mutant lines CA-osrac3, DN-osrac3
3 讨论与结论
在穗的发育过程中,花序分生组织的活性是决定水稻产量性状的核心因素[4,41]。本研究发现OsRAC3在水稻的花器官中有表达,尤其在幼穗与小花分生组织中强烈表达;持续激活型突变体CA-osrac3株系的籽粒显著增大。
华南农业大学陶利珍教授课题组前期研究报道OsRAC3作为细胞分裂素信号转导途径的负调控因子参与水稻冠根发育的调控;在水稻原生质体中,激活形式的OsRAC3,即结合GTP 的OsRAC3能与细胞分裂素信号途径中的OsAHP1/2 直接互作,招募OsAHP1/2 到质膜上,阻碍OsAHP1/2 的核质穿梭,从而抑制细胞分裂素信号[39]。CA-osrac3转基因植株的细胞分裂素信号转导途径受到抑制,而DN-osrac3转基因植株的细胞分裂素信号转导途径受到的抑制较弱。
水稻的每穗粒数与花序分生组织中的细胞分裂素水平密切相关[42]。花序分生组织中细胞分裂素水平升高能增强分生组织的活性,形成更多的分支,使水稻穗粒数增加[11],我们推测在水稻花序分生组织发育过程中,过表达CA-osrac3会抑制细胞分裂素信号,导致分生组织活性下降,形成的穗分支减少,最终导致每穗粒数减少。对于DN-osrac3转基因植株,虽然细胞分裂素信号受到的抑制减弱,但是每穗粒数仍然减少,对此,我们认为可能是过表达的DN-osrac3与其他RAC/ROPs 竞争GEFs,使得其他RAC/ROPs 的激活受到抑制,从而导致籽粒减少。
但是细胞分裂素对籽粒大小的调控作用比较复杂。不同类型的作用组织、信号通路中不同组分的变化均可能对籽粒大小产生影响,对于茎尖分生组织和正在发育的籽粒而言,细胞分裂素的水平可能是影响籽粒大小最为显著的因素之一[43]。HK6(Histidinekinase6)编码细胞分裂素组氨酸激酶受体,hk6失活突变体表现出对细胞分裂素敏感性下降,水稻籽粒数量减少,但籽粒增大[44]。CA-osrac3株系籽粒和千粒质量均显著大于野生型ZH11 的,而DN-osrac3转基因植株显著小于ZH11 的。在水稻中,小穗的颖壳限制籽粒的生长,在决定籽粒大小方面起主要作用[45]。基因影响籽粒大小主要是通过调节小穗颖壳中细胞分裂和细胞大小来实现[45],同时也受到细胞分裂素水平的影响[44]。我们推测OsRAC3对籽粒性状的影响可能是通过抑制细胞分裂素信号实现的。DN-osrac3转基因植株中,其他RAC/ROPs 的激活也受到抑制,因此其籽粒减小可能是通过其他RAC/ROPs 所介导的未知途径造成的。CA-osrac3转基因植株籽粒增大,可能是由于花序分生组织细胞分裂素信号受阻,导致细胞分裂活性降低,表现为穗小分支少,穗粒数减少;因此在灌浆期时,每个籽粒分配得到的光合同化物增加,籽粒增大。但是目前尚不清楚OsRAC3是否可以通过其他途径影响水稻籽粒性状,有待进一步研究阐明。

