外源褪黑素对铜胁迫下大豆幼苗生长及生理特性的影响
黄 荣 ,段明明,文 珂,蒋慧乾,梁晓恩,米 鸢,年 海
(华南农业大学 农学院/国家大豆改良中心 广东分中心, 广东 广州 510642)
大豆Glycinemax(Linn.) Merr.是一种重要的经济作物,在重金属污染的土壤上,其产油量和产量显著下降[1]。铜(Cu)作为植物生长的必需元素,同时也是重金属元素,适量的Cu 在氧化磷酸化、铁代谢、蛋白质运输和转录等方面起关键作用[2];过量的Cu 会抑制植物对水分和营养物质的吸收,降低同化能力,同时加剧有毒ROS、羟基和自由基的产生,这些自由氧和自由基会破坏基本的生物分子,如DNA、RNA、膜结构和蛋白质等[3]。有研究发现,过量的Cu 会破坏大豆的抗氧化系统和根系对营养的吸收[4];因此如何在Cu 胁迫下保护光合作用系统和维持较高的ROS、羟基和自由基的清除能力,对于促进大豆幼苗的正常生长具有重要意义。
褪黑素(Melatonin)具有吲哚环结构,相对分子质量小,是一种进化上保守的多效性分子,普遍存在于生物体中,是内源性的自由基清除剂和抗氧化剂,其中间体是以亲水性和疏水性而闻名的最佳抗氧化分子之一[5]。褪黑素很容易通过细胞膜进入线粒体、叶绿体和细胞核等细胞器中[6];褪黑素可以直接清除自由基,刺激抗氧化酶的产生,促进谷胱甘肽的合成,激活其他抗氧化剂[7],增加渗透调节物质的含量,提高线粒体电子传递效率等,从而对植物起到保护作用,有效缓解作物逆境中的非生物胁迫[8]。其中,超氧化物歧化酶(SOD)、过氧化氢酶(CAT) 和过氧化物酶(POD) 是重要的抗氧化酶,SOD 先将自由氧歧化为过氧化氢(H2O2) 和氧气(O2),H2O2具有强氧化性,CAT 和POD 进一步将H2O2歧化为O2和H2O,从而避免自由氧对生物体造成损害。褪黑素可以提高作物对重金属[9]、干旱[10]、高温[11]、冷胁迫[12]和盐度[13]条件的耐受性。有研究指出,施用100 μmol·L-1褪黑素可以通过提高抗氧化酶活性和保护同化系统等方式来有效缓解干旱胁迫对大豆生长的抑制[14]。Wei 等[15]也发现,在60 mmol·L-1的NaCl 胁迫下施用100 μmol·L-1褪黑素增加了香蕉植株可溶性蛋白含量,同时有效减缓叶绿素的降解,维持香蕉植株的健康生长。这些研究说明施用外源褪黑素有利于作物应对非生物胁迫。
关于外源褪黑素在作物应对非生物胁迫过程中功能的研究日益深入,而鲜有学者围绕外源褪黑素能否缓解大豆Cu 胁迫进而促进大豆的生长发育展开深入研究。因此本试验采用对Cu 敏感度不同的2 个大豆品种进行Cu 胁迫和褪黑素处理,研究褪黑素对不同基因型大豆幼苗生长、Cu 含量、抗氧化系统和渗透调节物质含量等的影响,探讨外源褪黑素应对大豆Cu 胁迫的生理机制,为外源褪黑素应用于缓解大豆Cu 胁迫提供有力的理论依据。
1 材料与方法
1.1 试验材料
供试种子:Cu 敏感品种‘桂早1 号’、耐Cu 品种‘巴西13’,由华南农业大学农学院/国家大豆改良中心广东分中心提供。w(褪黑素) >99.99%,使用五水硫酸铜(CuSO4·5H2O)模拟Cu胁迫。
1.2 试验设计
试验在华南农业大学启林北农场温室进行。设定的培养环境为25 ℃,60% 相对湿度,光周期为16 h 光/8 h 暗,光强550 μmol·m-2·s-1[16]。选用高120 mm、顶部直径150 mm、底部直径100 mm 的栽植盆,每盆装入500 g 无污染的石英砂。在每个花盆中种植9 颗外形一致、壮实饱满的种子,每天浇灌霍格兰营养液,生长10 d 后定植5 株长势较好的幼苗。待幼苗长至第一对三出复叶张开时,用混有不同浓度褪黑素(0、100 μmol·L-1)和不同浓度Cu (0、0.5 mmol·L-1)的霍格兰营养液每隔3 d 浇灌1 次,每次每盆100 mL,各处理分别为对照(CK)、单施褪黑素(MT)、铜胁迫(Cu)和铜胁迫下施用褪黑素(Cu+MT)。每种处理设置3 次重复,待大豆生长30 d 后,将幼苗整株取出,测定后续指标。
1.3 测定指标及方法
1.3.1 生长指标测定 采用直尺(单位:mm)测量幼苗株高(植株根颈部到顶部心叶之间的距离)、根长(植株根颈部到主根根尖的距离);用电子天平称量总鲜质量。
1.3.2 叶绿素相对含量测定 采用便携式SPAD-502 叶绿素计对每个处理的顶部3 片叶进行测定并记录,每个处理测10 次,取平均值。
1.3.3 地上部、地下部Cu 含量测量 采用浓硫酸-过氧化氢湿法消解[17]:称取0.5 g 样品(样品取样烘干后磨粉过0.150 mm 孔径的筛网),加1 mL 水润湿,加入8 mL 浓H2SO4摇匀,分2 次各加入H2O22 mL,置于电炉上加热消煮,消化,直到管内白烟散尽,此时溶液呈现无色澄清或者微带黄色,预示着样品已充分消化。随即取下消化管,静置冷却,随后将消化管中的溶液转移到50 mL 容量瓶中,期间进行3~4 次润洗,以确保消化样品全部转移,并用超纯水定容到50 mL,放于4 ℃备用。为了保证试验的准确性,每份材料设置2 次重复,每次消化过程设置2 个空白对照,校正试剂和方法误差,并使用原子吸收分光光度计AA-6880(日本岛津) 在218.17 nm 波长下测定Cu 含量。
1.3.4 抗氧化酶活性和丙二醛含量测定 称取各处理新鲜样品0.1 g,加入9 mL 50 mmol·L-1磷酸钠缓冲液,在12 000 r·min-1下离心5 min,分离上清液作为酶液备用。
SOD 活性使用硝基蓝四氮唑(NBT)光化学还原法[18]测定,CAT 活性采用紫外吸收法[18]测定,POD活性采用愈创木酚法[19]测定,丙二醛(MDA)含量通过硫代巴比妥酸计时法[19]测定。
1.3.5 渗透调节物质含量测定 新鲜样品中可溶性蛋白含量采用考马斯蓝亮法[19]测定,可溶性糖含量采用蒽酮显色法[20]测定。
1.4 数据分析
试验数据采用SPSS 20.0 数据处理系统和Excel 2019 进行统计分析。
2 结果与分析
2.1 褪黑素对Cu 胁迫下大豆生长的影响
从图1 可知,Cu 胁迫下‘桂早1 号’和‘巴西13’的根长、株高和鲜质量均显著降低(P<0.05);其中,对鲜质量影响最大,‘桂早1 号’减少49.53%,‘巴西13’减少32.86%。Cu 胁迫下施用褪黑素有效缓解了Cu 胁迫对根长、株高和鲜质量的抑制;‘桂早1 号’和‘巴西13’的根长分别增加33.83%和25.17%,株高分别增加11.89%和11.64%,鲜质量分别增加52.88%和19.38%。结果表明,褪黑素可以有效缓解Cu 胁迫带来的损害,促进幼苗的生长。

图1 褪黑素对Cu 胁迫下大豆生长的影响Fig. 1 Effect of melatonin on soybean growth under Cu stress
2.2 褪黑素对Cu 胁迫下大豆叶绿素相对含量的影响
由图2A 可知,与对照相比,单施褪黑素处理‘桂早1 号’的叶绿素相对含量无显著变化;Cu 胁迫下,‘桂早1 号’和‘巴西13’的叶绿素相对含量分别显著下降24.79% 和10.28%(P<0.05),说明过量的Cu 对叶绿素产生了损害。Cu 胁迫下施用褪黑素,‘桂早1 号’和‘巴西13’的叶绿素相对含量分别增加11.83%和8.6%,有效提高了Cu 胁迫下叶绿素相对含量。
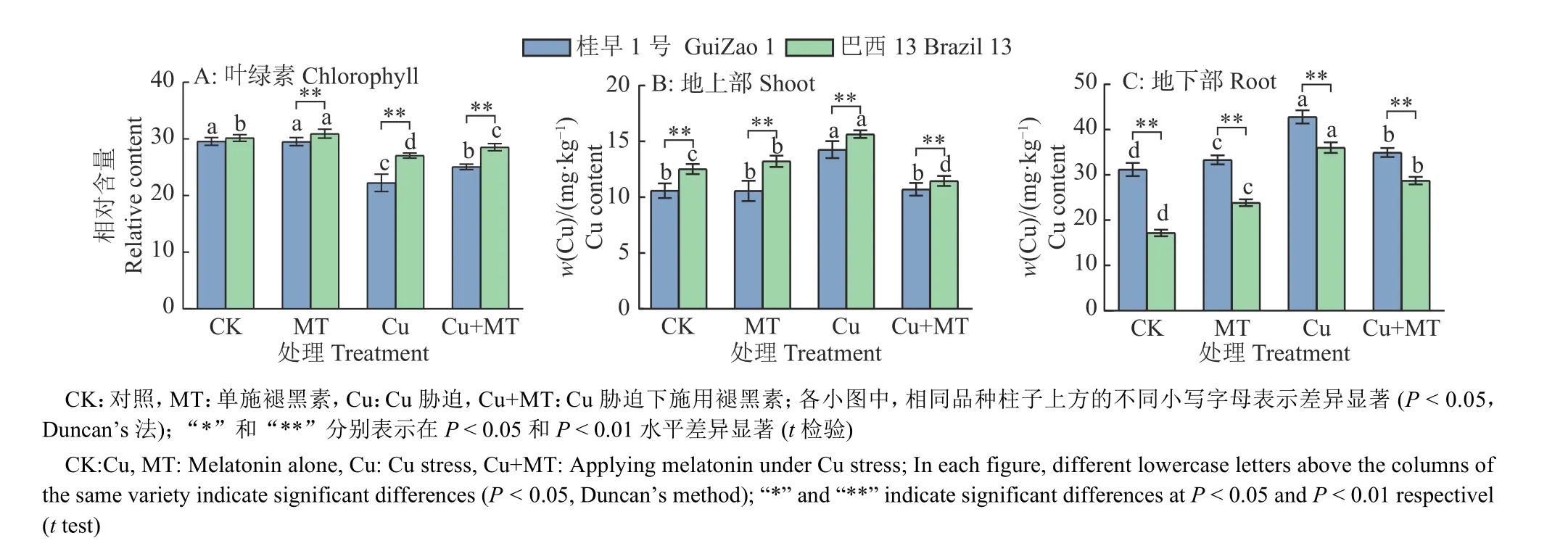
图2 褪黑素对Cu 胁迫下大豆叶绿素相对含量及地上部、地下部Cu 含量的影响Fig. 2 Effect of melatonin on chlorophyll relative content, and Cu contents of shoot and root in soybean under Cu stress
2.3 褪黑素对Cu 胁迫下大豆地上部、地下部Cu 含量的影响
由图2B、2C 可知,所有处理中,‘桂早1 号’和‘巴西13’地下部Cu 含量均高于地上部,说明Cu 主要积累在地下部。Cu 胁迫下施用褪黑素,2 个品种的地上部及地下部Cu 含量分别恢复至对照的1 0 1.0 4% 和1 1 1.9 9%(‘桂早1 号’)、91.38%和167.17%(‘巴西13’)。施加褪黑素显著降低了Cu 胁迫下2 个品种的Cu 含量(P< 0.05),表现为‘桂早1 号’地上部和地下部Cu 含量分别降低25.01% 和18.40%,‘巴西13’分别降低26.84%和20.28%。与对照相比,单施褪黑素促进Cu 吸收,Cu 作为植物必需元素,适量的Cu 有助于其生长。
2.4 褪黑素对Cu 胁迫下大豆抗氧化酶活性和MDA 含量的影响
SOD 是植物体内重要的抗氧化酶,其活性的高低直接反映植物细胞的抗氧化能力[21]。由图3A、3B 可知,与对照相比,单施褪黑素提高了‘桂早1 号’和‘巴西13’体内SOD 活性。Cu 胁迫下施用褪黑素,桂早1 号’和‘巴西13’地上部SOD活性分别显著提高19.07%和7.30%(P< 0.05)。地上部SOD 活性提升较地下部明显,这可能是因为褪黑素进一步提高了地上部的抗氧化能力,从而减少Cu 胁迫对地上部的氧化伤害。
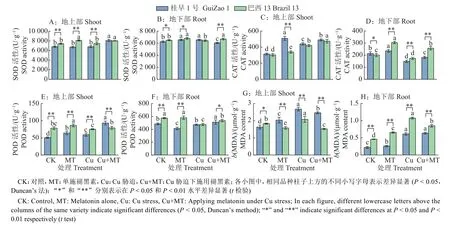
图3 褪黑素对Cu 胁迫下大豆抗氧化酶活性和MDA 含量的影响Fig. 3 Effects of melatonin on antioxidant enzyme activity and MDA content in soybean under Cu stress
与对照相比,单施褪黑素显著提高2 个品种地上部和地下部CAT 活性(图3C、3D)(P< 0.05);Cu 胁迫下,‘桂早1 号’和‘巴西13’地上部CAT活性显著提高,分别比CK 提高39.69%和38.67%,而地下部CAT 活性显著降低,可能是地下部受Cu胁迫程度较重,影响CAT 的合成。Cu 胁迫下施用褪黑素,‘桂早1 号’地上部和地下部CAT 活性显著提高11.27%和21.92%,‘巴西13’显著提高12.66%和48.35%(P< 0.05)。
由图3E、3F 可知,Cu 胁迫下施用褪黑素,‘桂早1 号’地上部、地下部POD 活性分别为93.43、512.85 U·g-1,‘巴西13’分别为79.32、537.06 U·g-1,与Cu 胁迫相比,‘桂早1 号’显著提升56.84%和8.68%(P< 0.05),‘巴西13’显著提升5.39% 和12.88%(P< 0.05)。2 个品种地下部的POD 活性均明显高于地上部的,可能Cu 胁迫对地下部的损害更为严重。
MDA 是植物在逆境胁迫下膜脂过氧化的产物,测定重金属胁迫下植物体内MDA 的累积量,可在一定程度上反映植物质膜受破坏的程度[22]。由图3G、3H 可知,与对照相比,Cu 胁迫下2 个品种地上部和地下部MDA 含量均显著增加,‘桂早1 号’显著增加44.55%和178.18%,‘巴西13’显著增加13.51%和133.88%(P< 0.05)。Cu 胁迫下施用褪黑素降低‘桂早1 号’和‘巴西13’的MDA含量,‘桂早1 号’地上部MDA 含量显著减少8.05%,‘巴西13’地上部和地下部MDA 含量显著减少26.56%和21.19%。总体来看,施用褪黑素可以缓解Cu 胁迫对膜脂结构的损害。
2.5 褪黑素对Cu 胁迫下渗透调节物质含量的影响
由图4A、4B 可知,Cu 胁迫下,‘桂早1 号’地上部、地下部可溶性糖含量分别为21.43、22.93 mg·g-1,‘巴西13’分别为44.63、17.96 mg·g-1,与对照相比,‘桂早1 号’地上部和地下部可溶性糖含量分别显著降低16.06% 和16.81%(P< 0.05),‘巴西13’分别显著降低23.05%和29.04%(P<0.05)。Cu 胁迫下施用褪黑素,‘桂早1 号’和‘巴西13’地上部可溶性糖含量分别显著提高了149.70%和58.75%(P< 0.05),地下部无显著变化(P> 0.05)。所有处理中,地上部可溶性糖含量普遍高于地下部。
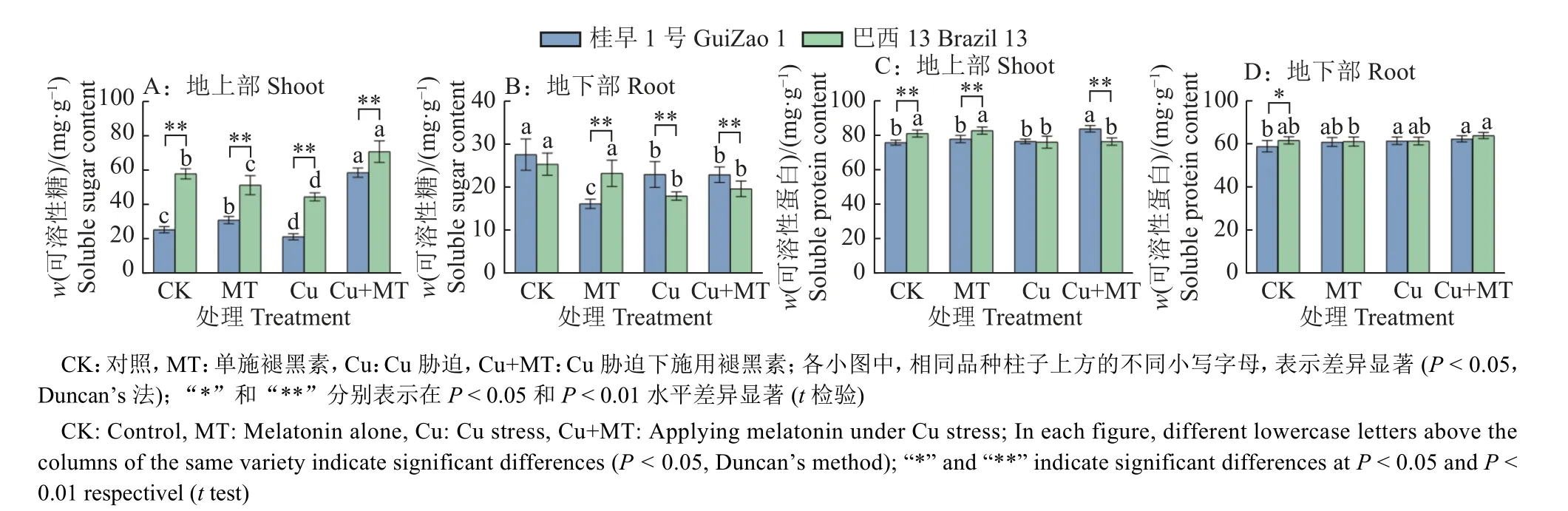
图4 褪黑素对Cu 胁迫下渗透调节物质含量的影响Fig. 4 Effect of melatonin on osmotic adjustment substance content under Cu stress
可溶性蛋白是重要的渗透调节物质,与对照相比,单施褪黑素提高了‘桂早1 号’和‘巴西13’地上部和地下部可溶性蛋白含量,但未达到显著水平;Cu 胁迫下施用褪黑素提高了2 个品种地上部和地下部可溶性蛋白含量,其中,‘桂早1 号’地上部可溶性蛋白含量提高较多,为9.55%(P<0.05)(图4C、4D)。结果表明,褪黑素对提高大豆可溶性蛋白含量起到一定的作用。
3 讨论与结论
在本研究中,我们深入了解了褪黑素如何调节暴露于过量Cu 水平的大豆的生长发育。Wu 等[23]研究发现褪黑素下调叶绿素分解代谢酶的活性,并抑制参与叶绿素分解代谢基因的表达,从而保护叶绿体和气孔的膜完整性,提高光合速率和糖的积累,促进Cu 胁迫下植物的生长和生物量的增加。Cu 胁迫下植株ROS 和MDA 含量增加,直接干扰生理生化属性并抑制光合功能、营养同化和糖代谢,施加外源褪黑素可以提高抗氧化能力,从而降低ROS 和MDA 水平,褪黑素还能保持根系的强健,促进根系生长。
Cu 胁迫抑制了‘桂早1 号’和‘巴西13’根长、株高和鲜质量的增加,植株矮小、瘦弱,可能是Cu 胁迫导致其生理代谢改变,阻碍了生长。施用褪黑素可有效缓解Cu 胁迫,虽未达到胁迫前的水平,但幼苗的生长得到改善,同时Cu 敏感品种‘桂早1 号’根长、株高和鲜质量恢复率高于耐Cu 品种‘巴西13’;表明褪黑素对耐Cu 胁迫较差的品种也能起到较好的保护效果,促进大豆幼苗在Cu 胁迫下正常生长发育。
叶绿素相对含量与叶绿素含量存在正相关关系,可以在一定程度上反映叶绿素含量的高低[17]。在Cu 胁迫下,叶绿素相对含量降低,这是因为过量的Cu 积累使叶绿体膜的完整性和流动性变差,下调了参与叶绿素合成的基因的表达,使光合效率降低。相比耐Cu 品种‘巴西13’,Cu 胁迫下Cu 敏感品种‘桂早1 号’的叶绿素相对含量降低更多,说明耐Cu 品种能更有效地减少过量Cu 对叶绿素的伤害。施加褪黑素后,‘桂早1 号’和‘巴西13’的叶绿素相对含量显著提高,说明褪黑素能有效缓解Cu 胁迫带来的损害。褪黑素保护了叶绿体内部膜系统的稳定,增强了非酶抗氧化剂和抗氧化酶清除叶绿体ROS 的能力,从而降低ROS 对膜系统的毒性。Cui 等[24]研究发现,干旱胁迫下施用褪黑素可以有效保护光反应系统,提高叶绿素含量,增强小麦耐旱性,本试验结果与之相似。
土壤重金属通过地下部被植物吸收,重金属在不同植物中迁移、转化和富集的机制不同,Cu 主要集中在地下部,往地上部的迁移率较小[25],本试验结果与之相同。Cu 胁迫下‘桂早1 号’和‘巴西13’地下部Cu 含量均高于地上部,Cu 在地下部富集,且耐Cu 品种‘巴西13’各处理地下部Cu 含量均低于Cu 敏感品种‘桂早1 号’,地上部Cu 含量均高于‘桂早1 号’,‘巴西13’可能是通过减少Cu 的吸收并向地上部转运来缓解Cu 胁迫。Cu 胁迫下施加褪黑素降低了‘桂早1 号’和‘巴西13’地上部和地下部Cu 含量,这表明褪黑素能有效减少大豆对Cu 的吸收。与对照相比,单施褪黑素促进了对Cu 的吸收,Cu 作为植物必需元素,适量的Cu 在光合作用、呼吸作用、抗氧化系统、花粉萌发和花粉管伸长中发挥重要作用。
重金属胁迫导致分子氧减少并释放出高反应性中间产物,如H2O2、超氧自由基(O2-) 和羟基(OH-)等,这些自由基和ROS 可引起质膜和蛋白质分解的连锁反应,导致DNA 和细胞膜损伤[26]。本结果表明耐Cu 品种‘巴西13’的SOD、CAT 和POD 活性在大部分情况下比Cu 敏感品种‘桂早1 号’的要高,可能是耐Cu 品种体内抗氧化酶活性较强,能更好地缓解Cu 胁迫。Cu 胁迫下施用褪黑素增强了植株SOD、CAT 和POD 活性,这与Cao 等[27]的研究结果一致。褪黑素提高了抗氧化相关酶的表达和活性,增强了植物对胁迫的应对能力。植物体内MDA 的积累可在一定程度上反映植物受伤害程度。Cu 胁迫下2 个品种地上部和地下部MDA 含量均增加,施用褪黑素后,除‘桂早1 号’地下部外,其他处理MDA 含量均下降,说明褪黑素能减少Cu 胁迫下膜脂过氧化,保护细胞膜脂结构。‘桂早1 号’是Cu 敏感型品种,在Cu 胁迫下地下部膜脂过氧化更为严重,所以MDA 含量维持在较高水平。
可溶性糖和可溶性蛋白是渗透调节物质,在胁迫中,植物体通过主动积累各种有机物或无机物来提高细胞液浓度,降低渗透势,提高细胞吸水或保水能力,从而增强对胁迫的适应性。本研究结果表明,Cu 胁迫降低了2 个品种地上部和地下部可溶性糖含量,施用褪黑素后,可溶性糖含量提高,可能是褪黑素缓解了Cu 胁迫对植物呼吸作用和光合作用的影响,上调了糖和氮代谢相关酶的活性。施用褪黑素对地上部可溶性蛋白含量的影响无明显规律。施用褪黑素后2 个品种地下部可溶性蛋白含量提高,但未达到显著水平,这与前人的研究[28]存在一定差异。
综上所述,Cu 胁迫影响大豆正常的生长发育,施用褪黑素可有效缓解Cu 胁迫对大豆生长的抑制作用,同时减少植株对Cu2+的吸收并向地上部转运。褪黑素增强大豆植株SOD、CAT 和POD 等抗氧化酶活性,降低MDA 含量,同时促进可溶性糖和可溶性蛋白合成,表明褪黑素能有效缓解Cu 胁迫,改善大豆幼苗的生长发育。

