不同基因型颗石藻(Emiliania huxleyi)对海洋酸化及 高光耦合的生理响应
林燕妮,王寅初,任庆敏,唐永政
(1.烟台大学海洋学院,山东 烟台 264005;2.中国科学院烟台海岸带研究所,山东 烟台 264003;3.国家基础学科公共科学数据中心 北京 100190;4.中国科学院海洋大科学研究中心,山东 青岛 266071)
颗石藻(Coccolithophore)为具有钙质外壳的单细胞海洋浮游植物,属于定鞭藻门(Haptophyta),定鞭藻纲(Prymnesiophyceae)[1]。作为海洋中钙化生产力最高的浮游植物类群,颗石藻的年碳酸钙产量为海洋年碳酸钙总产量的三分之一,远洋沉积物中的碳酸钙约有一半是由颗石藻生产沉降[2]。颗石藻是海洋初级生产力的重要贡献者,通常占初级生产力的1%到10%,在形成季节性水华时占40%[3]。颗石藻在生长过程中通过光合作用捕获二氧化碳,并在钙化作用中释放二氧化碳,两者对二氧化碳捕获和释放的差异是模拟海洋碳循环的重要因素[4],因此,颗石藻在生物地球化学循环和气候调节方面扮演重要角色[5-6]。Emilianiahuxleyi是分布最广的颗石藻物种,也是海洋碳循环研究中的“模式生物”。
随着人类生产活动对化石燃料消耗增加,大量CO2释放到大气中对全球气候及环境造成一系列问题,包括海洋酸化、全球变暖等。进而对海洋生态系统产生严重危害,影响海洋浮游植物的生长[7-8]。全球变暖会导致海洋上层混合层变浅,使生活在海洋混合层中上部分的颗石藻暴露在高光的海洋环境中[9-10],导致颗石藻会受到海洋酸化和更强光照辐照[11],不同环境因素的耦合对颗石藻的影响也会有差异。
颗石藻如何应对环境的变化受到众多关注。有研究表明颗石藻钙化作用产生的颗石粒钙质外壳可以保护藻细胞避免受光损伤[12],颗石粒对光照辐射起遮蔽作用,保护细胞耐受强光胁迫,使紫外辐射(UVR)和有效光辐射(PAR)的透过效率降低[9]。
CO2对不同种类E.huxleyi的钙化有着不同影响,有促进、抑制及无变化,有研究指出这种差别是由于遗传基础不同导致的种间差异所致[12]。蔡小霞等[14]对E.huxleyi在不同浓度CO2下的钙化作用进行了研究,发现CO2增加到一定浓度时能促进钙化作用,但浓度过高则抑制生长、钙化停止。不同种颗石藻钙化的响应程度不同,甚至同种的不同株系之间表现也有区别:随着二氧化碳浓度p(CO2)增加,E.huxleyi和Gehyrocapsaoceanica的钙化被抑制[15-16]。当p(CO2)从150 μatm增加到915 μatm时,Calcidiscuspelagicus的钙化对p(CO2)上升的响应很微弱,其钙化速率呈现非线性变化,当p(CO2)高于或低于现今水平时,其钙化作用都减弱[17]。因此研究海洋酸化对颗石藻钙化作用时具有种间特异性。
BENDIF等研究表明E.huxleyi分为α与β两个清晰的进化枝[18],两者之间有较为显著的生理与形态差异。本研究采用E.huxleyi两种不同基因型——采集自秘鲁上升流同一海域的藻株PERU41和PERU46。经进化分析表明,PERU41和PERU46分别属于α、β进化支,两者有遗传可比性,且经电镜观察发现PERU41具有较厚的钙质外壳而PERU46的外壳较薄。本研究考虑了两株颗石藻在不同p(CO2)下的生理响应及酸化条件下对短期高光胁迫的响应。
1 实验材料与方法
1.1 实验藻种及培养条件
实验所用的钙化颗石藻E.huxleyiPERU41和PERU46由法国欧洲环境地球科学教育研究中心Luc Beaufort教授提供。经系统发育分析证明,PERU41和PERU46分别属于E.huxleyi的α进化支与β进化支[19]。
实验藻株的培养光照为100 μmol·m-2·s-1,培养温度为15 ℃,光暗周期设置为12L∶12D。本实验p(CO2)设置两种:0.04%(低)和0.1%(高),其中0.04%是实验室目前空气中二氧化碳的分压,0.1%是预测至21世纪末大气中二氧化碳的浓度[10],通过在二氧化碳光照培养箱(HGZ-CO2-250,跃进医疗,中国上海)中控制纯二氧化碳与空气混合获得。培养基使用前,在相应二氧化碳分压下预先平衡。首先进行细胞驯化,在相应p(CO2)下培养实验藻株,当细胞浓度达到105个/mL后,再次进行驯化,使实验藻株适应相应的实验条件。接种起始密度为500 个/mL,当细胞浓度达到105个/mL以上时,将驯化适应实验条件后状态良好的藻株,转接到125 cm2的透气盖细胞培养瓶中进行正式实验,两藻株各设置三个平行。
正式实验培养周期10 d后(约12代),细胞密度达到5×104~1×105个/mL时收样,并测定藻细胞对短期高强度光照(400 μmol·m-2·s-1)的响应。
1.2 培养液碳酸盐系统参数测定
pH值的测定:使用pH计(上海雷磁)测定。
碱度(TA)的测定:使用总碱测试仪测定。
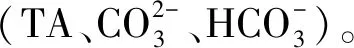
碳酸钙饱和度ΩCa的计算公式如下:
式中,Ksp为碳酸钙解离常数,单位为mol2·kg-2。
1.3 细胞生长率及粒径测定
藻细胞密度为5×104~1×105个/mL时收样,计算生长率,公式如下:
μ=(lnc2-lnc1)/(T2-T1),
式中,μ为生长率,c1为T2时的细胞浓度,c2为T1时的细胞浓度。
收样后对藻液进行稀释,由流式细胞摄像系统FlowCAM进行藻细胞粒径测量。
1.4 颗粒无机碳(PIC)和颗粒有机碳(POC)的含量测定
将0.7 μm的玻璃纤维膜进行预处理,经锡纸包裹后在马弗炉中450 ℃燃烧12 h以上,以除去滤膜上的碳。收藻时将100 mL藻液过滤收集到膜上,滤膜冷冻保存。用于测POC的玻璃纤维滤膜提前浓盐酸酸熏过夜,以除去膜上无机碳。将滤膜于60 ℃烘干2 h之后,锡纸包裹制样并在元素分析仪中进行PIC和POC含量测定。将细胞中POC和PIC含量与生长率(μ)相乘,计算PIC和POC的生产速率:
PIC产率=PIC含量×μ,
POC产率=POC含量×μ。
1.5 细胞外壳的结构观察
用25 mm聚碳酸酯滤膜(1 μm孔径)抽滤2 mL藻液,过滤前摇匀使藻细胞在膜上均匀分布,将收集到的细胞在烘箱50 ℃干燥2 h,使用扫描电子显微镜(SEM)拍照观察。
1.6 细胞色素含量测定
细胞色素使用100%甲醇4 ℃黑暗条件下过夜进行提取。将浸取液使用扫描分光光度计进行200~800 nm波长下扫描,用以下公式计算类胡萝卜素[21]、叶绿素a和叶绿素c[22]的含量(μg/mL):
ρ(叶绿素a)=16.29×(A665-A750)-8.54×
(A652-A750),
ρ(叶绿素c)=28.819 1×(A632-A750)-
6.013 8×(A665-A750),
ρ(类胡萝卜素=7.6×(A480-A750)-1.49×
(A510-A750)。
1.7 叶绿素荧光参数测定
最后一天收样时,使用叶绿素荧光仪(PAM,AquaPen-C,捷克PSI)对颗石藻细胞的叶绿素荧光进行测定。测量获得最大光化学效率(Fv/Fm)及在0、3、6、9、15、27和48 min时有效光化学效率(YPSⅡ)和非光化学淬灭(NPQ),并通过Origin拟合计算光系统Ⅱ(PSⅡ)的损伤/修复速率来反映细胞对短期高光胁迫的响应。
快速光响应曲线设置6个光强梯度(光合有效辐射PAR分别为10,20,50,100,300,500 μmol·m-2·s-1),每个光强时长为60 s,计算相对电子传递速率(rETR):
rETR=YPSⅡ×PAR×0.5,
其中,常数0.5表示细胞吸收的光能的50%传递到光系统Ⅱ(PSⅡ)。
表观光合效率(α)、饱和光强(Ik)及最大相对电子传递速率(rETRmax)通过Origin将rETR数据回归拟合得到。
光系统Ⅱ的修复速率k(min-1)及短期高光胁迫处理时光系统Ⅱ的修复速率r(min-1)的计算公式如下[23-24]:
k=-[ln(Yn/Y0)]/t,
r=k×Yn/(Y0-Yn)。
其中Yn和Y0表示YPSⅡ在时间tn和t0时的值。
1.8 统计分析
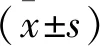
2 结 果
2.1 碳酸盐系统参数

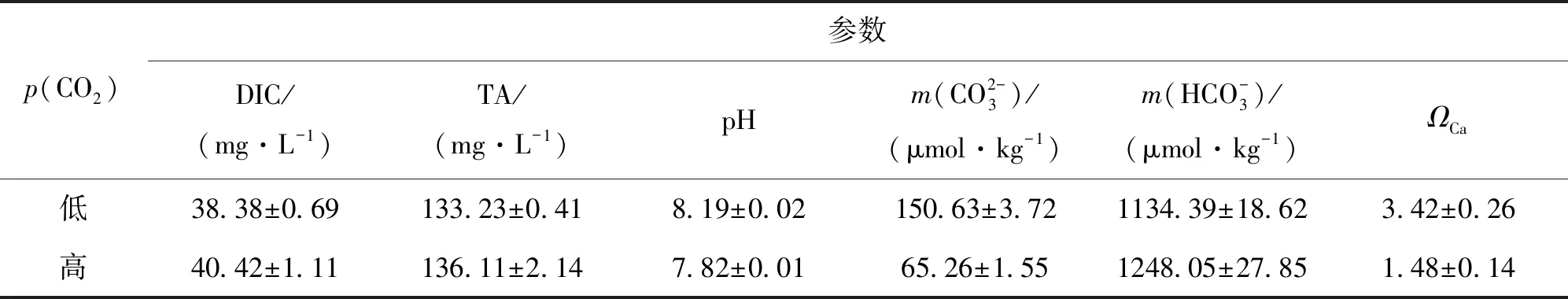
表1 初始培养基碳酸盐系统参数
2.2 细胞生长率及粒径
在高p(CO2)条件下,PERU41和PERU46生长率均下降,但相同p(CO2)条件下PERU46的生长率高于PERU41且差异具有统计学意义(图1(a))。
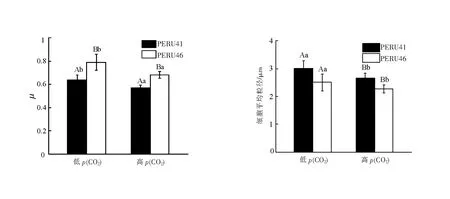
不同小写字母表示相同p(CO2)下不同藻株间差异有统计学意义(P<0.05);不同大写字母表示相同藻株在不同p(CO2)下差异有统计学意义(P<0.05)。
PERU41细胞平均粒径均显著大于PERU46。与低p(CO2)相比,在高p(CO2)条件下PERU46和PERU41的细胞粒径均显著减小(P<0.05)(图1(b))。PERU41细胞粒径较大,可能是其钙化能力较强,产生较厚的碳酸钙外壳,增大了细胞尺寸。PERU41细胞较小,可能是因为其具有较高的生长的速率,在胁迫条件下将更多的能量用于增殖。
2.3 PIC和POC的含量及产率
如表2所示,PERU46与PERU41中的PIC含量组间差异有统计学意义(P<0.05)。尤其是在高p(CO2)时,PERU41细胞内PIC含量有显著提高(P<0.05),而PERU46细胞内的PIC含量降低,说明酸化条件下PERU46的钙化作用显著降低。随着p(CO2)增加,藻株的PIC含量和产率均有所减少。PERU46的POC含量及产率均显著高于PERU41(P<0.05),细胞内POC含量高与PERU46高生长速率相符。在p(CO2)较高时,会导致颗石藻的生长速率下降及颗石藻细胞内的POC含量升高。在本实验中,PERU41的PIC/POC比值随着p(CO2)的增加而增加,但PERU46的PIC/POC比值随着p(CO2)的增加而减少,PERU46的变化规律与前人试验研究的规律相同[27-28]。

表2 酸化条件下POC和PIC的含量及产率
2.4 细胞外壳的钙化情况
由电镜观察结果(图2、3)可见,在高p(CO2)条件下,藻株的颗石粒大多会产生畸形状况,同时也有正常钙化的颗石粒。PERU46在高p(CO2)条件下观察到较多的畸形颗石粒,PERU41颗石粒的总体完整程度较PERU46更好。PERU41在不同的p(CO2)下都有完整的颗石粒,低p(CO2)条件下,电镜观察到破损的颗石粒多,而在较高p(CO2)培养条件下仍能发现较多的完整的颗石粒。据此推测,颗石藻PERU41适应酸性环境,高p(CO2)对其生物钙化作用没有产生明显的抑制作用。

图2 不同p(CO2)条件下颗石藻PERU41细胞形态及颗石粒状态

图3 不同p(CO2)条件下颗石藻PERU46细胞形态及颗石粒状态
2.5 细胞色素含量
与低p(CO2)相比,在高p(CO2)下两藻株细胞的光合色素含量均有所增加,PERU46细胞的叶绿素c及类胡萝卜素含量显著增加(P<0.05),分别增加了52%、21%,PERU41胞的叶绿素c含量增加显著(P<0.05),增加了15.3%(图4)。
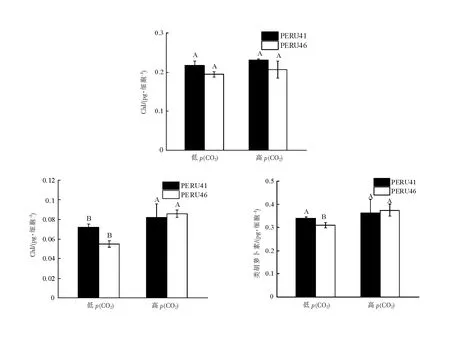
不同大写字母表示相同藻株在不同p(CO2)下差异有统计学意义(P<0.05)。
2.6 基于叶绿素荧光的光合生理变化
如图5所示,两种p(CO2)对PERU41与PERU46细胞的Fv/Fm无显著影响(P>0.05),两株藻细胞间的Fv/Fm差异无统计学意义(P>0.05)。

不同小写字母表示相同p(CO2)下不同藻株间差异有统计学意义(P<0.05),不同大写字母表示相同藻株在不同p(CO2)下差异有统计学意义(P<0.05)。
在低p(CO2)条件下,两藻株之间的表观光合效率α差异无统计学意义,PERU46的最大电子传递速率rETRmax显著低于PERU41(P<0.05),在高p(CO2)条件下,两藻株之间的α和rETRmax差异均无统计学意义(P>0.05),但PERU41的饱和光强Ik显著高于PERU46(P<0.05)。与低p(CO2)相比,高p(CO2)条件下PERU41和PERU46的Ik、α和rETRmax均显著下降(P<0.05),PERU41分别下降16.6%、35%、22.5%,PERU46分别下降22.1%、21.7%、18.8%(表3)。
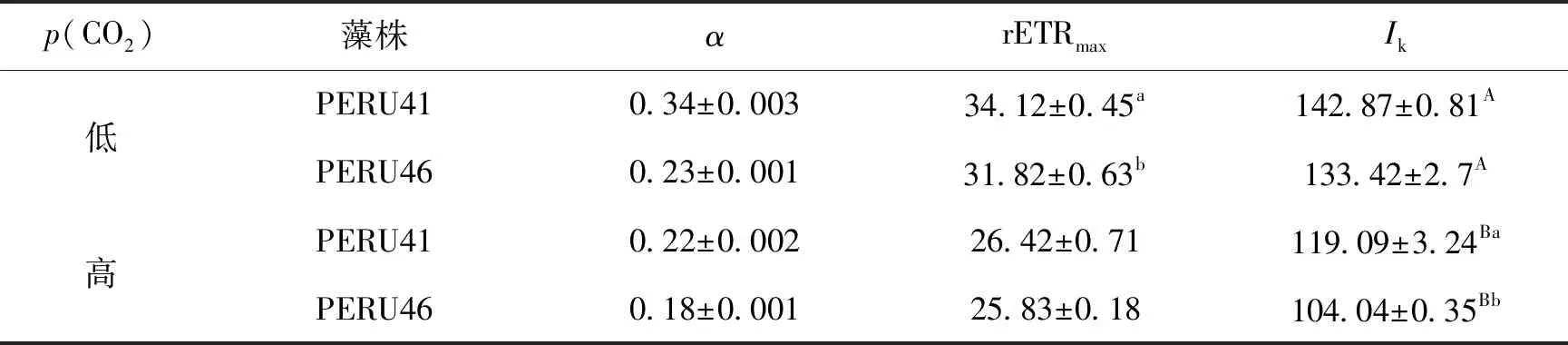
表3 高p(CO2)与低p(CO2)下的电子传递链参数α、rETRmax、Ik
2.7 对高光的短期光化学响应
低p(CO2)条件下适应后,PERU41和PERU46的有效光化合效率YPSⅡ在48 min的高光处理中具有相同的变化趋势,先显著下降30 min后趋于稳定。正常培养光照下的两藻株具有最高的YPSⅡ,高光胁迫下YPSⅡ均显著降低(图6(a)),其抑制率为50%左右,结果表明高光处理对颗石藻细胞的光合作用具有负面影响。在高光条件下,两藻株的NPQ变化趋势与YPSⅡ相反(图7(a)),表明藻细胞在高光条件下受到胁迫。短期高光处理后,与低p(CO2)条件相比,高p(CO2)条件下的PERU46的YPSⅡ显著下降,而PERU41细胞则无显著差异(图6(b))。
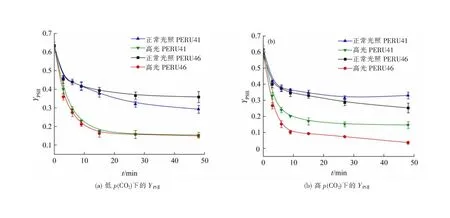
图6 不同p(CO2)下颗石藻的YPSⅡ
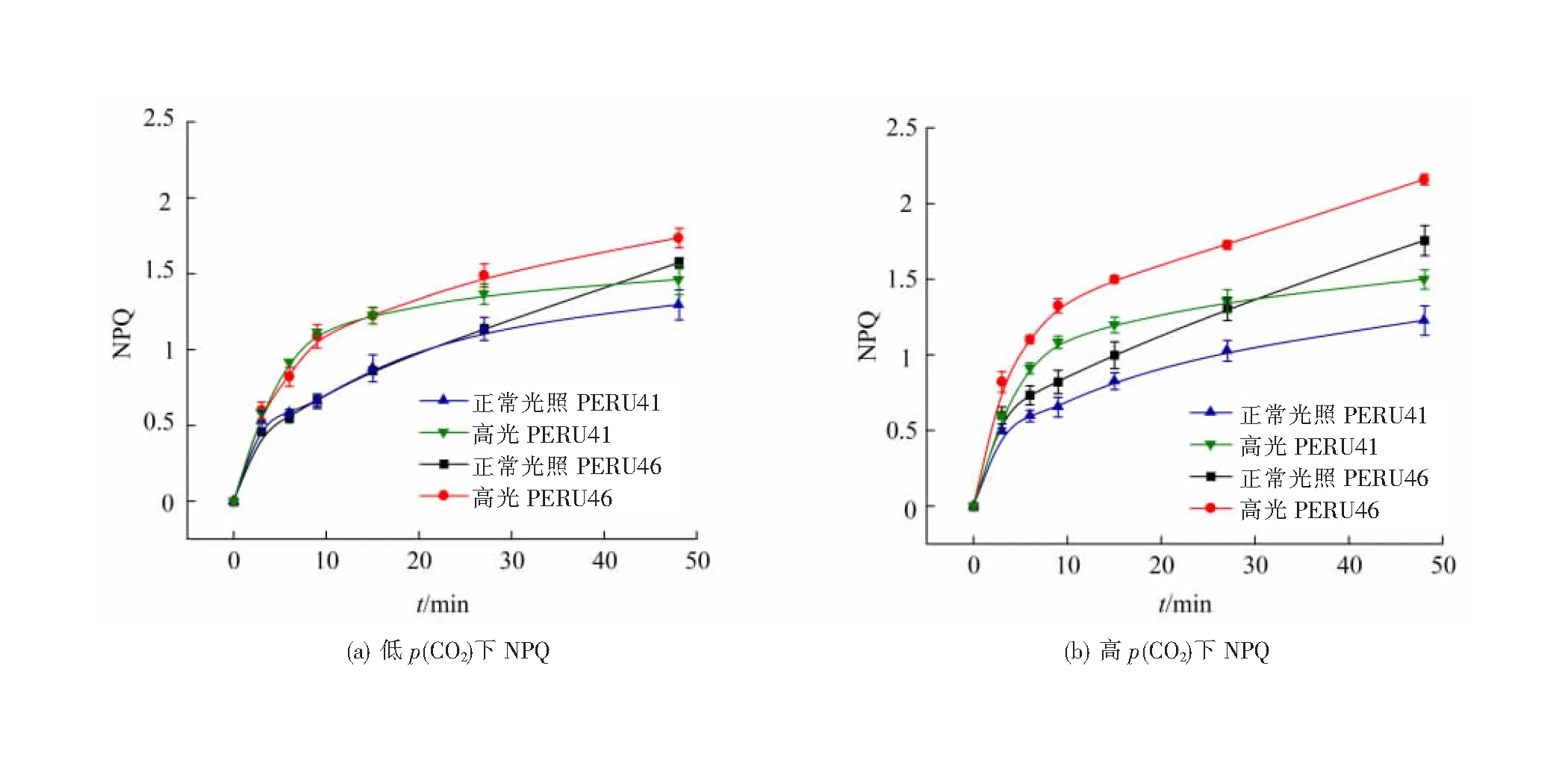
图7 不同p(CO2)颗石藻的NPQ
高p(CO2)条件下适应后,PERU46及PERU41的NPQ在高光处理下有所上升但差异无统计学意义。高p(CO2)短期高光处理下PERU46的NPQ更高(图7(b)),其通过增强NPQ耗散多余光能来应对高光胁迫,表明钙化较弱的藻株更容易受高光胁迫。
2.8 在高光下PSⅡ的损伤及修复速率
相同p(CO2)条件下,PERU41及PERU46的修复速率在正常光照下的修复速率均高于高光条件的修复速率,组间差异有统计学意义(P<0.05),两藻株之间的修复速率在相同光照处理下差异无统计学意义(P>0.05)。与低p(CO2)相比,高p(CO2)条件下适应的PERU46细胞在正常光照及高光下PSⅡ的修复速率均下降,但PERU41细胞PSⅡ的修复速率均上升(图8(a))。
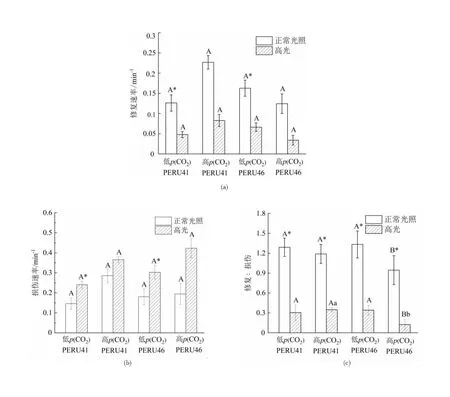
不同小写字母表示相同p(CO2)下不同藻株间差异有统计学意义(P<0.05);不同大写字母表示相同藻株在不同p(CO2)下差异有统计学意义(P<0.05);*表示正常光照和高光处理组间差异有统计学意义(P<0.05)。
低p(CO2)适应下高光处理导致两藻株PSⅡ的损伤速率均显著升高(P<0.05)。高p(CO2)条件下,两藻株PSⅡ的损伤速率在正常光照及高光处理下的差异均无统计学意义(P>0.05)。相比于低p(CO2)条件,高p(CO2)条件下细胞PSⅡ的损伤速率上升(图8(b))。
在正常光照低p(CO2)条件下生长的细胞其修复/损伤比值均大于1,说明PSⅡ修复速率大于损伤速率。高光处理下两藻株PSⅡ的修复/损伤比值显著下降。与低p(CO2)条件相比,高p(CO2)条件下的PERU46的PSⅡ修复/损伤比值显著下降约60%(P<0.05),且PERU41的修复/损伤比值显著高于PERU46(P<0.05)(图8(c))。
3 讨 论
3.1 酸化条件下细胞的生理响应
本实验探究E.huxleyi两种不同基因型的藻株PERU41和PERU46在不同p(CO2)下的生理响应差异。扫描电镜下观察细胞形态及颗石粒形态发现PERU41和PERU46的钙化存在差异,PERU41的钙化作用更强,酸化对其钙化具有促进作用,而PERU46的钙化作用较弱,酸化条件会抑制其钙化作用。高p(CO2)条件下,PERU46的生长率及POC的含量和产率均显著高于PERU41,这表明两株基因型不同的颗石藻对海洋酸化的响应方式不同,PERU41具有更强的钙化作用可以抵御海洋酸化的负面影响,而PERU46通过强的增殖能力来抵御海洋酸化。
酸化条件导致颗石藻细胞的饱和光强、表观光合效率及最大电子传递速率均降低,表明酸化条件抑制细胞的光合作用效率。高p(CO2)下PERU46细胞的叶绿素c及类胡萝卜素含量显著增加,分别增加了52%、21%。这可能是PERU46细胞受到更强的氢离子胁迫,细胞通过增加光合色素的含量来增强捕光能力获得更多能量来抵御高p(CO2)下的氢离子胁迫。PERU41与PERU46相比具有更高的电子传递效率,表明PERU41对光能的利用更为高效,这与PERU41相对较低的生长率不相符。这种情况表明,PERU41更强的钙化作用消耗了大量的能量,而PERU46的钙化相对较弱将光能更多的用于增殖。
大量研究表明,海洋酸化对颗石藻生长及钙化作用既有积极作用也有消极作用[29]。积极作用体现为可以增加海水中的二氧化碳及碳酸氢根离子等光合作用底物,增强海洋浮游植物的光合作用,从而对其生长具有正面影响。消极的酸化效应则会增加海水中氢离子的浓度,影响细胞膜的氧化还原及通透性,并影响胞内pH和蛋白质氨基酸的平衡[30-31]、降低E.huxleyi的光合作用效率[32]。JIN等的研究发现特定海洋酸化条件(1000 μatm的CO2浓度)对颗石藻的生长具有促进作用[33],这与本实验的结论一致。本实验中,高p(CO2)条件下细胞的生长速率虽略有下降,但POC生产速率相比于低p(CO2)条件升高,说明酸化对颗石藻E.huxleyi的正面效应相对于的负面效应更加显著。PERU46生长速率在两种二氧化碳浓度下均高于PERU41,说明PERU46通过增强增殖能力来适应海洋酸化条件。PIC/POC的比值及电镜下形态观察均表明PERU41的钙化能力更强。在高p(CO2)条件下,PERU46细胞的PIC含量及产率降低说明酸化条件下PERU46钙化作用受到了抑制,与前人的研究海洋酸化会导致颗石藻钙化作用下降相符[34]。
生物所同化的能量只用于生长和繁殖,不同生物的能量分配不同就形成不同的对策:选择r对策的生物分配更多能量用于繁殖,而选择K对策的生物则分配更多能量用于个体生长[35]。结合这两种不同基因型藻株以上生理参数以及生长速率的监测,推测PERU46和PERU41在应对酸化胁迫时分别采用了r对策与K对策,前者分配更多能量用于快速繁殖,而后者则保守地分配更多能量用于保护性的外壳加固。
3.2 不同p(CO2)及高光条件下细胞光合生理响应
本实验探究E.huxleyi两种不同基因型的藻株PERU41和PERU46在适应不同p(CO2)后进行短期高光胁迫,研究颗石藻对海洋酸化及高光耦合条件下的光合生理响应。细胞在受到光胁迫时会通过提高NPQ耗散光合色素捕获的过剩能量以达到保护目的[32]。在低p(CO2)短期的高光胁迫处理下,钙化较弱的PERU46比钙化作用较强的PERU41具有更高的非光化学淬灭能力,说明PERU46受到更强的高光胁迫。有研究表明E.huxleyi的颗石粒对不同光质的光都具有遮挡作用,可以阻挡10%~22%的可见光及20%~25%的紫外光[10]。因此PERU46受到更强的高光胁迫可能是由于其钙质外壳较薄相较于PERU41不能阻挡更多的可见光所导致的。
低p(CO2)条件下,经过短期高光处理的PERU41和PERU46细胞的最终YPSⅡ和修复比率/损伤比率相似。这结果说明PERU46通过其他的光耗散途径抵消PERU41更厚钙质外壳对高光的遮蔽作用,达到保护细胞的目的。高p(CO2)条件下,PERU46的最终YPSⅡ及短期高光处理下的修复速率均显著降低,这说明海水酸化会加剧高光对颗石藻的胁迫作用。
植物细胞的光合作用能否正常运行由光系统Ⅱ D1蛋白的损伤与修复间的平衡决定[36]。在高p(CO2)条件下,PERU46细胞高光胁迫下PSⅡ的修复速率下降,可能是由于高p(CO2)条件导致细胞消耗更多的能量抵御海水酸化。D1蛋白修复所能利用的能量减少,及酸化条件下细胞内氢离子浓度升高会直接影响D1蛋白修复分子的功能都会导致光系统Ⅱ中的D1蛋白修复速率下降。NISHIYAMA等的研究表明光合色素所吸收的过剩光能也会降低D1蛋白的修复速率[37]。本实验中,高p(CO2)条件下PERU46细胞内叶绿素c及类胡萝卜素含量显著增加,光系统就会吸收更多的光能,导致D1蛋白修复速率降低。高p(CO2)条件下,PERU41和PERU46细胞的损伤速率均提高且速率相近,表明酸化条件下E.huxleyi细胞更容易受到高光的胁迫。但PERU41细胞的PSⅡ修复速率提高,导致PERU41细胞的PSⅡ修复/损伤速率高于PERU46细胞。
高光胁迫下酸化条件中的PERU41细胞的最终YPSⅡ高于PERU46,表明酸化对钙质外壳的影响会导致颗石藻细胞更容易受到高光的胁迫。与低p(CO2)适应相比,高p(CO2)适应下PERU46细胞在短期高光胁迫下的最终YPSⅡ显著降低,表明海洋酸化会通过影响颗石藻钙化作用增强高光的胁迫作用。这可能是由于缺乏颗石粒提供的稳定微环境,钙化水平会影响海洋生物对海洋酸化的生理反应[38]。
4 结 论
综上所述,属于β进化枝的PERU46的比生长速率较高,而α进化枝的PERU41钙化水平较高。在海洋酸化条件中PERU46会消耗更多的能量用于增殖,而PERU41会增强钙化作用来适应环境变化,反映出两者不同的生存策略。与低p(CO2)适应相比,高p(CO2)适应下最终YPSⅡ、修复速率降低及损伤速率升高均表明酸化条件会增强高光对颗石藻的胁迫作用,而两者的应对策略也有所不同:PERU46通过增加NPQ来应对,而高钙化作用的PERU41则依靠更厚钙质外壳对高光的遮蔽作用。

