加味肝豆汤联合二巯丙磺钠驱铜治疗对湿热内蕴型病脂质代谢和胆汁酸的影响
王 飞,汪美霞,陶 庄,蒋真真
(1.安徽中医药大学,安徽 合肥 230012;2.安徽中医药大学第一附属医院,安徽 合肥 230031)
肝豆状核变性(hepatolenticular degeneration,HLD)又称Wilson病(Wilson’s disease,WD),是由编码铜转运ATP7B基因突变导致ATP酶功能减弱或消失引起的常染色体隐性遗传病[1]。临床上可见血清铜蓝蛋白(ceruloplasmin,CP)合成减少以及胆道排铜障碍,蓄积在体内的铜离子在肝、脑、肾、角膜等处沉积。根据WD临床表现的不同,将其划分为肝型、脑型及肝脑型[2-3]。世界范围内WD的发病率约为1/30 000,致病基因携带者约为1/90[4]。脂质代谢异常为WD常见临床症状之一,当肝脏脂质代谢网络调控发生紊乱,游离脂肪酸、游离胆固醇等在肝脏中积累,引起细胞器功能障碍甚至细胞死亡,长期的损伤修复过程会导致肝脏纤维组织弥漫性增生,最终导致肝硬化,肝硬化的发生概率随着病程的延长增加[5]。肝脏是胆汁酸(bile acid,BA)合成和再循环的重要场所,肝功能受损时,胆汁在肝脏淤积,进而影响糖脂代谢、能量消耗等环节[6]。肝豆汤是安徽中医药大学第一附属医院经临床实践研制的用于治疗湿热内蕴型WD的有效方剂,具有清热解毒、通腑利尿之功,加味肝豆汤是国医大师韩明向在肝豆汤的基础上加茵陈、郁金而成的验方。目前,关于WD伴脂质代谢紊乱的研究国内外少有报道。本研究旨在观察加味肝豆汤联合二巯丙磺钠(sodium dimercaptosulphonate,DMPS)驱铜治疗对湿热内蕴型WD患者脂质和胆汁酸代谢紊乱的临床疗效。
1 临床资料
1.1 诊断标准
1.1.1 WD诊断标准 参照《肝豆状核变性诊疗指南(2022年版)》[7]制定WD的诊断标准:①存在原因不明的精神神经症状和(或)肝病表现;②CP<0.2 g/L,和(或)24 h尿铜排出量>100 μg,或肝铜含量>250 μg/g;③角膜K-F色素环阳性;④父母近亲婚配,同胞中有确诊WD患者或死于原因不明的肝病者。符合①②的同时符合③或④即可明确诊断。
1.1.2 湿热内蕴证诊断标准 参考《中药新药临床研究指导原则》[8]制定湿热内蕴证诊断标准:主症包括肢体拘挛、言语含糊、脘腹胀满、纳食不香等次症包括面色晦暗、头昏目眩、黄疸水臌、口苦或臭、尿赤便结等;舌红或偏红,苔黄腻,脉弦滑数。
1.1.3 高脂血症诊断标准 参照《中国成人血脂异常防治指南(2016年修订版)》[9]制定高脂血症诊断标准:总胆固醇(total cholesterol,TC)≥5.18 mmol/L,三酰甘油(triglyceride,TG)≥1.70 mmol/L,高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)<1.04 mmol/L,低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)>3.37 mmol/L,≥1项指标异常者即可诊断为高脂血症。
1.2 纳入标准 ①符合WD诊断标准;②符合湿热内蕴证诊断标准;③符合高脂血症诊断标准;④年龄为12~30岁;⑤患者或其监护人均自愿签署知情同意书。
1.3 排除标准 ①既往有肝胆手术史者;②合并有心脑血管、消化系统、肾脏等严重损害者;③合并有病毒性、药物性、酒精性、自身免疫性肝脏损害及其他不明因素引起的肝脏损害者;④精神异常不能配合者;⑤服用其他中药或其他生物制剂者。
1.4 一般资料 收集安徽中医药大学第一附属医院脑病中心2021年9月至2022年11月住院的WD患者60例,按随机数字表法将其分为对照组和治疗组,每组30例。治疗组:男13例,女17例;年龄14~28岁,平均年龄(21.45±3.56)岁;病程3~7年,平均病程(4.69±1.25)年;统一Wilson病评定量表(unified Wilson’s disease rating scale,UWDRS)平均评分(48.33±8.78)分。对照组:男15例,女15例;年龄13~29岁,平均年龄(21.87±4.02)岁;病程2~6.5年,平均病程(4.98±1.78)年;UWDRS平均评分(48.45±9.11)分。两组患者性别、年龄、病程、UWDRS评分比较,差异均无统计学意义(P>0.05),具有可比性。本研究经安徽中医药大学第一附属医院伦理委员会批准及审核(伦理审查编号:2021MCZQ07)。
2 方法
2.1 治疗方法 两组患者均接受低铜、低脂、高蛋白饮食。对照组予以驱铜治疗,按照20 mg/kg缓慢静脉滴注DMPS(上海禾丰制药有限公司,国药准字H31021514),每日1次,静脉滴注6 d后,间歇2 d;予以10%葡萄糖酸钙20 mL静脉滴注,每日1次,共4个疗程。治疗组患者在对照组疗法基础上服用加味肝豆汤(萆薢、半枝莲、穿心莲各15 g,郁金12 g,黄芩、黄连各9 g,生大黄、茵陈各6 g)颗粒剂(四川新绿色药业公司生产),每日早晚各1袋,餐后用温开水150 mL冲服。8 d为1个疗程,两组均治疗4个疗程。
2.2 指标观察方法
2.2.1 湿热内蕴证积分及中医证候疗效判定标准 参考《中药新药临床研究指导原则》[8]制定湿热内蕴证证候积分标准,治疗前后分别观察主症(肢体拘挛、言语含糊、脘腹胀满、纳食不香)和次症(面色晦暗、头昏目眩、黄疸水臌、口苦或臭、小便黄赤、大便干结),主症按“轻度”“中度”“重度”分别计2、4、6分,次症按“轻度”“中度”“重度”分别计1、2、3分,正常计0分。见表1。采用尼莫地平法计算疗效指数,再根据疗效指数判定中医证候疗效。疗效指数=(治疗后湿热内蕴证积分-治疗前湿热内蕴证积分)/治疗前湿热内蕴证积分×100%。显效:75%≤疗效指数≤100%;有效:30%≤疗效指数<75%;无效:0≤疗效指数<30%;恶化:疗效指数<0。
2.2.2 血脂、肝功能、尿铜检测 治疗前后分别抽取患者空腹外周静脉血5 mL,2 000 r/min离心10 min,取上层血清,利用胆固醇氧化酶法测定TC、HDL-C、LDL-C水平,用磷酸甘油氧化酶法检测TG水平,采用胆汁酸循环酶法测定BA水平,采用乳酸脱氢法检测丙氨酸氨基转移酶(alanine transferase,ALT)、天冬氨酸氨基转移酶(aspartate transferase,AST)和γ-谷氨酰转移酶(γ-glutamyl transferase, GGT)水平,采用GGX型原子吸收分光光度计检测24 h尿铜水平。
2.2.3 安全性观察 治疗前后检测两组患者血常规、尿常规、粪常规、肝功能、肾功能、心电图。
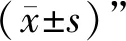
3 结果
3.1 两组患者中医证候疗效比较 两组患者中医证候疗效比较,差异有统计学意义(P<0.05),治疗组疗效优于对照组。见表2。
3.2 两组患者治疗前后湿热内蕴证积分比较 两组患者治疗后湿热内蕴证积分均较治疗前显著降低(P<0.05),且治疗组降低程度大于对照组(P<0.05)。见表3。

表2 两组患者中医证候疗效比较

表3 两组患者治疗前后湿热内蕴证积分比较
3.3 两组患者治疗前后血清BA、ALT、AST和GGT比较 治疗后两组患者血清BA、ALT、AST、GGT水平均较治疗前显著降低(P<0.05),且治疗组血清BA、ALT、AST、GGT水平降低程度显著大于对照组(P<0.05)。见表4。
3.4 两组患者治疗前后血清TC、TG、LDL-C和HDL-C水平比较 与治疗前比较,治疗后两组患者血清TC、TG、LDL-C水平均显著降低(P<0.05),血清HDL-C水平显著升高(P<0.05),且治疗组血清TC、LDL-C水平降低程度和HDL-C升高程度显著大于对照组(P<0.05)。见表5。
3.5 两组患者治疗前后24 h尿铜水平比较 第2、4个疗程末,两组患者24 h尿铜水平均较治疗前显著增加(P<0.05);第4个疗程末,治疗组24 h尿铜水平显著高于对照组(P<0.05)。见表6。
3.6 安全性观察 治疗后两组患者血常规、尿常规、粪常规、肝功能、肾功能和心电图均未出现明显异常,且在治疗过程中均未出现与药物相关的不良反应。

表4 两组患者治疗前后BA、ALT、AST和GGT比较
4 讨论
脂质代谢异常为WD的常见临床症状,主要表现为TC、TG、LDL-C升高和HDL-C降低,肝脏合成脂质过多、脂肪酸摄取过多或氧化失常、脂质分泌异常等是肝脏脂质代谢异常的主要原因[10]。内源性血脂主要合成于肝脏等组织细胞中,TC、TG、LDL-C、HDL-C是反映机体脂质代谢水平的常用指标。TC由LDL-C携带运输至全身,组织中多余的TC由HDL-C吸收,运输到肝脏,加工为BA排出体外。BA在肝细胞中生成TG及胆固醇酯,可降低BA对肝脏的损伤作用[11]。约70% BA形成于肝细胞中,通过胆盐输出泵输送至胆囊,进食后随胆囊收缩再排入十二指肠内,BA在胆汁淤积状态下可以造成肝和胆管细胞损伤,间接激活肌成纤维细胞,从而促进肝纤维化[12]。此外,BA可通过调控胰脂肪酶和脂蛋白酯酶的活性,提高对脂肪的水解代谢,间接激活M1受体,启动炎症级联反应,最终导致肝纤维化形成。25%以上的血脂异常患者合并脂肪肝[13],而ALT、AST、GGT作为检测机体肝功能损伤的主要指标,其含量升高能反映机体肝功能的损伤[14]。

表5 两组患者治疗前后血清TC、TG、HDL-C、LDL-C水平比较

表6 两组患者治疗前后24 h尿铜水平比较
WD可归属于中医学“肝积”“胁痛”“鼓胀”等范畴。《灵枢·五癃津液别》曰:“五谷之津液和合而为膏者,内渗入于骨空,补益脑髓,而下流于阴股。”指出膏脂由水谷精微化生而成,液者为膏,凝者为脂,嗜食肥甘厚腻,膏脂精微超出正常所需则凝结于皮下脏腑形成脂凝。胆汁酸乃胆汁主要成分,而胆汁的合成与肝密切相关,《东医宝鉴·胆腑》中“肝之余气,溢入于胆,聚而成精”,肝之功能受损,则胆汁生成排泄等方面皆受到影响。杨文明认为,WD的病机特点为本虚标实,其本为先天肝肾阴虚或病久伤阳致脾肾阳虚,其标为湿热内蕴,痰瘀互结,且铜浊毒邪贯穿疾病整个病程[15]。湿热、铜毒之邪侵袭,久则伤脾,脾虚湿困,阻滞中焦,则见食欲不振、腹胀痞满等症[16],当治以清热化湿、通腑利尿,方选高锌低铜之加味肝豆汤。肝豆汤中生大黄、黄连、黄芩药性苦寒,归脾、胃、大肠经,生大黄清热泻火、利湿退黄;黄连清热燥湿、泻火解毒;半枝莲、穿心莲、萆薢清解热邪浊毒。诸药合用,具有清利肠中湿热、通泄铜毒浊邪之功。加味肝豆汤在肝豆汤的基础上加用茵陈和郁金,茵陈清利湿热,郁金解郁疏肝、通腑利胆,加强原方清利湿热、通腑泄浊解毒的功效。
本研究发现,加味肝豆汤联合DMPS驱铜治疗能显著改善患者湿热内蕴证候,降低血清TC、TG、LDL-C、BA、ALT、AST水平,升高血清HDL-C水平,提示加味肝豆汤联合DMPS驱铜治疗可以有效改善患者脂质代谢及BA水平,保护肝功能。治疗2个疗程后,两组患者24 h尿铜均较治疗前显著升高,但组间差异无统计学意义,这可能与治疗时间较短有关;治疗4个疗程后,治疗组24 h尿铜水平显著高于对照组(P<0.05),说明加味肝豆汤联合DMPS驱铜治疗可显著降低体内游离铜含量。两组治疗后均未出现与药物相关的不良反应,说明加味肝豆汤的安全性高。
现代药理学研究[17]显示,加味肝豆汤中药物及其有效成分具有降低血脂、保护肝脏和促进胆汁排泄作用。大黄素通过促进下游蛋白微小异源二聚体表达,引起BA生成减少及代谢增加,减轻胆汁淤积。黄连可上调钠离子—牛磺胆酸协同转运蛋白等的表达水平,从而促进胆汁酸排泄,降低肝内胆汁淤积,改善肝功能[18]。黄芩苷联合姜黄素可降低肝内胆固醇7α-羟化酶等分子的表达水平,从而发挥抗胆汁淤积和促脂质代谢作用[19]。穿心莲可通过降低乳酸脱氢酶的活性发挥保肝作用[20]。茵陈中有效成分倍半萜内酯能够降低肝内脂肪蓄积[21]。郁金中吉马酮成分可有效抗脂肪生成,同时促脂肪分解[22]。
综上所述,以清热化湿、利腑泄浊解毒为功效的加味肝豆汤联合DMPS驱铜治疗能够有效改善湿热内蕴型WD患者临床症状,提高临床疗效。其作用机制可能与改善脂质代谢异常,调节BA代谢,保护肝功能相关。

