肝豆汤调控NLRP3炎症小体抑制病模型神经炎症的机制研究
杨瑞楠,程 楠,董健健,徐陈陈,徐乐文,文佩华,张 培
(1.安徽中医药大学研究生院,安徽 合肥 230012;2.安徽中医药大学神经病学研究所,安徽 合肥 230061)
Wilson病(Wilson’s disease,WD)是由ATP7B基因突变导致铜代谢障碍,进而出现肝脏及神经和精神等多系统症状的遗传病[1]。安徽中医药大学神经病学研究所自1970年代开始从中医证候学及辨证论治方面对WD进行研究,认为WD是由铜毒内聚、肝胆湿热内蕴所致,创用肝豆汤,通过其清热解毒、通腑利湿作用治疗WD患者,取得显著的临床疗效[2]。临床研究发现,肝豆汤可降低WD患者外周血炎症因子的表达水平,调节WD患者免疫功能。实验研究[3-4]发现,肝豆汤可减少WD神经细胞的氧化应激损伤,抑制神经细胞凋亡,改善高铜诱导的神经细胞变性坏死。但肝豆汤治疗铜蓄积诱导的神经细胞炎症损伤机制尚未阐明。
研究[5]证明,炎症反应存在于WD神经细胞内。课题组前期研究[6]发现,Nod样受体家族含pyrin结构域蛋白3(Nod-like receptor family,pyrin domain-containing protein 3,NLRP3)炎症小体在WD神经细胞损伤的病理过程中起重要作用,抑制NLRP3炎症小体激活可显著减少WD模型TX小鼠神经炎症导致的神经细胞损伤,并明显改善其行为学异常。可见,铜蓄积诱发的炎症损伤在WD患者脑损伤过程中起重要作用。本实验以WD动物模型和细胞模型为研究对象,观察肝豆汤调控NLRP3炎症小体对高铜诱导神经细胞炎症损伤的干预作用,为脑型WD的诊治提供理论基础。
1 材料
1.1 细胞与动物 小胶质细胞(BV-2细胞)、海马细胞(HT-22细胞)购自中国科学院上海细胞库。从美国Jackson动物实验中心引进TX种鼠,在中国科学院合肥物质研究院SPF级实验动物中心进行饲养及传代繁殖。以50只DL小鼠为对照组,将100只TX小鼠随机分为模型组和肝豆汤组,每只小鼠均为3月龄,体质量(20±5)g。为保证种鼠及其子代具备WD模型的特性,模型组入组动物均已进行基因检测。TX小鼠使用许可证号:SYXK(皖)2018-005。SPF级雄性SD大鼠30只,3月龄,体质量(210±25)g,购自济南朋悦实验动物繁育有限公司[生产许可证号:SCXK(鲁)2019-0003],饲养于安徽中医药大学神经病学研究所实验动物中心。本实验经安徽中医药大学动物伦理委员会批准(编号:AHUCM-rats-2020022)和中国科学院合肥物质研究院动物伦理委员会批准(编号:IACUC19001)。
1.2 药物及试剂 肝豆汤(金钱草、泽泻各24 g,大黄、姜黄、黄连各20 g,三七3 g)饮片购自同仁堂药店,煎煮2次,将2次药汁合并,文火煎煮浓缩至150 mL(含生药0.74 g/mL),冷却后保存于4 ℃冰箱。按照课题组前期构建的高效液相色谱指纹图谱分析方法[19],控制肝豆汤的质量。DMEM培养基(CA0002-500ML):中国Sparkjade公司;MEM细胞培养基(10100147)、胎牛血清(11090081):美国Gibco公司;半胱氨酸天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase,Caspase-1)(ab138483)、NLRP3(ab270449)、含CARD结构域的凋亡相关颗粒样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)(ab175449)、白细胞介素-1β(interleukin-1β,IL-1β)(ab254360):英国Abcam。
1.3 仪器 CK2型倒置相差显微镜:日本Olympus公司;Fine Do X6型全自动化学发光图像分析系统:上海天能科技有限公司;Power Pac Basic 型电泳仪:美国伯乐公司。
2 方法
2.1 细胞培养及传代 将HT-22及BV-2细胞置于37 ℃、5% CO2的条件下培养,细胞生长至密度约为80%时进行传代。
2.2 含药血清制备及保存 将30只SD大鼠适应性喂养1周后,每日分2次予以肝豆汤8 mL/kg(相当于60 kg成人临床剂量的6.3倍)灌胃,灌胃4周后,用3%戊巴比妥钠30 mg/kg深度麻醉,腹主动脉无菌采血,将血液静置于室温2 h后,3 000 r/min离心15 min,取上清。再6 700 r/min、4 ℃离心30 min,取上清,过滤,放置56 ℃水浴中灭活30 min,-20 ℃保存。
2.3 倒置相差显微镜下观察BV-2细胞活化水平 取对数生长期的BV-2细胞,消化收集,细胞悬液接种于96孔板,每组设6个复孔。当细胞生长至90%时,各组加入MEM或CuCl2培养液100 μL,作用时间结束后,于倒置相差显微镜下观察细胞形态,并对活化细胞计数。
2.4 CCK-8法检测细胞存活率 取对数生长期的细胞,消化收集,细胞悬液接种于96孔板,每组设6个复孔。当细胞生长至90%时,各组加入所需培养液100 μL,作用时间结束后,避光下每孔加入CCK8溶液10 μL,置于37 ℃、5% CO2条件下培养1.5 h后测试吸光度。
2.5 细胞条件培养 传代BV-2细胞,设正常组、模型组、5%肝豆汤血清组、10%肝豆汤血清组、15%肝豆汤血清组,当细胞生长至90%时,弃去原培养液,条件培养正常组加入MEM完全培养液;条件培养模型组加入含10 μmol/L CuCl2的MEM;各肝豆汤血清组先加入不同浓度含肝豆汤血清培养液作用1 h,后加入含10 μmol/L CuCl2的MEM;12 h后,各组弃去原培养液,加入DMEM完全培养液,作用24 h后,收集上清,将其分别加入HT-22细胞正常组、模型组、5%肝豆汤血清组、10%肝豆汤血清组、15%肝豆汤血清组中,24 h后收集上清及细胞。
2.6 细胞乳酸脱氢酶(lactate dehydrogenase,LDH)漏出率及氧化应激水平检测 收集条件培养的各实验组培养液100 μL,依据LDH检测试剂盒说明书操作,检测各组细胞LDH漏出率;收集条件培养的各实验组细胞,按照索莱宝公司活性氧(reactive oxygen species,ROS)检测试剂盒说明书装载荧光探针DCFH-DA,检测各组细胞DCF荧光强度;收集条件培养的各实验组细胞,依据索莱宝公司丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢(hydrogen peroxide,H2O2)、还原型谷胱甘肽(glutathione,GSH)、氧化型谷胱甘肽(glutathione oxidized,GSSG)活性检测试剂盒说明书操作,在酶标仪各指标所需波长处检测吸光度值,根据细胞检测公式计算MDA、SOD、H2O2、GSH、GSSG水平。
2.7 BV-2细胞的分组及处理 体外传代并培养BV-2细胞,分为正常组、模型组、5%肝豆汤血清组、10%肝豆汤血清组、15%肝豆汤血清组,各肝豆汤血清组先加入不同浓度含肝豆汤血清的培养液作用1 h,后同模型组一起加入含 10 μmol/L CuC12的MEM作用12 h,干预结束后收集各组上清及细胞。
2.8 酶联免疫吸附试验检测各组细胞炎症因子水平 收集各组BV-2细胞上清,按试剂盒说照书检测各组细胞IL-1β、白细胞介素-18(interleukin-18,IL-18)、肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)水平。
2.9 动物分组及给药方法 分为正常组(DL小鼠50只)、模型组(TX小鼠50只)、肝豆汤组(TX小鼠50只)。对各组小鼠灌胃28 d,正常组与模型组采用生理盐水(20 mL/kg)灌胃,肝豆汤组采用肝豆汤(20 mL/kg)灌胃,每日2次,末次给药后,用3%戊巴比妥钠30 mg/kg麻醉后处死小鼠,于冰上取小鼠海马组织进行脑组织损伤水平及NLRP3炎症小体相关蛋白表达水平检测。
2.10 行为学检测
2.10.1 Barnes迷宫 设置迷宫所需圆形平台,直径为122 cm,高99 cm,平台周边有20个均匀分布的直径为10 cm的孔,各孔外观均匀,平台中央设置1个黑色可移动的逃生盒,只有1个孔连接到逃生盒,实验前先将小鼠放在逃生盒熟悉环境,30 s后将小鼠拿到平台,计时3 min,观察小鼠能否找到逃生盒及其找到目标洞口的潜伏期。
2.10.2 旷场实验 试验所需的装置为方形箱子,规格为50 cm×50 cm×40 cm,其底部分为边缘区(1区)、中间区(2区)、中心区(3区)。实验所需全部小鼠被放入实验区域同一位置,观察其自由活动,时间为5 min。
2.10.3 高架十字实验 设置实验所需两条相对开放臂和两条相对闭合臂及中央区,实验前将小鼠放置于装置内适应30 min,正式测试时,从中央区放进动物(面对闭合臂),观察其进入2种臂的次数及所停留的时间。进行以上实验时,每测试完一只小鼠,清除其粪便、尿液,并用75%乙醇无菌操作。以上实验的检测与分析使用Ethovision XT系统进行。
2.11 苏木精-伊红(hematoxylin-eosin,HE)染色法检测脑组织形态 将脑组织进行固定等前期处理后切片,厚度为4 μm,山羊血清封闭,苏木精和伊红染液染色,于显微镜下观察脑损伤情况。
2.12 Western blot检测NLRP3炎症小体相关蛋白表达水平 取各组海马组织,加入PMSF和RIPA裂解液及磁珠研磨;取各组BV-2细胞,加入PMSF和RIPA裂解液,冰上裂解30 min。随后4 ℃条件下12 000 r/min离心30 min,取上清液,加入蛋白上样缓冲液后,立即水浴8 min,随后保存于-20 ℃冰箱。电泳后将蛋白进行转膜。常温封闭4 h,一抗4 ℃过夜孵育,二抗室温摇床孵育1.5 h后曝光,后用Image J软件(1.53版本,美国国立卫生研究院)分析条带灰度值。
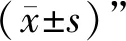
3 结果
3.1 CuCl2诱导BV-2细胞活化 与正常组比较,加入CuCl2后,BV-2细胞表面突起逐渐收缩,并呈现出胞体增大、突起变短、细胞形态呈圆形的活化状态。2~200 μmol/L CuCl2激活的BV-2细胞活化率显著增加(P<0.05)。见图1。
注:A.正常组;B.模型组;与正常组(0 μmol/L CuCl2组)比较,*P<0.05
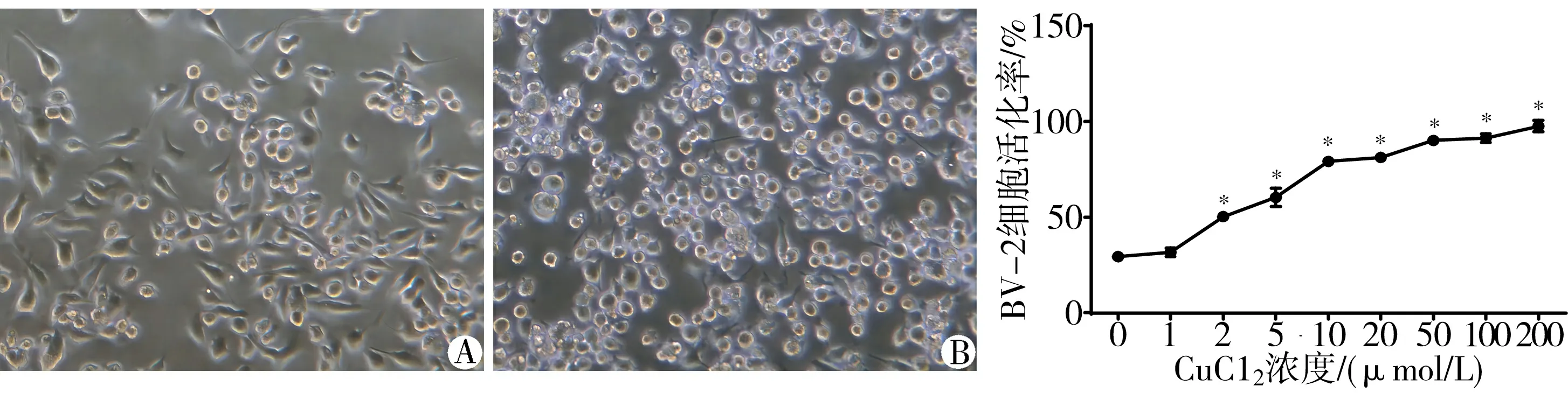
3.2 CuCl2诱导BV-2细胞活化间接引起HT-22细胞损伤 对BV-2细胞和HT-22细胞单独予以不同浓度CuCl2处理。CCK8检测结果显示,与正常组比较,CuCl2在1~50 μmol/L浓度范围内未引起显著的BV-2细胞及HT-22细胞死亡(P>0.05)。见图2。BV-2细胞与HT-22细胞条件培养下,10 μmol/L CuCl2可显著降低HT-22细胞存活率(P<0.05)。见图3。

注:与正常组比较,*P<0.05
注:A.正常组;B.模型组;与正常组比较,*P<0.05
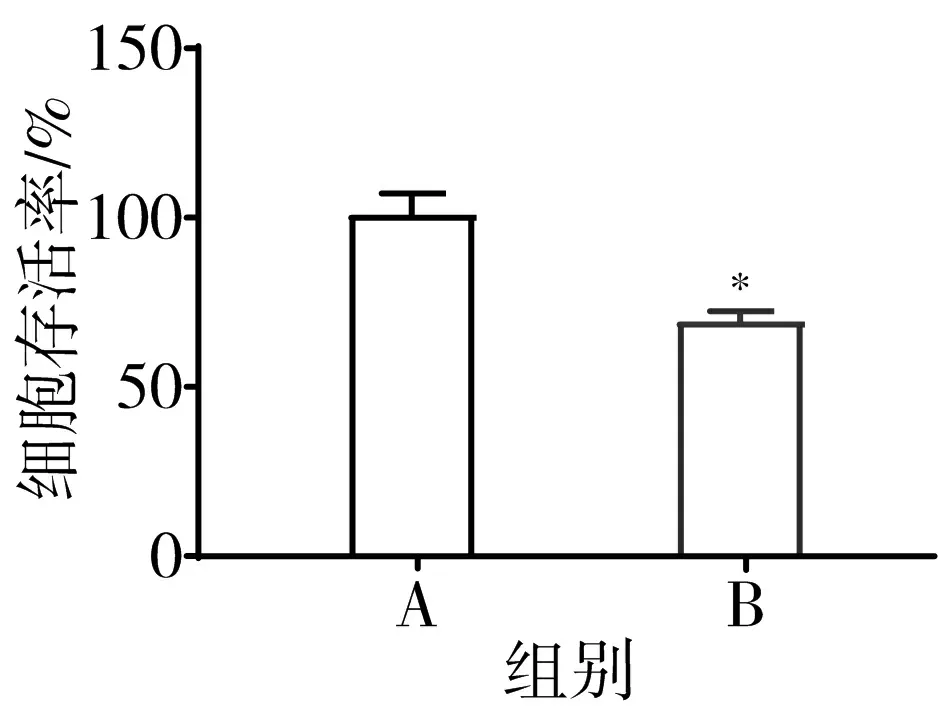
3.3 含肝豆汤血清减轻CuCl2诱导条件培养对HT-22细胞的损伤 将不同浓度含肝豆汤血清单独作用于HT-22细胞及BV-2细胞,分为正常组、5%肝豆汤血清组、10%肝豆汤血清组、15%肝豆汤血清组、20%肝豆汤血清组。CCK8检测结果显示,与正常组比较,各组细胞存活率无明显变化(P>0.05)。见图4。将不同浓度含肝豆汤血清作用于条件培养细胞,10%和15%含肝豆汤血清可显著提高模型组条件培养细胞活力(P<0.05)。见图5。

注:A.正常组;B.5%肝豆汤血清组;C.10%肝豆汤血清组;D.15%肝豆汤血清组;E.20%肝豆汤血清组

注:A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.4 含肝豆汤血清可抑制CuCl2诱导BV-2细胞的活化 与正常组比较,经CuCl2损伤后,细胞折光性显著下降,表面突起逐渐皱缩,并呈现出胞体增大、突起变短、呈圆形的活化状态,细胞贴壁不良,细胞密度降低;与模型组比较,肝豆汤组细胞表面突起伸出,贴壁状态得到改善,折光性较模型组显著增强。见图6。



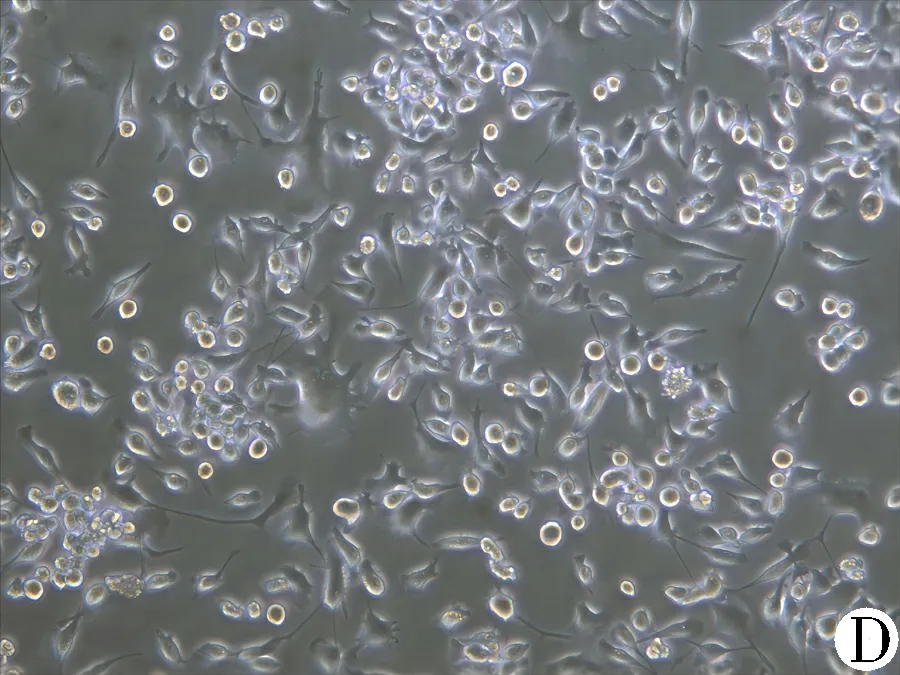

注:A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组
3.5 含肝豆汤血清可降低CuCl2条件培养的HT-22细胞LDH漏出率 模型组条件培养细胞上清液中LDH活力较正常组显著增加(P<0.05);与模型组比较,肝豆汤组细胞上清液中LDH活力均显著降低(P<0.05)。见图7。

注:A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.6 含肝豆汤血清可降低CuCl2条件培养的HT-22细胞氧化应激水平 与正常组比较,模型组ROS活性,MDA、H2O2水平显著升高(P<0.05),SOD活力、GSH/GSSG显著降低(P<0.05);与模型组比较,肝豆汤组ROS活性,MDA、H2O2水平显著降低(P<0.05),SOD活力、GSH/GSSG显著升高(P<0.05)。见图8。
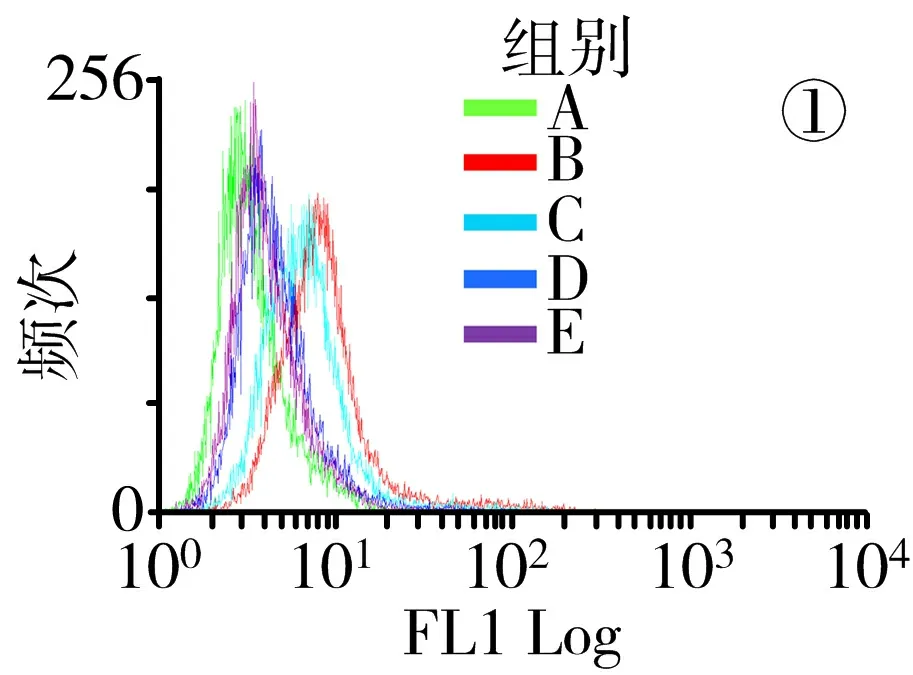
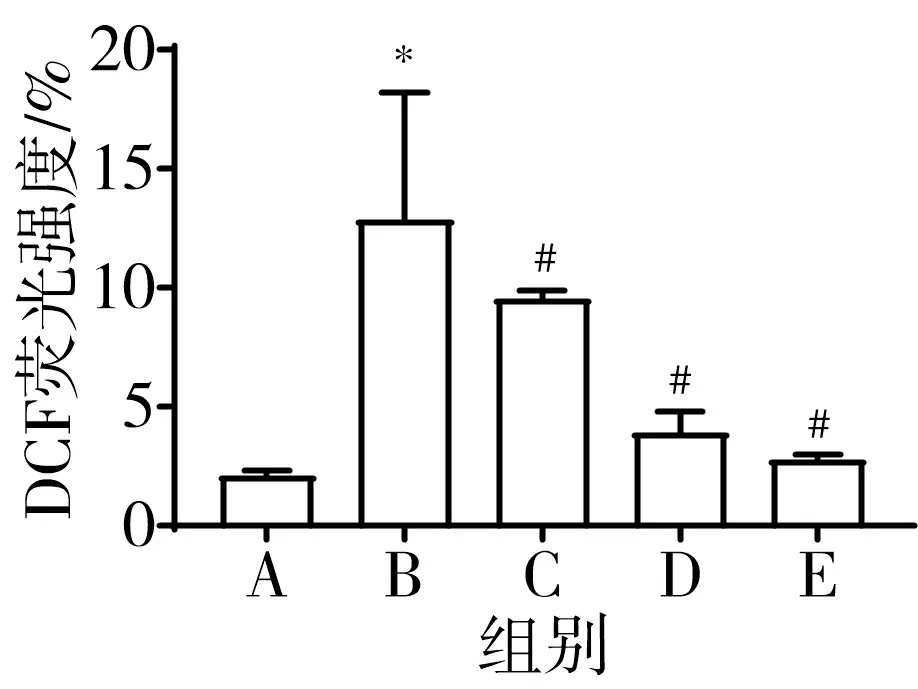




注:图①为ROS峰线图;A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.7 含肝豆汤血清可抑制CuCl2诱导的BV-2细胞炎症因子分泌 与正常组比较,模型组BV-2细胞中IL-1β、IL-18、TNF-α、iNOS水平均显著升高(P<0.05);与模型组比较,含肝豆汤血清可剂量依赖性降低CuCl2诱导的BV-2细胞中IL-1β、IL-18、TNF-α、iNOS水平(P<0.05)。见图9。




注:A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.8 含肝豆汤血清可下调CuCl2诱导的BV-2细胞NLRP3炎症小体相关蛋白表达水平 与正常组比较,模型组Caspase-1、NLRP3、ASC、IL-1β蛋白表达水平显著升高(P<0.05);与模型组比较,含肝豆汤血清可降低Caspase-1、NLRP3、ASC、IL-1β蛋白表达(P<0.05)。见图10。


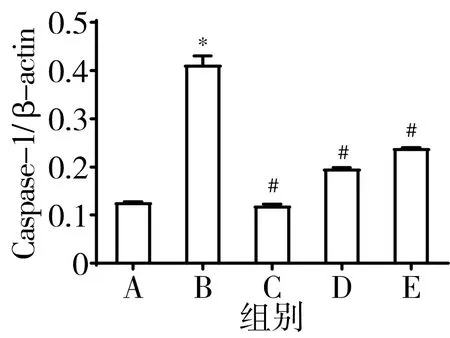

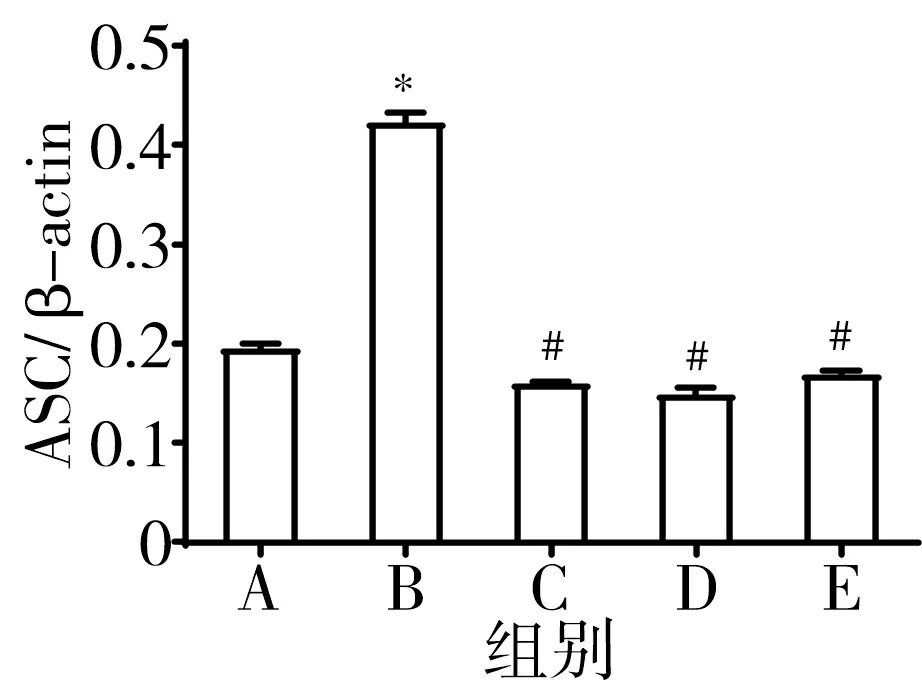
注:A.正常组;B.模型组;C.5%肝豆汤血清组;D.10%肝豆汤血清组;E.15%肝豆汤血清组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.9 肝豆汤可改善TX小鼠行为学异常 从各组小鼠中随机选取38只进行行为学试验。Barnes迷宫中,肝豆汤可显著缩短TX小鼠进入目标洞潜伏期(P<0.05)。高架十字迷宫中,肝豆汤治疗组小鼠开臂进入次数百分比、开臂持续时间显著升高(P<0.05)。旷场实验中,肝豆汤可显著增加TX小鼠运动中央时间、总路程、直立次数(P<0.05),降低TX小鼠边上时间、静止时间(P<0.05)。见图11。




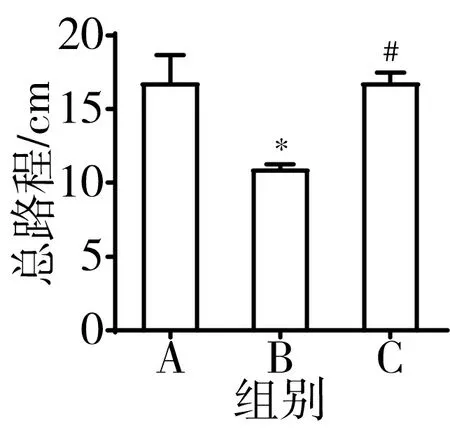

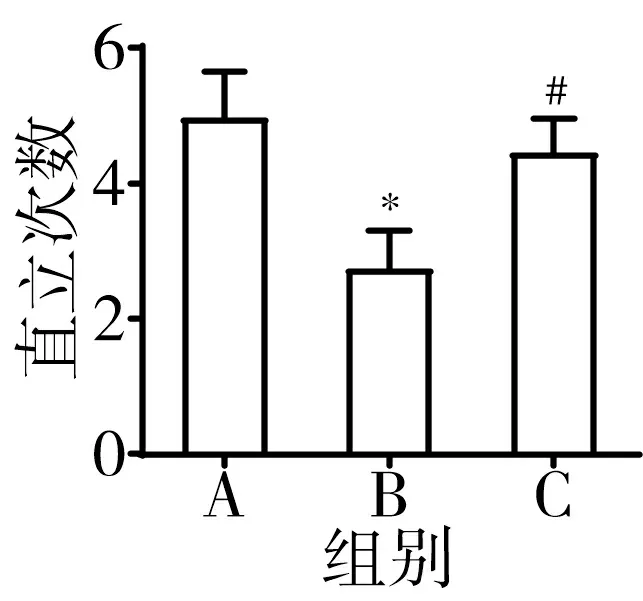

注:A.正常组;B.模型组;C.肝豆汤组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
3.10 肝豆汤可减轻TX小鼠海马组织神经细胞损伤 HE染色结果显示,正常组海马组织细胞形态正常,周围神经纤维紧密,未见明显异常。模型组海马组织细胞排列稀疏,多见锥体细胞坏死,核固缩或溶解消失(黑色箭头)。肝豆汤组海马组织细胞形态规则,排列整齐,神经细胞核大而圆,细胞质丰富,浅蓝色或蓝色均匀,核仁清楚,层次及细胞线清晰。见图12。
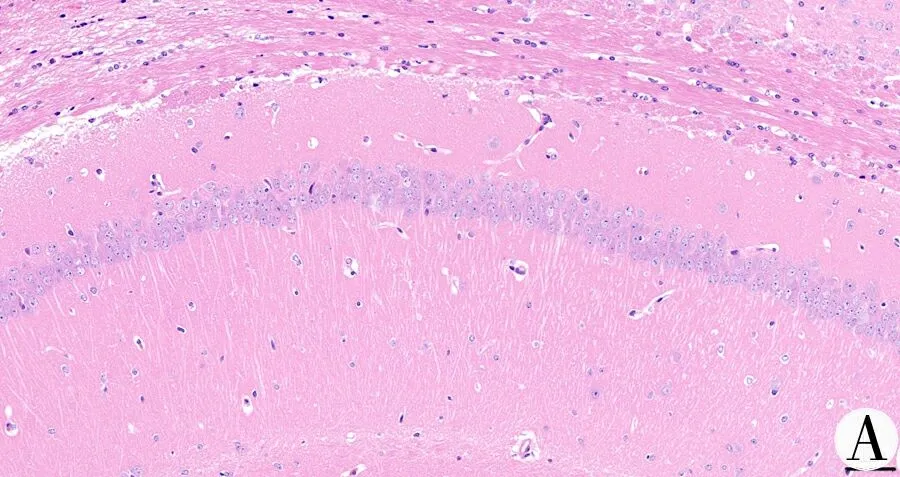


注:A.正常组;B.模型组;C.肝豆汤组;箭头示核固缩或溶解消失
3.11 肝豆汤抑制TX小鼠海马组织NLRP3炎症小体活化 口服中药肝豆汤能同时阻断TX小鼠海马组织NLRP3、Caspase-1、IL-1β、ASC蛋白的表达(P<0.05)。见图13。


注:A.正常组;B.模型组;C.肝豆汤组;与正常组比较,*P<0.05;与模型组比较,#P<0.05
4 讨论
人体神经系统功能维持正常需要铜的参与。当神经细胞内铜稳态失调时,高浓度铜离子可诱导以小胶质细胞活化为特征的炎症反应并引起神经损伤[7-8]。有研究[5]发现,多种神经遗传变性疾病中枢神经系统损伤的重要机制之一为炎症反应,其特征为小胶质细胞活化,活化的小胶质细胞能够促进神经系统损伤的修复,而当炎症反应长期慢性存在时,则会加重神经系统的损伤。铜离子在脑中堆积引起的胶质细胞活化及神经细胞变性坏死是WD神经细胞损伤的重要机制,并有可能是治疗的重要靶点[9]。本实验发现,模型组小胶质细胞活化,且促使条件培养下的HT-22细胞氧化应激水平增高及细胞损伤,炎症因子表达水平较正常组显著增加。结果表明,WD细胞模型中铜离子沉积能诱导BV-2细胞活化,促进炎症因子分泌,从而加剧神经细胞损伤。此外有研究[10]发现,TX小鼠脑内铜沉积区域存在小胶质细胞活化及炎症因子分泌,并伴有神经细胞的变性坏死。以上提示炎症是WD神经细胞损伤的重要机制。
作为一种多蛋白复合物,NLRP3炎症小体由NLRP3、Caspase-1前体和ASC构成,在脑内主要在小胶质细胞和星形胶质细胞内表达[11]。近年来研究[12-13]证明,NLRP3炎症小体活化与多种神经系统遗传、变性疾病相关。NLRP3炎症小体与WD神经细胞损伤紧密相关。Dong等[6]研究发现,在WD小鼠模型中,NLRP3炎症小体对炎症因子的释放有促进作用,出现脑组织病理性损伤,而沉默NLRP3或药物抑制NLRP3炎症小体激活可改善铜堆积导致的神经细胞病理性损伤,从而防止神经退行性变。本实验发现,与正常组比较,TX小鼠海马组织NLRP3炎症小体相关蛋白Caspase-1、NLRP3、IL-1β、ASC表达水平升高。亦有多项研究[14-17]发现,激活的NLRP3炎症小体释放炎症因子,造成细胞损伤。
WD的中医辨证复杂多变,但是驱“铜毒”仍然是主要的治疗目标[18],肝豆汤各药物配合,共同发挥泻火解毒、清泻湿热、泻下攻积、活血祛瘀的作用。课题组前期建立了肝豆汤的高效液相色谱指纹图谱,从而良好控制了肝豆汤的质量,并发现盐酸小檗碱是其主要成分之一[19]。研究[20]发现,盐酸小檗碱可能通过阻断三叉神经痛大鼠的NLRP3炎症小体通路,降低其神经系统炎症反应,从而减轻神经节间的痛觉传递。本实验发现,肝豆汤可显著抑制WD细胞模型BV-2细胞的活化,减少BV-2细胞炎症因子的分泌,降低氧化应激水平,减轻神经细胞病理性损伤,显著提高条件培养HT-22细胞的存活率。为了进一步研究肝豆汤对NLRP3炎症小体的调控作用,给予TX小鼠口服肝豆汤治疗,并将含肝豆汤血清作用于细胞,结果发现,肝豆汤可显著降低TX小鼠海马组织及体外BV-2细胞NLRP3炎症小体相关蛋白Caspase-1、NLRP3、IL-1β、ASC的表达水平;肝豆汤可减轻TX小鼠海马组织神经细胞坏死,改善TX小鼠认知及运动功能损伤。以上结果表明,肝豆汤可抑制NLRP3炎症小体活化,减轻TX小鼠脑内铜沉积引起的病理损伤,改善TX小鼠行为学异常。
综上所述,NLRP3炎症小体激活是WD病理进程中的重要环节,肝豆汤可通过抑制NLRP3炎症小体激活,显著减少神经细胞炎症损伤,改善WD小鼠的认知及行动功能障碍,进而保护神经细胞。因此,抑制NLRP3炎症小体激活可能是肝豆汤治疗WD的机制之一。然而,本实验仍有局限性,NLRP3炎症小体的激活和调控方法以及肝豆汤在其中发挥作用的机制仍需研究。因此,今后应进一步对NLRP3炎症小体上游及下游的信号通路进行深入研究,以便为治疗WD提供新的思路。

