猪繁殖与呼吸综合征并发副猪嗜血杆菌与猪链球菌感染的鉴别诊断和防治
高 艺,郭彦辉,余 蕊,韩 爽,郝光恩,谢永兴,张潇月,杨玉艾,孙永科,张 恒,3
(1.云南农业大学动物医学院,云南昆明 650210;2.山东信得科技股份有限公司,山东青岛 266104;3.西北农林科技大学动物医学院,陕西杨凌 712100)
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是一种有囊膜的正链RNA病毒,根据基因组和抗原多样性可将其分为两种基因型,即欧洲型(PRRSV-1)和北美型(PRRSV-2)[1]。我国自1996年分离到PRRSV以来,报道的流行毒株大多属于PRRSV-2型,包括经典型、高致病性型(HP-PRRSV)以及NADC30-like和NADC34-like型[2]。PRRSV引起的猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)俗称“蓝耳病”,是一种高度免疫抑制性疾病[3],会导致动物致命性或持续性感染[4],其临床症状取决于动物的生长阶段、免疫状态、继发或合并感染的病原体以及环境条件和管理水平等[5],主要表现母猪流产、早产、产弱仔等繁殖障碍,以及仔猪、育肥猪呼吸系统紊乱和生长迟缓等症状,是一种严重危害养猪业的高度接触性传染病[4]。目前,混合感染已成为畜禽养殖场的普遍现象。PRRSV是生猪养殖场流行的主要病原体之一[6],可引起机体的高度免疫抑制,因此易与副猪嗜血杆菌(Haemophilus parasuis,HPS)[7]、猪链球菌(Streptococcus suis,SS)[8]等细菌发生混合或继发感染。
HPS是一种革兰氏阴性、非溶血性、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)依赖型细菌,是一种条件致病菌,在特定情况下(如应激和免疫抑制),可引发以纤维素性多发性浆膜炎、关节炎和脑膜炎为主要特征的格拉瑟病(Glasser's disease)[9],引起的猪群发病率和死亡率较高,给养猪业带来重大经济损失。目前HPS至少已确定15种血清型,其中在我国流行最普遍的是血清型4和5,其次是血清型13、14和12[10]。
SS是有荚膜的革兰氏阳性球菌,目前共有35个血清型(1~34、1/2型),最常见的为2型[11]。SS也是一种条件致病菌,常存在于猪上呼吸道,但它可穿透黏膜屏障进入血液、关节和中枢神经系统而致病,引起菌血症、心内膜炎、关节炎、肺炎和猝死等[12]。此外,SS是一种人兽共患病病原体,能够引起链球菌脑膜炎综合征和中毒性休克综合征,严重时可导致死亡[13]。
2022年11 月,某存栏2 000头母猪的大型规模化养猪场,在使用PRRSV活疫苗(CH-1R株)免疫后,饲养的母猪及40~50日龄仔猪突发疫病,症状主要表现为高热、精神沉郁、呼吸困难、食欲减退或停食,发病率约为15%,病死率约为8%。为确定该猪场的发病原因,以便制定科学防治方案,对该猪场采集的血清及肺脏进行病毒抗体和抗原检测、细菌分离鉴定及分型,对分离菌株进行药敏试验,以期为猪场PRRSV与其他病原的混合感染防控提供参考。
1 材料与方法
1.1 病料来源
某规模化猪场疑似患病的母猪和40~50日龄仔猪。
1.2 主要试剂、疫苗及药物
PRRSV ELISA抗体检测试剂盒、PCV2 ELISA抗体检测试剂盒,购于BioCheck公司;CSFV ELISA抗体检测试剂盒,购于IDEXX公司;病毒核酸提取试剂盒,购于AXYGEN公司;Evo M-MLV一步法RT-PCR试剂盒,购于艾科瑞生物科技有限公司;DL 2000/5000 DNA Marker,购于Takara公司;胰蛋白胨大豆琼脂(trypticase soy agar,TSA)、胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、LB琼脂,购于青岛海博生物技术有限公司;药敏纸片,购于杭州微生物试剂有限公司;SS-1、2、7、9型分型标准阳性血清参考品,购于中国兽医药品监察所;新生牛血清,购于杭州天杭生物科技股份有限公司;NAD,购于生工生物(上海)股份有限公司;无菌脱纤维羊血,购于南京全隆生物技术有限公司;HP-PRRSV GDr180株活疫苗(信蓝宁)、PRRSV CH-1a株灭活疫苗(信蓝净),为北京信得威特科技有限公司产品;注射用头孢噻呋钠,为江西省腾龙生物药业有限公司产品。
1.3 仪器设备
T100 PCR仪,美国Bio-Rad公司产品;电泳仪,北京六一生物科技有限公司产品;Tanon 3500BR凝胶成像系统,上海天能公司产品;恒温培养箱,北京五洲东方科技发展有限公司产品;酶标仪,赛默飞世尔科技公司产品。
1.4 引物设计与合成
根据相关文献设计HP-PRRSV和NADC30-like毒株NSP2高变区的鉴别诊断引物[14],PCV2[15]和CSFV[16]检测引物(表1),HPS 16S rRNA[17]、SSgdh基因[18]特异性鉴定引物(表2),HPS 1~15型PCR分型引物[19](表3)。所有引物序列,均由生工生物(上海)股份有限公司合成。

表1 病毒检测引物序列
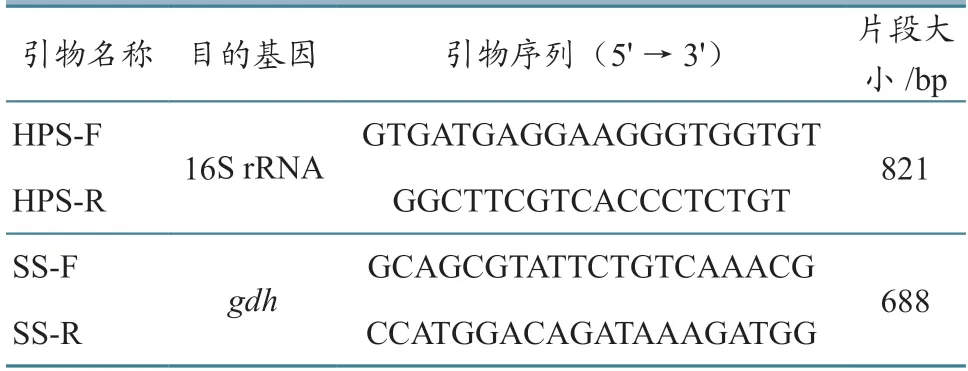
表2 HPS和SS鉴定引物序列

表3 HPS 1~15型PCR分型引物序列
1.5 病猪临床症状及病理剖检观察
观察病猪整体状态、精神状态和饮食状态,并对病死猪进行临床剖检,观察各组织脏器的病理变化。
1.6 病毒抗体检测
随机采集母猪和40~50日龄仔猪的血清样品共75份,分别按照PRRSV、PCV2、CSFV抗体检测试剂盒说明书,进行病毒抗体检测。根据各试剂盒说明书,使用酶标仪在合适波长处读取试验结果,并进行试验有效性判定,计算并分析试验结果的阳性率、S/P或阻断率平均值、标准差和离散度。
1.7 病毒核酸检测
随机采集母猪和40~50日龄仔猪的血清样品共25份,以及病死猪肺脏样品4份(进行研磨处理),按照病毒核酸提取试剂盒说明书要求,提取样品中的病毒核酸,分别采用PRRSVNSP2高变区鉴别诊断引物以及CSFV和PCV2检测引物,进行病毒核酸检测,同时设立阴性对照。PCR扩增产物经10 g/L琼脂糖凝胶电泳检测并观察结果,阳性样品送生工生物工程(上海)股份有限公司进行序列测定。
1.8 PRRSV NSP2基因测序及遗传进化分析
将测序序列通过BLAST与NCBI上国内外PRRSV参考毒株的NSP2基因高变区序列进行比对分析,用MEGA 7.0软件中的Neighbor-Joining法,构建进化树并分析各毒株的遗传进化关系。
1.9 细菌分离及PCR鉴定
无菌条件下取100 µL肺脏研磨液接种于TSA平板培养基(含28.125 µg/µL NAD和100 mL/L新生牛血清)和血琼脂平板培养基(含100 mL/L无菌脱纤维羊血),用玻璃珠涂板法进行涂布,于37 ℃培养箱中培养18~36 h,观察细菌生长状态;挑取培养基上疑似HPS和SS形态特征的单个菌落,进一步接种TSA平板培养基和血琼脂平板培养基进行纯化,同时用HPS 16S rRNA和SSgdh基因特异性鉴定引物对疑似菌落进行PCR扩增,并设立阴性对照;将PCR扩增产物,经10 g/L琼脂糖凝胶电泳检测并观察结果。
1.10 HPS分型鉴定
将鉴定为HPS阳性的单个菌落接种于TSB液体培养基(含28.125 µg/µL NAD和100 mL/L新生牛血清),37 ℃振荡培养18 h;取1 mL菌液12 000 r/min离心2 min,弃上清;将沉淀用PBS洗涤2次,用100 µL PBS振荡混匀,100 ℃水浴10 min,12 000 r/min离心2 min,取上清液作为DNA模板,用HPS 1~15型PCR分型引物进行PCR扩增,同时设立阴性对照;将PCR扩增产物,经10 g/L琼脂糖凝胶电泳检测并观察结果。
1.11 SS分型鉴定
将鉴定为SS阳性的单个菌落接种TSB 液体培养基(含100 mL/L新生牛血清),37 ℃振荡培养18 h,8 000 r/min离心10 min,弃上清;将沉淀用PBS洗涤2次,制成5×108CFU/mL的细菌悬液;取20 µL菌液与20 µL SS-1、2、7、9型标准阳性血清参考品,在玻片上充分混匀,5 min内观察有无凝集反应。
1.12 细菌药敏试验
用纸片扩散法测定HPS和SS分离菌株的耐药性。取100 µL HPS和SS培养液,分别涂布含28.125 µg/µL NAD + 100 mL/L新生牛血清和只含100 mL/L新生牛血清的TSA平板培养基上,选取新霉素、多西环素、青霉素、大观霉素、氟苯尼考、环丙沙星、恩诺沙星、阿莫西林、头孢曲松等24种常用抗生素为试验药物,将各药敏片均匀贴附于平板培养基表面,于37 ℃下培养16~24 h,观察并测定药敏片抑菌圈直径,耐药性判断标准参考药敏纸片说明书。
2 结果
2.1 临床症状及剖检观察
病猪临床表现为高烧不退、精神萎靡、食欲不振、流涎、呼吸困难,有时腹式呼吸,不愿行走或行走缓慢,耳朵及四肢等末梢器官表面发绀,呈暗紫色,体表皮肤出现明显的蓝紫色斑块(图1-A、B)。剖检发现:病猪胸腔及心包有大量积液,心脏表面有纤维素性渗出物,淋巴结肿大;肺脏间质增宽,外观呈鲜红色,肺脏表面可见暗红色斑块状淤血及鲜红色出血块(图1-C)。
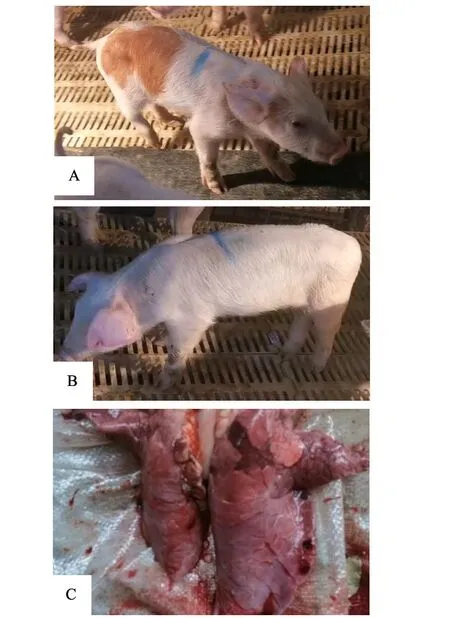
图1 患病猪临床症状及肺脏病变
2.2 PRRSV、PCV2及CSFV抗体检测
病毒抗体检测结果(表4)显示:PRRSV、PCV2、CSFV抗体阳性率分别为60.0%(45/75)、98.67%(74/75)、97.33%(73/75),离散度分别为98.08%、20.98%、17.07%。结果表明,该猪场目前处于PCV2和CSFV抗体水平高、PRRSV抗体水平低的状态。
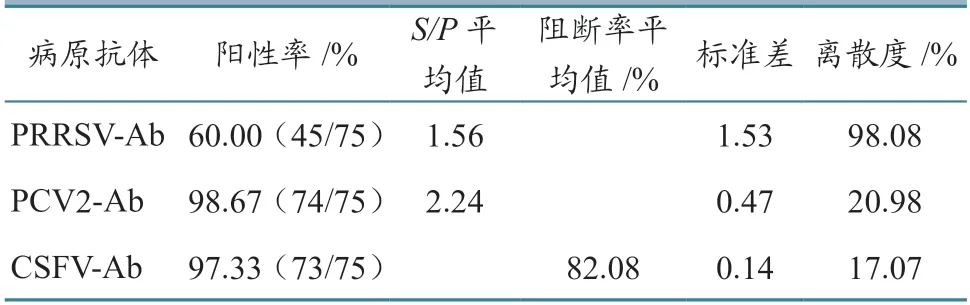
表4 PRRSV、PCV2、CSFV的抗体检测结果
2.3 病毒PCR检测
用HP-PRRSV和NADC30-like毒株NSP2高变区鉴定引物进行的PCR扩增结果显示:25份血清样品中,有9份扩增出984 bp的条带(图2),与预期大小相符,血清阳性率为36.0%(9/25);4份肺脏样品中,均有扩增条带,其中肺脏2和肺脏1、3、4的扩增条带大小不同,分别为681 bp和984 bp,与预期大小相符(图3);血清及肺脏样品中,PCV2和CSFV均为阴性。

图2 血清PRRSV RT-PCR琼脂糖凝胶电泳结果
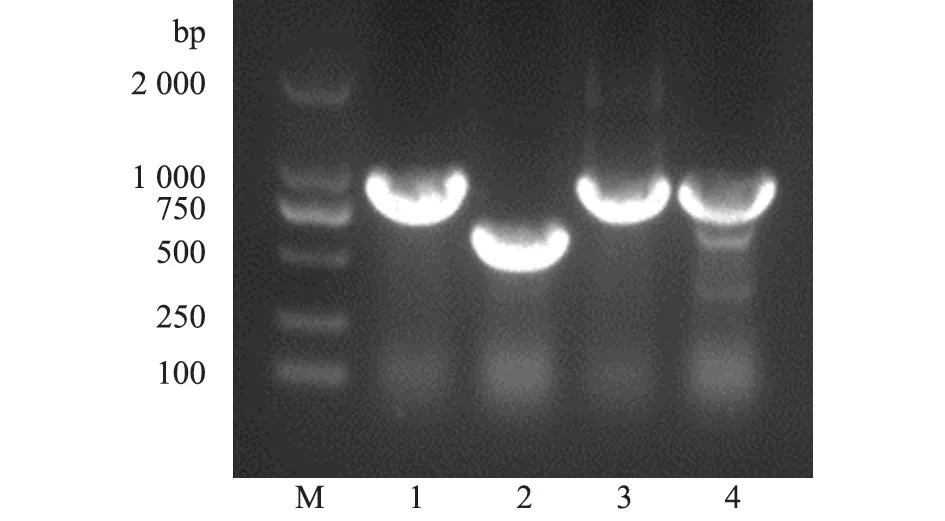
图3 肺脏PRRSV RT-PCR琼脂糖凝胶电泳结果
2.4 PRRSV NSP2基因遗传进化分析
将测序结果进行BLAST比对分析的结果(图4)显示:2号肺脏样品(命名为AH1)PRRSVNSP2基因序列与GenBank中的NADC30-like毒株有90.7%~93.7%的同源性,其余样品(命名为AH2)的PRRSVNSP2基因序列与GenBank中JXA1-like毒株有98.8%~99.8%的同源性。
根据PRRSVNSP2基因序列构建的进化树(图5)显示:PRRSV分为PRRSV-1型和PRRSV-2型,其中PRRSV-2型包括NADC30-like(Lineage 1)、QYYZ-like(Lineage 3)、VR2332-like(Lineage 5)和JXA1-like(Lineage 8)。AH1与我国流行的HeN1401、SX1-1607等NADC30-like毒株处于同一分支,同属于Lineage 1;AH2与JSYZ1909-16、rJXA1-R等JXA1-like毒株处于同一分支,同属于Lineage 8。
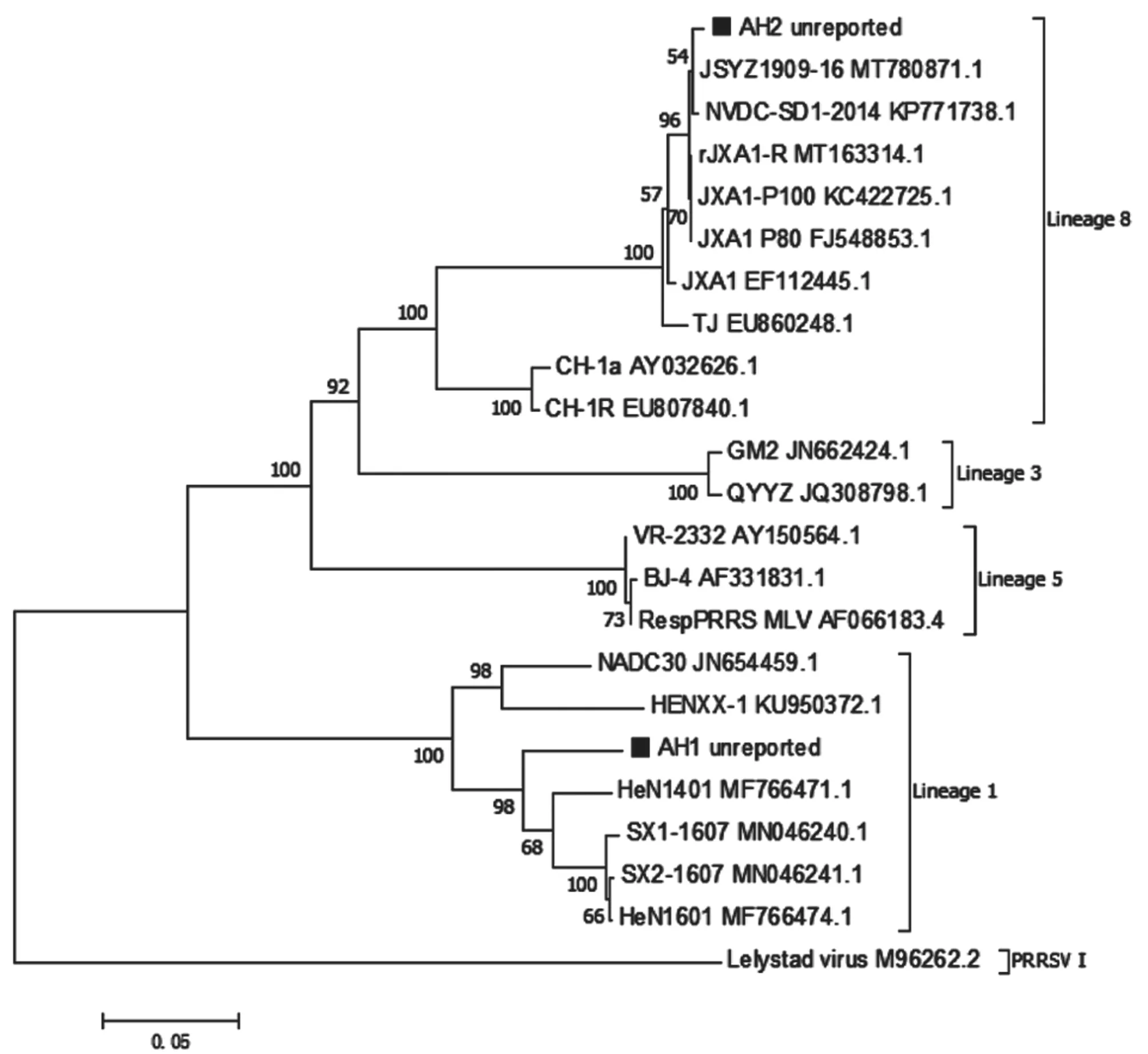
图5 PRRSV NSP2基因遗传进化树分析结果
2.5 细菌分离培养
将肺脏组织研磨液分别涂布于TSA平板培养基和血琼脂平板培养基,24 h后发现:TSA平板上有圆形、边缘整齐、表面光滑、灰白色、半透明、针尖大小菌落(图6),符合HPS形态特征;血琼脂培养基上有呈圆形、半透明、灰白色、表面光滑、边缘整齐且有溶血环的菌落(图7),符合SS形态特征。
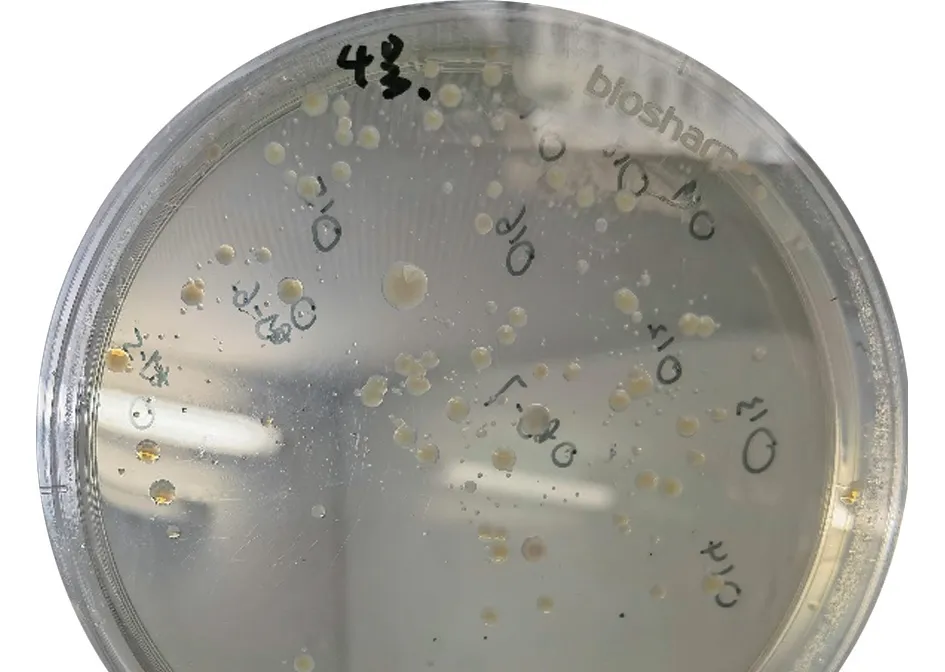
图6 TSA平板培养基上菌落形态
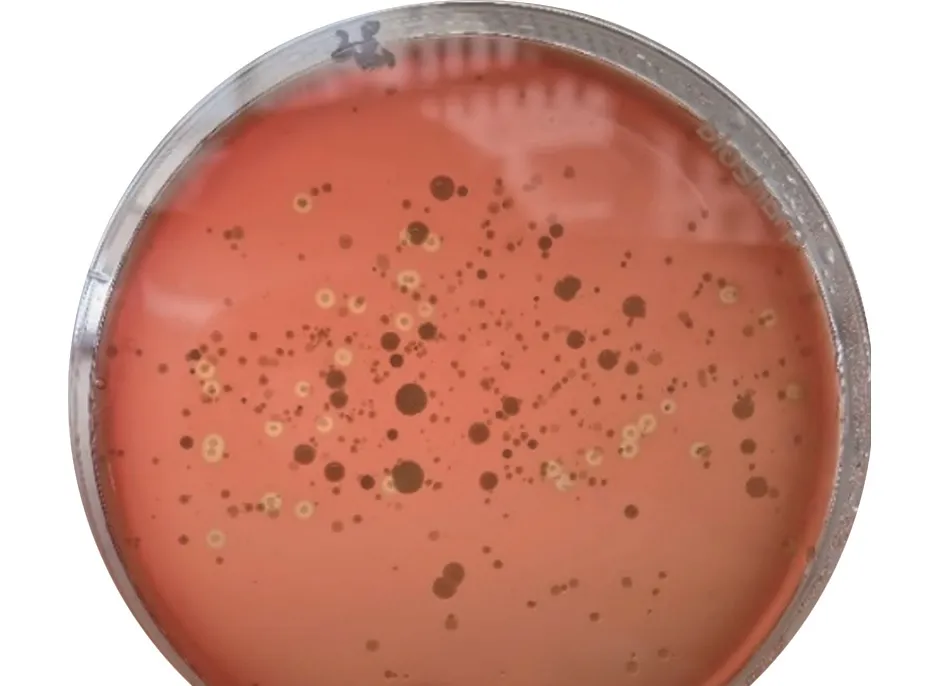
图7 血琼脂平板培养基上菌落形态
2.6 细菌PCR鉴定
用HPS 16S rRNA和SSgdh基因特异性鉴定引物,对平板培养基上生长的疑似菌落进行PCR鉴定。HPS 16S rRNA PCR琼脂糖凝胶电泳结果显示,4份肺脏样品均扩增出821 bp目的片段(图8),与预期大小相符;SSgdh基因PCR琼脂糖凝胶电泳结果显示,4份肺脏样品均扩增出688 bp目的片段(图9),与预期大小相符。
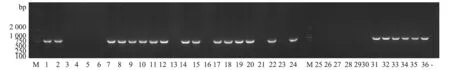
图8 HPS 16S rRNA PCR琼脂糖凝胶电泳结果
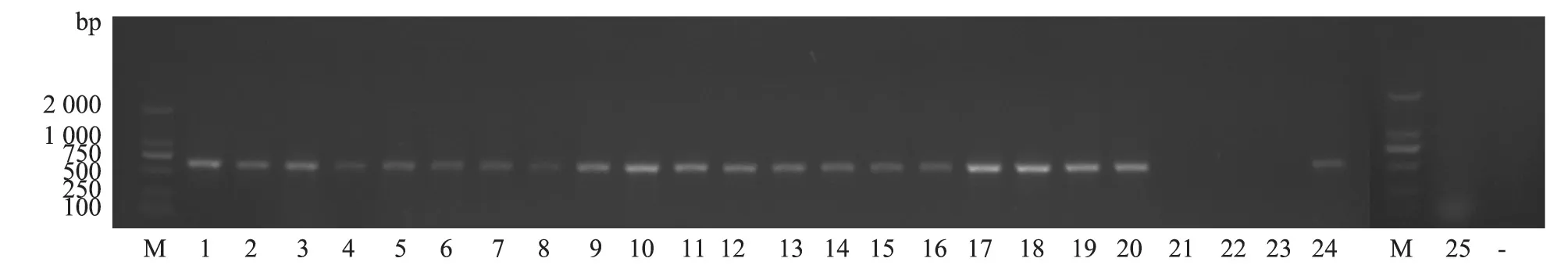
图9 SS gdh基因PCR琼脂糖凝胶电泳结果
2.7 HPS分型
用HPS-1~15型PCR分型引物,确定分离纯化HPS菌株的血清型。结果(图10)显示:经HPS-5/12、12型引物分别扩增出大小为560 bp、508 bp的条带,与预期大小条带相符,其余血清型均未扩增出相应条带。结果表明,本次分离纯化的HPS菌株血清型为12型。

图10 HPS 1~15型PCR琼脂糖凝胶电泳结果
2.8 猪链球菌分型
采用玻片凝集法和SS-1、2、7、9型标准阳性血清参考品,确定分离纯化SS菌株的血清型。结果(图11)显示,分离菌株与SS-9型标准阳性血清产生明显的凝集现象,与SS-1、2、7型标准阳性血清均未见凝集现象。结果表明,本次分离纯化的SS菌株血清型为SS-9型。

图11 SS玻片凝集试验结果
2.9 药敏试验
本次分离的HPS菌株对多西环素、青霉素、大观霉素、恩诺沙星、头孢曲松、头孢噻呋、头孢氨苄、丁胺卡那、甲氧苄啶、头孢拉定、头孢唑林敏感,对新霉素、氟苯尼考、环丙沙星、阿莫西林、头孢噻肟-棒酸、诺氟沙星、氧氟沙星、链霉素、四环素、红霉素、卡那霉素、复方新诺明、氨苄西林耐药(表5);SS分离菌株对新霉素、多西环素、青霉素、大观霉素、氟苯尼考、环丙沙星、恩诺沙星、阿莫西林、头孢曲松、头孢噻呋、头孢噻肟-棒酸、头孢氨苄、丁胺卡那、头孢拉定、头孢唑林、诺氟沙星、氧氟沙星、氨苄西林敏感,对卡那霉素中介,对甲氧苄啶、链霉素、四环素、红霉素、复方新诺明耐药(表6)。

表5 HPS分离菌株药敏试验结果 单位:mm

表6 SS分离菌株药敏试验结果 单位:mm
3 临床干预治疗
基于本试验疾病诊断及细菌药敏试验结果,对猪场采取以下治疗及防控措施:将发病猪及时隔离、消毒,淘汰无治疗价值病猪,防止猪只交叉感染;加强通风、消毒,降低猪场环境病毒载量。对发病猪每天肌内注射1次头孢噻呋钠5 mg/kg,连续注射2~3 d;在饲料和饮水中,添加“黄芪多糖”和“电解多维”,以减轻猪群临床症状和排毒,治疗猪群细菌性疾病,提高动物机体免疫能力。药物治疗7 d后,先普免HP-PRRSV活疫苗(GDr180株)1头份/头,间隔21 d普免1次,21 d后再普免PRRSV灭活疫苗(CH-1a株)2 mL/头,在普免前先小群试用,观察2 d无不良反应后再扩大免疫。通过采取以上综合防控措施,该猪场猪群PRRSV抗体阳性率由60.0%(45/75)上升至100%(75/75),离散度由98.08%降至22.87%,HPS和SS抗原检测全部转为阴性,猪场逐渐恢复稳定状态,母猪及仔猪群精神状态良好,无咳喘等呼吸道问题发生,猪场病情得到有效控制。
4 讨论
目前,HP-PRRSV和NADC30-like是我国主要流行毒株,两者的混合感染在猪呼吸道疾病综合征发病猪中较为常见[20]。NADC30-like毒株虽不像HP-PRRSV毒株具有高致病性,但NADC30-like毒株的高度重组以及与其他病原体的合并感染,增加了PRRSV的突变率[21],易导致新毒株出现,给PRRS防控带来较大困难。Kumar等[22]研究表明,受PRRSV感染的动物机体可通过不同的机制诱导细菌继发感染,例如破坏上皮屏障,参与调节细菌粘附受体表达,以及改变宿主免疫反应。Li等[7-8]研究发现,PRRSV毒株的高重组率和广泛传播,加剧了它与某些细菌混合和继发感染情况,如SS和HPS。此外,在SS发病机制研究[23]中发现:PRRSV与SS合并感染时,PRRSV会抑制细胞发挥免疫功能,影响它们清除SS的能力,导致SS在组织中更广泛传播;并且SS的继发感染会增强PRRSV感染介导的炎症反应,引发动物机体更严重的临床症状[24]。PRRSV的持续演变使其致病机制的研究变得费力,它与其他猪病原体合并感染的诊断与治疗也变得更加困难。因此,养殖场在进行PRRS防控时,应借助病原学、血清学检测手段,以及病原基因测序技术和药敏试验,制定“一场一策”的免疫程序[25];防止滥用抗菌药,避免耐药性的产生和无效用药;采取疫苗免疫和药物压制的方案精准防控疾病。
根据该猪场的发病情况、病猪临床症状、实验室检测结果,综合判断该猪场是由于PRRSV抗体离散度较大,且流行的HP-PRRSV与NADC30-like毒株与免疫的CH-1R毒株不匹配,引起猪群发病导致感染猪免疫抑制,继而感染HPS和SS。目前,我国主要采取疫苗免疫的方式预防和控制PRRS[26]。临床上使用的商业化PRRSV经典毒株活疫苗仅针对同源毒株提供完全有效的保护,对HPPRRSV、NADC30-like毒株交叉保护有限[27-28]。HP-PRRSV活疫苗包括JXA1-R、HuN4-F112、TJM-F92和GDr180株[26],其中GDr180株活疫苗对PRRSV阳性活跃场的紧急免疫能有效控制疫情,在对抗HP-PRRSV毒株时效果显著,同时在面对NADC30-like和GM2等新流行毒株感染时,也能提供较好的免疫保护[29]。段振华[30]等在PRRS防控中发现,PRRSV灭活疫苗能有效控制NADC30-like毒株感染。因此,本研究制定了活疫苗加灭活苗的综合免疫方案,利用PRRSV GDr180株活疫苗激活机体的细胞免疫与体液免疫,同时使用PRRSV CH-1a株灭活疫苗进行加强免疫,进一步提高机体的体液免疫水平,快速提供免疫保护。根据本研究的细菌药敏试验结果,HPS和SS均对头孢类药物敏感,如头孢曲松、头孢噻呋等,其中头孢噻呋钠被广泛用于猪场疾病的预防和治疗,具有长效、安全性高的优点,在临床上可有效预防和治疗由HPS和SS引起的猪呼吸道疾病,以及治疗SS引起的败血症、多发性关节炎或多发性浆膜炎[31]。
5 结论
本研究对某规模化猪场发生疫病的猪进行临床症状和病理解剖观察,采集血清和肺脏进行PRRSV、PCV2、CSFV抗体和抗原检测,以及细菌分离鉴定和分型,确定该猪场疫情由HP-PRRSV和NADC30-like PRRSV毒株以及HPS-12型、SS-9型混合感染所致。头孢类药物对本次分离的HPS和SS菌株较为敏感。通过采取隔离、消毒等生物安全措施,PRRSV活苗和灭活苗的综合免疫,使用HPS和SS敏感药物进行治疗,病情得到有效控制。本研究为规模化猪场发生PRRSV与其他病原混合感染的鉴别诊断及精准防控提供了成功经验。

