腐乳酸浆水中产β-葡萄糖苷酶乳酸菌的研究
张佳萍 夏宁 滕建文 韦保耀 黄丽 张博
摘要:桂林腐乳酸浆水是桂林腐乳制作过程中的凝固剂,其富含的微生物赋予了腐乳特有的品质。而桂林腐乳酸浆水中乳酸菌的种类及其具有的优良功能活性尚不清晰。该研究从酸浆水中筛选出10株乳酸菌,其中5株具有产β-葡萄糖苷酶能力。经生理生化和16S rRNA鉴定,a1、a3、a7和b16为利莫西发酵乳杆菌(Limosilactobacillus fermentum),b8为德氏乳杆菌(Lactobacillus delbrueckii)。b8展现出最高的β-葡萄糖苷酶活力(发酵6 h时为(41.22±0.47) U/105 CFU),生长活力和产酸能力也显著高于其余4株产酶乳酸菌(P<0.05)。此外,德氏乳杆菌b8在培养12 h时的DPPH、ABTS自由基清除率分别为(16.29±2.22)%、(51.02±2.43)%。综上,德氏乳杆菌b8具有较好的功能活性和生长活力,该研究既丰富了对桂林腐乳酸浆水中乳酸菌的认识,又为豆制品行业提供了潜在的功能性发酵菌株。
关键词:乳酸菌;桂林腐乳;β-葡萄糖苷酶;产酸能力;抗氧化活性
中图分类号:TS214.2文献标志码:A 文章编号:1000-9973(2023)10-0027-06
Study on β-Glucosidase-Producing Lactic Acid Bacteria in Sour Slurry of Sufu
ZHANG Jia-ping, XIA Ning, TENG Jian-wen*, WEI Bao-yao, HUANG Li, ZHANG Bo
(College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China)
Abstract: Sour slurry of Guilin sufu is a coagulant in the production process of Guilin sufu.The microorganisms rich in it give unique quality to sufu. However, the types of lactic acid bacteria in the sour slurry of Guilin sufu and their excellent functional activities are still not clear. In this study, ten strains of lactic acid bacteria are screened out from sour slurry, among which, five strains have the capacity to produce β-glucosidase. After physiological, biochemical and 16S rRNA identification, a1, a3, a7 and b16 are Limosilactobacillus fermentum, and b8 is Lactobacillus delbrueckii. b8 shows the highest β-glucosidase activity ((41.22±0.47) U/105 CFU at 6 hours of fermentation), and the growth activity and acid-producing capacity are significantly higher than those of the other four strains of lactic acid bacteria (P<0.05). In addition, at 12 hours' culture, the scavenging rates of Lactobacillus delbrueckii b8 on DPPH and ABTS radicals are (16.29±2.22)%, (51.02±2.43)% respectively. In conclusion, Lactobacillus delbrueckii b8 has good functional activity and growth activity. This study has not only enriched the understanding of lactic acid bacteria in sour slurry of Guilin sufu, but also provided potential functional fermentation strains for the soybean product industry.
Key words: lactic acid bacteria; Guilin sufu; β-glucosidase; acid-producing capacity; antioxidant activity
桂林腐乳作為“桂林三宝”之一,以质地细腻、气香味鲜、风味独特的特点被消费者所喜爱[1]。豆腐凝固过程中析出的黄浆水经自然发酵1~2 d后形成酸浆水[2],在腐乳后续生产中作为凝固剂添加。酸浆水中丰富的微生物参与腐乳发酵的全过程,并赋予其诱人的香味和细腻的口感。其中,乳酸菌作为腐乳酸浆水中的主要微生物,对腐乳的风味、功能活性等的形成起到了重大作用[3-5],故分离鉴定酸浆水中的乳酸菌有利于桂林腐乳的工业化生产。
此外,发酵豆制品(如腐乳、豆酱、豆豉)含有与大豆酚类物质结构变化相关的微生物[6],有利于结合态的酚类物质从食品基质中游离[7],进而提高产品的功能活性。大豆异黄酮是主要的大豆酚类物质[8],但天然大豆中约97%~98%的异黄酮以不易直接被人体吸收的结合型糖苷形式存在[9],糖苷需被水解成游离型苷元后才可被人体吸收和利用。β-葡萄糖苷酶是水解大豆异黄酮糖苷的关键酶,已有学者从柿子醋醪[10]、宁夏浆水[11]和牛初乳[12]中分离出具有β-葡萄糖苷酶活性的乳酸菌,如植物乳杆菌R3[10]、植物乳杆菌YHG1-155[11]和植物乳杆菌LSP-16[12]等。但腐乳酸浆水中是否存在该种活性乳酸菌及活力大小均尚未可知。
本研究以桂林腐乳酸浆水为材料,利用特定培养基筛选产β-葡萄糖苷酶的乳酸菌,并评估其生长活力、产酸和抗氧化能力,为腐乳中乳酸菌的开发和利用提供了参考。
1 材料与方法
1.1 主要培养基及试剂
MRS液体培养基[13]:蛋白胨10 g、牛肉膏10 g、酵母粉5 g、磷酸氢二钾2 g、柠檬酸二铵2 g、葡萄糖20 g、吐温80 1 mL、七水硫酸镁0.58 g、四水合硫酸锰0.25 g、乙酸钠2 g、蒸馏水1 L,121 ℃灭菌20 min。
MRS固体培养基:MRS液体培养基添加17 g/L琼脂后灭菌。
碳酸钙固体培养基:MRS固体培养基添加20 g/L碳酸钙后灭菌。
七叶苷显色培养基[14]:MRS固体培养基添加0.5%的七叶苷和0.025%的柠檬酸铁。
主要试剂:4-硝基苯基-β-D-吡喃葡糖苷(p-NPG)、七叶苷、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS),购自上海源叶生物科技有限公司;对硝基苯酚(p-NP),购自天津大茂化学试剂有限公司;生理生化试剂盒,购自青岛海博生物科技有限公司。
1.2 仪器与设备
分析天平 瑞士Mettler Toledo集团;超净操作工作台 苏州净化设备有限公司;高速冷冻离心机 美国Thermo公司;数显恒温水浴锅 青岛聚创环保设备有限公司;灭菌锅 上海申安医疗仪器厂;pH计 梅特勒-托利多仪器(上海)有限公司;超声波破碎仪 赛飞(中国)有限公司。
1.3 样品及其来源
腐乳酸浆水为2018年4月22日取自广西桂林市临桂区四方井、桂清泉两家腐乳厂自然发酵1 d后的黄浆水。样品使用PET瓶盛装,将瓶盖扎孔以透气,于低温条件下带回实验室,置于4 ℃下保存,并在12 h内分离微生物。
1.4 产β-葡萄糖苷酶乳酸菌的分离与初筛
取5 mL腐乳酸浆水于装有45 mL无菌水的无菌三角瓶中,混匀后进行梯度稀释,涂布于碳酸钙固体培养基上,于37 ℃恒温下厌氧培养48 h。挑选产生溶钙圈的单菌落进行纯培养,将纯化后的单菌落接种于七叶苷显色培养基上,于37 ℃下厌氧培养24 h,若菌落周围出现明显棕黑色物质,则该微生物疑似可产生β-葡萄糖苷酶;若无显色反应,则该微生物不产生β-葡萄糖苷酶。
1.5 无细胞提取物的获得
参考vila等[15]的方法并稍作修改。挑取纯化后的乳酸菌单菌落于MRS液体培养基中,于37 ℃下培养24 h,每隔3 h取样测定。将菌悬液离心(8 000 g,4 ℃,10 min),弃去上清液,用磷酸钠缓冲液(0.5 mol/L,pH 6.5)洗涤沉淀2次后,重悬于上述缓冲液中。调节OD600 nm至0.5(菌落密度约为105 CFU/mL),加入1 mL溶菌酶(3 mg/mL),于37 ℃下孵育30 min,在细胞破碎仪中低温(冰浴)超声破碎(超声时间2 s,间歇3 s,45 W,15 min),得到破碎液。于8 000 g、4 ℃下离心10 min,上清液即为无细胞提取物(粗酶液),用于β-葡萄糖苷酶活力、抗氧化活性的测定。
1.6 β-葡萄糖苷酶活力的测定
参考前人的研究方法[15-17]并稍作改动,向100 μL无细胞提取物中加入900 μL磷酸钠缓冲液(0.5 mol/L,pH 6.5),在37 ℃水浴锅中预热10 min,加入1 mL 5 mmol/L p-NPG(已预热),于37 ℃精确反应30 min,立即加入1 mL 1 mol/L碳酸鈉(4 ℃)终止反应,室温下放置5 min,在400 nm处测定吸光度。以100 ℃灭活30 min的粗酶液、磷酸钠缓冲液作对照。结果以1 mL菌落密度约为105 CFU/mL的粗酶液在37 ℃、pH 6.5反应条件下每分钟酶解p-NPG产生1 μmol p-NP的能力表示(U/105 CFU)。
1.7 抗氧化活性的测定
根据覃超等[18]的方法测定无细胞提取物的DPPH自由基和ABTS阳离子自由基清除能力。
1.8 菌株的生长曲线及其产酸能力
参考徐佳敏等[19]的方法,将菌株活化后,接种到MRS液体培养基中,于37 ℃厌氧培养24 h,每3 h取样测定pH和OD600 nm值。
1.9 生理生化及分子生物学鉴定
1.9.1 生理生化鉴定
根据《乳酸细菌分类鉴定及实验方法》[20]及《伯杰细菌鉴定手册》[21]对菌株的种属进行鉴定。
1.9.2 分子生物学鉴定
参照黄紫衡等[22]的方法对菌株的DNA进行提取与扩增。PCR扩增产物委托上海美吉生物医药科技有限公司完成测序。测序结果与NCBI的Blast数据库进行比对,利用MEGA 6构建系统发育树。
1.10 数据处理
每个样品平行测定3次,结果以平均值±标准差表示。采用Excel与Origin 2023进行统计分析与画图。
2 结果与分析
2.1 产β-葡萄糖苷酶乳酸菌的筛选与鉴定
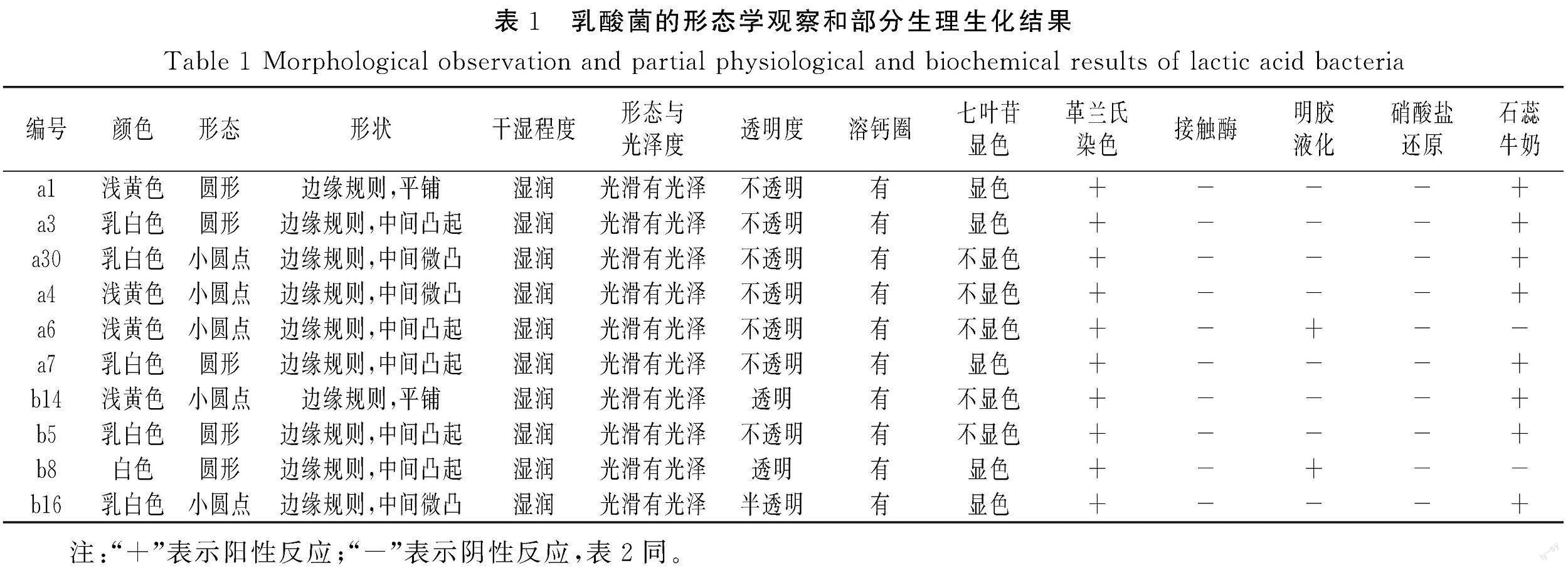
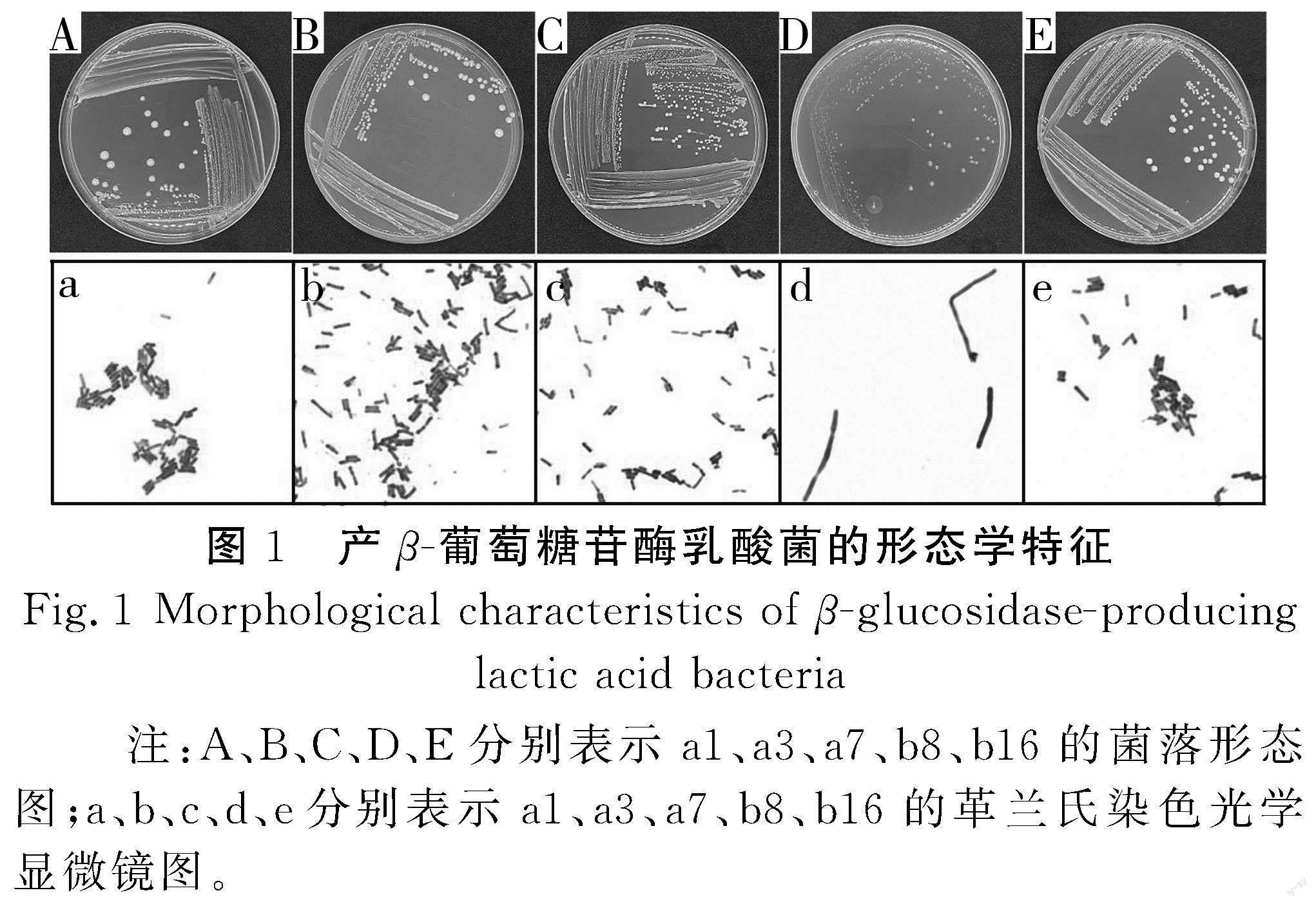
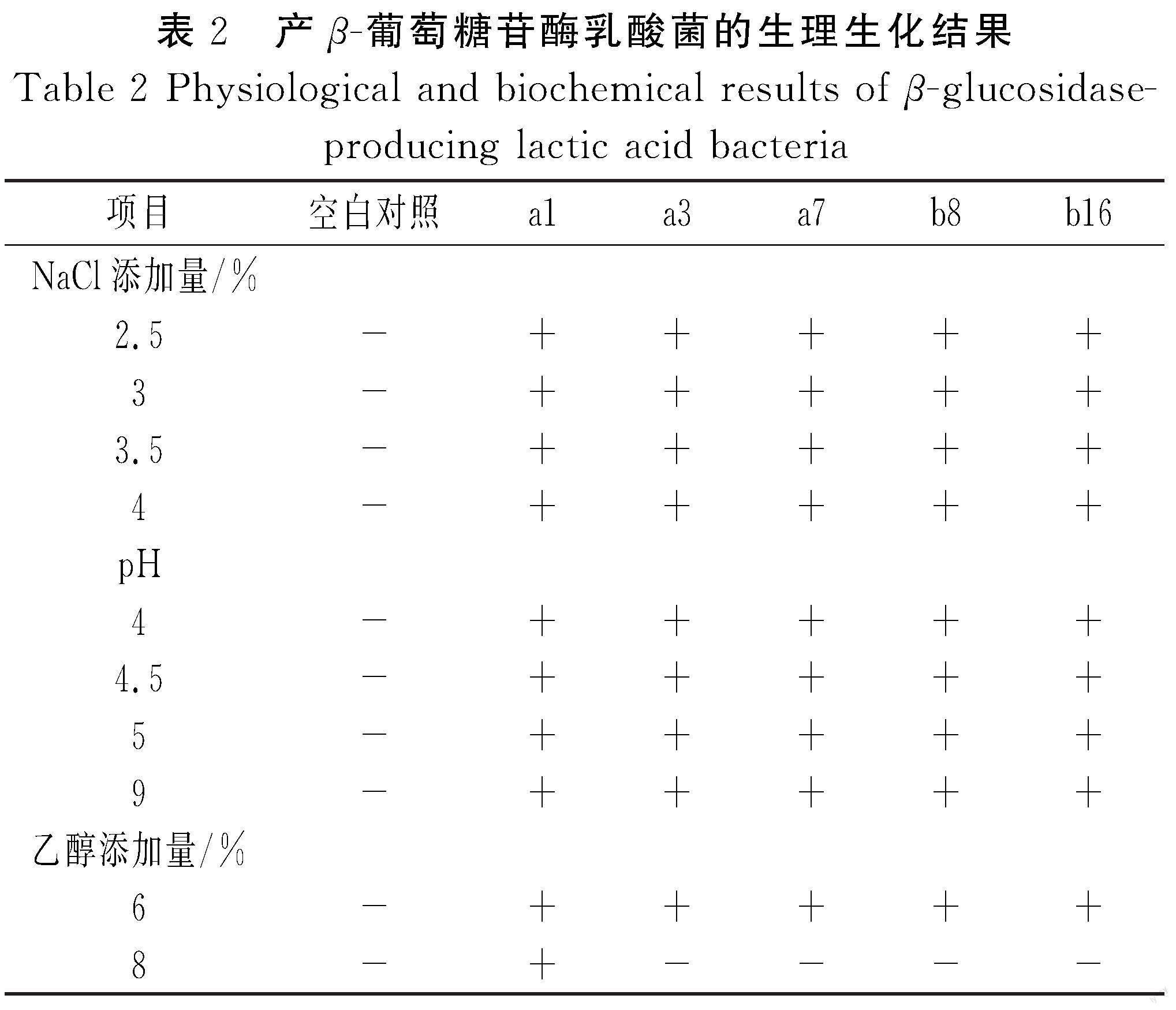
从桂林腐乳酸浆水中筛选出10株具有溶钙圈的菌株(见表1),通过形态学观察与生理生化实验判定均为乳酸菌。经七叶苷显色培养基筛选(见图1),发现5株菌株疑似产β-葡萄糖苷酶,分别为a1、a3、a7、b8、b16。结合5株菌的生理生化结果(见表2),初步鉴定b8为德氏乳杆菌(Lactobacillus delbrueckii),其余4株为利莫西发酵乳杆菌(Limosilactobacillus fermentum)。
图2分子生物学结果显示,a1、b16与Limosilactobacillus fermentum strain TMPC 46B23的亲缘关系相近(相似性为100%),菌株a3、a7与Limosilactobacillus fermentum strain MSJK0025的亲缘关系相近(相似性为100%),菌株b8与Lactobacillus delbrueckii subsp. bulgaricus strain IMAU92033的亲缘关系相近(相似性为100%)。
酸浆水为自然发酵方式制备的,因此其中乳酸菌的组成极易受到环境影响。张斌[23]从广灵县酸浆水中分离出了27株乳明串珠菌、13株德氏乳杆菌和26株植物乳杆菌。费永涛[24]从广东省开平市腐乳厂的酸浆水中筛选得到1株具有α-半乳糖苷酶活性的解淀粉乳杆菌L6。叶青[25]从江苏如皋搬经镇和山东临沂采集的酸浆水中分离得到了产酸能力较强的罗氏乳杆菌045、戊糖乳杆菌127、副干酪乳杆菌228、干酪乳杆菌337和干酪乳杆菌336。刘琳琳等[26]从云南建水豆腐酸浆水中分离出了短乳杆菌、棒状乳杆菌、弯曲乳杆菌和融合魏斯氏菌。然而,鲜有关于桂林腐乳酸浆水中乳酸菌情况的报道,本文以产β-葡萄糖苷酶为筛选条件,筛选得到1株德氏乳杆菌和4株发酵乳杆菌,为进一步研究不同地域酸浆水中乳酸菌的组成提供了参考。
2.2 菌株的生长曲线及产酸能力
由图3可知,0~6 h为菌株的快速生长期,5株菌在发酵6 h时OD600 nm>0.9,之后生长速度缓慢并伴有衰亡趋势。培养液的pH值在0~6 h显著下降(P<0.05)。其中,b8培养液的pH值下降最快,其培养6 h时pH为4.33,发酵后期甚至低于4.0,这可能与其具有更强的生长活力(OD600 nm)相关,其余4株菌培养液的pH值稳定在4.5。pH值是培养液中氢离子浓度的表征,在一定程度上能够反映菌株的产酸情况,故b8的产酸能力最高,b16次之,a1、a3、a7的产酸能力最低。
在之前的报道中,不乏一些具有高产酸能力的乳酸菌从酸浆水中被分离出来。Li等[27]从自然发酵大豆乳清中分离得到植物乳杆菌JMC-1,其黄浆水发酵16 h后的pH值降至4.0以下。叶青[25]在自然发酵的酸浆水中筛选得到干酪乳杆菌336,其培养8 h时的pH值为4.4左右。贺云[5]使用从腐乳酸浆水中分离的植物乳杆菌发酵黄浆水,其pH值在发酵6 h时降至4.4左右。综上所述,分离自桂林腐乳酸浆水的德氏乳杆菌b8降低培养液pH的能力与大部分分离自酸浆水的乳酸菌类似。
2.3 菌株的β-葡萄糖苷酶活力
5株乳酸菌的β-葡萄糖苷酶活力均呈先增大后减小的趋势(见图4),这可能与培养后期乳酸菌的生长活力减弱、培养液的pH值降低有关[12]。德氏乳杆菌b8的β-葡萄糖苷酶活力在培养6 h时达到峰值((41.22±0.47) U/105 CFU),其余4株菌的酶活较低,均低于30 U/105 CFU。对比已有研究,Jose等[28]筛选出了β-葡萄糖苷酶活力较高的鼠李糖乳杆菌CRL981,其酶活为8.45 UE/mg,同时证明了β-葡萄糖苷酶在转化大豆异黄酮的过程中起着关键作用。冯程程等[29]发现坚强肠球菌GW18275在以纤维二糖为碳源时有最大的β-葡萄糖苷酶活力(16.02 U/mL)。李璞钰[11]在宁夏浆水中筛选出4株具有较高β-葡萄糖苷酶活力的乳酸菌,包括3株植物乳杆菌和1株发酵乳杆菌,但酶活力均低于25 U/mL。然而,因酶液提取条件、菌株密度、菌株生长特性的差异,菌株β-葡萄糖苷酶活力的高低不能通过酶活的大小进行直接对比。但德氏乳杆菌b8在生产β-葡萄糖苷酶方面具有较高的优势,若将其应用于发酵豆制品的加工,有望提高大豆多酚的生物利用率。
2.4 菌株的抗氧化活性
在本研究中,5株具有产β-葡萄糖苷酶能力的乳酸菌均具有一定的清除DPPH和ABTS阳离子自由基的能力(见图5)。菌株在MRS液体培养基中生长12 h后,除a3之外的其余4株乳酸菌对ABTS阳离子自由基的清除率均大于40%,其中a7和b8的ABTS阳离子自由基清除率最高。5株乳酸菌对DPPH自由基的清除率均较低(小于20%),但b8对DPPH自由基的清除能力略优于其余4株菌株。
3 结论
本研究以桂林腐乳酸浆水为原料,从中筛选出5株具有β-葡萄糖苷酶活性的乳酸菌,并对比了其生长、产酸、抗氧化和生产β-葡萄糖苷酶的能力。经测定,a1、a3、a7和b16为利莫西发酵乳杆菌,b8为德氏乳杆菌。其中,德氏乳杆菌b8具有较优良的生长活力和功能特性,其快速生长期为0~6 h,培养24 h时的pH值下降到4.0以下,培养12 h时的DPPH、ABTS阳离子自由基清除率分别为(16.29±2.22)%、(51.02±2.43)%。本研究对桂林腐乳酸浆水中乳酸菌的种类和功能活性进行了初步探索,为发酵豆制品行业提供了潜在的功能性菌株。
参考文献:
[1]罗维义.桂林腐乳[J].中国酿造,1983(1):38-39.
[2]吴惠贞,李维新,林礼钊,等.腐乳生产过程的微生物量变分析与研究[J].中国调味品,2022,47(12):168-173.
[3]CAI H, DUMBA T, SHENG Y, et al. Microbial diversity and chemical property analyses of sufu products with different producing regions and dressing flavors[J].LWT-Food Science and Technology,2021,144:111245.
[4]DAI Y, XU Z, WANG Z, et al. Effects of fermentation temperature on bacterial community, physicochemical properties and volatile flavor in fermented soy whey and its coagulated tofu[J].LWT-Food Science and Technology,2023,173:114355.
[5]賀云.豆腐酸浆中乳酸菌的分离鉴定及其在酸浆豆腐中的应用[D].无锡:江南大学,2018.
[6]KHOSRAVI A, RAZAVI S H. Therapeutic effects of polyphenols in fermented soybean and black soybean products[J].Journal of Functional Foods,2021,81:104467.
[7]CARBONI M C, RODRIGUES R C, DOMENEGHINI M G, et al. New insights into non-extractable phenolic compounds analysis[J].Food Research International,2022,157:111487.
[8]SWALLAH M S, FAN H, WANG S, et al. Prebiotic impacts of soybean residue (okara) on eubiosis/dysbiosis condition of the gut and the possible effects on liver and kidney functions[J].Molecules,2021,26(2):326.
[9]HATI S, VIJ S, SINGH B P, et al. β-Glucosidase activity and bioconversion of isoflavones during fermentation of soymilk[J].Journal of the Science of Food and Agriculture,2015,95(1):216-220.
[10]焦时阳,王晓彤,侯玉新,等.柿子醋醪中优良乳酸菌的筛选及其耐受性和功能性分析[J].食品工业科技,2023,44(8):161-169.
[11]李璞钰.宁夏浆水微生物中高产β-葡萄糖苷酶乳酸菌筛选及其对沙棘果多酚生物转化的研究[D].银川:宁夏大学,2022.
[12]GOURIPUR G, KALIWAL B. Screening and optimization of β-glucosidase producing newly isolated Lactobacillus plantarum strain LSP-24 from colostrum milk[J].Biocatalysis and Agricultural Biotechnology,2017,11:89-96.
[13]YAO R, WONG C B, NAKAMURA K, et al. Bifidobacterium breve MCC1274 with glycosidic activity enhances in vivo isoflavone bioavailability[J].Beneficial Microbes,2019,10(5):521-531.
[14]程雅韵,李志华,汪庭瑞,等.产人参皂苷转化β-葡萄糖苷酶乳酸菌菌株的筛选[J].食品科技,2014,39(8):13-17.
[15]VILA M, HIDALGO M, SNCHEZ-MORENO C, et al. Bioconversion of anthocyanin glycosides by Bifidobacteria and Lactobacillus[J].Food Research International,2009,42(10):1453-1461.
[16]LIU Y, CHENG G, HAN T, et al. Microbial transformation of tectoridin from Pueraria flos by Lactobacillus and bifidobacteria[J].Food Chemistry,2012,131(1):149-154.
[17]LEE K H, KIM S H, WOO K S, et al. Functional beverage from fermented soymilk with improved amino nitrogen, β-glucosidase activity and aglycone content using Bacillus subtilis starter[J].Food Science and Biotechnology,2016,25(5):1399-1405.
[18]覃超,唐富豪,滕建文,等.产β-葡萄糖苷酶乳酸菌发酵对百香果皮多酚含量和功能活性的影响[J].食品与发酵工业,2023,49(8):230-236.
[19]徐佳敏,周桂珍,田晓菊.葡萄酒酿造中降解生物胺乳酸菌的筛选、鉴定及其特性[J].食品与发酵工业,2022,48(21):48-53.
[20]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:130-142.
[21]R·E·布坎南,N·E·吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:336-357.
[22]黄紫衡,陈欢,黄丽,等.六堡茶渥堆过程中可培养微生物的分离与鉴定[J].食品科学,2022,43(16):177-185.
[23]张斌.酸浆水中微生物的分离鉴定及酸浆豆腐的工艺优化[D].晋中:山西农业大学,2020.
[24]费永涛.豆腐黄浆水酸化过程中菌群分析及其关键乳酸菌的代谢研究[D].广州:华南理工大学,2018.
[25]叶青.乳酸菌酸浆豆腐工艺优化及凝固机理初探[D].锦州:锦州医科大学,2018.
[26]刘琳琳,王嘉琪,曾剑华,等.云南建水豆腐酸浆中乳酸菌的分离与鉴定[J].中国食品学报,2019,19(11):239-245.
[27]LI C, RUI X, ZHANG Y, et al. Production of tofu by lactic acid bacteria isolated from naturally fermented soy whey and evaluation of its quality[J].LWT-Food Science and Technology,2017,82:227-234.
[28]JOSE A M, MARISA S C, GRACIELA S D G. Aglycone production by Lactobacillus rhamnosus CRL981 during soymilk fermentation[J].Food Microbiology,2009,26(3):333-339.
[29]馮程程,蔡子哲,陈琼,等.产β-葡萄糖苷酶乳酸菌益生特性研究[J].食品与发酵工业,2022,48(15):85-90.

