Hsa-miR-148a-3p通过下调DUSP1基因促进乳腺癌细胞的恶性行为
许家铭,林 龙,陈琼慧,李 兰
1海南省中医院,海南 海口 570000;2海口市人民医院肿瘤化疗科,海南 海口 570208;3海南医学院第一附属医院,海南 海口570102
乳腺癌是全世界最常见的肿瘤之一(11.7%),甚至超过了肺癌(11.4%)[1]。其发病率逐年增加,且发病年龄逐渐年轻化。目前,已经成为威胁女性健康的第一杀手。乳腺癌的发生是一个由多种基因和多种因素引起的复杂生物学过程。随着分子生物学的发展,通过对乳腺癌基因表达谱的分析发现,不同的基因表达与乳腺癌的各种生物学行为有关[2]。因此,肿瘤基因谱的研究有助于肿瘤的诊断和治疗以及预后的判断。
微小RNA(miRNA)通过与mRNA 的3'非翻译区(3'UTR)的序列特异性碱基配对来抑制基因表达,导致其翻译抑制或降解。有证据表明,miRNA可通过控制癌细胞中不同的细胞和代谢途径来调节基因表达,进而作为抑癌基因或致癌基因,因此其可能成为多种癌症的有前途的生物标志物[3,4]。先前的研究提示,Hsa-miR-148a-3p在乳腺癌[5],胃癌[6],卵巢癌[7]中均有研究,提示其在癌症中可能是一个相对重要的miRNA,然而,关于其在乳腺癌中的研究较少,且尚未有研究关注其下游目标。本研究从生信分析出发,进行一系列数据库分析,确定了与乳腺癌相关的miRNA,即Hsa-miR-148a-3p,关于其对乳腺癌细胞增殖,迁移,侵袭和凋亡的影响进行了更具体的研究,且研究确定了其靶向的基因双特异性磷酸酶1(DUSP1),提出了一个新的信号轴,这或许可以为人类乳腺癌的治疗提供新的靶点和机制。
1 材料和方法
1.1 数据收集及分析
使用The Cancer Genome Atlas(TCGA)数据库(https://www.facs.org/quality-programs/cancer/ncdb)获取乳腺癌组织样本和癌旁组织样本的差异表达的miRNA和mRNA数据,使用R语言包对获取的数据进行分析,筛选差异基因的标准为:|log2 Fold change|≥2同时p-value<0.01。
1.2 差异miRNA靶基因的预测及mRNA的确定
使用miRTarBase(http://mirtarbase.mbc.nctu.edu.tw/php/index.php) TargetScan(http://www.targetscan.org/)和ENCORI(https://starbase.sysu.edu.cn/)数据库预测差异miRNA的靶基因,并将三个数据库的靶基因取交集,交集靶基因与mRNA测序基因取交集,确定后续研究的mRNA。
1.3 mRNA蛋白质-蛋白质互作分析及top10 Hub基因的筛选
使用String 数据库联合Cytoscape3.7.1 软件将mRNA的蛋白质-蛋白质互作分析网络图进行可视化,利用Cytoscape3.7.1 软件的cytohHubba 插件筛选top10Hub基因。
1.4 miRNA-TOP10hub基因网络图的构建及TOP10hub基因表达水平的验证
使用Cytoscape3.7.1 软件将miRNA 数据和TOP10 hub基因数据导入软件,绘制miRNA-TOP10 hub基因网络图。使用TCGA数据库的数据绘制TOP10 hub基因表达水平的箱线图。
1.5 实验验证
1.5.1 组织样本 收集2019年1月~2021年2月海南省中医院采集经病理学诊断证实的人乳腺癌和癌旁组织样本各30例。所有患者均签署知情同意书,所有组织标本均在手术切除时采集,然后立即在液氮中冷冻并储存在-80 ℃中备用。实验经海南省中医院伦理委员会批准。
1.5.2 细胞培养和细胞转染 正常乳腺上皮MCF10A细胞和人乳腺癌MCF-7,MDA-MB-231细胞从中国科学院上海细胞生物学研究所获得,并在37 ℃、5%CO2的湿润环境中培养。人乳腺癌细胞系MCF-7和MDA-MB-231在Roswell Park Memorial Institute RPMI 1640培养基(Invitrogen)中培养,补充10%FBS和1%青霉素-链霉素。MCF10A细胞在含有5%马血清(HS,Invitrogen)、0.5 μg/mL 氢化可的松(Sigma)、10 μg/mL 胰岛素(Sigma)、0.02 μg/mL EGF(Pepro Tech)、0.1 μg/mL霍乱毒素(Sigma)和青霉素-链霉素的DMEM-F12(Invitrogn)中培养。Hsa-miR-148a-3p mimics,NC mimics,HsamiR-148a-3p inhibitor,NC inhibitor由RiboBio(中国广州)构建。所有细胞系以5×105/孔的密度在6孔板中培养,并孵育过夜。使用LipofectamineTM2000 试剂(Invitrogen)进行转染,并在37 ℃、5%CO2的潮湿条件下再孵育48 h。
1.5.3 定量逆转录PCR(RT-qPCR)根据制造商的说明,使用TRIzol(TaKaRa)从细胞中提取总RNA。使用PrimeScript RT master mix(TaKaRa)或miScript逆转录试剂盒(Qiagen)进行mRNA 或miRNA 的逆转录(RT)。使用特异性引物进行扩增。SYBR Green定量PCR反应在20 μL反应体积,含有2×PCR Master Mix(Applied Biosystems)。使用2-ΔΔCT方法对每个样本的基因表达进行相对定量。每个实验一式三份。引物序列如下:hsa-miR-148a-3p:上游引物:5'-TCAGTGCACT ACAGAACTTTGT-3';下游引物:5'-GTGCGTGTCGT GGAGTCG-3';DUSP1:上游引物:5'-AGAGCCCCAT TACGACCTCT-3';下游引物:5'-CCAGAGGAACTC GGGTGAAG-3';U6:上游引物:5'-CTCGCTTCGGC AGCACA-3';下游引物:5'-AACGCTTCACGAATTT GCGT-3';GAPDH:上游引物:5'-TCATGACCACAG TCCATGCC-3';下游引物:5'-TTCTAGACGGCAGGT CAGGT-3'。
1.5.4 荧光素酶报告活性测定 将DUSP1 3'UTR的野生型和突变型Hsa-miR-148a-3p结合序列克隆到pGL3 Basic 载体中(Promeg)。Hsa-miR-148a-3p 和DUSP1重组质粒的3'UTR(WT或MUT)共转染293T细胞。使用LipofectaminTM2000试剂(Invitrogen)进行转染,并使用双荧光素酶报告检测系统(Promega)检测荧光素素酶活性。
1.5.5 CCK-8实验 将细胞密度调整为20 000/mL,用CCK-8试剂盒(MCE)检测细胞增殖。细胞转染后,在培养24、48和72 h后,向每个孔中加入10 μg CCK-8溶液。用微量板读数器在450 nm的吸光度下测量光密度值。
1.5.6 划痕实验 将细胞置于六个孔板中,每孔含有3.5×105个细胞和2 mL完整培养基。培养细胞直至达到95%汇合。然后,使用20 μL移液管尖端在每个孔中创建垂直伤口,并将不含FBS的培养基添加到每个孔中。在0和48 h用光学显微镜(Axio Lab.A1 pol)收集每个孔的图像。ImageJ 软件1.8.0(National Institutes of Health)用于分析图像。
1.5.7 Transwell 实验 通过用50 mL Matrigel(BD Biosciences)涂覆腔室来评估细胞侵袭。将100 mL无血清培养基中的1×105个细胞置于涂有Matrigel的上室中。将含有10%FBS的500 mL完整培养基置于下部室中。将侵袭到下腔室的细胞固定在4%多聚甲醛中,并在室温下用0.1%结晶紫染色15 min,然后在倒置相差显微镜(Olympus)下选至少3个随机视野计数。
1.5.8 流式细胞术使用Annexin V/PI试剂盒(KeyGen Biotech)通过流式细胞术检测细胞的凋亡。简而言之,转染后,将细胞置于六个孔板中,每孔含有2.0×105个细胞和2 mL完整培养基。再孵育24 h后,收集细胞并在黑暗中与Annexin V孵育15 min。然后,将细胞与PI在黑暗中孵育25 min。并通过流式细胞仪(BD Biosciences)计算细胞凋亡率。
1.5.9 动物实验 5周龄雄性BALB/c裸鼠39只,饲养在25 ℃的无菌条件下。将稳定转染Hsa-miR-148a-3p mimics、Hsa-miR-148a-3p inhibitor 的MCF-7 细 胞(100 μL PBS中含1×107个细胞)皮下注射裸鼠的左侧区域。每组3只小鼠用于测量肿瘤体积和质量。6周后,通过颈椎脱位对小鼠实施安乐死,并称取肿瘤组织的质量和计算肿瘤体积。通过游标卡尺测量肿瘤的长度(L)和宽度(W)并使用以下公式来计算肿瘤体积(V):V(mm3)=0.5×L×W2。每组10只小鼠用于生存分析,实验期间如果出现溃疡、感染或坏死,或小鼠濒临死亡,则终止实验并对小鼠实施安乐死。动物实验由海南省中医院动物伦理委员会批准。
1.5.9.1 免疫组织 组织标本在室温下用10%福尔马林固定5 h,包埋在石蜡中,然后切成切片(3µm)。随后,用二甲苯I和II对组织进行脱蜡(各10 min),在梯度乙醇中脱水。用pH为6的柠檬酸盐缓冲液进行热介导回收抗原,然后将切片浸泡在3%过氧化氢中10 min以阻断内源性过氧化物酶,并在室温下用5%牛血清白蛋白密封30 min。然后,将样品与以下抗体在4 ℃下孵育过夜:DUSP1(1∶100;Affinity)。随后,将样品与山羊抗兔IgG H&L/HRP抗体在37 ℃下孵育50 min。将细胞在室温下用二氨基联苯胺染色10 min,然后在室温下再用苏木精染色3 min。使用光学显微镜捕获免疫染色图像。使用Image pro plus v6.0计算光密度。
1.6 统计学分析
使用SPSS软件(19.0版)对本研究中的数据进行了t检验和单因素方差分析。LSD和Dunnet被用作事后测试。统计数据用均数±标准差表示。当P<0.05认为差异具有统计学意义。
2 结果
2.1 TCGA数据库筛选乳腺癌中的差异miRNA
使用R语言的edge R工具包处理数据,筛选出乳腺癌组织样本和癌旁组织样本中差异表达的miRNA和mRNA,其结果表明,共筛选出乳腺癌中相关的差异miRNA共54个,其中8个下调,46个上调,其火山图和热图(图1A、B)。共筛选出乳腺癌中相关的差异mRNA共799个,其中509个下调,290个上调,其火山图和热图(图1C、D)。

图1 乳腺癌中差异miRNA和mRNA火山图和热图Fig.1 Volcano plot and Heat map of the differential miRNAs and mRNAs in breast cancer.A:Differential miRNA heat map in breast cancer.B: Volcano plot of differential miRNA in breast cancer.C: Differential miRNA heat map in breast cancer.D:Volcano plot of differential miRNAin breast cancer.
2.2 乳腺癌中差异miRNA靶基因预测及分析
54个差异miRNA预测得到靶基因3716个,与差异mRNA取交集,共得到150个交集基因(图2A),交集基因进行蛋白-蛋白互作分析,去除单个的基因(图2B)。筛选蛋白-蛋白互作网络图中的TOP10hub基因,得到10 个hub 基因,分别为MET,LPAR1,LAMC1,FOS,EGFR,PIK3R1,DUSP1,GNAI1,LAMA4,NR3C1(图2C)。通过Cytoscape3.7.1 构建miRNA-TOP10hub 基因网络图,其中DUSP1基因连接的miRNA较多,说明其可能较为重要,且Hsa-miR-148a-3p可调控DUSP1,故选择其中的Hsa-miR-148a-3p/DUSP1信号轴进行研究(图2D)。
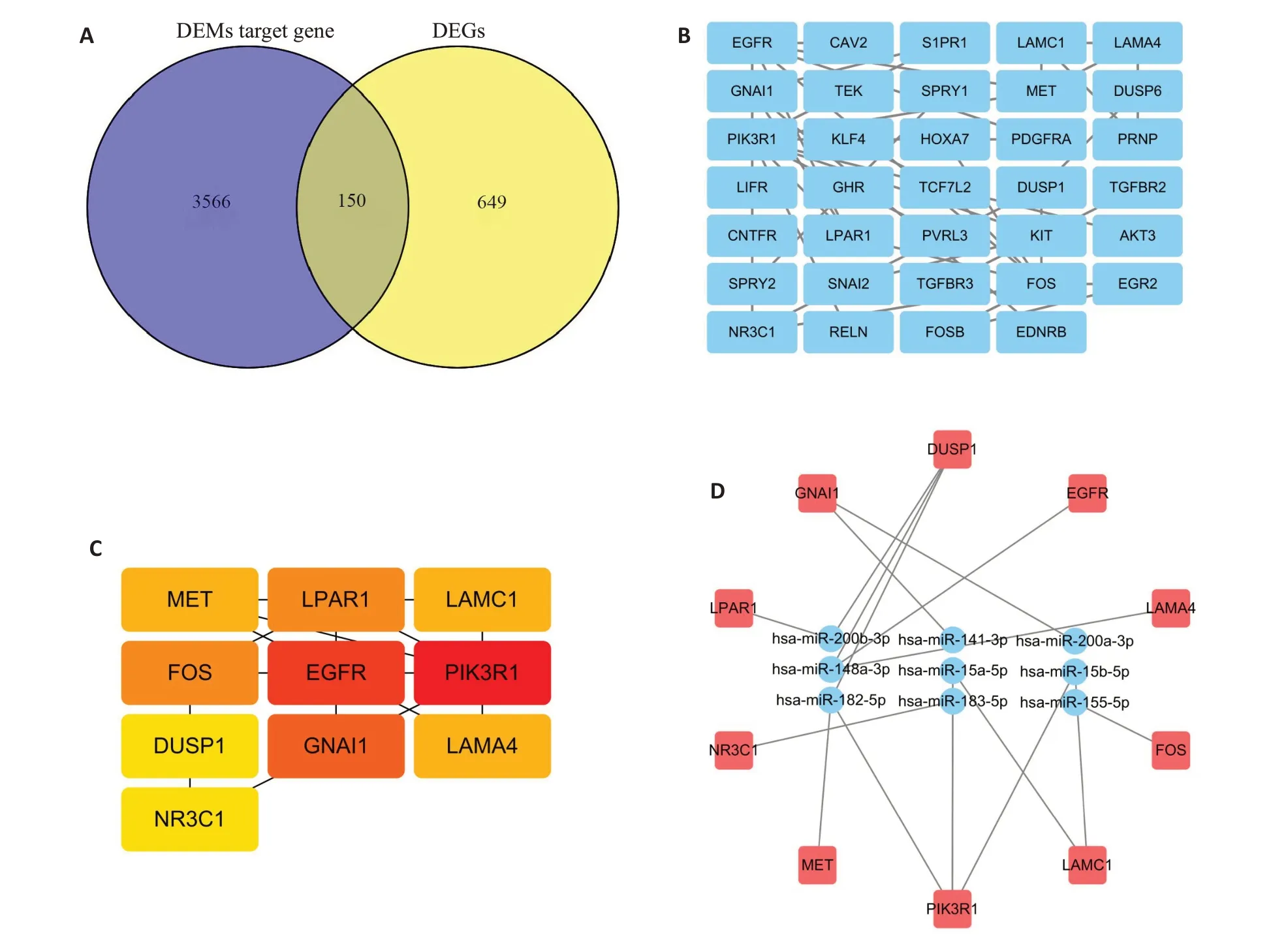
图2 乳腺癌中差异miRNA靶基因的预测及分析Fig.2 Prediction and analysis of differential miRNA the of in breast cancer.A: Venn diagram of the target genes of the Differential miRNA and mRNA.B:PPI analysis of differential miRNA target genes.C:TOP10 hub gene network.D: MiRNA-top10hub gene network.DEMs: Differential expression miRNA;DEGs:Differential expression mRNA.
2.3 TCGA数据库验证TOP10 hub基因的表达水平
TCGA数据库验证TOP10 hub基因在乳腺癌中的表达水平,其结果显示,与正常组织相比,MET,LPAR1,LAMC1,FOS,EGFR,PIK3R1,DUSP1,GNAI1,LAMA4,NR3C1 基因在乳腺癌组织中均显著下调(P<0.05,图3)。
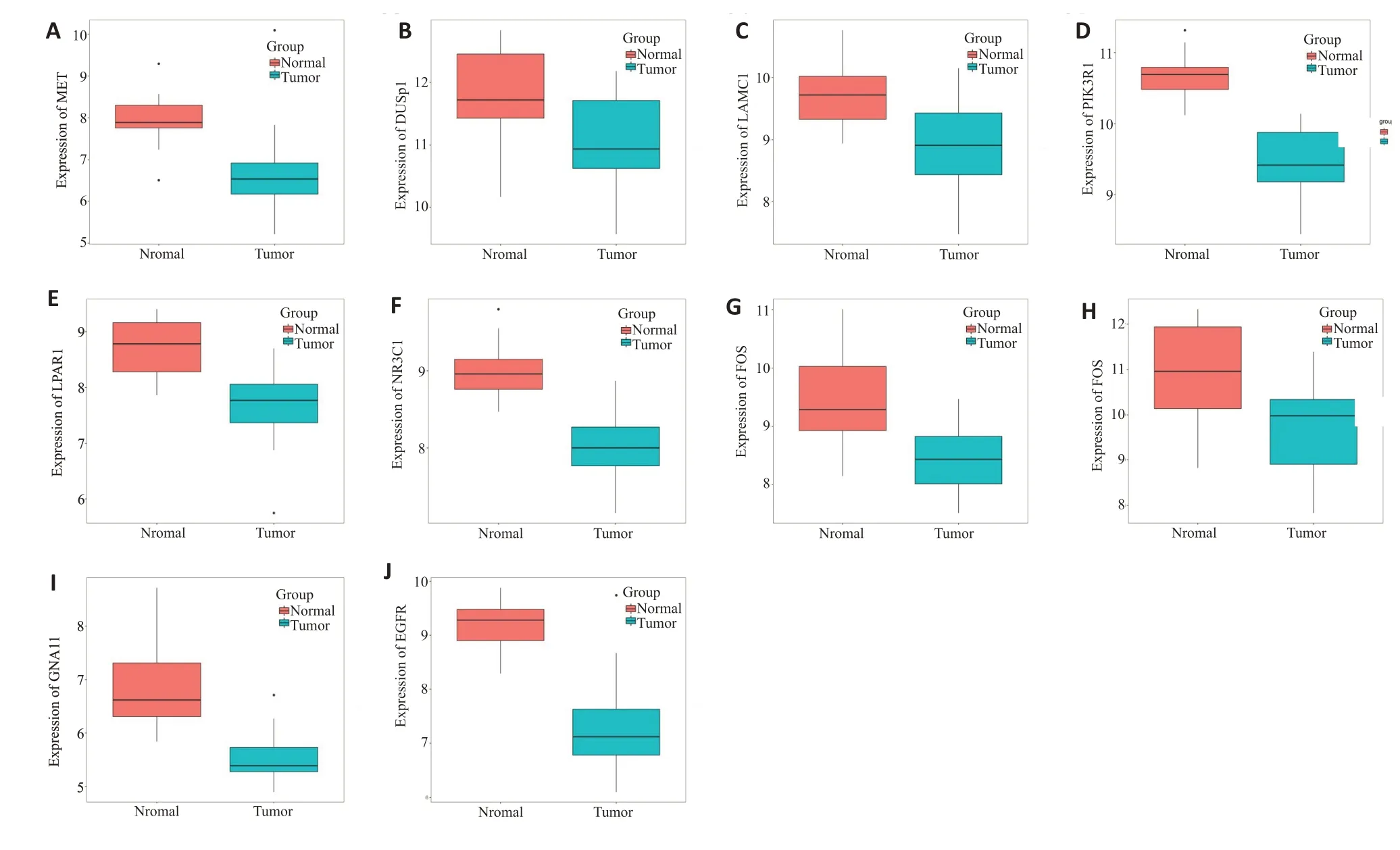
图3 TCGA数据库验证TOP10 hub基因的表达量Fig.3 TCGAdatabase verification of TOP10 hub gene expression.A-J:TCGAdatabase verifies the expression level of MET,LPAR1,LAMC1,FOS,EGFR,PIK3R1,DUSP1,GNAI1,LAMA4,and NR3C1 genes in normal tissues and breast cancer tissues.
2.4 Hsa-miR-148a-3p和DUSP1在乳腺癌组织和细胞中的表达水平
RT-qPCR 实验结果表明,与癌旁组织相比,HsamiR-148a-3p在人乳腺癌组织中显著上调(P<0.05,图4A),而DUSP1在人乳腺癌组织中显著下调(P<0.01,图4B)。与MCF10A细胞相比,hsa-miR-148a-3p在人乳腺癌MCF-7,MDA-MB-231细胞中显著上调(P<0.01)(图4C),而DUSP1在乳腺癌细胞中显著下调(P<0.01,图4D)。
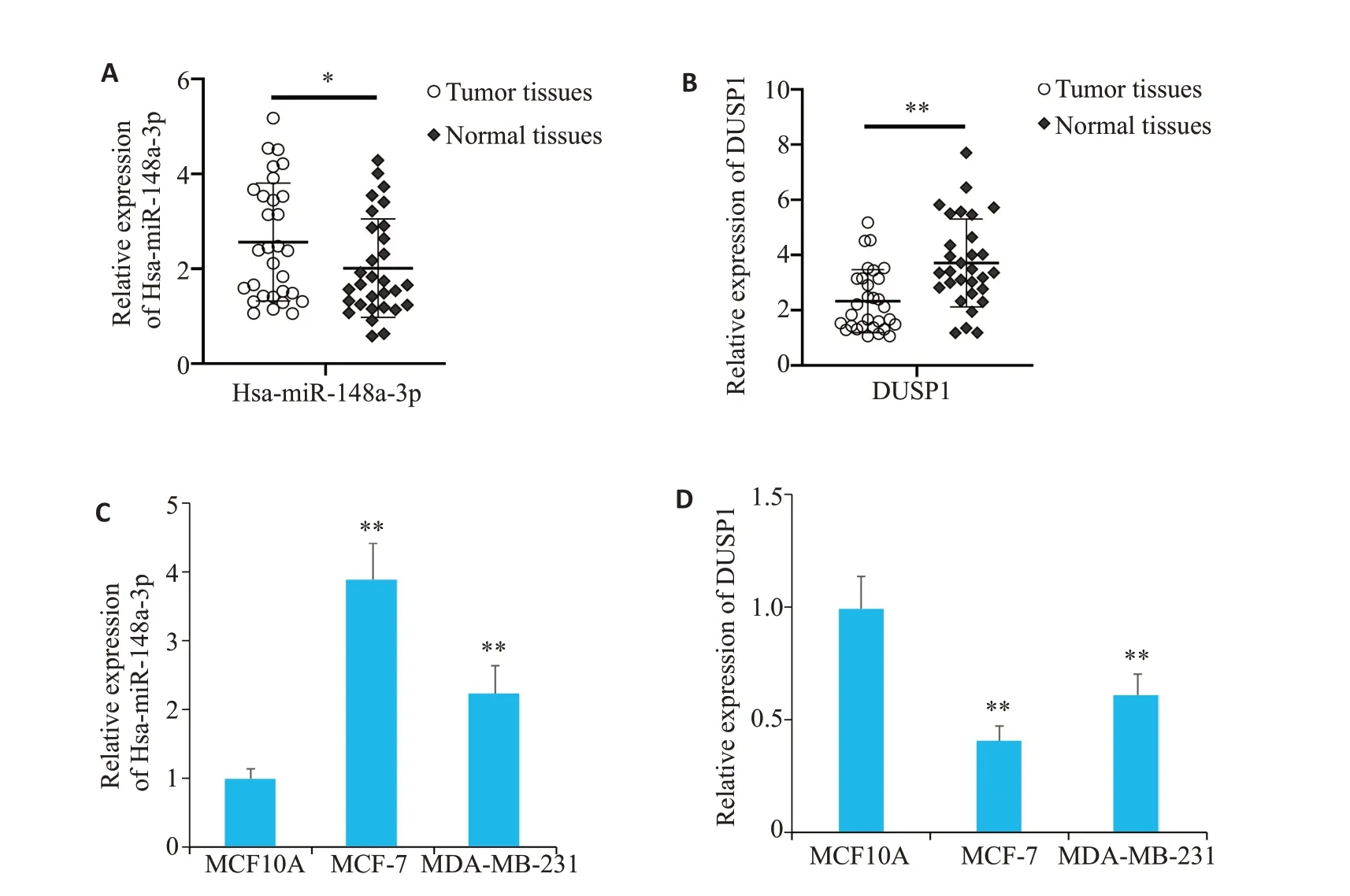
图4 RT-qPCR实验检测Hsa-miR-148a-3p和DUSP1在乳腺癌组织和细胞中的表达水平Fig.4 Expression levels of Hsa-miR-148a-3p and DUSP1 in breast cancer tissues and cells detected by RT-qPCR.A,B:Expression of Hsa-miR-148a-3p and DUSP1 in breast cancer and adjacent tissues detected by RT-qPCR;**P<0.01,*P<0.05 vs normal tissues group.C,D: The expression of Hsa-miR-148a-3p and DUSP1 in MCF10A cells,MCF-7 cells and MDA-MB-231 cells by RT-qPCR.**P<0.01,*P<0.05 vs MCF10Agroup.
2.5 Hsa-miR-148a-3p和DUSP1在乳腺癌中靶向关系的验证
RT-qPCR实验结果表明,过表达Hsa-miR-148a-3p后,Hsa-miR-148a-3p的表达水平升高(P<0.01),DUSP1的表达水平降低(P<0.01);敲除Hsa-miR-148a-3p后,Hsa-miR-148a-3p表达水平降低(P<0.01),DUSP1的表达水平升高(P<0.01,图5A、B)。TargetScan数据库发现Hsa-miR-148a-3p和DUSP1具有结合位点(图5C),双荧光素酶活性报告实验结果显示,Hsa-miR-148a-3p mimic转染降低了含有wt-DUSP1的细胞的荧光素酶活性(P<0.01)(图5D)。
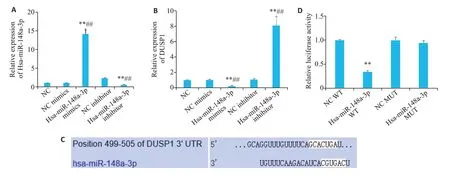
图5 Hsa-miR-148a-3p和DUSP1在乳腺癌中的靶向关系Fig.5 Targeting relationship between Hsa-miR-148a-3p and DUSP1 in breast cancer.A,B:After overexpression of Hsa-miR-148a-3p,the expression level of Hsa-miR-148a-3p and DUSP1 was detected by RT-qPCR;C:Prediction of the binding sites of Hsa-miR-148a-3p and DUSP1 using TargetScan database;D: Target binding of Hsa-miR-148a-3p to DUSP1 detected by double luciferase activity reporting assay.**P<0.01 vs NC group,NC WT group;##P<0.01 vs NC mimics group,NC inhibitor group.
2.6 Hsa-miR-148a-3p对乳腺癌细胞增殖的影响
CCK-8实验结果表明,Hsa-miR-148a-3p过表达后可促进乳腺癌细胞的增殖(P<0.01),Hsa-miR-148a-3p敲除后则抑制乳腺癌细胞的增殖(P<0.01,图6)。
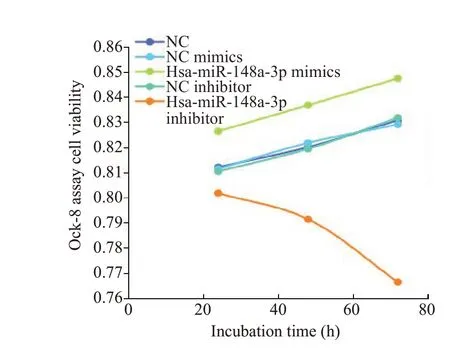
图6 Hsa-miR-148a-3p促进乳腺癌细胞的增殖Fig.6 Hsa-miR-148a-3p promotes proliferation of breast cancer cells.**P<0.01 vs NC group,##P<0.01 vs NC mimics group,##P<0.01 vs NC inhibitor group.
2.7 Hsa-miR-148a-3p对乳腺癌细胞迁移的影响
划痕实验结果表明,Hsa-miR-148a-3p过表达后可促进乳腺癌细胞的迁移(P<0.01),Hsa-miR-148a-3p敲除后则抑制乳腺癌细胞的迁移(P<0.01,图7)。

图7 Hsa-miR-148a-3p促进乳腺癌细胞的迁移Fig.7 Hsa-miR-148a-3p promotes migration of breast cancer cells(Original magnification:×40).**P<0.01 vs NC group,##P<0.01 vs NC mimics and NC inhibitor group.
2.8 Hsa-miR-148a-3p对乳腺癌细胞侵袭能力的影响
Transwell实验结果表明,Hsa-miR-148a-3p过表达后可促进乳腺癌细胞的侵袭(P<0.01),Hsa-miR-148a-3p敲除后则抑制乳腺癌细胞的侵袭(P<0.01,图8)。
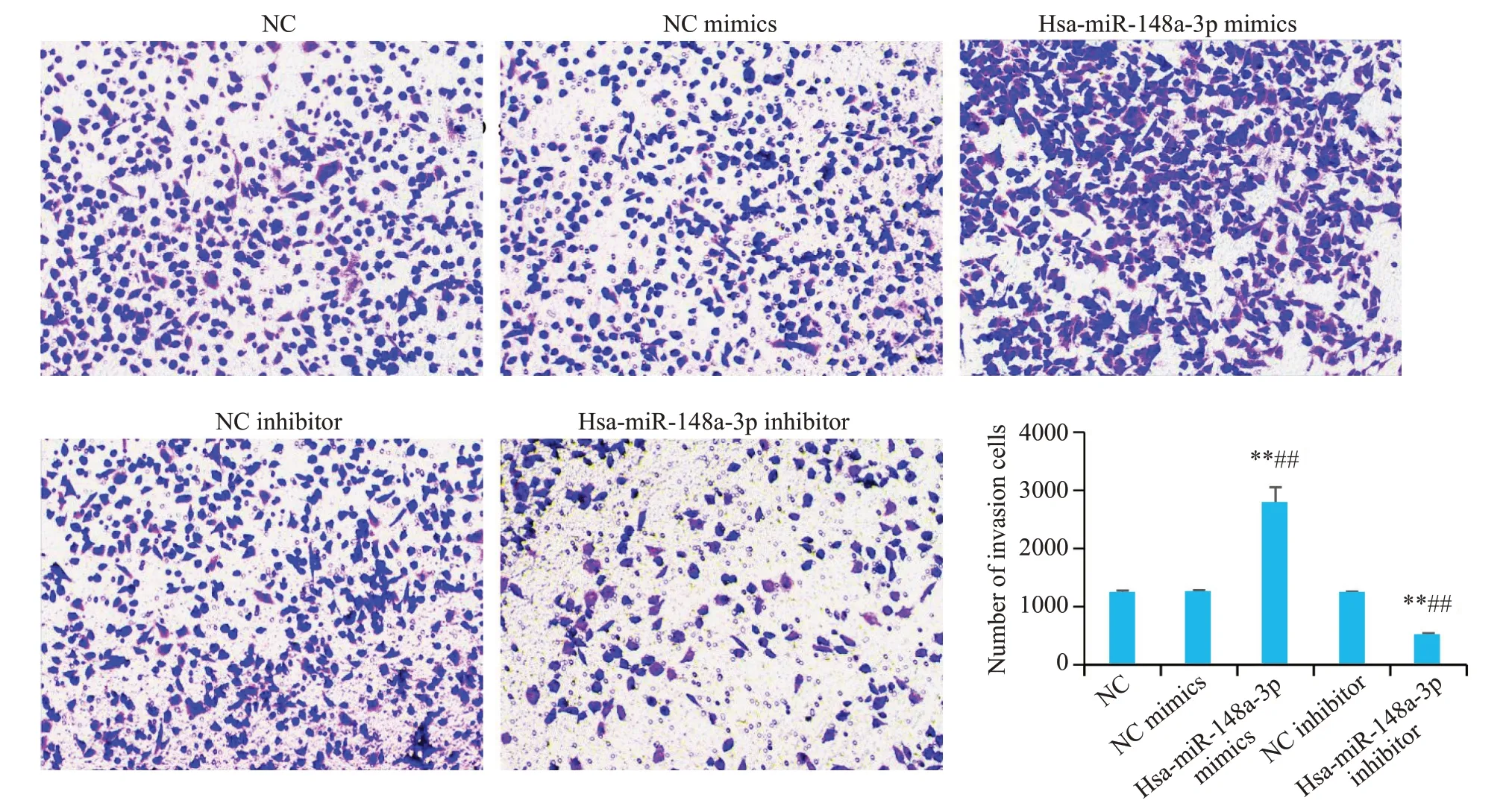
图8 Hsa-miR-148a-3p促进乳腺癌细胞的侵袭Fig.8 Hsa-miR-148a-3p promotes invasion of breast cancer cells(×100).**P<0.01 vs NC group,##P<0.01 vs NC mimics group and NC inhibitor group.
2.9 Hsa-miR-148a-3p对乳腺癌细胞凋亡的影响
流式细胞术实验结果表明,Hsa-miR-148a-3p过表达后可抑制乳腺癌细胞的凋亡(P<0.01),Hsa-miR-148a-3p敲除后则促进乳腺癌细胞的凋亡(P<0.01,图9)。
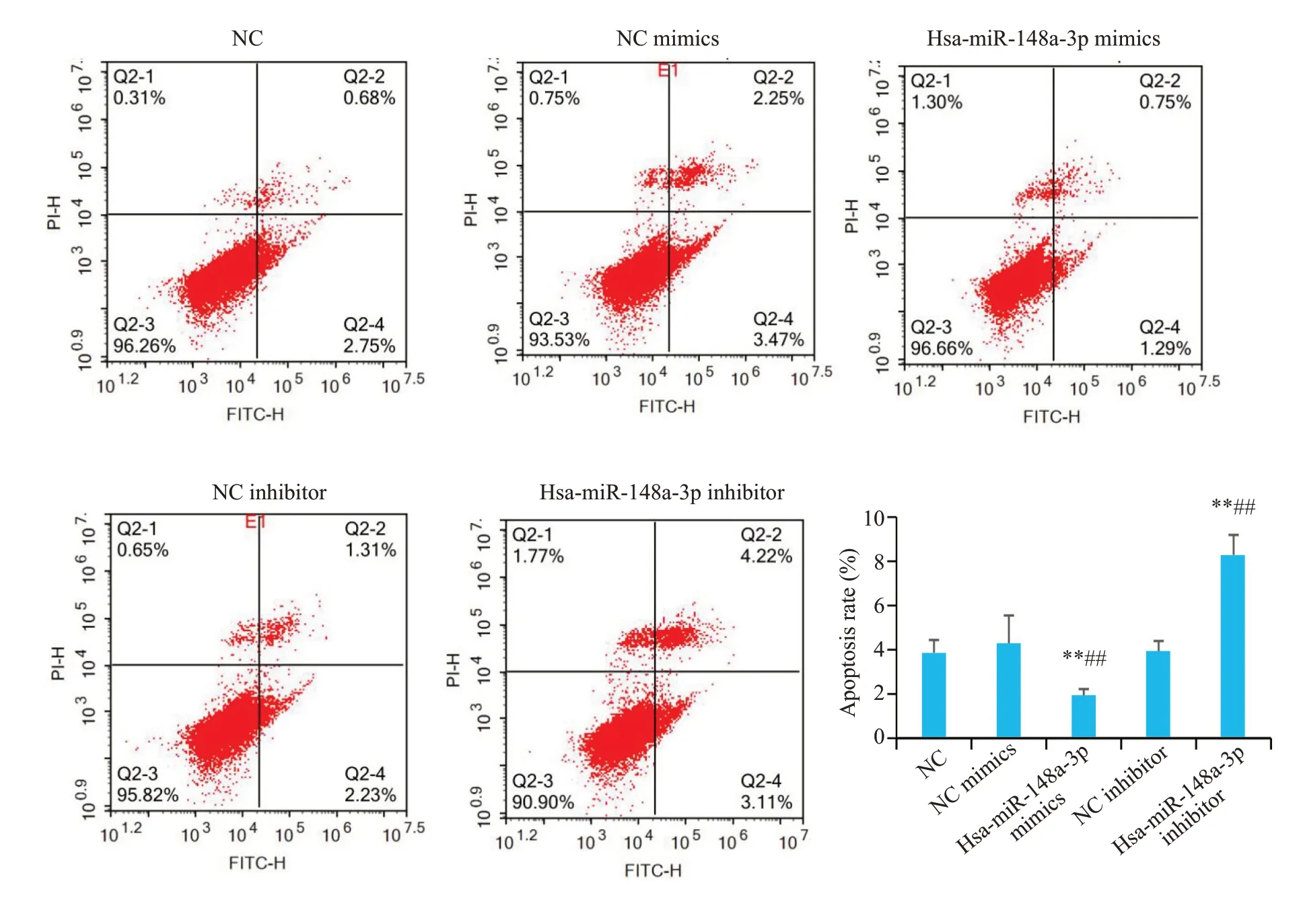
图9 Hsa-miR-148a-3p抑制乳腺癌细胞的凋亡Fig.9 Hsa-miR-148a-3p inhibits apoptosis of breast cancer cells.**P<0.01 vs NC group,##P<0.01 vs NC mimics group and NC inhibitor group.
2.10 Hsa-miR-148a-3p对小鼠肿瘤及DUSP1的影响
在乳腺癌异种移植小鼠模型中,与NC 组相比,Hsa-miR-148a-3p mimics组小鼠的肿瘤质量和体积显著增加(P<0.05),Hsa-miR-148a-3p inhibitor组小鼠的肿瘤质量和体积显著降低(P<0.05,图10A~C)。Kaplan-Meier生存曲线分析结果显示,与NC组相比,Hsa-miR-148a-3p mimics组小鼠的存活时间短,而HsamiR-148a-3p inhibitor组小鼠的生存水平高于NC组小鼠(P<0.05,图10D)。免疫组化结果显示,与NC组相比,Hsa-miR-148a-3p mimics组DUSP1的表达水平显著降低(P<0.01),Hsa-miR-148a-3p inhibitor组DUSP1的表达水平显著增加(P<0.01,图10E、F)。
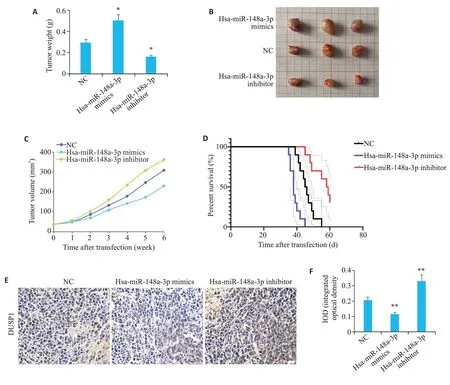
图10 Hsa-miR-148a-3p在体内对小鼠肿瘤及DUSP1表达的影响Fig.10 Effect of Hsa-miR-148a-3p on breast cancer cell xenograft growth and DUSP1 expression in nude mice.A,B:Tumor weight in mice.C: Tumor volume in mice.D: Kaplan-Meier survival curve analysis of survival of the mice.E,F:Immunohistochemistry for detecting the protein expression level of DUSP1 in the xenografts(×400).**P<0.01 vs NC group.
3 讨论
通过大规模基因测序发现,人类基因组中只有不到2%基因被转录成编码蛋白质的RNA,98%以上的基因被转录成非编码蛋白RNA[8]。本研究通过分析TCGA数据库中的测序数据,分析乳腺癌中相关miRNAmRNA对。先前研究认为,miRNA以完全或不完全互补的方式与mRNA的3'-UTR区相互作用,促进mRNA降解并抑制miRNA翻译,其在细胞生长发育、分化、增殖、凋亡、细胞周期等细胞生物学行为中发挥着重要作用[9-12]。通过一系列数据库分析,本研究确定研究对象Hsa-miR-148a-3p及其靶向的基因DUSP1。研究发现,miR-148-3p在部分癌症中作为抑癌基因,在部分癌症中又可作为促癌基因,比如,miR-148-3p作为抑癌基因靶向抑制DNMT1 mRNA 的3'-UTR,降低DNMT1 的翻译水平,进而抑制肺癌细胞的增殖、侵袭,促进细胞凋亡[13];miR-148a-3p通过靶向SRPK2抑制结肠癌细胞的转移及侵袭能力[14];miR-148a-3p过表达可以显著抑制其靶基因ERBB3和AKT2的mRNA和蛋白水平,进一步抑制膀胱癌细胞的增殖、侵袭和迁移能力[15];本研究发现,hsa-miR-148a-3p在乳腺癌细胞和组织中显著上调,其可促进乳腺癌细胞的增值,迁移和侵袭,抑制乳腺癌细胞的凋亡。在动物实验中发现,hsa-miR-148a-3p促进肿瘤组织质量和体积的增加,缩短小鼠生存期,说明其在乳腺癌中可作为促癌基因存在。
DUSP1 也称为丝裂原活化蛋白激酶磷酸酶-1(MKP-1),最初在培养的小鼠细胞中鉴定[16,17],其是双特异性磷酸酶的原型成员,在灭活丝裂原激活蛋白激酶(MAPK)的不同亚型中发挥重要作用[18,19]。近年来,DUSP1在许多领域得到了研究。DUSP1的功能集中于细胞增殖、分化和转化、应激反应、炎症、周期阻滞和凋亡,其主要是通过调节MAPK信号通路实现的[20]。越来越多的研究发现,DUSP1对肿瘤的影响可能多种多样且复杂[21]。DUSP1在某些肿瘤中可能致癌[22,23],而在某些肿瘤中可能抗癌[24,25]。本研究发现,DUSP1在乳腺癌中显著下调,数据库分析发现其可能是hsa-miR-148a-3p的靶基因,其表达水平可能受到hsa-miR-148a-3p的负调控。通过双荧光素酶报告基因实验证实hsamiR-148a-3p和DUSP1之间的负调节。细胞实验和动物实验均进一步证实了hsa-miR-148a-3p 可以调节DUSP1的表达水平。
总之,研究证实了hsa-miR-148a-3p是一种起促癌作用的miRNA,DUSP1是一种抑癌基因。在乳腺癌细胞中,hsa-miR-148a-3p通过抑制DUSP1表达而作为癌基因发挥作用。由于hsa-miR-148a-3p对乳腺癌细胞生物学行为的影响是一种综合效应。因此,关于hsa-miR-148a-3p下游的靶基因仍需进一步研究。