非肌层浸润性膀胱癌组织中PKM2和ALYREF 表达及与预后预测价值研究
朱 军,沈 欣,曹 冬(江苏省靖江市中医院/南京中医药大学翰林学院附属医院泌尿外科,江苏靖江 214500)
膀胱癌是常见泌尿系统肿瘤,全球每年新发43.0万例,死亡16.5万例[1]。非肌层浸润膀胱癌(nonmuscle invasive bladder cancer,NMIBC)是最常见膀胱癌类型,占初发膀胱恶性肿瘤的70%[2]。NMIBC治疗主要以经尿道膀胱肿瘤电切手术、术后辅助局部灌注化疗为主,但60% NMIBC患者术后会发生肿瘤局部复发或转移[3]。丙酮酸激酶M2亚型(pyruvate kinase M2,PKM2)是糖酵解过程中的关键酶,催化磷酸基从磷酸烯醇式丙酮酸转移到ADP,生成ATP和丙酮酸[4]。研究发现,在肝癌等恶性肿瘤中PKM2表达升高,促进肿瘤代谢,导致肿瘤的增殖及转移,是新的肿瘤标志物[5]。RNA结合蛋白Aly/REF输出因子(Aly/REF export factor,ALYREF)是一种热稳定的核蛋白,起分子伴侣的作用,参与DNA转录活性调节[6]。研究发现,乳腺癌等肿瘤中ALYREF表达升高能够在转录水平激活NEAT1的表达,促进肿瘤的侵袭及迁移,导致肿瘤进展[7]。目前NMIBC中PKM2,ALYREF表达的临床意义尚不明确。本研究通过检测NMIBC癌组织中PKM2和ALYREF的表达,探讨两者预后意义,报道如下。
1 材料与方法
1.1 研究对象 选取自2017年2月~2020年2月期间南京中医药大学翰林学院附属医院泌尿外科收治的84例NMIBC患者。纳入标准:①经术后病理明确为膀胱尿路上皮癌且无肌层浸润;②初次诊治,既往无放化疗治疗;③患者及家属已知情同意并签字,临床资料完整。排除标准:①并发其它恶性肿瘤;②并发间质性膀胱炎、尿路感染或肝肾功能障碍等疾病;③经尿道膀胱肿瘤电切后型全身化疗或免疫治疗,或行根治性膀胱切除术。其中,男性50例,女性34例;年龄31~74(63.25±5.78)岁;有吸烟史者41例;肿瘤直径≥3cm者21例,<3cm者63例;肿瘤单发60例,肿瘤多发24例;肿瘤TNM分期:Ta/Tis期41例,T1期43例;低级别尿路上皮癌53例,高级别尿路上皮癌31例。本研究经本院伦理委员会审核批准通过。
1.2 仪器与试剂 EnVision两步法免疫组化染色试剂盒(北京中杉金桥公司,货号PV6000);抗体PKM2,ALYREF(美国Cell Signaling Technology公司,货号#4053,#12655);CX60显微镜(日本奥林巴斯公司)。
1.3 方法
1.3.1 PKM2,ALYREF蛋白检测及分组:免疫组织化学检测:留取经尿道膀胱肿瘤电切术中获取的NMIBC癌组织和正常膀胱黏膜组织,常规石蜡包埋,切片后行免疫组化染色,实验步骤按照试剂盒说明书进行。镜下观察染色情况,进行染色评分。染色深度评分:无染色0分,浅黄色1分,棕黄色2分,棕褐色3分。染色面积评分:阳性面积<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分。染色深度与染色面积评分的乘积≥2分判定为阳性,<2分判定为阴性。根据癌组织PKM2,ALYREF蛋白染色情况,将所有NMIBC患者分为PKM2阳性组(n=60)和阴性组(n=24),ALYREF阳性组(n=62)和阴性组(n=22)。
1.3.2 治疗及随访:所有患者住院期间接受经尿道膀胱肿瘤电切术,术后接受规范的膀胱局部灌注化疗。随访方案:术后第一年每三个月门诊随访一次,术后第二年至第三年每半年电话或门诊随访一次。随访方式为门诊膀胱镜检查,尿脱落细胞检查及盆腔CT等影像学检查等,了解NMIBC肿瘤复发与进展及患者生存情况。随访终点为2023年2月1日。NMIBC肿瘤进展定义为肿瘤膀胱局部复发或肌层浸润,盆腔淋巴或远处器官转移,发生肿瘤相关死亡。无进展生存时间(progression free survival,PFS)定义为自确诊之日至肿瘤进展的间隔时间。
1.4 统计学分析 采用SPSS 23.0软件进行数据分析。计数资料以率(%)表示,组间比较采用卡方检验。相关性分析采用Spearman秩相关分析。生存分析采用Kaplan-Meier分析,Log-rank检验比较生存曲线间的差异。单因素及多因素COX比例风险模型分析影响NMIBC患者PFS预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1 NMIBC癌及正常膀胱黏膜组织中PKM2,ALYREF蛋白表达 见图1。PKM2黄褐色阳性染色主要位于癌组织中的细胞膜及细胞浆,ALYREF蛋白阳性染色主要位于细胞核。NMIBC膀胱癌组织中PKM2,ALYREF蛋白阳性率分别为71.43%(60/84),73.81%(62/84),高于膀胱正常黏膜组织11.90%(10/84),10.71%(9/84),差异具有统计学意义(χ2=61.225,68.522;P=0.000,0.000)。

图1 NMIBC癌及正常膀胱黏膜组织中PKM2,ALYREF蛋白表达(200×)。
2.2 膀胱癌组织中PKM2与ALYREF蛋白表达的相关性 NMIBC膀胱癌组织中PKM2与ALYREF蛋白表达呈显著正相关(r=0.734,P=0.000)。
2.3 不同临床病理特征NMIBC患者癌组织PKM2,ALYREF蛋白表达比较 见表1。T1期、高级别NMIBC癌组织中PKM2,ALYREF蛋白阳性率分别高于Ta/Tis期、低级别癌组织(均P<0.05)。
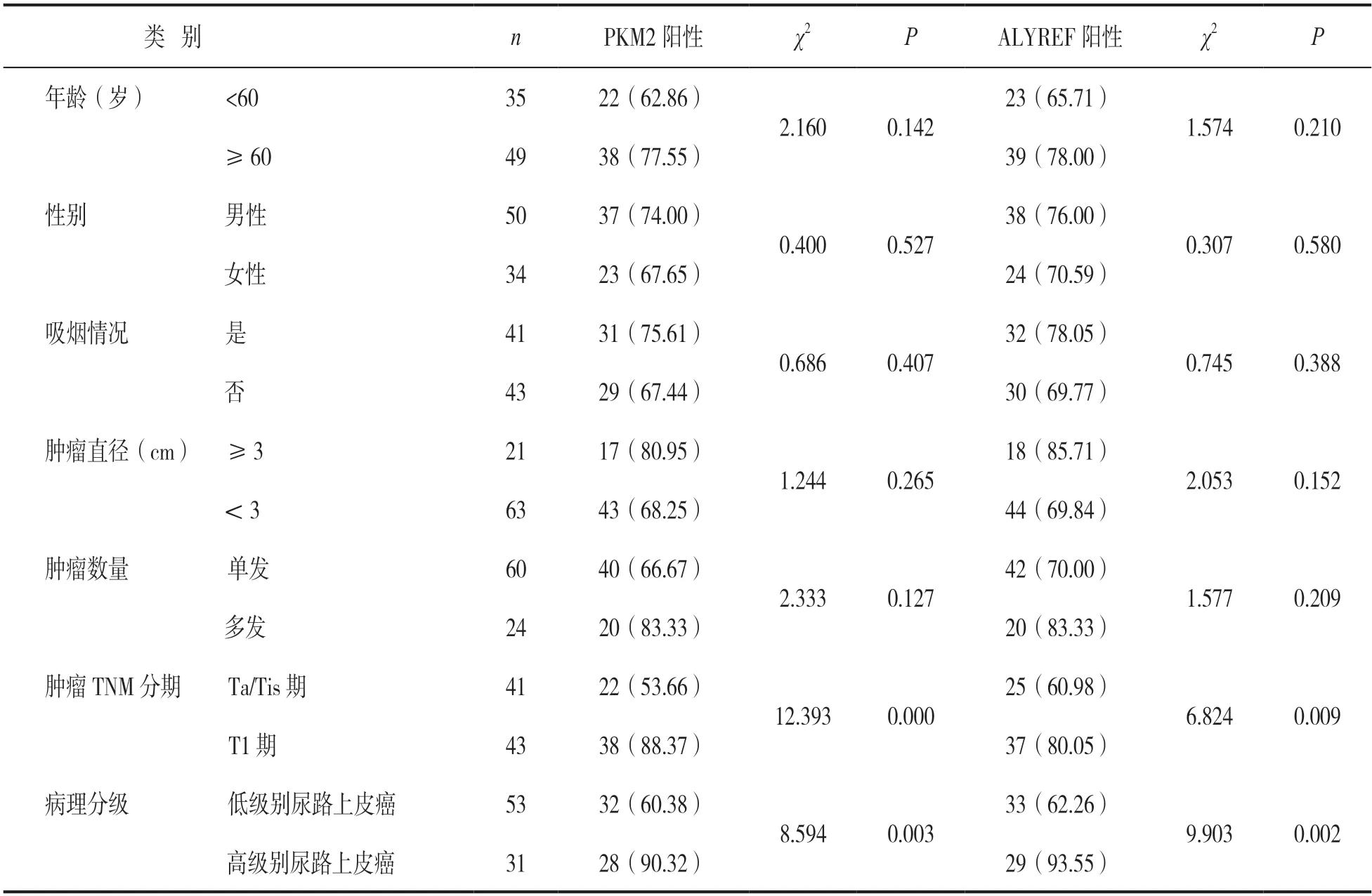
表1 PKM2,ALYREF蛋白表达与临床病理参数的关系[n(%)]
2.4 PKM2,ALYREF蛋白表达对NMIBC患者PFS预后的影响 见图2。84例NMIBC患者随访期间,无失访,34例发生肿瘤复发或转移,三年总体PFS为59.52%(50/84)。PKM2阳性组和阴性组患者的三年总体PFS分别为48.33%(29/60),87.50%(21/24)。PKM2阳性组患者三年累积PFS显著低于PKM2阴性组患者(Log-Rank testχ2=10.040,P=0.002)。ALYREF阳性组和阴性组三年总体PFS分别为48.39%(30/62),90.91%(20/22)。ALYREF阳性组患者三年累积PFS显著低于阴性组患者(Log-Rank testχ2=11.110,P=0.001)。

图2 Kaplan-Meier曲线分析PKM2,ALYREF蛋白表达对NMIBC患者PFS预后的影响
2.5 影响NMIBC患者PFS预后的因素分析 见表2,3。以NMIBC患者是否发生肿瘤进展为因变量(1=是,0=否,t=时间),COX回归分析结果显示,肿瘤TNM分期T1期、高级别,PKM2阳性,ALYREF阳性是影响NMIBC患者PFS预后的独立危险因素。

表2 单因素COX比例风险模型

表3 多因素COX比例风险模型
3 讨论
膀胱癌是泌尿外科常见恶性肿瘤,我国膀胱癌每年新发患者例数达8.2万例[8]。目前临床上主要根据NMIBC的肿瘤分期、病理分级等临床病理参数评估患者临床预后,但NMIBC肿瘤异质性较大,肿瘤治疗后易发生复发和转移,难以准确评估患者临床预后[9]。深入研究NMIBC肿瘤发生发展的机制,寻找能够评估NMIBC预后的肿瘤标志物,对于指导NMIBC的临床治疗,意义重大。
肿瘤代谢异常是肿瘤的基本特征之一。Warburg效应是肿瘤糖代谢改变的主要特征,即在有氧或无氧条件下肿瘤细胞均会选择产能效率较低的糖酵解途径,消耗葡萄糖快速产生三磷酸腺苷,满足肿瘤过度增殖对能量的需求[10]。PKM2是细胞中糖酵解过程的限速酶,在肿瘤代谢和肿瘤增殖中发挥重要作用。研究表明,PKM2在肝癌等多种癌症中高度表达,能够促进癌症细胞的增殖和迁移,导致肿瘤进展[4-5]。本研究中,NMIBC癌组织中PKM2表达升高,并与肿瘤TNM分期、病理分级有关,提示PKM2促进NMIBC的发生发展。膀胱癌中PKM2表达升高的机制与肿瘤缺氧微环境有关。膀胱癌肿瘤细胞的过度增殖导致肿瘤细胞处于缺血缺氧的状态,缺氧微环境能够上调肿瘤细胞内缺氧诱导因子1α的表达,缺氧诱导因子1α进入细胞核结合PKM2基因启动子缺氧反应原件,在转录水平促进PKM2蛋白表达[11]。膀胱癌中PKM2的表达升高能够参与促进肿瘤恶性进展。分析其机制,PKM2能够通过促进肿瘤细胞糖酵解,快速产生三磷酸腺苷,满足肿瘤细胞过度增殖需要的同时,大量葡萄糖代谢中间产物如丙酮酸、乳酸等代谢物质堆积,经脂肪酸合成代谢途径合成磷脂,为肿瘤细胞细胞膜磷脂提供原料[10]。另一方面,PKM2还能够与信号转导子和转录激活子3结合形成复合物,促进血管内皮生长因子的分泌,诱导肿瘤血管生成,促进肿瘤侵袭及转移的发生,导致肿瘤恶性进展[12]。因此,NMIBC中PKM2表达升高能够促进膀胱癌肿瘤的发生发展,是潜在的评估NMIBC患者预后的肿瘤标志物。本研究中证实,PKM2阳性表达的NMIBC患者PFS预后较差。笔者分析,PKM2阳性表达的膀胱癌肿瘤细胞恶性程度高,肿瘤的侵袭转移能力较强,增加了NMIBC患者经尿道膀胱肿瘤电切术后复发和转移的风险。此外,PKM2表达升高还会降低肿瘤细胞对铂类化疗药物敏感性。有学者报道,PKM2表达升高能够促进肿瘤细胞糖酵解,增加细胞内还原性代谢产物的水平,中和顺铂等化疗药物治疗过程中产生的活性氧,降低化疗药物治疗疗效[13]。因此,PKM2阳性表达的NMIBC膀胱癌肿瘤细胞术后肿瘤复发转移风险较高,导致不良PFS预后。
ALYREF是一种转录蛋白复合物的伴侣蛋白,能结合并剪接靶基因mRNA,介导mRNA由细胞核向细胞质的转移过程,在转录后水平发挥基因表达调控作用[14]。研究表明,肿瘤中ALYREF能够辅助RNA甲基转移酶2,甲基化修饰下游癌基因mRNA的5甲基胞嘧啶位点,促进癌基因表达,导致肿瘤发生发展[15]。本研究中,NMIBC癌组织中ALYREF蛋白表达升高,与国内学者体外细胞实验结果一致[16]。NMIBC中ALYREF的表达升高可能与转录后调控异常有关。研究表明,miRNA-26a-5p是ALYREF mRNA稳定性调节的重要因子,miRNA-26a-5p的表达下调引起肿瘤细胞中ALYREF mRNA稳定性增加,导致ALYREF蛋白表达上调[17]。本研究中,NMIBC癌组织中ALYREF蛋白表达与不良临床病理特征有关,提示ALYREF促进NMIBC的肿瘤进展。分析其机制,ALYREF作为碱性区域亮氨酸拉链转录因子的转录共激活因子,能促进细胞核中AKT的磷酸化激活,进而诱导周期素依赖的蛋白激酶D1等的表达,促进肿瘤细胞G2期向M期的进行,导致肿瘤过度增殖[18]。此外,有学者发现,膀胱尿路上皮癌中ALYREF通过其K171结构域识别NOP2/Sun RNA甲基转移酶家族成员2,促进RAS癌基因家族样蛋白6和胸苷激酶1 mRNA的5甲基胞嘧啶位点的甲基化,两者蛋白表达升高,最终促进恶性肿瘤的增殖及侵袭[19]。本研究中,ALYREF阳性表达是影响NMIBC患者PFS预后的独立因素,提示ALYREF是新的NIMBC预后相关肿瘤标志物。分析其原因,ALYREF的表达升高能够促进转录因子Yes相关蛋白 mRNA 3’非编码区域328至331碱基处的甲基化修饰,提高mRNA的稳定性,Yes相关蛋白表达上调不仅促进肿瘤细胞的侵袭和转移能力,还能诱导干性转录因子SRY盒转录因子10的表达,导致肿瘤细胞对酪氨酸激酶抑制剂等药物耐药性的形成[20]。因此,临床泌尿外科医生可根据NMIBC癌组织中ALYREF的表达,对患者临床预后进行风险评估,对于高危复发的患者予以积极治疗及随访,以改善患者临床预后。
本研究中,NMIBC癌组织中PKM2与ALYREF蛋白表达呈明显正相关,提示两者可能共同参与促进NMIBC的肿瘤进展。分析其机制,与ALYREF对PKM2 mRNA的表观遗传学修饰有关。研究发现,ALYREF能够通过其赖氨酸残基K171位点,结合并促进PKM2 mRNA的5甲基胞苷的甲基化修饰,增加PKM2 mRNA的稳定性,促进膀胱癌肿瘤细胞的增殖[11]。因此,NMIBC中阻断PKM2与ALYREF之间的相互作用可能是潜在的NMIBC肿瘤治疗方案,值得进一步研究。
综上所述,膀胱癌组织中PKM2,ALYREF表达升高,两者表达呈显著正相关,并与肿瘤TNM分期及病理分级有关,共同促进NMIBC的肿瘤的发生发展。NMIBC癌组织中PKM2和ALYREF阳性表达是影响患者PFS预后的独立危险因素,是新的评估NMIBC患者PFS预后的肿瘤标志物。临床医师可根据PKM2和ALYREF的表达情况,对NMIBC的肿瘤进展风险进行评估,对于高危患者予以积极随访和治疗,例如予以卡介苗生物治疗或短期内进行二次经尿道膀胱肿瘤电切,以减少肿瘤复发,改善患者预后。但本研究也存在一定的不足之处,本研究样本量有限,未对NMIBC不同的类型进行分层分析,研究结果可能存在一定的偏倚,有待今后扩大样本含量进一步研究。

