甲状腺乳头状癌患者血清EGR1/2 mRNA水平检测在临床早期实验诊断中的价值研究
周 钧,汪庭军,唐 珍(苏州市立医院北区 .检验科;.普外科,江苏苏州 215008)
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌类型中最常见的一种类型,PTC发生时临床症状不明显,通常确诊时即已出现转移现象[1-3]。因此,寻找临床特异度诊断标志物对PTC早期诊断具有重要的意义,早期生长反应因子(early growth response factor,EGR)不同成员具有不同的转录调节功能[4]。EGR1普遍存在于机体各个部位,在细胞生长和分化过程中发挥重要作用[5],可作为抑癌基因抑制多种恶性肿瘤生长增殖及分化,例如乳腺癌、胃癌、喉癌等[6-7]。EGR2在体内广泛分布,其表达水平受多个信号通路的影响调控,能被细胞因子、激酶、应激反应相关的多种细胞外信号分子诱导[8],参与多种疾病的发生与发展,例如甲状腺癌、胃癌、肝癌等[9-10]。但EGR1 mRNA和EGR2 mRNA对PTC发生产生影响的相关研究较少,因此,本研究主要探讨EGR1 mRNA和EGR2 mRNA水平变化对PTC早期诊断的临床价值。
1 材料与方法
1.1 研究对象 选择2019年1月~2022年2月在苏州市立医院确诊治疗的78例PTC患者为PTC组,男性41例,女性37例,年龄42~65(50.67±6.29)岁;46例甲状腺良性肿瘤患者为良性肿瘤组,男性22例,女性24例,年龄43~67(51.34±6.31)岁;对照组为38例同期到本院体检的健康者,男性21例,女性17例,年龄41~60(49.84±6.11)岁。三组人员年龄、性别差异均无统计学意义(F=0.599,χ2=0.492,均P>0.05),收集整理所有患者的临床基本资料。纳入标准:①PTC患者和甲状腺良性肿瘤患者均经病理检查确诊;②患者入院前未服用过激素类药物和其它肿瘤相关治疗类药物;③患者及家属均知情,签署知情同意书。排除标准:①伴有其它恶性肿瘤患者;②伴有严重感染或其它血液系统疾病者;③伴有严重自身免疫性疾病者。本研究内容已经本院伦理委员会审核通过。
1.2 仪器与试剂 Trizol试剂盒(赛默飞世尔科技有限公司),实时荧光定量PCR试剂盒(武汉默沙克生物科技有限公司),7500荧光定量PCR仪(美国ABI公司)。
1.3 方法
1.3.1 样本采集:分别抽取对照组体检时、患者清晨空腹静脉血3~5 ml,3 500 r/min离心15 min,取上清于-80℃保存备用。
1.3.2 实时荧光定量PCR法:采用实时荧光定量PCR方法检测血清中EGR1 mRNA和EGR2 mRNA相对表达量。使用Trizol提取各组血清中的总RNA,然后将RNA反转录为cDNA,根据实时荧光定量PCR试剂盒操作说明进行操作,qRT-PCR反应体系20 µl:SYBR© Premix Ex TaqTMII(2×)(北京伊塔生物科技有限公司)12.5 µl,dNTP1.6 µl,TaqDNA聚合酶1 µl,PCR上下游引物(10 µmol/L)各1 µl,加ddH2O至25 µl;反应参数:92℃预变性20s,96℃变性2s,85℃延伸20s,80℃退火6s,共30个循环。为减小实验误差,各样品重复3次。引物序列见表1,以GAPDH作为内参基因,采用2-△△Ct值表示相对表达水平。

表1 引物序列
1.4 统计学分析 采用SPSS25.0软件进行数据分析,计数资料以n(%)表示,采用χ2检验;计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间计量资料比较及进一步的两两比较分别采用单因素方差分析及snk-q检验,采用Pearson法分析EGR1 mRNA与EGR2 mRNA表达水平的相关性,采用ROC曲线分析血清中EGR1 mRNA和EGR2 mRNA表达对PTC患者早期诊断的临床价值,P<0.05为差异具有统计学意义。
2 结果
2.1 PTC组、良性肿瘤组和对照组血清EGR1mRNA,EGR2mRNA水平对比 见表2。PTC组、良性肿瘤组患者血清EGR1 mRNA,EGR2 mRNA水平低于对照组(q=13.857,20.241; 16.514,25.785,均P<0.05),PTC组患者血清EGR1 mRNA,EGR2 mRNA水平低于良性肿瘤组(q=5.199,7.966,均P<0.05),差异均有统计学意义。
表2 PTC组、良性肿瘤组和对照组血清EGR1 mRNA,EGR2 mRNA水平对比(±s)
项目对照组(n=38)良性肿瘤组(n=46)PTC组(n=78)F值P值EGR1 mRNA1.03±0.140.81±0.100.74±0.08103.402<0.001 EGR2 mRNA0.98±0.120.76±0.090.67±0.06166.508<0.001
2.2 不同病理特点PTC患者血清EGR1mRNA,EGR2 mRNA水平分析 见表3。PTC患者在不同肿瘤分期、浸润程度及淋巴结转移方面血清EGR1 mRNA,EGR2 mRNA水平差异均有统计学意义(均P<0.05)。
表3 不同病理特点PTC患者血清EGR1 mRNA,EGR2 mRNA水平分析(±s)

表3 不同病理特点PTC患者血清EGR1 mRNA,EGR2 mRNA水平分析(±s)
病理特征nEGR1 mRNAt值P值EGR2 mRNAt值P值年龄(岁) <50350.76±0.101.4720.1450.69±0.121.6060.112≥50430.73±0.080.65±0.10性别 男410.75±0.130.9810.3300.70±0.151.8780.064女370.72±0.140.64±0.13肿瘤直径(cm) <3340.77±0.131.8390.0700.68±0.081.0210.311≥3440.72±0.110.66±0.09 TNM分期 Ⅰ~Ⅱ380.78±0.152.2060.0300.71±0.123.4810.001Ⅲ~Ⅳ400.71±0.130.63±0.08浸润程度 未浸润包膜470.79±0.182.9450.0040.73±0.164.455<0.001超过包膜310.67±0.170.58±0.12淋巴结转移 无450.77±0.162.4150.0180.70±0.142.3820.020有330.69±0.120.63±0.11
2.3 PTC患者血清EGR1 mRNA与EGR2 mRNA水平相关性分析 采用Pearson相关性分析,结果显示PTC患者血清EGR1 mRNA与EGR2 mRNA表达呈正相关(r=0.216,P<0.05)。
2.4 PTC患者血清EGR1 mRNA与EGR2 mRNA水平早期诊断的ROC曲线分析 见图1。血清EGR1 mRNA早期诊断PTC的ROC曲线下面积为0.693,敏感度、特异度分别为91.03%,41.30%;EGR2 mRNA早期诊断PTC的ROC曲线下面积为0.775,敏感度、特异度分别为91.03%,52.17%;二者联合检测早期诊断PTC的ROC曲线下面积为0.829,敏感度、特异度分别为85.90%,73.91%。
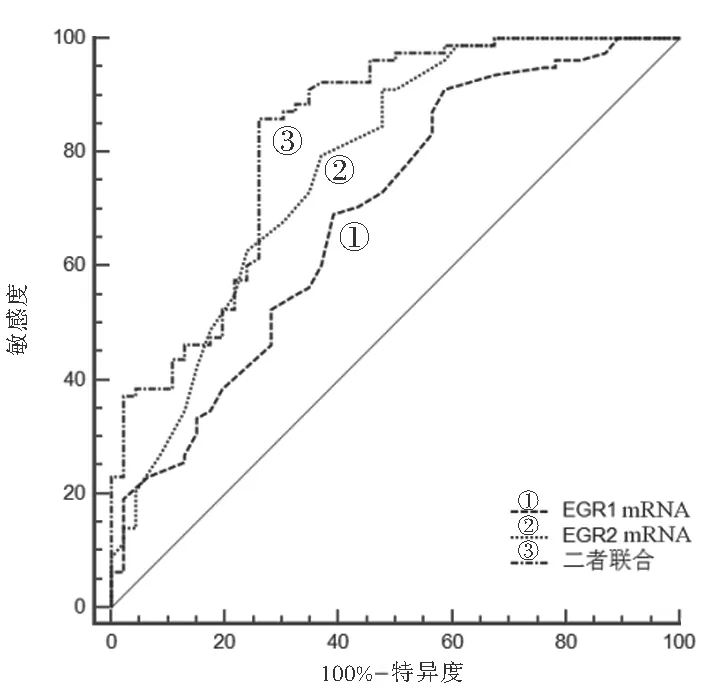
图1 PTC患者血清EGR1 mRNA与EGR2 mRNA水平早期诊断的ROC曲线
3 讨论
甲状腺是人体重要的内分泌腺体,在机体激素水平调节、新陈代谢、生长发育等方面起着重要的作用[11]。甲状腺结节是甲状腺细胞出现异常增生的常见疾病,通常为良性结节,但仍有10%~15%为恶性结节,病变发展为甲状腺癌等相关恶性肿瘤疾病[12]。甲状腺癌(thyroid carcinoma)主要分为乳头状癌、未分化癌、滤泡状癌和髓样癌,其中,乳头状癌占全部甲状腺癌的半数以上[13]。PTC发生发展是一个多因素、多机制的过程,碘异常摄入、辐射、肿瘤家族史、内分泌紊乱等都可能引发PTC,近年来PTC发病率逐年增长,女性发病率高于男性,多为中青年人群[14]。PTC恶性程度低,但易出现淋巴结转移和复发,且多数患者早期症状不明显、不易发现,病程进展缓慢。PTC发生早期,若肿瘤出现特异性核改变时,临床诊断较为容易;若肿瘤仅在局灶出现某些不确定的核改变,临床常规形态学检查难以作出准确判断,另外,一部分良性病变中会出现乳头状增生病变,该病变无特异度细胞核改变,且核增大、淡染等不典型形态或乳头状结构也不明显,很难与乳头状癌区分; 当出现甲状腺微小乳头状癌,尤其是镜下发现的甲状腺微小乳头状癌位于硬化性间质内,其细胞形态不具有特异度,给临床诊断造成了一定的困难[15]。因此,早期进行确诊对患者治疗和预后具有重要意义。
早期生长反应因子(EGR)又称为即刻早期基因,在体内主要参与影响细胞生长、分化和凋亡等一系列过程,是机体维持稳定运行的重要转录因子[16]。EGR1属于即刻早期基因成员之一,在体内可刺激正常细胞从静止期进入增殖期,参与细胞生长分化等过程[17]。研究发现,正常细胞的异常分化是引起肿瘤发生的必经过程,而大部分的生长因子基因和原癌基因的启动子区域中均存在EGR1蛋白的结合位点,提示EGR1可能与肿瘤的发生发展密切相关[18]。EGR1在体内分布广泛,例如脑部、肺部、乳腺等多部位均有表达,EGR1在正常机体内高表达,在恶性肿瘤细胞中表达降低,提示EGR1基因可能有抑制肿瘤细胞生长增殖的功能[19]。GUO等[20]研究了EGR1和EGR2通过抑制PTEN和BAX的表达,抑制PTC细胞生长的作用机制,EGR1和EGR2通过直接结合启动子区域调控PTEN和Bax的表达,从而抑制PTC的发生发展,EGR1和EGR2有望成为PTC临床诊断的分子标志物和治疗靶点。本研究结果显示,PTC组患者血清EGR1 mRNA水平显著低于良性肿瘤组(P<0.05),血清EGR1 mRNA表达与肿瘤分期、淋巴结转移、浸润程度有关,血清EGR1 mRNA早期诊断PTC的ROC曲线下面积为0.693,敏感度、特异度分别为91.03%,41.30%,表明EGR1 mRNA诊断PTC的敏感度较高,但特异度较低,提示EGR1 mRNA水平与PTC发生发展密切相关,可能作为抑癌基因参与抑制PTC的发生发展,诊断PTC时需结合其它指标进行综合判断。
EGR2转录因子最早在果蝇胚胎发育分节现象中被发现,包含一个C2H2型的锌指结构,由406个氨基酸组成[21]。EGR2属于反式作用蛋白,体内广泛分布,通过调节多种信号通路在体内表达,与某些基因的启动子相结合从而影响下游基因的表达[22]。既往研究表明,EGR2参与细胞生长、分化和凋亡等过程,参与调节并影响多种类型疾病的发生发展,例如胃癌、肝癌等[23]。ZANG等[24]研究了miR-224-5p靶向EGR2促进甲状腺乳头状癌发生发展机制,结果显示PTC组织和细胞中miR-224-5p表达上调,EGR2表达下调,且与PTC患者的TNM分期和淋巴结转移有关(P<0.05),miR-224-5p直接靶向EGR2基因,两者水平表达呈负相关(P<0.05),上调EGR2会减弱miR-224-5p的致癌作用。本研究结果显示,PTC组患者血清EGR2 mRNA水平显著低于良性肿瘤组(P<0.05),血清EGR2 mRNA表达与肿瘤分期、淋巴结转移、浸润程度有关,EGR2 mRNA早期诊断PTC的ROC曲线下面积为0.775,敏感度、特异度分别为91.03%,52.17%,表明EGR2 mRNA诊断PTC的敏感度较高,但特异度较低,提示EGR2 mRNA水平与PTC发生发展密切相关。
本文研究结果显示,PTC患者血清中EGR1 mRNA与EGR2 mRNA表达呈正相关,二者联合检测早期诊断PTC的ROC曲线下面积为0.829,敏感度、特异度分别为85.90%,73.91%,说明两者可能共同作用于PTC肿瘤细胞的生长、分化和凋亡等过程,对PTC早期诊断具有较高的临床价值,但两者具体的作用机制还需进一步设计试验深入研究。
综上所述,PTC患者血清EGR1 mRNA和EGR2 mRNA水平显著下调,且二者联合检测对PTC早期诊断具有更好的效能。但是,本研究纳入的样本量较少,后续会增加样本量,继续验证本研究结论,以期对患者临床诊断提供参考。

