子宫内膜癌患者术前血清apo AI和Apelin水平检测对预测淋巴脉管间隙浸润风险的价值研究
梁燕茹,郑 瑜,李 倩(.石家庄市妇幼保健院妇产科,石家庄 050000;.保定市妇幼保健院妇产科,河北保定 07000)
子宫内膜癌(endometrial carcer,EC)主要病理特征为子宫内膜量增多,镜下可见腺体数量及大小明显增加、形态异常,多发于绝经后女性,近年来患者群体有年轻化趋势。EC可直接改变子宫内膜形态及内环境,且多伴有异常子宫出血,威胁其他器官安全,影响患者身心健康。子宫切除术联合淋巴结切除术是治疗EC的重要方案,但术后淋巴脉管间隙浸润(lymph vascular space invasion,LVSI)是影响患者淋巴结转移的独立因素,已有研究[1]证实存在LVSI的EC患者术后淋巴结转移风险较高。因此,通过寻找可预测EC患者LVSI风险的指标以指导临床方案制定具有一定价值。载脂蛋白AI(apolipoprotein AI,apo AI)是高密度脂蛋白主要成分,具有促进脂质代谢、胆固醇运输的作用,近年来有研究[2-3]将其作为肿瘤诊断标志物,指出其水平异常降低是恶性肿瘤患者预后不佳的重要因素。Apelin由脂肪细胞分泌,是一种新型脂肪因子,广泛存在于中枢神经、心血管、肺、肾等器官或组织中,可调控代谢平衡、能量生成,且对调控内环境稳定有一定影响,其异常表达可导致代谢性疾病[4-5],关于其在肿瘤增殖中的作用机制是近年来研究热点。目前临床中关于apo AI,Apelin与EC关系的相关文献较少,且是否与LVSI有关尚未见研究报道。本研究选取石家庄市妇幼保健院EC患者,探究血清apo AI,Apelin水平预测EC患者LVSI风险的价值,旨在为临床提供参考。
1 材料与方法
1.1 研究对象 选取2020年2月~2022年6月石家庄市妇幼保健院妇产科EC患者97例为研究组。纳入标准:符合EC诊断标准[6],均经病理学检查确诊,且均于石家庄市妇幼保健院行子宫切除术,手术前后病理检查结果一致。排除标准:①术前经放化疗干预;②并发其他恶性肿瘤;③近期服用激素类药物。年龄48~62(55.38±3.27)岁;体质量指数19.4~28.6 (24.67±2.31)kg/m2;绝经70例。本研究经石家庄市妇幼保健院伦理委员会审批通过。
1.2 仪器与试剂 血清apo AI检测试剂盒(美国Abcam公司),血清Apelin检测试剂盒(上海科艾博生物技术有限公司),DAKO Omnis全自动免疫组化染色机(赛默飞世尔)。
1.3 方法
1.3.1 血清apo AI,Apelin检测:入院24 h内采集空腹静脉血4 ml,室温静置2 h,转速3 000 r/min离心15 min,取上清液,-80℃保存,采用免疫荧光法检测血清apo AI水平;酶联免疫法检测血清Apelin水平,具体操作严格按照试剂说明书进行。
1.3.2 LVSI评估:采用免疫组织化学法,取病理标本切片后由石家庄市妇幼保健院2名经验丰富的病理科医师进行盲检,并判定结果,若判定结果不明确则组织其他病理医师讨论,直至意见一致。LVSI三级评估:弥漫性LVSI:周围存在多病灶或喷雾样LVSI;局灶性LVSI:单个LVSI病灶;不存在LVSI。其中弥漫性LVSI,局灶性LVSI均定义为LVSI阳性,不存在LVSI定义为LVSI阴性。
1.4 统计学分析 通过SPSS22.0处理数据,计量资料以均数±标准差(±s)表示,采用独立样本t检验;计数资料以n(%)表示,采用χ2检验;采用Logistic回归分析EC患者LVSI风险的影响因素;采用ROC分析术前血清apo AI,Apelin水平评估EC患者LVSI风险的价值,获取曲线下面积(area under curve,AUC)、95%置信区间(95%CI)、敏感度、特异度、Youden指数及cut-off值,不同方案间曲线下面积比较采用MedCalc软件分析,进行DeLong检验,联合检测实施Logistic二元回归拟合,返回预测概率logit(p),将其作为独立检验变量,其中AUC值>0.7表明价值较高;采用R语言4.2.1软件Decision Curve包,以风险阈值为横坐标、净收益率为纵坐标绘制决策曲线,分析术前血清apo AI,Apelin水平评估EC患者LVSI风险的净受益率。检验标准α=0.05。
2 结果
2.1 EC患者LVSI结果及一般资料比较 见表1。97例EC患者中LVSI阴性69例,阳性28例。LVSI阳性患者肿瘤≥2 cm,非子宫内膜样腺癌、低分化、肌层浸润≥1/2的比例多于LVSI阴性患者,术前血清apo AI水平低于阴性患者,Apelin水平高于阴性患者(均P<0.05)。
表1 不同LVSI结果的EC患者一般资料比较[n(%),(±s)]

表1 不同LVSI结果的EC患者一般资料比较[n(%),(±s)]
类 别阳性(n=28)阴性(n=69)t/χ2P年龄(岁)≥55 11(39.29)29(42.03)0.0620.804<5517(60.71)40(57.97)体质量指数(kg/m2)≥25 10(35.71)30(43.48)0.4960.482<25 18(64.29)39(56.52)绝经是21(75.00)49(71.01)0.1580.692否7(25.00)20(28.99)流产史有8(28.57)13(18.84)1.1120.292无20(71.43)56(81.16)并发症糖尿病6(21.43)4(5.80)3.7090.054高血压4(14.29)2(2.90)2.7050.100高血脂3(10.71)1(1.45)2.2990.130肿瘤大小(cm)≥2 19(67.86)27(39.13)6.5920.010<2 9(32.14)42(60.87)病理类型子宫内膜样腺癌18(64.29)63(91.30)8.6860.003非子宫内膜样腺癌10(35.71)6(8.70)分化程度高、中分化12(42.86)46(66.67)4.6970.030低分化16(57.14)23(33.33)子宫颈间质浸润有6(21.43)4(5.80)3.7090.054无22(78.57)65(94.20)肌层浸润深度≥1/220(71.43)26(37.68)9.0980.003<1/28(28.57)43(62.32)卵泡刺激素(U/L)4.86±1.034.93±0.990.3120.756促性腺激素(U/L)4.43±0.954.29±0.910.6780.499雌二醇(pmol/L)295.37±61.04310.52±66.491.0450.299 apo AI(g/L)0.83±0.190.96±0.222.7380.007 Apelin(μg/L)440.76±60.37387.89±58.424.001<0.001
2.2 EC患者LVSI风险的影响因素分析 见表2。EC患者LVSI结果为因变量(赋值:阴性=0,阳性=1),以LVSI阳性患者肿瘤大小、病理类型、分化程度、肌层浸润程度、血清apo AI,Apelin水平为自变量,采用Logistic回归分析,结果显示,肿瘤≥2cm、非子宫内膜样腺癌、低分化、肌层浸润≥1/2,血清Apelin水平升高是EC患者LVSI阳性的独立危险因素,血清apo AI升高是LVSI阳性的保护因素(均P<0.05)。
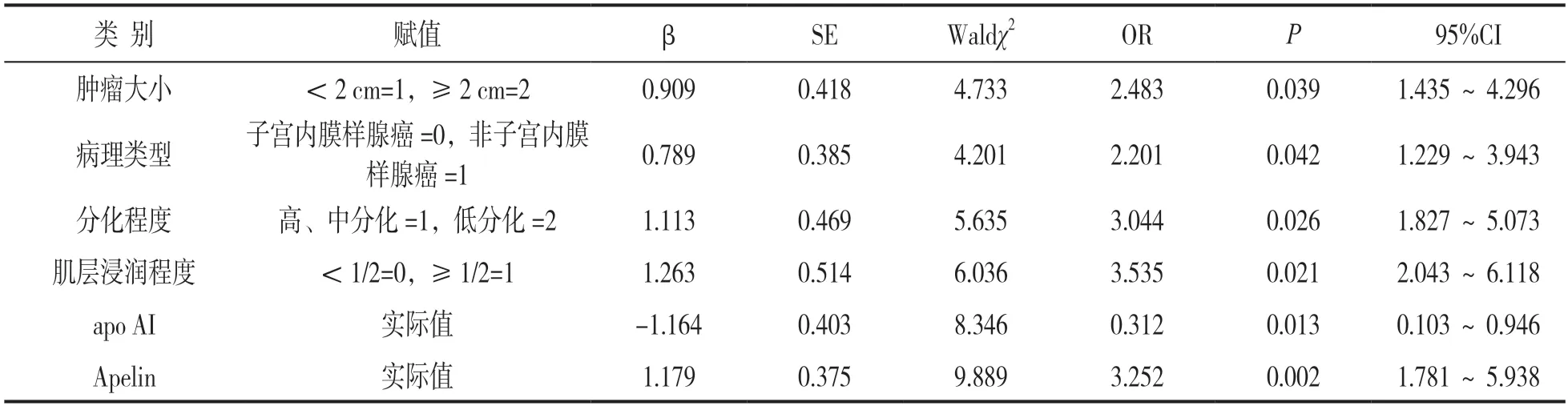
表2 EC患者LVSI风险的影响因素分析
2.3 术前血清apo AI,Apelin水平评估EC患者LVSI风险的ROC分析 见表3,图1。术前血清apo AI,Apelin评估EC患者LVSI风险的AUC值分别为0.741,0.712,提示术前血清apo AI,Apelin评估EC患者LVSI风险具有较高价值(P<0.001)。进一步分析显示,术前血清apo AI,Apelin联合检测评估EC患者LVSI风险的AUC值为0.801,高于二者单独评估的AUC值,表明术前血清apo AI,Apelin联合检测评估EC患者LVSI风险具有更高价值(P<0.001),其敏感度和特异度分别为73.91%,85.71%。

图1 术前血清apo AI,Apelin水平评估EC患者LVSI风险

表3 血清apo AI,Apelin水平评估EC患者LVSI风险
2.4 术前血清apo AI,Apelin水平评估EC患者LVSI风险的决策曲线分析 见图2。以风险阈值为横坐标、以净收益率为纵坐标绘制决策曲线,结果显示,当风险阈值为0~0.6时净受益率>0,表明具有临床意义,且当风险阈值越小时净受益率越大,净受益率最大为0.3。当风险阈值为0~0.55时,术前血清apo AI,Apelin联合检测的净受益率大于单独检测。

图2 术前血清apo AI,Apelin水平评估EC患者LVSI风险
3 讨论
淋巴脉管间隙浸润(LVSI)的形成过程较为复杂,肿瘤细胞突破基底膜浸润、侵袭周围组织时可能侵犯间质中的小血管、淋巴管,并在小血管、淋巴管形成同聚物,即为脉管内癌栓,若LVSI在淋巴管、小血管内游走或扩散至其他器官、组织时,则造成肿瘤转移。因而很多学者[7-8]认为LVSI是肿瘤细胞转移的关键步骤,临床需加以重视。相关研究[9]指出,LVSI与EC淋巴结转移密切相关,且发生LVSI后患者复发率明显提高、生存率有所下降。另有研究[10-11]证实,LVSI是EC患者预后的重要影响因素,且对患者生存期有一定影响。因此,在术前预测EC患者LVSI风险具有一定参考价值。
随着近年来对肿瘤病理机制研究的不断深入,有学者[12]认为血清apo AI水平异常降低与肿瘤转移密切相关,这在肝癌、肺癌、结肠癌等肿瘤[13-15]相关研究中得到证实。相关研究[16]指出apo AI主要通过抑制肿瘤增殖活力达到抑制肿瘤增殖的目的,在此基础上,本研究进一步发现,LVSI阳性的EC患者血清apo AI水平明显降低,在保持其他因素不变的情况下,血清apo AI水平变化仍是EC患者LVSI阳性的独立影响因素,表明血清apo AI水平降低对EC患者术后发生LVSI有促进作用。apo AI可通过激活磷酸腺苷蛋白激酶改善葡萄糖代谢,进而加快降解Nanog,下调肿瘤细胞活性,达到抑制肿瘤转移的目的。
Apelin是一种新型脂肪因子,具有调控代谢平衡与内环境稳定、提高胰岛素敏感性、改善胰岛抵抗、促进外周组织脂肪酸氧化等作用,可纠正糖脂代谢平衡,其水平异常表达与多种代谢性疾病密切相关[17]。多种代谢疾病如高血压、糖尿病、肥胖等均会提高EC发病风险,而Apelin是否与EC直接相关,仍需进一步相关数据证实。作为新发现的脂肪相关因子,目前关于Apelin的研究主要集中于肿瘤及心血管疾病领域,其对新生血管生成有促进作用[18]。近年研究显示,Apelin通过对宿主血管的旁分泌作用,刺激肿瘤新生血管肿瘤新生血管形态和功能成熟[19]。这可能是Apelin参与EC发生、进展的重要机制。本研究通过Logistic回归分析,发现术前血清Apelin水平高表达是EC患者LVSI阳性的独立危险因素。但关于Apelin的信号转导机制尚未有权威论证,推测可能为Apelin通过作用于APJ受体参与磷酸腺苷蛋白激酶受体,且与受体结合后可激活Gi蛋白加快摄取葡萄糖,但其下游机制还需进一步证实。
本研究通过ROC曲线分析发现,术前血清apo AI,Apelin评估EC患者LVSI风险均具有较高价值,且二者联合检测的价值高于单独检测,提示通过检测术前血清apo AI,Apelin水平或可作为评估EC患者LVSI发生风险的参考指标。为进一步分析术前血清apo AI,Apelin预测子宫内膜癌LVSI风险的价值,本研究通过绘制决策曲线进行分析,当风险阈值为0~0.55时,术前血清apo AI,Apelin联合检测的净受益率大于单独检测,进一步证实二者联合检测具有一定临床应用价值,这或对临床治疗方案制定有参考作用。决策曲线方法2006年提出,目前临床如何选择阈值概率仍较难达成共识,使其推广应用受到一定限制。而建立较为准确的预测模型后,决策曲线利于医生在风险与获益中选择,以实现利益最大化。
综上,EC患者术前血清apo AI,Apelin水平均存在异常表达,血清apo AI低表达、Apelin高表达表明患者LVSI风险较高,通过检测二者水平对预测LVSI风险具有一定临床价值。但本研究受限于临床实际,无法通过进一步扩大样本量对该预测模型进行扩展性验证,研究结果可能存在一定偏倚,有待临床多中心、选取更多样本进行验证。

