中西医对宫腔粘连诊治的认识及进展*
张潇潇 黄礼云
宫腔粘连(Intrauterine adhesions,IUA),指由于宫腔手术损及子宫内膜基底层,子宫内膜发生纤维化,导致子宫容积缩小,宫腔部分或完全封闭[1]。其主要表现为月经量减少、闭经、复发性流产、不孕等。有文献报道,因人工流产、刮宫术所致的IUA发生率高达40%[2]。本文分别从其发病的中、西医病因病机、诊治及预防作一总结,具体研究如下。
1 发病原因
1.1 机械损伤机械损伤是目前临床公认导致IUA的最主要原因。宫腔手术造成子宫内膜基底层损伤,无法进行再生及自我修复,导致粘连形成。常见原因主要包括人工流产术、稽留流产后清宫术、子宫黏膜下肌瘤电切术等宫腔手术史。在中国,人工流产居IUA病因的首位[3]。在国外学者的临床观察中,IUA的高危因素还包括剖宫产术后、放置宫内节育器等[4]。
1.2 低雌激素状态低雌激素状态也是目前普遍被接受的学说之一[5]。雌激素对于子宫内膜腺体及间质具有增生及修复作用,其水平过低可能造成子宫内膜较薄、更容易受损而形成宫腔粘连。IUA患者由于子宫内膜雌激素受体表达异常、对雌激素的敏感性下降、子宫内膜被破坏以及子宫内膜供血不足等原因,对生理剂量的雌激素反应较差,使雌激素无法发挥促进内膜修复的作用[6]。
1.3 宫腔感染生殖道结核杆菌是目前惟一被证实会导致IUA的明确病原体[7],且生殖道结核通常与严重的IUA相关[8]。结核分枝杆菌感染宫腔后早期并无明显表现,随着感染进展,可引起子宫内膜产生局灶性或多发性溃疡、坏死、出血。最终,子宫内膜发生粘连,宫腔形态发生改变甚或完全封闭[9]。
1.4 其他发病相关机制及学说实际上,IUA的发病机制并不十分明确。目前学界普遍认同的观点还有子宫内膜血流低灌注[10]、纤维细胞增生活跃[11]、神经反射[12]、子宫内膜干细胞增殖及分化异常[13]等。另外,IUA也存在于少数无宫腔手术史的患者中,提示IUA与遗传因素[14]可能也有关。
1.5 中医病因病机历代中医古籍中并没有“宫腔粘连”这一病名,根据临床表现可将其归于“月经过少、闭经、不孕”等范畴。《女科撮要》指出:“小产如生采,破其皮壳,断其根蒂,岂不重于大产”。从病因来看,宫腔粘连多由妇科手术后胞宫受到损伤所致,归结于不内外因之金刃所伤。手术操作强行使胎元陨落、犹如“生采”,直接损伤了胞宫。《景岳全书·妇人规》云:“凡妊娠而数堕胎者,必以气脉亏损而然”。多次堕胎,必然耗伤肾之气血精元。而宫腔手术使外邪入侵机会增加,邪气乘虚而入,与血搏结成瘀,瘀血阻塞胞宫以致经血不通。由此,精元气血亏虚、胞脉阻塞不通、胞宫失养,必然导致月经量减少、闭经、不能摄精成孕等表现[15]。因此,中医认为宫腔粘连形成的病机主要为肾虚血瘀之虚实夹杂证。
2 诊断
2.1 经阴道超声经阴道二维超声经济、无创,是诊断IUA首选的方法。超声下IUA常见的影像学改变为子宫内膜菲薄或厚薄程度不均、内膜线连续性中断、子宫内膜局部毛糙或与周围肌层分界不清等[16]。经阴道三维超声在二维超声的基础上,加入了横跨宫颈至宫底整个子宫长轴的冠状面[16],能更加清楚、立体地显示宫腔整体形态和内膜的连续性,是对二维超声的补充诊断。三维超声下IUA可能有子宫内膜回声不均、子宫内膜下陷、子宫内膜连续性中断、宫腔分离、宫角显示不清等影像学表现[17]。
2.2 宫腔声学造影宫腔声学造影在常规超声的基础上借助造影剂辅助显影,能更加立体、清晰的显示宫腔形态和内膜特征。IUA在宫腔声学造影中常表现为:有桥状强回声带随造影剂移动或连接于宫腔两侧壁,或表现为宫腔扩张受限。若粘连程度较重,则宫腔可能完全闭合无法扩张。中华医学会2015年发布的《宫腔粘连临床诊疗中国专家共识》[1]指出,对于临床上高度怀疑IUA者,若无宫腔镜检查的条件,建议选择宫腔声学造影协助明确诊断。
2.3 宫腔镜宫腔镜可以在直视下了解宫腔粘连的部位、性质及程度,目前被认为是IUA诊断的金标准。并且宫腔镜在诊断的同时能完成治疗的目的,避免了再次手术的可能,减少了患者的痛苦。
3 分度
目前临床上常用的国内IUA分度如下[1]。见表1。
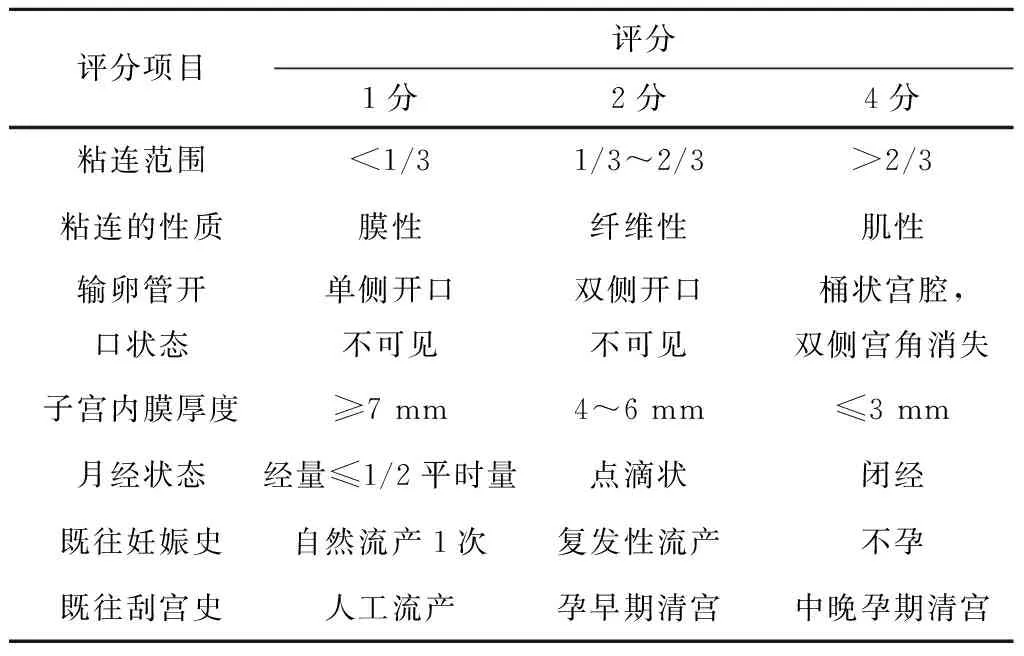
表1 2015年中华医学会妇产科学分会对IUA进行诊断分级评分标准
4 治疗与术后预防
4.1 西医方面宫腔镜下宫腔移边分离术(Transcervical resection of abhesion,TCRA)是目前临床治疗首选方案[1]。TCRA主要分为机械性宫腔镜手术及能源系统宫腔镜手术。无论采用何种宫腔镜技术,基于IUA复发的可能较大,术后均需积极预防。关于IUA术后预防也可分为物理预防与药物预防2种。物理预防是指手术后在宫腔内放置支撑阻隔或生物屏障材料[10]。宫腔支撑阻隔包括Foley球囊、宫内节育器等。而宫腔生物屏障材料如羧甲基壳聚糖、透明质酸等,具有减少创面渗出、抑制胶原纤维增生的功能,能有效避免粘连再次形成。此外,随着对IUA研究的深入,一些新的生物技术也被尝试用于IUA患者术后再次粘连的预防,如新鲜羊膜移植、干细胞宫腔灌注等,其有效性有待于临床进一步研究。雌孕激素序贯疗法是目前临床普遍认同的药物预防方式。但是,关于雌激素的使用时机及用量目前尚无统一定论。无论TCRA前或TCRA后,口服大剂量雌激素均有助于子宫内膜修复,预防术后再次粘连的发生。Liu等[18]对120例IUA患者进行试验研究后发现,术前以雌二醇9 mg/d口服预防粘连的效果更明显。刘玉环等[19]研究也表明,中重度IUA分离术后雌二醇10 mg/d口服能有效增加月经量、恢复宫腔形态、改善妊娠结局,且雌激素连续使用治疗比雌孕激素人工周期治疗效果更明显。但也有研究显示,大剂量雌激素的使用会形成宫腔内局部高雌二醇环境,使炎症因子等释放增加,加速内膜纤维增生,形成宫腔粘连[10]。美国妇科内镜协会2010年指南[20]建议的参考计量为:TCRA后每日2.5 mg雌二醇口服。Zhang等[21]也证明,在TCRA后,雌激素使用的最佳剂量为生理剂量。综上,雌孕激素的使用无统一标准,应结合患者的粘连严重程度、炎症程度、雌孕激素受体的生物活性等进行具体化制定。
4.2 中医方面
4.2.1 辨证论治辨证论治是中医的基本治则。与历代医家认为IUA病机主要为肾虚血瘀的辨证论治观点相对应,补肾活血为其基本治疗原则。王英等[22]以补肾养血、活血调经为原则,自拟益肾养膜汤,其基本药物组成为阿胶、熟地黄、当归、肉苁蓉、菟丝子、牡丹皮等,联合丹参注射液宫腔灌注,明显改善了宫腔手术后患者宫腔粘连情况。储志燕等[23]总结临床经验自拟消积活血方,主要采用活血化瘀、清热利湿之中药如:桃仁、红花、莪术、生薏苡仁、鸡血藤、香附等治疗IUA,也取得了显著疗效。
4.2.2 月经周期疗法中医认为,女性月经周期是由阴阳气血的消长盛衰而形成,因此应根据女性在不同月经周期具有不同的生理特点进行分阶段治疗。吴阳等[24]于行经期以土鳖虫、地龙等行血通络之品通调为顺;经后期则自拟加减助卵汤,调膜助养,以黄芪、党参、白术补脾益气;覆盆子、桑椹、菟丝子填补肝肾精髓。周璐等[25]在IUA患者TCRA后加用中药分期治疗,经前期主用熟地黄、巴戟天滋补肾之阴阳,经期主用益母草、桃仁化瘀通经,经后期主用菟丝子、女贞子滋肾养精。3个月后,患者月经恢复率能达到80%以上。
4.2.3 其他中医治疗方法刘柱香等[26]采用补肾化瘀类中药配合针灸疗法,主穴选用三阴交、肾俞、血海、关元、复溜,对患者恢复月经、增加子宫内膜厚度方面具有良好改善效果。王慧等[27]对人流术后患者使用耳穴压豆 (主穴为肾、脾、肝、内分泌、卵巢、子宫) 联合复方左归胶囊口服,有效促进了子宫内膜生长,预防宫腔粘连的再发生。此外,还有中药外敷、埋线等中医适宜技术也被用于IUA患者术后再次粘连的预防,并取得了良好效果。
5 小结
综上所述,随着宫腔手术的增加,IUA的发病率也逐渐升高。创伤、低雌激素状态及感染是目前较公认的导致IUA的3大因素。兼具诊断与治疗双重功能的宫腔镜,是IUA诊断的金标准,TCRA术也是IUA的首选治疗方式。术后对再次粘连的预防十分重要,可采用宫腔球囊及其他各种宫腔生物屏障,同时联合激素周期疗法。其中,雌激素的具体用量应根据患者的粘连程度、炎症状态等个体化制定。中医中药在治疗及预防宫腔粘连方面具有巨大潜力,将成为临床研究的热门话题。

