热处理对紫薯抗氧化物质的影响
曹凤红,陈晓嫚,黄爱兰,胡 静
(蚌埠医学院公共基础学院,安徽 蚌埠 233030)
紫薯,又名紫甘薯、黑薯等,肉质块根呈紫红色,主要种植在亚洲,在我国引进及大规模种植较晚[1]。紫薯营养丰富,不仅有淀粉、纤维素、蛋白质、果胶、维生素等成分外,还富含氨基酸、多酚、黄酮、花色苷、硒元素等多种活性成分物质,常作为功能性添加剂以及提取植物色素等的重要原材料[2-5]。研究表明,多酚、黄酮、花青素等成分具有良好的抗氧化、抗癌、预防高血压等功能[6-8]。
花色苷,是一种水溶性类黄酮类的物质,广泛存在于多种植物中,其含量及类型因植物品种、环境的不同而存在差异[9-10]。紫薯中花青素主要是矢车菊色素与芍药色素,类型主要是单酰基或者双酰基花青素[11]。酰基化的花青素,与黑米、蓝莓等中的无酰基化花青素相比,对光,酸碱等的灵敏度低,稳定性更高[12]。紫薯多酚类物质,具有高产、稳产的特征,有利于紫薯加工及其相关产品的开发。
食品的安全性、感官特性、营养价值等质量特性,特别是具有生物活性的天然植物化学物质的形成或释放,受初级生产以及工业加工的影响。目前,最常见的加工方式是煮、蒸、微波、烤、炸等热处理。热处理对植物化学物质含量的影响主要取决于其加工条件、食品基质的结构和特定化合物的化学性质[13-14]。现有研究表明,不同的热加工方式对植物中的抗氧化物质的影响不同。XU等[15]研究了微波与蒸汽同时蒸煮提高熟料紫甘薯营养品质的应用,研究指出,煮熟后,除咖啡酸外,总酚类、黄酮类、花青素和酚酸类等植物化学物质含量均有不同程度的增加。BLESSINGTON等[16]提出,土豆在煮、烤、炸和微波处理中其总酚含量和抗氧化活性显著增加。HOU等[17]研究表明,烘焙后甘薯蛋白质和维生素C含量降低,抗氧化活性显著提高。目前,对于家庭常用热处理方式对紫薯的抗氧化物质含量及其抗氧化活性的影响研究较少。
本研究分析了蒸、煮、烤三种热处理方式对紫薯总多酚、总黄酮和总花色苷含量的影响,并对提取物结构进行分析,同时对比了体外抗氧化活性,旨在为紫薯功能化食品热加工及鉴定提供一定的参考。
1 实验部分
1.1 材料、试剂与仪器
紫薯,产自安徽省蚌埠市,于2021年10月收获。
没食子酸、硫酸亚铁、柠檬酸、亚硝酸钠、硝酸铝、水杨酸、过硫酸钾、福林酚、甲醇、硫酸、氢氧化钠、甲基红、溴甲酚绿、盐酸、硝酸铝、亚硝酸钠、碳酸钠、乙酸钠、磷酸氢二钠、磷酸二氢钾、氯化钾、氯化钠、维生素C等,均为分析纯,上海国药集团化学试剂有限公司;芦丁(纯度97%,北京沃凯生物有限公司);2,2-联苯基-1-苦基肼基(DPPH),2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)(纯度大于98.5%,上海Macklin公司)。
GZX-DH.500BS恒温干燥箱(上海跃进医疗器械有限公司);HZK-FA110分析天平(华志(福建)电子科技有限公司);UDK159凯氏定氮仪(意大利VELP公司);JW-3021H离心机(安徽嘉文仪器有限公司);EVOLUTION 220紫外可见光分光光度计(美国Thermo Fisher公司);HH-W600恒温水浴锅(常州迈科诺仪器有限公司);Nicolet iS50 ATR傅里叶红外光谱仪(美国Thermo Fisher公司)。
1.2 实验方法
1.2.1 紫薯营养成分含量的测定
根据《食品安全国家标准 食品中水分的测定》(GB 5009.3—2016)的要求测定紫薯的水分含量。
根据《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5—2016)的要求测定紫薯的粗蛋白质含量。
根据《食品安全国家标准 植物类食品中粗纤维的测定》(GB/T 5009.10—2003)的要求测定紫薯的粗纤维含量。
1.2.2 紫薯待测样液的制备
参考黄彪等[18]的方法,并稍作调整,称取1.000 g磨碎紫薯湿样于棕色玻璃管中,加入含0.1%盐酸的74%的乙醇溶液10 mL,70 ℃恒温水浴箱中提取30 min,冷却到室温,提取液在转速5 000 r/min条件下离心5 min,将上清液转移至蒸发瓶中,残渣重复提取两次,合并提取液。将三次提取液旋转蒸发除去乙醇,后定容至10 mL,得待测样液,样液置于4 ℃条件下冷藏备用。
1.2.3 加热方法
取同批次鲜紫薯,均重(95±5)g,形状相似,洗净,切成2 cm薄片备用。
蒸制:紫薯置于蒸锅内,分别蒸15、25、35、45、55 min。
煮制:紫薯置于蒸锅内,分别煮15、25、35、45、55 min。
烤制:紫薯置于烤箱中,250 ℃分别烤制15、25、35、45、55 min。
热处理后,冷却至室温,按照1.2.2方法制备紫薯待测样液。
1.2.4 总多酚含量的测定
使用福林酚比色法[19],以没食子酸作为标准品。配制1 g/L的没食子酸溶液,移液管移取1.0、2.0、3.0、4.0、5.0 mL至10 mL的容量瓶,定容、摇匀,得到0.1、0.2、0.3、0.4、0.5 mg/mL标准溶液。分别取蒸馏水、标准溶液0.5 mL于25 mL比色管中;加2.5 mL福林酚试剂、摇匀,反应5 min,后加7.5%的Na2CO3溶液2 mL,比色管定容、摇匀;室温静置1 h,于765 nm波长处测得吸光值(OD值)。根据没食子酸浓度与所对应OD值绘制标准曲线:y=1.920x-0.015 6,R2=0.995 6。
取待测样液(1.2.2方法中)0.5 mL于25 mL比色管中,以蒸馏水做空白对照,测定765 nm处的OD值,后代入没食子酸标准曲线计算紫薯样品中总多酚的含量。
1.2.5 黄酮含量的测定
参考DEWANTO等[20]的方法,稍作调整,以芦丁作为标准品。配备0.2 g/L的芦丁溶液,移取1.0、2.0、3.0、4.0、5.0 mL,至10 mL的容量瓶,定容、摇匀,得到0.02、0.04、0.06、0.08、0.100 mg/mL标准溶液。取3 mL标准溶液,加15%的NaNO2溶液1.5 mL,混匀静置6 min,后加5% Al(NO3)3溶液1.5 mL,混匀静置6 min,加4% NaOH溶液20 mL,混匀,于510 nm波长下测OD值,根据芦丁浓度与所对应测得的OD值绘制标准曲线方程:y=1.325x-0.009 7,R2=0.998 5。
取待测样液(1.2.2方法中)3 mL,以蒸馏水做空白对照,按照上述方法,测定510 nm波长处的OD值,后代入芦丁标准曲线计算紫薯样品中黄酮的含量。
1.2.6 总花色苷含量的测定
采用pH示差法[21],测量紫薯当中的花色苷含量。取KCl缓冲溶液9 mL(0.025 mol/L,pH=1.0)、CH3COONa缓冲溶液9 mL(0.400 mol/L,pH=4.5),取1.0 mL待测液(1.2.2方法中)分别加入其中,以蒸馏水做空白对照,分别测定紫薯样液-氯化钾-盐酸缓冲溶液与紫薯样液-乙酸钠-盐酸缓冲溶液在520、700 nm波长处的OD值。按照下列算式进行计算:
C=(A×D×Mw×1 000)/(ε×1),
A=(A520-A700)pH1.0-(A520-A700)pH4.5,
其中,C为样品中花色苷的含量(mg/g),A为最大波长下的吸光度值,D为样品稀释的倍数,ε=26 900,消光系数和分子量Mw以矢车菊素葡萄糖苷计Mw=449.2。
1.2.7 羟基自由基清除能力的测定
参考黄彪等[18]的方法,取待测液(1.2.2方法中)0.5 mL,分别加1 mL 的10 mmol/L的水杨酸-乙醇溶液1 mL 6 mmol/L FeSO4溶液,加1 mL 6 mmol/L H2O2,振荡混合,37 ℃下水浴10 min,于510 nm波长下测量OD值(A1);以无水乙醇代替紫薯待测样液做空白实验,于510 nm波长下测OD值(A0);以无水乙醇替代水杨酸-乙醇溶液、双氧水,加0.5 mL紫薯待测样液,于510 nm波长下测OD值(A2),以0.15 mg/mL维生素C为阳性对照。羟基自由基清除能力(I1)按下式计算:
I1=[1-(A1-A2)/A0]×100%.
1.2.8 DPPH自由基清除能力的测定
参考HU等[6]的方法,取0.5 mL待测液(1.2.2方法中),加0.1 mmol/L的DPPH 1.5 mL,混匀,暗处反应0.5 h,于517 nm波长下测OD值(A1);以0.5 mL无水乙醇代替待测液,于517 nm波长下测量OD(A0),以0.15 mg/mL维生素C为阳性对照。DPPH自由基清除能力(I2)按下式计算:
I2=(1-A1/A0)×100%.
1.2.9 ABTS自由基清除能力的测定
参考黄彪[18]等的方法,ABTS(浓度为7.0 mmol/L)与K2S2O8(2.5 mmol/L)混合,避光、静置12~16 h;用pH为7.4的磷酸盐缓冲液稀释混合液,调整,使其在734 nm波长条件下的OD值为0.7左右,得到ABTS工作液。以蒸馏水做空白,取待测液(1.2.2步骤中)0.5 mL,加ABTS工作液2.0 mL,50%甲醇2.5 mL,混匀、反应6 min,734 nm波长下测OD值(A1);无水乙醇代替待测液,734 nm波长下测OD值(A0);磷酸缓冲液代替ABTS工作液,734 nm波长下测OD值(A2),以0.15 mg/mL维生素C为阳性对照。ABTS自由基清除能力(I3)按下式计算:
I3=[1-(A1-A2)/A0]×100%.
1.2.10 红外光谱分析
紫薯冷冻干燥后,参考张艳玲等[22]的方法,采用红外光谱测定其结构。取1 mg样品和200 mg干燥的溴化钾,以200 mg 溴化钾为空白,充分研磨,压片,后用红外光谱仪在 400~4 000 cm-1范围内扫描样品。
1.2.11 数据处理与分析
每个样品进行3次平行实验,用SPSS 20.0进行显著性(p<0.05)分析,结果采用“平均值±标准差”表示,用Origin 9.0进行作图。
2 结果与分析
2.1 紫薯的主要营养成分
对同一批次的紫薯的水分、蛋白质、粗纤维及总多酚、黄酮和总花色苷的含量进行测定。
由表1可知,紫薯的水分含量为63.62%,蛋白质的含量为2.38%,粗纤维含量为0.58%。紫薯样品的总多酚含量0.771 mg/g,总黄酮含量1.193 mg/g,总花色苷含量1.236 mg/g。黄彪等[18]研究了不同品种紫薯中的总多酚、黄酮和花色苷的含量,结果表明不同品种紫薯鲜样中的抗氧化物质含量有一定的差别,其中总多酚的含量为0.90~1.97 mg/g,黄酮含量为0.32~1.20 mg/g,总花色苷的含量为0.45~0.70 mg/g。紫薯的营养成分因品种及产地的差异呈现出不同程度的区别。
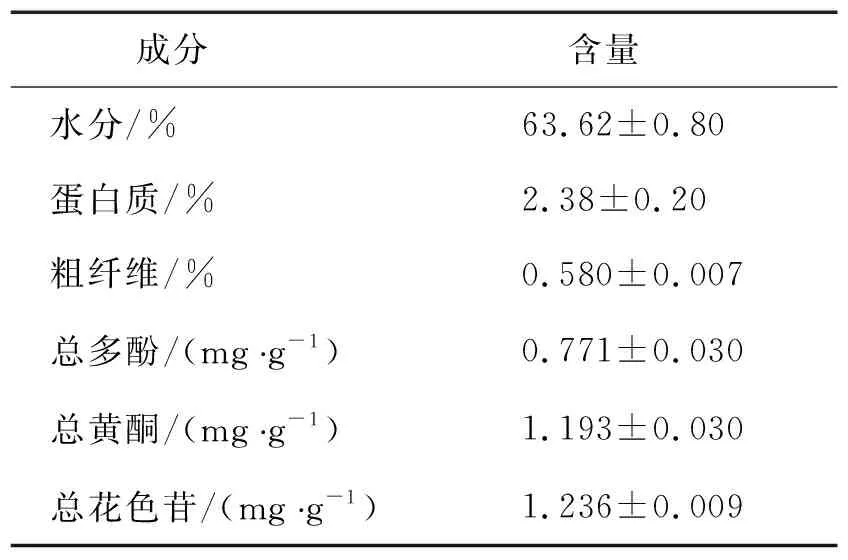
表1 紫薯水分、蛋白质、粗纤维含量及抗氧化物质的含量(鲜重)
2.2 热处理对紫薯抗氧化物质含量的影响
2.2.1 热处理对紫薯总多酚含量的影响
不同的热处理时间对紫薯中的总多酚含量的影响如图1所示。由图1可知,热处理后,总多酚的含量较对照组(未热处理样)均有一定增加,不同热处理对总多酚的含量有不同程度的影响。蒸制15~35 min、煮制15~25 min和烤制15~35 min条件下,总多酚含量与热处理时间呈正相关,分别在蒸制35 min、煮制25 min、烤制35 min时达到最大值,为2.764 mg/g、2.239 mg/g、3.408 mg/g。蒸制时间超过35 min、煮制超过25 min、烤制时间超过35 min后,总多酚的含量随时间增长而下降。热处理后总酚含量的增加可能是由于热作用导致紫薯组织结构的破坏,提高了从细胞基质中酚类化合物的可提取性,并刺激膳食纤维结合多酚的释放,形成游离酚类化合物[23]。FALLER等[24]研究了煮、蒸、微波热处理对马铃薯中酚类化合物的含量影响,指出热处理后酚类化合物的含量分别增加了81.4%、22.8%和80.81%。MOYO等[25]研究指出,煮制增加了总多酚的含量。LO等[26]研究表明,茄子烧烤后总酚含量有所增加。烤制处理,总多酚的含量增加最大,蒸制次之,煮制最小。抗氧化物质含量随热处理方式及时间呈现的变化,可能是由于煮制的时候,紫薯浸没在水中,随着煮制时间的增加,抗氧化物质溶于水而流失。同时抗氧化物质受到加热的影响,随着时间的增加,抗氧化物质受到热破坏而减少。
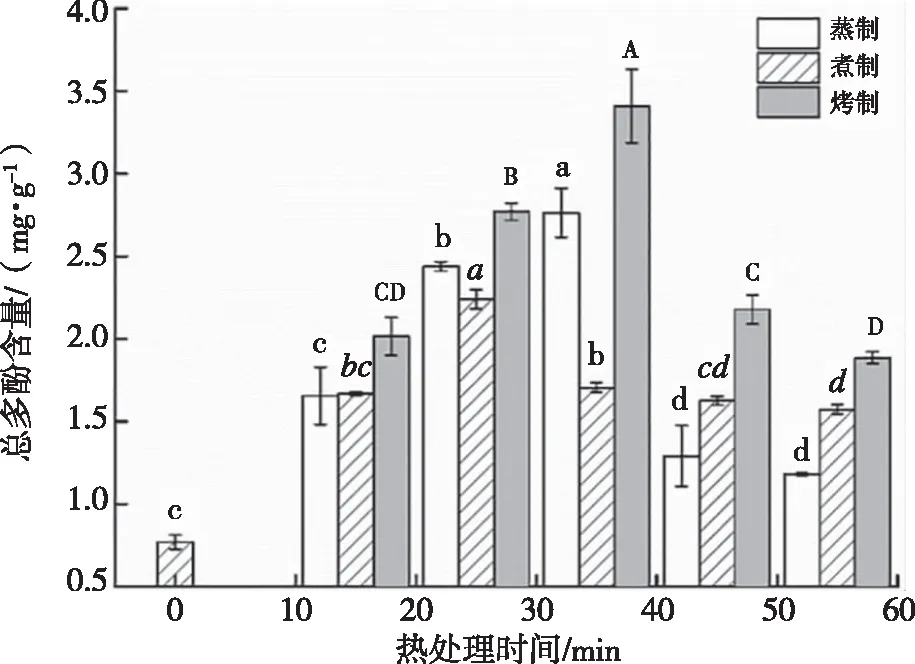
图1 热处理对紫薯总多酚含量的影响
2.2.2 热处理对紫薯黄酮含量的影响
不同热处理时间对紫薯提取物中黄酮含量的影响如图2所示。由图2可知,热处理后,黄酮含量均有一定增加,不同热处理对黄酮的含量有不同程度的影响。蒸制15~35 min、煮制15~25 min和烤制15~35 min条件下,黄酮含量与热处理时间呈正相关,分别在蒸制35 min、煮制25 min、烤制35 min时达到最大值,为6.433 mg/g、4.257 mg/g、5.273 mg/g。当热处理时间过长时,黄酮的含量呈现下降趋势,其可能的原因是黄酮的热降解作用[27]。相比较而言,黄酮在蒸制后其含量的增加较烤制更大,煮制增加量最小。黄酮含量的增加,可能是由于烹饪处理会破坏食物的微观结构,使得黄酮的提取更完全[8]。SINGH等[28]指出,不同植物在煮沸后,由于游离黄酮醇水平的提高,黄酮含量有不同程度(9.5%~410.9%)的增加。黄酮含量的变化与总多酚含量的变化趋势相似(图2)。
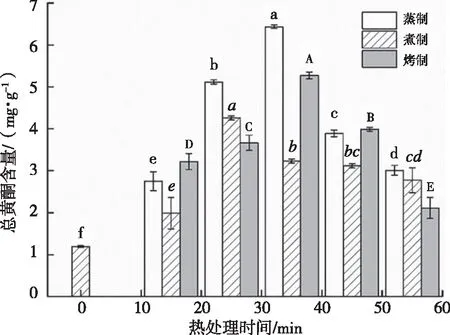
图2 热处理对紫薯黄酮含量的影响
2.2.3 热处理对紫薯总花色苷含量的影响
不同的热处理时间对紫薯中总花色苷含量的影响如图3所示。由图3可知,热处理后,总花色苷的含量均有一定增加,不同热处理对总花色苷的含量有不同程度的影响。烤制后,花色苷的增加量最大,在烤制35 min处达最大,为9.385 mg/g;蒸制次之,在蒸制25 min处达最大,为7.103 mg/g,煮制增加量最小,在煮制25 min时达最大,为5.616 mg/g。热处理导致花色苷含量的不同程度增加的原因可能是热处理改变细胞基质完整性,软化植物组织,增加花色苷的提取率,同时热处理使多酚氧化酶失活,减少花色苷的酶降解损失[29-30]。 花色苷溶于水,煮制相对于蒸制及烤制,其花色苷在煮制的过程中溶于水而使其含量有一定的损失,同时蒸制和烤制条件下,紫薯的含水量下降,这可能也是使花色苷含量增加的原因。LACHMAN等[31]研究指出,红肉马铃薯熟化后总花青素浓度增加。总花色苷含量随温度的变化趋势与多酚及黄酮含量的变化趋势相似(图3)。

图3 热处理对紫薯总花色苷含量的影响
2.3 热处理对紫薯体外抗氧化能力的影响
羟基自由基是活性最强的氧自由基,DPPH是一个在氮桥原子上有一个未配对价电子的自由基,ABTS是另一个自由基,自由基对蛋白质、核酸、脂质等大分子物质有较大的损害性[23]。抗氧化剂对以上自由基的清除被认为是评价抗氧化剂清除自由基活性的方法。抗氧化剂的抗氧化能力与植物的化学物质(酚类、花青素、黄酮、类胡萝卜素等)密切相关[32]。热处理对紫薯自由基清除能力的影响如图4至图6所示。
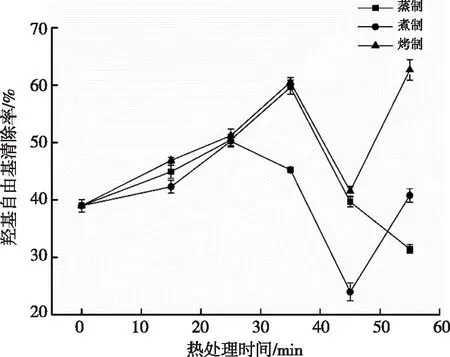
图4 热处理对紫薯的羟基自由基清除能力的影响
由图4可知,热处理后,紫薯的羟基自由基的清除率随热处理时间呈现先增加后降低的趋势。其中,烤制和蒸制较煮制的清除率增加幅度更大,较之紫薯鲜样(对照组)的清除率(38.98%),分别在蒸制35 min、煮制25 min、烤制55 min达到最大值,分别为59.64%、50.23%、62.65%,显著高于阳性对照组(0.15 mg/mL维生素C)的清除率(34.20%)。羟基自由基清除率随热处理时间的变化与总多酚、黄酮及花色苷的变化趋势呈现一定的正相关。煮制及烤制55 min时,其清除率有所提高,可能与其他抗氧化物质的生成有关。
由图5可知,紫薯对DPPH自由基的清除率随热处理时间的变化与其对羟基自由基清除率的变化趋势相似。较之紫薯鲜样(对照组)的DPPH自由基清除率(39.93%),分别在蒸制35 min、煮制25 min、烤制25 min达到最大值,分别为61.19%、57.28%、62.69%,略小于阳性对照组(0.15 mg/mL维生素C)的清除率(80.40%),随后清除率总体呈现下降的趋势。

图5 热处理对紫薯的DPPH自由基清除能力的影响
由图6可知,紫薯的ABTS清除率在不同的蒸制条件下呈现较大的差异。蒸制和煮制,其ABTS自由基的清除率呈现相似的变化趋势,较之紫薯鲜样(对照组,76.15%)分别在35 min、25 min处达到最大,为87.70%、86.45%,接近阳性对照组(0.15 mg/mL维生素C)清除率(90.32%)。随着蒸煮时间的延长,其ABTS自由基的清除率开始下降。蒸煮方式下,ABTS自由基的清除率的变化趋势与抗氧化物质的含量的变化趋势相似。烤制条件下,紫薯ABTS自由基的清除率随烤制时间的增加而增加,0~25 min增加明显,25~55 min增加幅度较小,这可能与烤制导致的美拉德反应、焦糖化反应有关。

图6 热处理对紫薯的ABTS自由基清除能力的影响
热处理后,紫薯的抗氧化活性的增加,可能是与热处理引起的紫薯抗氧化成分含量的变化及组成有关。HU等[6]研究不同品种紫薯的抗氧化活性,结果表明,不同品种提取物中花青素的组成和含量对其生物活性有显著影响。同时加热可能会引起许多化学反应,如美拉德反应、焦糖化、酯和糖苷的降解或水解,从而产生新的抗氧化剂。
2.4 提取物结构鉴定

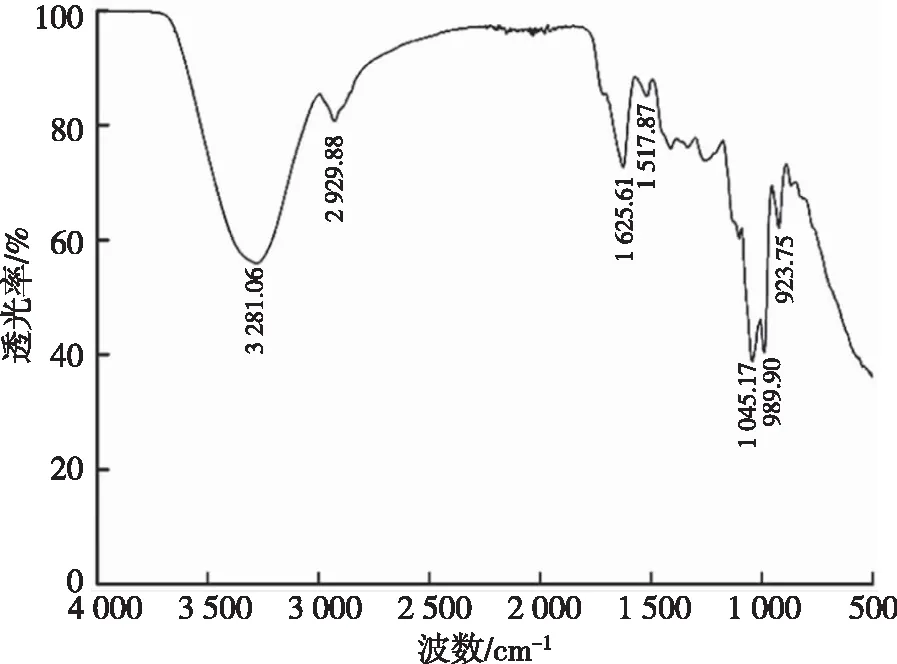
图7 紫薯提取物的红外光谱图
3 结论
本研究采用三种常用的家庭热处理方式分别加热紫薯,考察紫薯的总多酚、黄酮、总花色苷的含量及羟基自由基、DPPH自由基、ABTS自由基的清除率的变化及提取物结构,获取了合适的热处理方式。蒸制35 min、煮制25 min、烤制35 min条件下,紫薯提取物抗氧化物质含量分别达最大值,抗氧化活性较高,紫薯感官评价良好。适当的热处理方式,有助于促进紫薯纤维素成分的断裂和基质的软化,促进抗氧化物质在肠胃中的吸收。过长时间的热处理,不利于紫薯抗氧化物质的保留,同时造成一定的资源浪费。

