基于肠肝轴研究肠道菌群与非酒精性脂肪性肝病的相关性*
周 芳 杨建美 龚承先 郭玉飞 张 雪 屈银宗
非酒精性脂肪性肝病(Non-alcoholic Fatty Liver Disease,NAFLD)又称非酒精性脂肪肝,是指除外酒精和其他明确的肝损害因素所致的,以弥漫性肝细胞大疱性脂肪变为主要特征的临床病理综合征。其发病机制复杂,包括遗传因素和表观遗传因素、饮食因素、胰岛素抵抗、脂毒性、促炎因子以及肠道微生物组在内的“多重打击”学说被广泛接受用于解释NAFLD 的代谢及分子机制[1]。近年来,基于中医“肝脾同病,肝病治脾”基础理论,围绕肠肝轴治疗NAFLD的研究越来越多,但仍缺乏深入的分子生物学研究。本项目基于肠肝轴研究肠道菌群、5-羟色胺(5-hydroxytryptamine,5-HT)、肝细胞核因子 4α(Hepatocyte Nuclear Factor 4α,HNF4 α)与NAFLD(肝郁脾虚证)的相关性,为临床疏肝健脾治疗NAFLD(肝郁脾虚证)提供科学依据。
1 资料与方法
1.1 一般资料选取45例2021年9月—2022年9月湖北省中西医结合医院消化内科门诊就诊的NAFLD(肝郁脾虚证) 患者,另设健康对照组45例,来源于湖北省中西医结合医院体检中心健康体检人群。NAFLD(肝郁脾虚证)组:男 31例,女14例;年龄(49±5.30)岁;身体质量指数(24.51±2.37) kg·m-2。健康对照组:男30例,女15例;年龄 (50±4.80) 岁,身体质量指数(25.03±2.09) kg·m-2。2组一般情况比较,差异无统计学意义(P<0.05)。本研究经湖北省中西医结合医院伦理委员会同意。所有患者均自愿加入本研究并签署知情同意书。
1.2 诊断标准西医诊断标准:西医诊断标准及非酒精性脂肪性肝病轻、中、重度分级参照《非酒精性脂肪性肝病防治指南(2018更新版)》[2]拟定。中医诊断标准:中医诊断标准参照《非酒精性脂肪性肝病中医诊疗专家共识意见(2017)》[3]中肝郁脾虚证标准拟定。
1.3 纳入标准①符合NAFLD(肝郁脾虚证)中医诊断标准和西医诊断标准;②年龄18~65岁。
1.4 排除标准①合并有严重的心肝肾疾病;②近4周服用影响血脂代谢药物;③近4周服用影响肠道菌群的药物;④合并肠道疾病,如炎症性肠病、肠易激综合征等。
1.5 观察指标
1.5.1 粪便菌群情况用统一发放的粪便采集杯分别无菌收集2组新鲜粪便样本2~5 g,于-80 ℃冰箱保存。提取总RNA,在Illumina Hiseq2500测序平台(厂家:Illumina,型号:2500)进行16S rRNA 高通量测序及肠道菌群多样性分析,分别检测2组大便肠球菌、大肠杆菌、乳酸杆菌、双歧杆菌拷贝数。
1.5.2 血清5-HT水平分别采集2组空腹外周血5 ml,经离心处理(2800 r/min)离心时间12 min,离心半径9 cm,按照试剂盒要求采用酶联免疫吸附法测定2组血清中5-HT的情况。
1.5.3 NAFLD(肝郁脾虚证)患者肝脏组织HNF4α的表达情况45例NAFLD(肝郁脾虚证)患者在超声引导下经皮肝脏穿刺吸取活组织,进行肝脏脂肪含量测定及病理检查。根据肝脏脂肪含量测定结果参照《非酒精性脂肪性肝病防治指南(2018更新版)》[2]标准将NAFLD患者分为轻度、中度、重度3组。按照免疫组化染色试剂盒要求,在显微镜下10×10视野观察各组标本,以细胞浆出现棕黄色颗粒为阳性。每张切片镜下随时选取5个视野观察阳性产物分布、染色情况。对每例切片,按照半定量积分法判断结果。此部分将会由湖北省中西医结合医院2名经验丰富的病理科医生阅片完成,2人结论一致时则记录结果,当出现争议结果的时候,则请第3名病理科医生进行阅片,以2个意见相同者为准。

2 结果
2.1 2组患者肠道菌群拷贝数比较与健康对照组比较,NAFLD(肝郁脾虚证)组肠道中肠球菌、大肠杆菌明显增多,乳酸杆菌及双歧杆菌均明显减少,差异具有统计学意义(P<0.05)。见表1。

表1 2组患者肠道菌群拷贝数比较
2.2 2组患者血清5-HT水平比较与健康对照组比较,NAFLD(肝郁脾虚证)组血清中5-HT的水平明显更高,差异具有统计学意义 (P<0.05)。见表2。
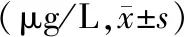
表2 2组患者血清5-HT水平比较
2.3 NAFLD(肝郁脾虚证)组患者肝脏组织HNF4α表达比较根据肝脏组织学活检将45例NAFLD(肝郁脾虚证)患者分为轻、中、重组,观察各组肝脏组织HNF4α阳性积分,发现随着NAFLD患者疾病严重程度的递增,HNF4α阳性积分逐渐减少,NAFLD重度组与轻度组、中度组比较差异具有统计学意义(P<0.05),NAFLD中度组与轻度组比较差异无统计学意义(P>0.05)。见表3。
2.4 NAFLD(肝郁脾虚证)与肠道菌群/5-HT/HNF4α的相关性分析NAFLD(肝郁脾虚证)患者肠道菌群与血清5-HT相关性分析发现,肠球菌、大肠杆菌与5-HT呈正相关(r=0.7532,P<0.05;r=0.9216,P<0.05);乳酸杆菌、双歧杆菌与5-HT呈负相关(r=-0.8228,P<0.05;r=-0.8543,P<0.05)。见图1。肠道菌群与肝脏HNF4α相关性分析发现,肠球菌、大肠杆菌与HNF4α呈负相关(r=-0.7567,P<0.05;r=-0.5628,P<0.05);乳酸杆菌、双歧杆菌与HNF4α呈正相关(r=0.4235,P<0.05;r=0.4887,P<0.05)。见图2。血清5-HT与肝脏HNF4α的相关性分析发现,两者呈负相关(r=-0.6858,P<0.05)。见图3。提示,肠道菌群失调与血清5-HT分泌、肝脏HNF4α表达存在相关性。
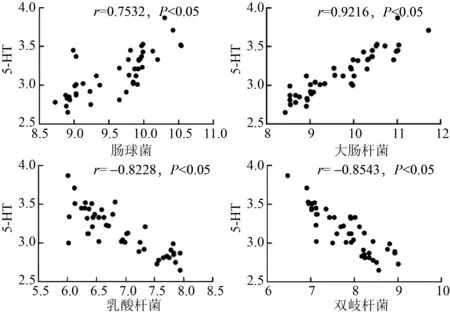
图1 NAFLD(肝郁脾虚证)患者肠道菌群与血清5-HT的相关性分析

图2 NAFLD(肝郁脾虚证)患者肠道菌群与肝脏HNF4α的相关性分析

图3 NAFLD(肝郁脾虚证)患者血清5-HT与肝脏HNF4α的相关性分析
3 讨论
随着人类饮食结构和生活习惯的改变,NAFLD的发病率逐渐升高,已经成为全球最普遍的肝脏疾病之一。流行学研究表明:全球NAFLD患病率高达25.24%,当前中国患病率约为 29.2%,且年发病率约为 5.0%,处于不断增长中[3]。因其临床表现隐匿而不被人们重视,但其随着疾病进展不仅能损害肝细胞功能,还对机体其他多个器官功能产生影响,逐渐发展为肝纤维化、肝硬化、肝衰竭甚至肝癌等,严重威胁人类健康,也同时给社会经济带来了沉重负担,已经成为全球主要的慢性肝病和公共卫生问题。针对NAFLD的西医治疗,早先认为通过体育锻炼及饮食控制即可,后逐渐认识到单纯控制肝脏脂肪变是不能逆转肝纤维化的发生,药物治疗无法代替,但所用药物一般是保肝、降脂、抗氧化等药物,缺乏抗肝纤维化或者逆转肝纤维化功效。然而,中医学能从整体出发,在NAFLD的治疗上具有独特优势。
肠肝轴理论是1998年由马歇尔教授首次提出,是指肠道微生物群和肝脏通过门静脉循环相互交流的复杂网络,该理论来源于胃肠道与肝脏之间密切的解剖及生理关系[4]。近年来,针对肠道微生物与肝脏疾病的研究越来越多,已经成为未来肝病领域研究热点。肠肝轴平衡的维系与肠道微生物及肠道屏障、胆汁酸代谢等密切相关,且各因素之间相辅相成[5]。一旦肠道微生态构成和功能改变,肠道黏膜的屏障功能受损,其通透性发生改变,肠道内细菌及其代谢产物则可以通过门静脉到达肝脏,干扰胆汁酸代谢,激活肝脏固有免疫系统,进而释放一系列炎性因子和血管活性物质,启动氧化应激、内质网应激,引起肝细胞变性坏死及凋亡[6-8],这些物质亦会反向造成肠道黏膜损伤,由此形成恶性循环,与NAFLD的发病及预后密切相关。其中肠道菌群产生的色氨酸代谢产物是微生物群落和宿主-微生物之间沟通的重要信号分子,可能有助于维持肠道和全身稳态[9]。5-HT由色氨酸代谢而来,其可通过与肠道、肝脏等不同组织器官间各型5-HT受体(5-HT receptor,5-HTR)相结合发挥调控作用。当5-HT结合肝脏5-HTR后可降低如肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、 核因子κB(Nuclear factor kappa-B,NF-κB)等的水平、调节肝巨噬细胞的免疫,抑制炎症反应,从而避免肝脏受到多种因素攻击,是目前调控5-HT信号系统防治NAFLD的重要机制之一[10]。另外,5-HT也作为一种神经递质调控着人体情绪,这与中医“肝主疏泄,调情志”理论不谋而合。
HNF4a是一种配体依赖性转录因子,属于高度保守的核受体超家族一员,在肝脏中强势表达,是肝细胞重要的标志物[11]。在肝脏,HNF4α能够参与肝脏结构形成以及胆汁、氨基酸、糖代谢、脂肪代谢等过程,维持肝肠稳态,防止饮食诱导的NAFLD形成和进展,其表达缺陷可引起肝细胞形态和功能分化的异常改变[12];在肠道, HNF4α又是重要的肠道黏膜屏障功能基因,可调控肠上皮细胞的增殖、分化、凋亡,维持肠道黏膜菌群的稳态[13,14]。
中医学中并没有NAFLD的病名,属于“肝着、痞满”等范畴,中医认为NAFLD的发病与饮食失调、情志失常、劳逸失度等因素有关,这些因素可导致肝失疏泄、脾运失健,痰湿内蕴、瘀血阻络,肝脾同病、肝郁、脾虚、痰浊、痰瘀为其基本病机,发病部位主要为肝、脾,治疗上,《金匮要略》提出“肝病实脾”基础理论。五行中肝属木,脾属土,两者在生理上互相依赖,在病理上互相影响,肝主疏泄,脾主运化,只有脾气健运,才能布散水谷精微,滋养肝脏,肝得以疏泄,痰湿、瘀血得散,因此强调在治肝的同时先调脾,肝脾同治。有研究表明,肠肝轴功能紊乱是肝脾同病的病理基础,而中医针对肝郁脾虚型NAFLD应用疏肝健脾法治疗的现代机制或在于调节肠肝轴,通过肠肝轴这一靶点使水谷精微得以布散全身,进而调节全身脂质代谢治疗非酒精性脂肪性肝病[15,16]。
基于NAFLD肠肝轴功能紊乱,以及色氨酸代谢产物5-HT与肝脏HNF4α在肠道菌群、肝脏代谢的重要作用,推测肝脏HNF4α表达与肠道5-HT分泌的失调可能为肠肝轴功能紊乱的内在机制。而肠肝轴作为肝脾同病的病理基础,肝脾同病作为NAFLD的中医发病基础,亦推测NAFLD肝郁脾虚证可能与肠道菌群、5-HT、HNF4α存在必然关系,进而参与NAFLD(肝郁脾虚证)的发病。
本研究发现,NAFLD(肝郁脾虚证)患者存在肠道菌群失调,与健康对照组比较NAFLD(肝郁脾虚证)组血清中存在差异表达的5-HT(P<0.05),肝脏组织中HNF4α存在差异表达,并且差异表达的HNF4α随着NAFLD严重程度的增加,肝脏HNF4α的表达是减少的(P<0.05)。相关性分析发现,肠道菌群失调与血清5-HT分泌、肝脏HNF4α表达存在相关性。表明了肠道菌群紊乱、肝脏HNF4α表达与肠道5-HT分泌的失调可能为NAFLD(肝郁脾虚证)肠肝轴功能紊乱相关。肝脾同病的机制内涵,将肠肝轴概念具体化,为下一步临床应用疏肝健脾法治疗NAFLD (肝郁脾虚证)提供了科学依据。
此研究存在一定局限性,一是研究所用肠道菌群多样性不足;二是差异表达的肠道菌群、5-HT、HNF4α参与NAFLD(肝郁脾虚证)发病的具体机制不明确。下一步将展开具体研究,探寻具有代表性的菌群,研究肠道菌群失调与差异分泌的5-HT、差异表达HNF4α是通过何种机制参与NAFLD(肝郁脾虚证)的发病,揭示临床疏肝健脾治疗NAFLD(肝郁脾虚证)的科学内涵。

