子宫内膜异位症相关性卵巢癌的临床特征列线图
王媛媛,李颖颖,马克青,高 雅,常丰华,封全灵(郑州大学第三附属医院妇科,河南 郑州 450052)
子宫内膜异位症相关性卵巢癌(endometriosis-associated ovarian cancer,EAOC)是一类在组织学上和子宫内膜异位症(endometriosis,EMs)密切相关的卵巢癌[1]。在一项长达14年的前瞻性研究中,研究者们发现EMs患者后期卵巢癌的发病率为1.90%~18.70%,认为EMs与卵巢恶性肿瘤之间具有潜在关联,也有学者称EMs是卵巢癌的癌前病变[2-3]。EAOC作为卵巢癌的一种特殊类型,预后往往相对较好,80%的患者5年内可保持病情无进展,5年内总体生存率高达85%[4]。目前临床上EAOC确诊主要依靠手术+病理阅片,但漏诊率常因肿瘤的“燃尽效应”及医生阅片时对EMs病灶的忽视而增加,难以与一般类型的卵巢癌相鉴别[4-5]。本研究主要通过收集患者的一般临床资料,探索可鉴别EAOC与non-EAOC的相关指标,初步构建鉴别诊断EAOC的列线图,为EAOC的病理阅片反向提供临床支持,进一步为疾病的诊疗、临床指导等提供参考依据。
1 对象与方法
1.1 对象
选择2005年1月至2021年12月于郑州大学第三附属医院确诊为卵巢透明细胞癌与卵巢子宫内膜样腺癌90例患者为研究对象,将其分为EAOC组(23例)及non-EAOC组(67例)。EAOC诊断应符合下述条件之一[6]:①EMs和卵巢癌存在于同侧卵巢,无论是否存在病理连续;②卵巢癌与EMs发生于对侧卵巢或是子宫、输卵管、肠道等性腺外器官。定义:黏连分级参考1996年美国生殖医学会黏连改良的分级标准[7]。纳入标准:①本院初次手术,并经过两个以上高年资病理医师阅片;②原发性恶性肿瘤;③病史资料完整;④无其他影响肿瘤标志物水平的疾病。排除标准:①临床信息不全者;②其他转移性恶性肿瘤;③术前有放化疗病史;④合并严重心脑血管或肝肾器质性病变者。
1.2 方法
1.2.1 临床资料收集 收集资料:①一般资料如年龄、结婚年龄、初潮年龄、孕产次、超声下肿块大小(最大截面),结合带完整,绝经状态、合并子宫良性病变(肌瘤或息肉)、直系亲属癌症史及首发症状;②炎症指标如中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)、单核细胞/淋巴细胞比值(monocyte-to-lymphocyte ratio,MLR)、血小板×中性粒细胞/淋巴细胞比值(severity of illness index,SII)、单核细胞×中性粒细胞/淋巴细胞比值(systemic inflammation response index,SIRI);相关肿瘤标志物CA153、CA199、CA125、HE4、ROMA指数指标;③术后病理特征包括FIGO分期、腹水、中重度盆腔黏连、淋巴结转移指标。

2 结果
2.1 不同临床特征比较
两组患者在年龄、结婚年龄、孕产次、直系亲属癌症史、超声下肿块大小、结合带完整性方面差异无明显统计学意义(P>0.05)。EAOC组患者初潮年龄[(13.35±1.23)岁]较non-EAOC组[(14.69±2.52)岁]小,且多处于未绝经状态,差异有统计学意义(P<0.05)。EAOC组中合并子宫良性病变的患者较non-EAOC组多(78.3%vs41.8%),存在统计学意义(P<0.05)。EAOC首发症状以痛经或不规则出血为主,而non-EAOC临床上多以发现包块或腹痛腹胀等不适表现为主(P<0.05,表1)。
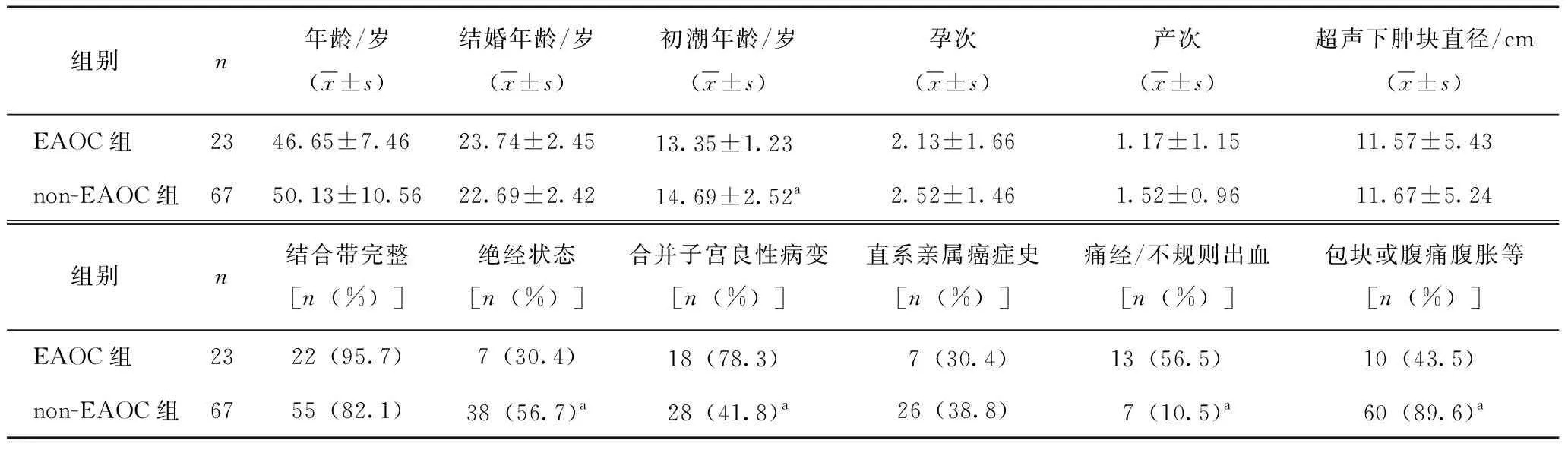
表1 两组患者临床资料比较
2.2 两组患者实验室指标比较
与non-EAOC组相比,EAOC组患者SII、SIRI、HE4水平及ROMA指数较低,差异有统计学意义(P<0.05);两组患者相关炎症指标如NLR、PLR、MLR及其他肿瘤指标物CA153、CA199及CA125差异无统计学意义(P>0.05,表2)。
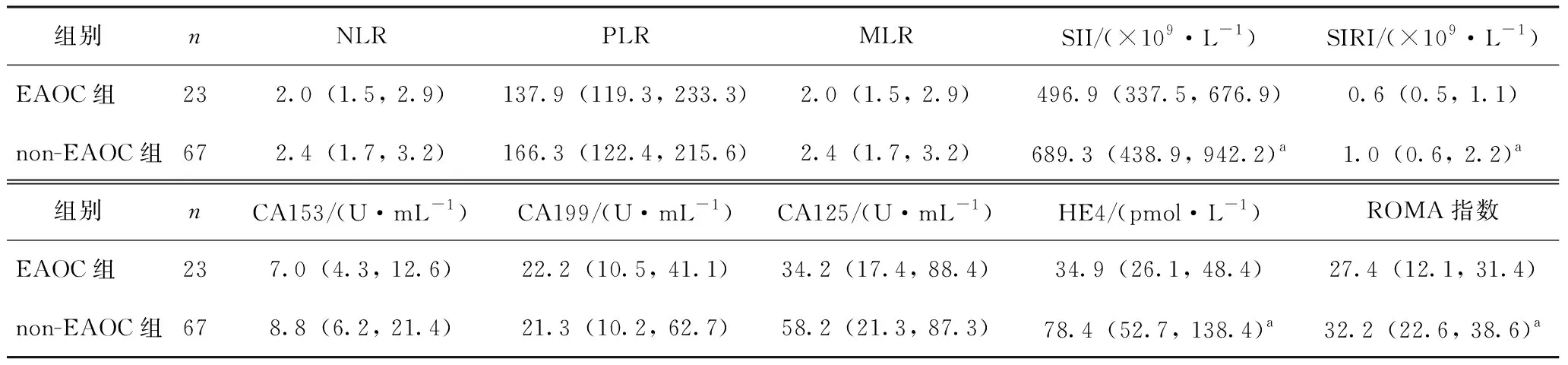
表2 相关炎症指标及肿瘤标记物比较[M(Q1,Q3)]
2.3 EAOC相关危险因素的logistic回归分析
将单因素分析中有统计学意义的因素纳入多因素logistic回归分析。分析发现绝经状态(OR=0.135,95%CI:0.027~0.664)、合并子宫肌瘤或息肉(OR=14.426,95%CI:2.553~81.499)、痛经或不规则出血(OR=4.682,95%CI:0.933~23.500)、ROMA指数(OR=0.948,95%CI:0.901~0.998)为疾病独立影响因素(表3)。

表3 EAOC高危特征的多因素logistic回归分析
2.4 列线图的建立及模型的评估
整合表3筛选出来的EAOC高危因素,构建EAOC诊断列线图模型(图1)。采用Brier评分评估模型的区分度和校准度,可见ROC曲线下面积(area under the curve,AUC)为0.896,Brier评分为0.108分(图2),提示该模型有较好的预测能力及精准度。由DCA曲线(图3)可见,当阈值率为0.1~0.7时,列线图预测的临床净收益大于“全干预”和“不干预”,提示列线图具有较好的临床适用性。
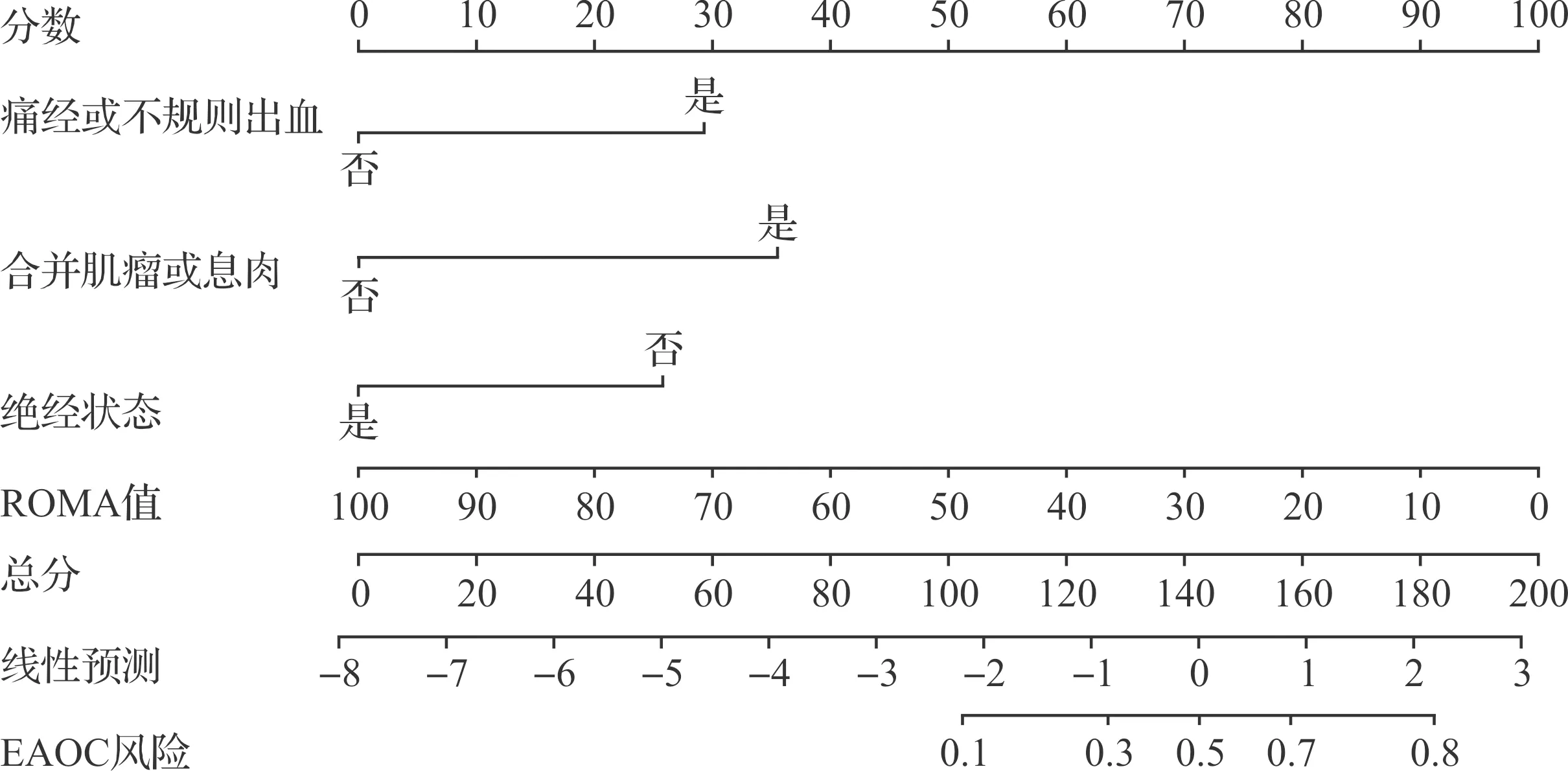
图1 诊断EAOC的列线图模型
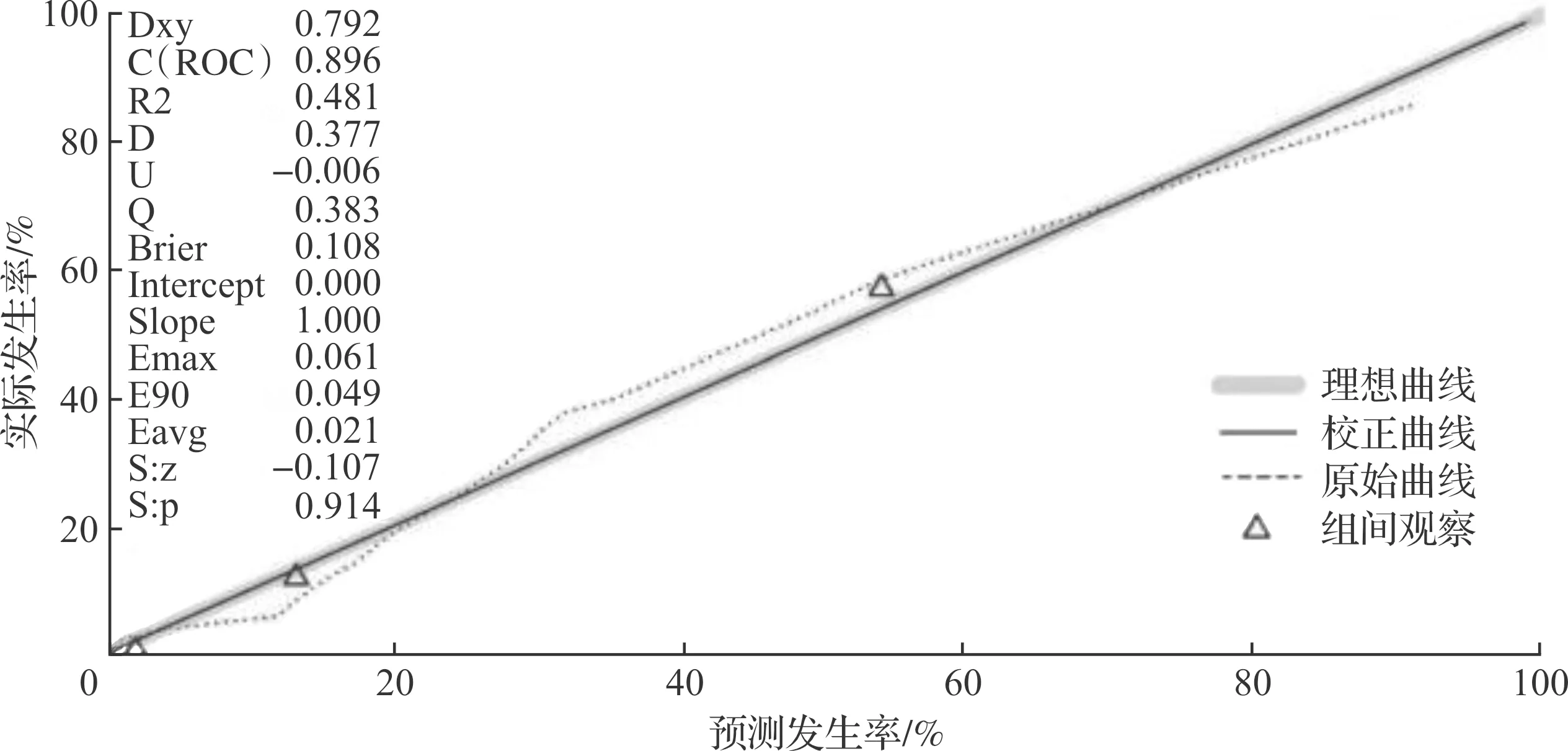
图2 列线图模型的Brier评分
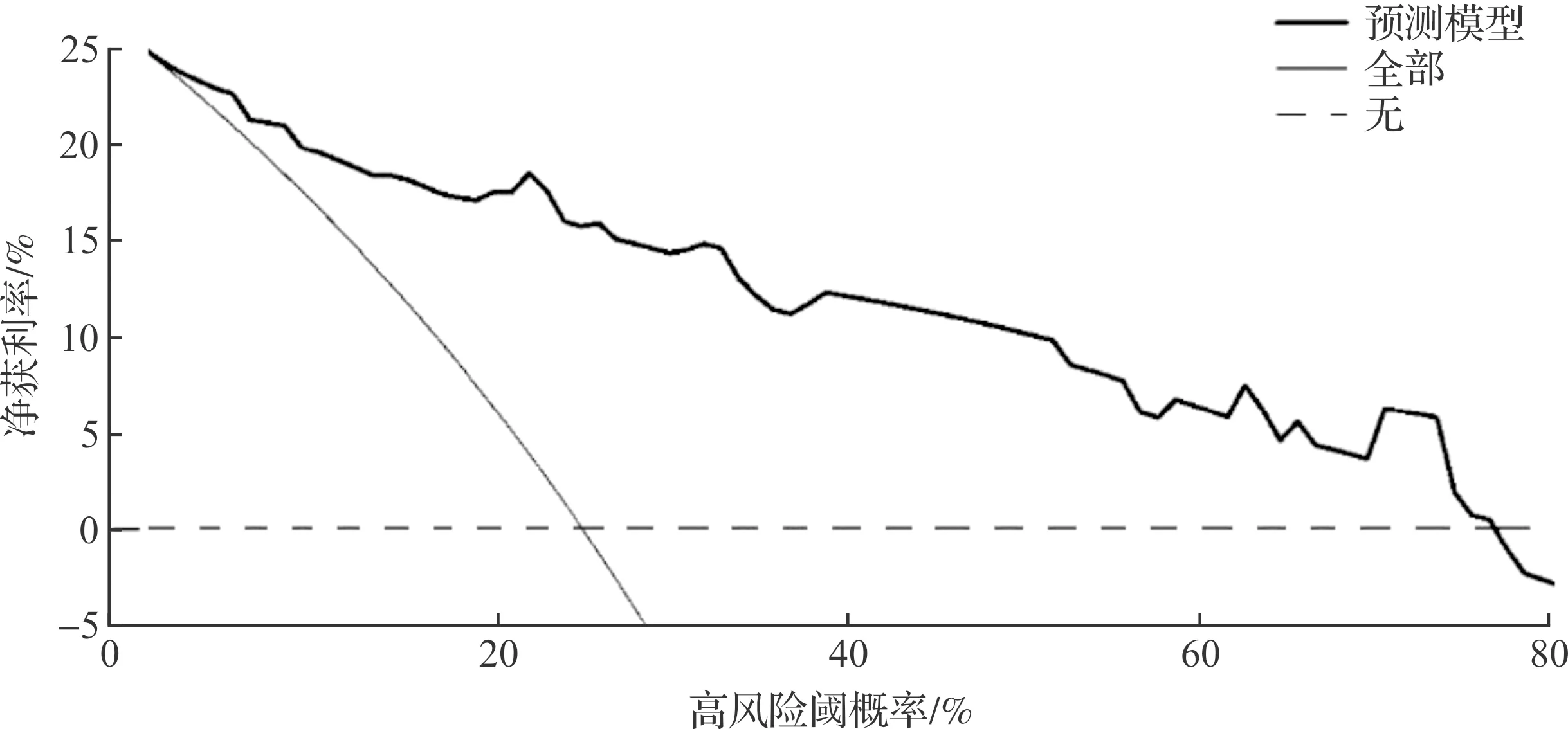
图3 列线图DCA曲线
2.5 两组患者病理资料比较
两组患者在病理分期上差异有统计学意义(P<0.05),EAOC患者临床分期较non-EAOC组早;但两组在病理类型、发病侧别、是否合并腹水、中重度盆腔黏连及淋巴结转移方面无差异(P>0.05,表4)。
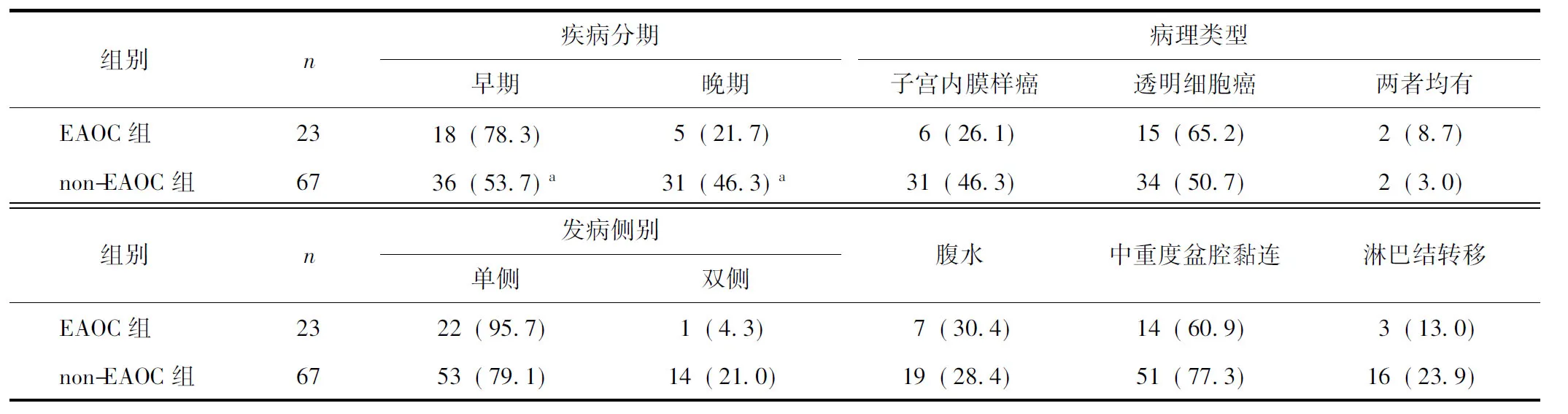
表4 两组患者病理资料比较 [n(%)]
3 讨论
既往研究发现,EMs可以在多种因素的影响下恶变为EAOC[8],目前已知的发生机制有以下几种:①氧化应激反应:内膜剥脱出血释放的铁离子刺激组织细胞生长失衡;②炎症反应机制:TNF、IL的产生促进肿瘤的转移,同时也抑制机体的免疫反应[9];③雌激素过度表达:促进内膜的增殖、侵袭,同时损伤细胞DNA向恶性转化[10];④环境因素:如二噁英明确具有致癌作用;⑤分子遗传学:PTEN、ARIDIA抑癌基因的失活,bcl-2等相关凋亡基因的功能下降[11],KRAS和PI3K激活致癌通路,miRNAs某些分子表型如miR-342的靶向刺激,还有某些尚不清楚发生机制的分子与恶变相关:如TSPAN1及HNF1B的过表达。其中氧化应激反应可通过影响抑癌基因的失活甚至凋亡来发挥作用。
本研究发现EAOC患者多未绝经,常合并子宫肌瘤或息肉良性病变,这与《子宫内膜异位症诊治指南(第三版)》[1]及包媛媛等[12]的报道相符。EAOC组初潮年龄较小,可能与初潮早增加经血逆流的概率、增加EMs风险有关。上文结果显示EAOC首发症状多以痛经或不规则出血为主,non-EAOC多以发现包块及腹痛、腹胀等不适表现为主(P<0.05)。推测EAOC出现上述症状与其EMs起源相关,EMs患者常见临床表现即为痛经与不规则出血[1]。相比而言,non-EAOC患者早期往往没有明显症状提示,多在晚期出现腹痛、腹胀表现,与消化系统疾病不易区分。在既往研究中,研究者们根据卵巢癌的不同发展模式构建了“卵巢癌二元论模型”;由EMs发展而来的EAOC多属于Ⅰ型卵巢癌,相对惰性,往往侵袭性和播散性较低[2,13]。本研究推测除却本质上两组发病机制的区别,临床症状不典型、就诊时间延长也可能是non-EAOC患者分期较晚的影响因素。
SII、SIRI代表体内不同的炎症免疫途径,血小板、单核细胞和中性粒细胞介导的促炎症反应增加,淋巴细胞介导的抗炎反应微弱或被抑制,促进了肿瘤细胞的侵袭和转移,且两者可提示癌症的预后[14-15]。既往文献报道肿瘤标记物HE4、ROMA指数诊断卵巢癌的效能较高,且肿瘤标记物的水平与患者无进展生存期成负相关[16];本研究发现,EAOC组HE4及ROMA指数均低于non-EAOC组,差异有统计学意义(P<0.05),这与EAOC预后较好以及本研究中两组患者的病理分期结果相符。且通过分析列线图可见,若患者以“痛经或不规则出血”为主诉、询问病史处于未绝经状态、患者同时“合并肌瘤或息肉”,结合ROMA指数临床医生应考虑EAOC诊断(AUC=0.898,P<0.05)。因条件限制,文章采用的回顾性研究所固有的偏差是本研究的局限性,该列线图模型需要更多的机构样本来做进一步临床验证。
综上所述,EAOC患者与non-EAOC患者有较多相似的临床特点,但依旧有其独特的临床特点及病理特征,临床上需要仔细判别两者之间的区别。临床医生应与病理医师加强合作,努力构建EAOC“临床+手术+病理”的诊断模式,提高对EAOC的诊断意识。

