达芬奇机器人系统治疗子宫内膜癌415例分析
翟梁好,董 健,荆 茹,周福兴,魏 莉,陈必良(空军军医大学西京医院妇产科,陕西 西安 710032)
子宫内膜癌作为女性常见的恶性肿瘤,在欧美等发达国家已成为严重危害女性健康的一大杀手[1]。在某些发达国家,其发病率居女性肿瘤的第四位,死亡率居第六位。子宫内膜癌与肥胖的关系非常密切,肥胖被认为是其独立危险因素[2-3]。在过去 30 年中,由于子宫内膜癌的危险因素(特别是肥胖和人口老龄化)在人群中日益常见,子宫内膜癌的总发病率上升了132%[4]。随着亚洲人群的生活水平提高和饮食习惯西方化,亚洲地区子宫内膜癌的发病率逐年上升,出现年轻化、高侵袭性、低分化等趋势,严重危害亚洲女性的生命健康[5]。
近年来,与机器人相关的技术得到改善有关,选择达芬奇机器人手术治疗的子宫内膜癌患者增多[6]。已有大量文献报道,与传统腹腔镜和开腹手术方式相比,使用达芬奇机器人手术治疗子宫内膜癌在手术时间、术中出血量、术后恢复时间和手术并发症等方面更具优势[7-9]。但是关于机器人手术治疗子宫内膜癌的长期生存预后分析少见报道。为进一步明确机器人辅助下手术治疗子宫内膜癌的应用优势和长期预后情况,本文就415例接受达芬奇机器人手术治疗的子宫内膜癌患者的临床资料和生存预后进行分析,旨在探讨达芬奇机器人手术在治疗子宫内膜癌中的优势。
1 对象与方法
1.1 对象
选取2014年5月至2020年12月在空军军医大学西京医院妇产科接受达芬奇机器人手术治疗的子宫内膜癌初治患者。纳入标准:术前病理诊断为子宫内膜癌,病历资料完整,经知情同意,自愿选择达芬奇机器人手术,随访记录完整。排除标准:①合并严重心、肺疾病及肝、肾功能不全者;②患严重精神疾病或不能配合者;③严重凝血功能障碍或血液病者;④不能耐受麻醉和手术者;⑤存在转移性肿瘤及其他恶性肿瘤者。本研究共纳入415例患者,一般资料见表1。

表1 415例达芬奇机器人系统治疗子宫内膜癌患者一般资料
1.2 方法
1.2.1 术前准备 完善术前检查:包括消化系彩超、泌尿系彩超、血生化及肿瘤标志物等。所有患者术前均接受腹部MRI或计算机断层扫描进行临床分期。详细检查心肺状况、腹部手术史和并发症,决定合适的手术方法,制定围术期管理计划,与患者及家属交代病情并告知手术风险,签署知情同意书。
1.2.2 手术方法 所有患者均行子宫全切联合输卵管卵巢切除术、子宫根治性切除术联合输卵管卵巢切除术、前哨淋巴结活检有无盆腔主动脉旁淋巴结清扫。低风险子宫内膜癌患者接受子宫全切术、输卵管卵巢切除术和前哨淋巴结活检;高或中风险子宫内膜癌患者可采用全子宫切除、输卵管卵巢切除术、双侧盆腔淋巴结切除术和腹主动脉旁淋巴结切除术。使用达芬奇机器人手术系统及配套设施,具体装机及操作方法见参考文献[10-11]。
1.2.3 观察指标 ①手术用时、术中出血量;②收集手术病理信息,如病理分型及分化程度、淋巴结切除数量、淋巴结转移数目;③术后情况:围术期并发症(肠梗阻、出血、感染、静脉血栓),术后肛门排气时间,术后住院时间;④长期随访患者,主要随访结局事件为死亡,次要终点为肿瘤复发,随访截止时间为2022年5月。

2 结果
2.1 纳入患者一般资料
子宫内膜癌患者平均发病年龄(53.34±9.35)岁,纳入患者最小年龄26岁,最大年龄83岁;平均BMI(25.14±3.89)kg/m2,其中肥胖患者(BMI>28 kg/m2)80例(19.28%);有盆腔手术史(结扎术/剖宫产术/输卵管切除术/卵巢囊肿剥除术)的患者186例(44.82%);未生育患者23例(5.54%);合并代谢综合征患者133例(32.05%),其中兼有高血压和糖尿病患者30例(7.23%),单纯高血压患者79例(19.04%),单纯糖尿病患者24例(5.78%)。
2.2 围术期情况
415例达芬奇机器人手术均顺利完成,无中转开腹。手术平均时间(178.44±54.07)min;平均术中出血量(57.90±43.63)mL;平均淋巴结切除数目(22.32±8.25)枚;术后并发症9例(2.17%),其中感染2例、下肢静脉血栓5例、肠梗阻2例,经积极治疗均治愈;平均术后肛门排气时间(1.01±0.34)d,平均术后住院时间(5.79±1.57)d。根据BMI、年龄、有无合并代谢综合征等临床特征分组,分析其对机器人手术的围术期情况(手术时间、术中出血量、术后排气时间、术后住院时间和淋巴结切除数目)的影响。结果发现,围术期情况不受患者BMI、年龄、有无合并代谢综合征等临床特征影响(P>0.05)。
2.3 术后肿瘤病理学特征
根据患者肿瘤病理学特征对415例达芬奇机器人系统治疗的子宫内膜癌进行分型(表2),Ⅰ型子宫内膜癌患者385例(92.77%),其中高分化内膜癌占57.11%,中低分化占35.66%;Ⅱ 型子宫内膜癌30例(7.23%);子宫内膜癌Ⅰ期患者占77.59%,Ⅱ期占9.64%,Ⅲ期占11.81%,Ⅳ期占0.96%。

表2 415例达芬奇机器人系统治疗子宫内膜癌患者肿瘤病理学特征
2.4 生存预后分析
本研究通过电话形式随访415例纳入患者的生存情况,其中26例患者因疾病未控或复发死亡:术后1年内疾病未控死亡患者8例,术后1~3年内因复发转移死亡患者15例,另有3例患者于术后3年后死亡(2例因复发转移死亡,1例死于肾衰竭);分析其病理类型:高分化子宫内膜样腺癌7例,中低分化子宫内膜样腺癌13例,Ⅱ型子宫内膜癌6例(2例为癌肉瘤,2例为子宫内膜透明细胞癌,1例为浆液性癌,1例为黏液性癌)。
除此26例患者,其余病例均存活。有8例患者术后复发,现均在化疗缓解中。生存分析结果显示达芬奇机器人手术治疗子宫内膜癌的3年累积生存率为94.2%,5年累积生存率为93.4%;3年无病生存率为93.4%,5年无病生存率为90.4%(图1)。不同分期患者生存率分析见表3。

A:415例子宫内膜癌患者术后累积生存率;B:415例子宫内膜癌患者术后无病生存率。图1 415例达芬奇机器人系统治疗子宫内膜癌患者术后生存分析

表3 不同分期子宫内膜癌患者3、5年累积生存率和无病生存率(%)
根据BMI、年龄、有无代谢合并症临床特征分析各组术后生存率。结果提示,术后生存率不受BMI、年龄、代谢合并症临床特征影响(图2)。
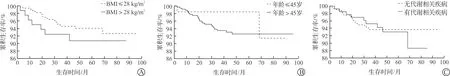
A:BMI对子宫内膜癌患者术后累积生存率的影响;B:年龄对子宫内膜癌患者术后累积生存率的影响;C:代谢合并症对子宫内膜癌患者术后累积生存率的影响。图2 不同临床特征对达芬奇机器人系统治疗子宫内膜癌患者术后累积生存率的影响
3 讨论
腹腔镜技术引入妇科领域以来,通过微创手术治疗子宫内膜癌已逐渐成为一种安全且受欢迎的选择,即使对于患有严重肥胖或其他并发症的患者也是如此[12-14]。一些研究已经比较了不同手术方法的结果(包括腹腔镜、机器人、开放式手术、阴式手术),建立每一种技术的可行性和安全性作为肿瘤治疗的等效性[15-16]。随着技术的进步和机器人辅助下子宫内膜癌手术的普及,使用机器人手术治疗子宫内膜癌的患者长期生存情况已成为人们关注和讨论的话题。本研究对415例机器人手术后的子宫内膜癌患者进行回顾性分析,3年累积生存率为94.2%,5年累积生存率为93.4%;3年无病生存率为93.4%,5年无病生存率为90.4%。
子宫内膜癌全面分期手术的关键步骤在于淋巴结的切除,淋巴结切除的数量可能是淋巴结切除术最重要的参数,也是衡量手术质量的一个指标[17]。高位腹主动脉旁淋巴结切除是在腹主动脉、下腔静脉、肾动脉、肾静脉、十二指肠和输尿管周围进行操作。此处解剖复杂,上界达肾动静脉,下界至腹主动脉分叉,前方至十二指肠、小肠及其血管、胰腺,后方至椎体、神经、腰升静脉、腰大肌,两侧毗邻输尿管、卵巢动静脉及肾脏。手术要有良好的显露,但该区域显露难、手术要求精确度高,而传统腹腔镜手术系统的二维视野、手术视野盲区、显露困难等不足,使高位腹主动脉旁淋巴结清扫的彻底性及精确性受到了一定程度的限制。机器人手术系统相对可以完美地克服这些缺点,使其在早期子宫内膜癌手术中的应用具有较明显的优越性[18-19]。
由于低级别子宫内膜癌的死亡率低,在选择术式时可更多考虑患者术后生活质量。多项临床研究表明,与开腹手术相比,子宫内膜癌的机器人手术失血量少,住院时间短,术后并发症少[7,15,20-22]。与腹腔镜技术相比,机器人技术的优势在肥胖患者身上体现得最为明显[21,23]。较短的学习曲线也有利于机器人手术的广泛使用[24]。虽然机器人辅助下子宫内膜癌手术的大规模应用仍然面临着一系列的挑战,如高昂的成本和检测、维护费用[25],缺少触觉感、对术者技术要求高[26]等。这些都是制约机器人辅助下手术的发展和广泛推广的重要原因。但是随着机器人技术的不断完善,其使用成本和操作系统一定会更加符合临床实践。
综上所述,使用达芬奇机器人手术治疗子宫内膜癌可在手术时间、术中出血量及住院时间等方面使患者获益,且不受患者年龄、肥胖、代谢综合征等因素限制。并且使用机器人手术后,患者的长期生存获益可以得到保障。随着机器人辅助手术治疗子宫内膜癌的应用增多,其安全性及长期生存获益情况有必要接受多中心、大样本的前瞻性临床研究进行验证。

