腹腔镜胃腔外楔形切除与开腹手术治疗低危险度胃间质瘤对患者胃肠功能、免疫功能的影响*
刘 军,胡 斌,陈 巍
陕西省西安市中心医院普外科,陕西西安 710003
低危险度胃间质瘤(LRGST)是十分常见且发病率较高的一种消化道间叶组织型肿瘤,并且这一肿瘤发生率较高的一个生理位置就是胃部[1]。目前临床中对于LRGST的主要治疗方式之一就是外科切除,但是因为LRGST发生转移的概率以及风险较低,因此相对于传统的器官全切,临床中往往都会优先选择局部切除[2]。所以,胃腔外楔形切除术成为绝大部分外科医生治疗LRGST的常用手术方式[3]。依据目前临床相关指南,在LRGST的治疗过程中可以应用腹腔镜手术,但是会因为医生在腹腔镜下的操作增加患者肿瘤发生破裂并播撒的风险与概率[4]。随着近几年社会经济的持续发展与进步,临床中的一系列微创器械和医疗技术也随之得到了长足的发展,并且出现了一系列全新的相关腹腔镜设备,包括单孔腹腔镜、腹腔镜辅助以及悬吊式腹腔镜等。这一系列全新腹腔镜设备的出现以及应用也推动了临床中对于LRGST治疗的发展与进步[5]。但是目前临床对LRGST是使用腹腔镜治疗还是用开腹术治疗并没有普遍一致的观点。基于此,本文主要是针对性地探讨并分析使用腹腔镜与开腹手术分别进行胃腔外楔形切除治疗LRGST对患者免疫功能以及胃肠功能所产生的影响。
1 资料与方法
1.1一般资料 选取2021年5月至2022年5月本院收治的LRGST患者68例为研究对象,依据术式不同分为对照组和研究组,每组34例。对照组:男12例,女22例;年龄35~65岁,平均(52.1±2.1)岁;肿瘤位置,胃窦5例,胃体11例,胃底8例,贲门10例。研究组:男13例,女21例;年龄35~65岁,平均(52.3±2.2)岁;肿瘤位置,胃窦6例,胃体12例,胃底7例,贲门9例。两组一般资料比较,差异均无统计学意义(P>0.05),有可比性。本研究经本院医学伦理委员会批准。
纳入标准:(1)符合临床中对胃间质瘤的诊断[6];(2)符合手术指征;(3)年龄>20岁;(4)患者术前免疫功能正常;(5)患者意识清晰且精神正常,可配合进行研究。排除标准:(1)合并严重的心肺疾病;(2)患有恶性肿瘤;(3)术前肿瘤发生转移或周围侵犯;(4)既往有腹部手术史;(5)长期使用活血及抗凝药物。
1.2方法
1.2.1对照组 采用开腹胃腔外楔形切除术。手术体位为平卧位,在患者的腹部正中进行一个手术切口,然后依据不同患者实际的肿瘤位置实施楔形切除。
1.2.2研究组 腹腔镜胃腔外楔形切除术。以胃底部肿瘤为例:手术体位为向右倾斜、脚低头高体位。首先,从患者的胃大血管弓下位置对大网膜进行分离,一直分离至结肠脾曲位置,将患者的脾门和脾胃韧带充分地暴露在手术者的视野中。然后在脾下极周边及胰尾末端位置将胃网膜左侧的血管进行完全显露,使用血管夹将该血管夹断。对患者的胃底后壁进行牵拉,然后将脾胃韧带拉紧,同时将胃短动脉离断,直至完全分离脾上极和胃底。将脾上极和胃底完全分离之后将胃底、胃壁往右下方牵拉,顺着膈肌的方向将胃膈韧带往食管裂孔的方向分离,并充分游离胃底贲门。完成游离操作之后,将胃底贲门往右上方的位置牵拉,使胃底部的肿瘤能够充分地显露在操作者视野中。假如此时无法有效、准确定位患者的肿瘤位置,可以在术中视情况联合胃镜更加准确地对肿瘤位置定位。肿瘤定位之后将肿块基底部的胃壁往左上腹提拉,在提拉的过程中要注意不能钳夹到肿瘤。使用无创钳夹将肿瘤周围的胃壁钳夹,然后往左上方牵拉胃壁与肿瘤,使胃底部能够充分地张紧。将切割闭合器置入,并调整位置使闭合器能够将胃壁夹住并与肿瘤下方位置接近;确认位置无误之后激发闭合器,切割并闭合胃壁。提起已经完全切断的肿瘤侧胃壁,使首次切割线的终点能够显露,同时将首次切割线的终点作为二次切割的起点。再次将闭合器置入,确认位置无误后激发闭合器,楔形切除胃壁部分和肿瘤。假如完成切割后,切端位置有出血时,给予常规止血缝扎。最后将成功切除的肿瘤病灶送入取物袋中,并常规送检。
1.3观察指标
1.3.1两组胃肠功能比较 比较两组术后首次排气及术后饮食恢复时间。术后首次排气:术后3~4 d患者放屁,腹胀症状消失或减轻,同时可伴随排便,患者腹部症状如嗳气、呃逆等明显好转;经腹部听诊提示患者的肠鸣音已恢复至正常,每分钟至少3~4次,同时给予患者实施腹部平片检查,片中未见出现相关肠梗阻表现,如气液平面等。术后饮食恢复时间:指患者在术后首次开始进食流食的时间。
1.3.2两组并发症比较 比较两组的并发症发生情况,并发症包含切口感染、胃排空延迟、胃出血。切口感染:手术切口出现红、肿、热、痛等表现;在为患者换药时可以发现患者的切口周围出现明显红肿,且伴有渗出;患者通常还会出现发热。胃排空延迟:患者会表现出相关临床症状,如上腹痛、腹胀感、嗳气、早饱、呕吐及恶心等;76%的复方泛影葡胺胃部造影检查结果提示,胃部存在明显潴留,且在20 min之内患者胃部没有发生蠕动或蠕动明显减弱,没有流出道梗阻。胃出血:术后24 h胃液>300 mL,且胃液的颜色与术后刚开始时相比没有明显变清变淡,则可诊断为胃出血。
1.3.3两组免疫功能比较 比较两组T淋巴细胞总值(CD3+T淋巴细胞)、分化决定族抗原4(CD4+T淋巴细胞)、白细胞分化抗原8(CD8+T淋巴细胞)比例,以及CD4+T淋巴细胞/CD8+T淋巴细胞比值。在患者接受手术治疗前及患者术后出院前1 d抽取患者的空腹静脉血,常规离心(3 800 r/min离心10 min)得到血清标本,采用流式细胞仪检测CD3+、CD4+、CD8+T淋巴细胞。
1.3.4两组术后复发情况比较 分别在术后4个月及术后9个月对患者进行随访,统计两组患者的复发情况,并进行记录。复发诊断:做CT或胃镜等检查,影像能够明显看到肿瘤病灶或转移病灶。
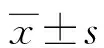
2 结 果
2.1两组胃肠功能比较 与对照组相比,研究组术后首次排气时间、术后饮食恢复时间更快(P<0.05)。见表1。
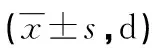
表1 两组胃肠功能比较
2.2两组并发症比较 研究组并发症发生率低于对照组(P<0.05)。见表2。

表2 两组并发症比较
2.3两组免疫功能比较 治疗后研究组CD3+、CD4+T淋巴细胞比例及CD4+T淋巴细胞/CD8+T淋巴细胞比值高于对照组(P<0.05),CD8+T淋巴细胞比例低于对照组(P<0.05)。见表3。
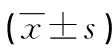
表3 两组免疫功能比较
2.4两组术后复发情况比较 两组术后总复发率比较,差异无统计学意义(P>0.05)。见表4。

表4 两组术后复发情况比较
3 讨 论
LRGST在临床当中具有一定的恶性潜质,使用放射治疗对于LRGST进行干预并不能获得十分理想的效果,因此当前临床对LRGST的治疗方法主要有药物治疗、内镜治疗以及手术治疗[7]。内镜治疗主要适用于体积及尺寸较小的LRGST,但是在使用胃镜对胃底部的较大肿瘤进行处理时,十分容易导致患者在术中或者术后发生胃穿孔以及胃出血,同时还会导致出现不完整肿瘤切除的风险[8]。目前对LRGST进行药物治疗时主要是应用分子靶向类药物进行干预,而药物治疗主要是对患者术前治疗的辅助。通过采用分子靶向类药物治疗能够使患者肿瘤体积在术前得到有效减小,使临床分期有效降低,从而在使手术范围大大缩小的同时也能够尽可能地避免联合脏器切除的风险,使患者得到根治性切除的概率大大增加[9]。
就目前的医疗条件以及现状分析而言,绝大部分的LRGST患者都需要通过外科手术治疗。既往对于LRGST的治疗,绝大部分都是采用开腹手术。开腹手术能够使术者在手术过程中获得更加清晰的视野,并且也能够更加彻底地切除肿瘤病灶[10]。但是随着社会的不断发展以及开腹手术的逐渐应用,人们开始逐渐发现使用开腹手术之后患者会出现一系列的相关并发症,同时还会使患者术后的恢复时间大大延长[11]。随着医疗技术与设备的不断进步以及发展,腹腔镜设备与技术开始日渐成为前外科临床中所关注的一个重点及热点。在腹腔镜的临床应用过程中,其表现出了一系列开腹手术所无法比拟的优势,比如恢复快、创伤小、患者术后并发症低等。但是腹腔镜在临床应用的过程中也存在着部分的缺点,主要表现:当前的腹腔镜技术以及经验相对于开腹手术而言偏少,因此绝大部分患者的腹腔镜手术时间明显更长;并且还有部分学者指出,使用腹腔镜手术进行治疗时手术者的视野相对较差,因此无法实现对肿瘤的彻底切除。因此目前临床中对于LRGST使用开腹手术或者是腹腔镜手术进行治疗,依旧存在争议。
绝大部分LRGST患者在接受腹部手术之后,不管是开腹手术或者是腹腔镜手术都会表现出十分明显的胃肠功能异常现象[12]。导致这一现象发生的主要因素就是在手术过程中的相关操作以及麻醉等都会使患者原有的胃肠功能受到影响,此外,术后的疼痛也会对患者的胃肠功能恢复产生一定的影响。而术后胃肠功能是否能够及时且有效地恢复将直接影响到患者术后的康复治疗以及康复速度[13]。因此,越来越多的学者开始关注如何在保障疗效的同时尽可能地使患者在术后更快地恢复胃肠功能。本研究结果提示,研究组患者胃肠功能恢复更快。导致这一结果的原因是相对于开腹手术而言,腹腔镜手术在操作过程中视野更加清晰,因此其也会更加有效地避免对患者手术周围组织以及脏器的损伤,患者正常的肠胃功能所受到的影响也更小[14]。
虽然手术与免疫力降低之间并没有直接关系,但是手术之后免疫力降低是十分常见的一种现象。最可能的原因就是在手术过程中,术者的一系列操作对患者的正常脏器以及生理功能产生的影响,从而导致免疫力降低;同时在手术过程中所导致的出血也会使患者身体的内环境平衡受到影响,从而影响患者的免疫功能[15]。本研究结果提示,治疗后研究组CD3+、CD4+T淋巴细胞比例及CD4+T淋巴细胞/CD8+T淋巴细胞比值高于对照组(P<0.05),CD8+T淋巴细胞比例低于对照组(P<0.05)。由本研究结果分析可以得知,两组患者不管是接受开腹手术还是接受腹腔镜手术,术后患者的免疫功能均发生了不同程度的降低,但是研究组患者的降低程度明显更小。这也提醒,腹腔镜胃腔外楔形切除术对于患者免疫功能所产生的抑制程度更加轻微。分析其可能的原因:相对于开腹手术,腹腔镜胃腔外楔形切除术的伤口更小,术中对患者造成的组织创伤也更小,对患者术后免疫功能的影响也小。
目前临床中较有争议的一项内容就是腹腔镜胃腔外楔形切除术能否实现与开腹手术同等的疗效。本研究结果提示,两组术后总复发率比较,差异无统计学意义(P>0.05)。但是本研究仅仅对两组患者进行了短期的随访,未对患者进行长期随访来进一步验证本研究的结论,后期若条件以及时间允许,将会对患者进行长期随访,从而进一步确认腹腔镜胃腔外楔形切除术治疗LRGST患者的效果。
腹腔镜胃腔外楔形切除术在临床应用时的注意事项主要包括以下几方面:首先,需要严格掌握手术适应证。胃底近贲门位置的肿瘤一定要预防在切除之后继发形成贲门狭窄。因此,胃底近贲门位置的肿瘤更加适合使用开腹手术进行治疗。假如肿瘤体积太大,也十分容易导致肿瘤破裂并种植,且取标本时的切口尺寸太大,对患者的损伤加大。其次,准确定位肿瘤病灶的位置是关键。在患者接受手术治疗之前需要接受胃镜治疗和CT检查,从而进一步明确患者体内的肿瘤病灶位置和大小;在手术过程中可以使用相关手术器械进行探查和触诊,进一步明确肿瘤病灶的定位。第三,一定要维持胃腔通畅,避免发生狭窄。在手术过程中,假如需要使用切割器进行楔形切割时,一定要尽可能地进行横形切割,特别是胃窦和胃底的肿瘤病灶。第四,手术操作过程中一定要及时且彻底地进行止血。胃拥有十分丰富的血运,使用切割器进行切割之后,创面会不可避免地出现渗血;渗血量较少是正常的,但是如果出现活动性出血时,则需要通过缝合来止血。对胃系膜进行分离操作时,如果血管尺寸较大需要充分地配合使用相关器械,如钛夹和超声刀等,确保能够彻底地止血。
综上所述,使用腹腔镜胃腔外楔形切除术治疗LRGST时,患者术后肠胃功能恢复更快,且使用腹腔镜胃腔外楔形切除术治疗对于LRGST患者免疫功能所产生的影响更小,该术式术后短期复发率与开腹手术相当。

