碳青霉烯类耐药肠杆菌目细菌耐药性及耐药基因分析*
侯素君,尹盟盟,王均梅,别海文,梁永娟,朱元祺
1.山东省日照市中医医院检验科,山东日照 276800;2.青岛大学附属医院检验科,山东青岛 266003
当前,细菌耐药已成为全球公共健康领域的重大挑战,其中尤以碳青霉烯类耐药肠杆菌目细菌(CRE)引起的感染形势最为严峻,碳青霉烯类抗菌药物包括亚胺培南、美洛培南和厄他培南等,是治疗多重耐药革兰阴性杆菌所致感染最有效的抗菌药物之一。随着该类药物在临床的广泛应用,肠杆菌目细菌对碳青霉烯类抗菌药物的耐药率呈逐年快速上升趋势[1]。耐药细菌感染致住院时间延长、费用增加、病死率增高,在社区或医院中可引起散发,交叉传播,甚至导致暴发流行,对婴幼儿、老年人和免疫缺陷者的威胁巨大。因此,探讨医院CRE菌株的耐药表型和基因型,可以为医院CRE菌株感染的临床治疗和医院感染暴发的防控提供科学依据。
1 材料与方法
1.1菌株来源 收集2020年7月至2023年1月日照市中医医院临床患者标本中分离的77株CRE菌株,剔除同一患者同一部位重复分离的菌株。
1.2质控菌株 大肠埃希菌ATCC25922、肺炎克雷伯菌ATCC700603、大肠埃希菌ATCC700323、大肠埃希菌ATCC35218、肺炎克雷伯菌ATCCBAA1705、肺炎克雷伯菌ATCCBAA2146均由省临床检验中心提供。
1.3仪器与试剂 VITEK 2 Compact全自动细菌鉴定及药敏分析仪(法国生物梅里埃公司)、Labnet C1301-230EU型手掌形离心机(美国Labnet公司)、Bio-Rad MyCycier型PCR扩增仪(美国Bio-Rad公司)、Eppendorf 5415R型台式高速离心机(德国Eppendorf公司)、北京六一 DYCP-31DN型琼脂糖凝胶电泳仪(北京六一生物科技有限公司)、Bio-Rad凝胶成像仪(美国Bio-Rad公司)、Bio-Rad电泳槽(美国Bio-Rad公司),2×Accurate Taq预混液(湖南艾科瑞生物工程有限公司),DL2000 DNA Marker (日本TaKaRa公司),琼脂糖 (日本TaKaRa公司),4S Gelred 核酸染料(香港BBI Life Science Corporation),Wizard Genomic DNA Purification Kit(美国Promega公司),胰蛋白胨大豆肉汤培养基(TSB,杭州滨和微生物试剂公司),Etest条(温州市康泰生物科技有限公司),头孢哌酮/舒巴坦、替加环素药敏纸片均为英国Oxid公司产品。
1.4方法
1.4.1菌株鉴定及药敏试验 菌株分离与培养严格按照《全国临床检验操作规程》(第4版)[2]进行,使用VITEK 2 Compact全自动微生物分析仪进行菌株鉴定及药敏试验。药敏试验结果判断根据美国临床和实验室标准协会(CLSI)最新版标准判断,收集临床标本中分离的肠杆菌目细菌药敏试验报告中亚胺培南、美洛培南最小抑菌浓度(MIC)≥4 μg/mL或厄他培南≥2 μg/mL(已用Etest条复核)的菌株[3]。
1.4.2碳青霉烯酶表型确证试验 改良碳青霉烯酶灭活试验(mCIM)操作步骤:参照CLSI 2020年版M100操作标准,用1 μL接种环挑一满环菌落,加入2 mL TSB肉汤中乳化,振荡10~15 s,每管放入1张含10 μg美洛培南的无菌纸片,确认纸片浸没于菌悬液中,35 ℃孵育4 h,将美洛培南纸片贴于已涂布大肠埃希菌ATCC25922悬液的MH平板,35 ℃孵育18~24 h,量取抑菌圈直径。 乙二胺四乙酸(EDTA)改良碳青霉烯酶灭活试验(eCIM)操作步骤:另取一支试管,加入2 mLTSB肉汤,再加入20 μL 0.5 mol/L EDTA溶液混匀,EDTA浓度最终为5 mmol/L。其余步骤同mCIM。 mCIM判断标准:美洛培南抑菌圈直径为6~15 mm或直径16~18 mm但抑菌圈内有散在菌落时,为碳青霉烯酶阳性;抑菌圈直径≥19 mm,为碳青霉烯酶阴性;抑菌圈直径为16~18 mm或直径为19 mm但抑菌圈内有散在菌落,则无法判断是否存在碳青霉烯酶,为碳青霉烯酶不确定[4]。eCIM判断标准:eCIM与mCIM结果比较,美洛培南抑菌圈直径相差≥5 mm为金属β-内酰胺酶阳性,美洛培南抑菌圈直径相差≤4 mm为金属β-内酰胺酶阴性,待测菌株产丝氨酸蛋白酶。
1.4.3基因检测 煮沸裂解法提取DNA模板,采用PCR扩增碳青霉烯酶耐药基因,扩增条件为94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火40 s,72 ℃延伸50 s,共35个循环;72 ℃再延伸10 min。扩增后产物取10 μL通过1.5%琼脂凝胶电泳30 min,最终在凝胶成像仪上观察结果。引物信息见表1,引物序列查阅文献[5]获得,由上海生工生物工程有限公司合成引物,并进行相应的测序分析,与目的基因、阳性对照条带位置的扩增产物送上海生工生物工程有限公司完成测序,基因序列在http://blast.ncbi.nlm.nih.gov/blast.cgi进行比对,确定耐药基因亚型。
1.5统计学处理 采用全国细菌耐药监测网提供的Whonet5.6软件收集药敏试验结果,使用SPSS 21.0统计软件进行分析,计数资料以例数或百分比表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1CRE菌株的种类与临床分布 77株CRE临床分离株中,肺炎克雷伯菌33株(42.9%)、大肠埃希菌15株(19.5%)、阴沟肠杆菌12株(15.6%)、弗劳地枸橼酸杆菌7株(9.1%)、雷氏普罗威登斯菌3株(3.9%)、产气肠杆菌3株(3.9%)、奇异变形杆菌2株(2.6%)、产酸克雷伯菌2株(2.6%)。77株CRE菌株来源标本以痰液和尿液为主,其中分离自痰液33株(42.86%)、尿液30株(38.96%)、胸腔积液6株(7.79%)、穿刺液5株(6.49%)、脑脊液2株(2.60%)。77株CRE菌株的科室分布:颅脑外科23株,重症医学科10株,脑卒中监护室9株,急诊科6株,泌尿外科6株,肺病科5株,肝胆胰脾科3株,胸外科3株,脑病科2株,心血管内科2株,骨六科2株,康复科2株,髋膝骨科1株,风湿肾病科1株,妇科1株,肿瘤科1株。
2.2CRE菌株药敏试验结果 77株CRE菌株中超广谱β-内酰胺酶(ESBLs)的检出率为100.0%,对替加环素敏感性最高(97.4%),其次为阿米卡星(44.2%)、复方磺胺甲噁唑(39.0%),对其余抗菌药物的敏感性均低于20.0%。大肠埃希菌对阿米卡星的敏感性为80.0%,肺炎克雷伯菌和阴沟肠杆菌对阿米卡星的敏感性分别为48.5%和50.0%。见表2。
2.3耐药基因扩增结果 77株CRE菌株中74株产碳青霉烯酶,3株未检出。其中,33株肺炎克雷伯菌中20株携带KPC基因,12株携带NDM基因,1株未检出碳青霉烯酶,主要产KPC(60.6%);15株大肠埃希菌中12株携带NDM基因,3株携带KPC基因,主要产NDM(80.0%);12株阴沟肠杆菌携带NDM基因(100.0%);7株耐弗劳地枸橼酸杆菌携带NDM基因(100.0%);3株雷氏普罗威登斯菌中2株携带NDM基因,1株未检出碳青霉烯酶;3株产气肠杆菌中1株携带NDM基因,1株携带KPC基因,1株未检出碳青霉烯酶;2株产酸克雷伯菌中1株携带NDM基因,1株携带IMP基因;2株奇异变形杆菌携带NDM基因。碳青霉烯酶基因型中NDM占66.2%(49/74),KPC占32.4%(24/74),IMP占1.4%(1/74)。琼脂电泳图见图1~3。
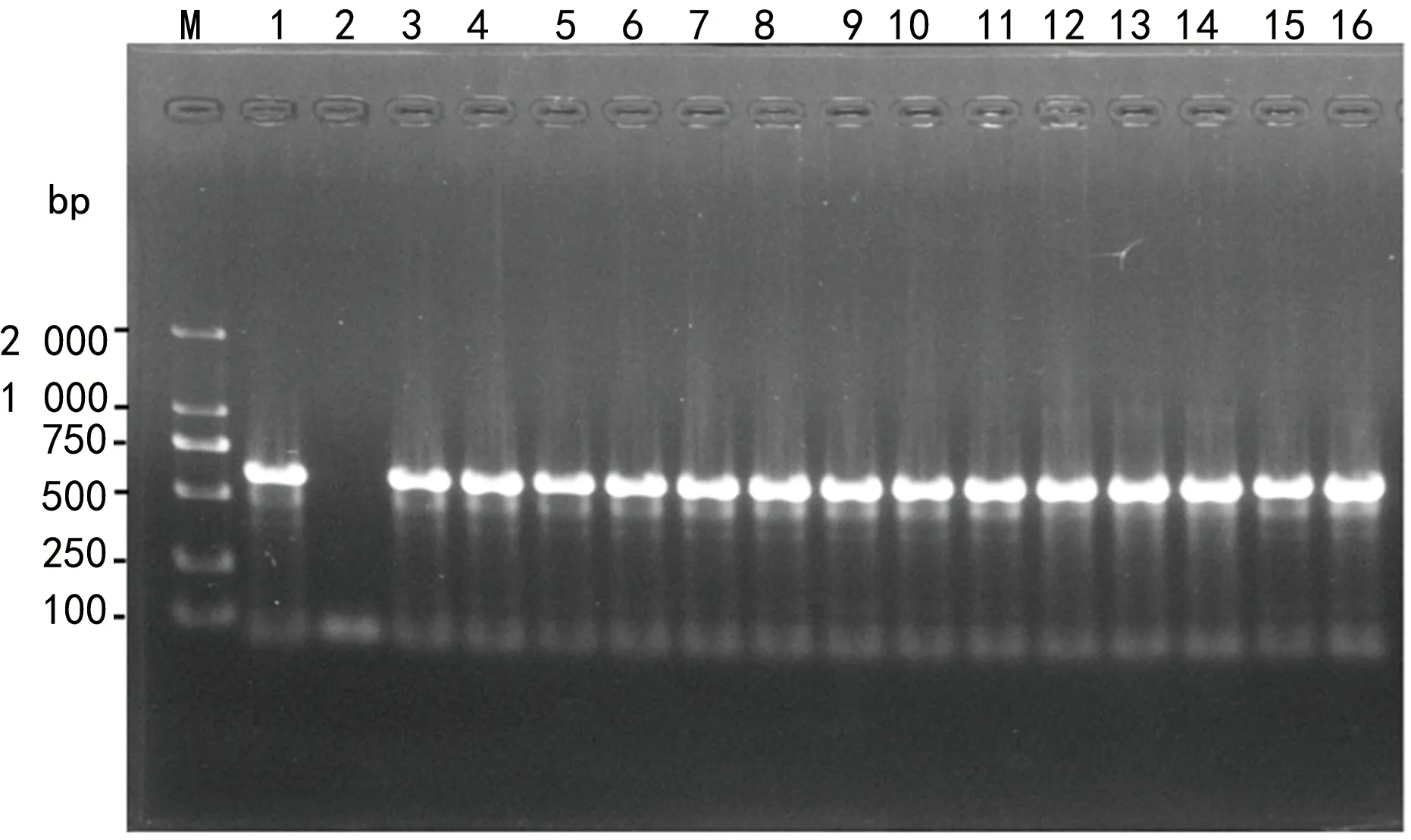
注:M为DL2000 DNA标志物;1为blaNDM阳性对照;2为blaNDM阴性对照;3~16为临床菌株blaNDM阳性。图1 PCR扩增菌株blaNDM基因的电泳图
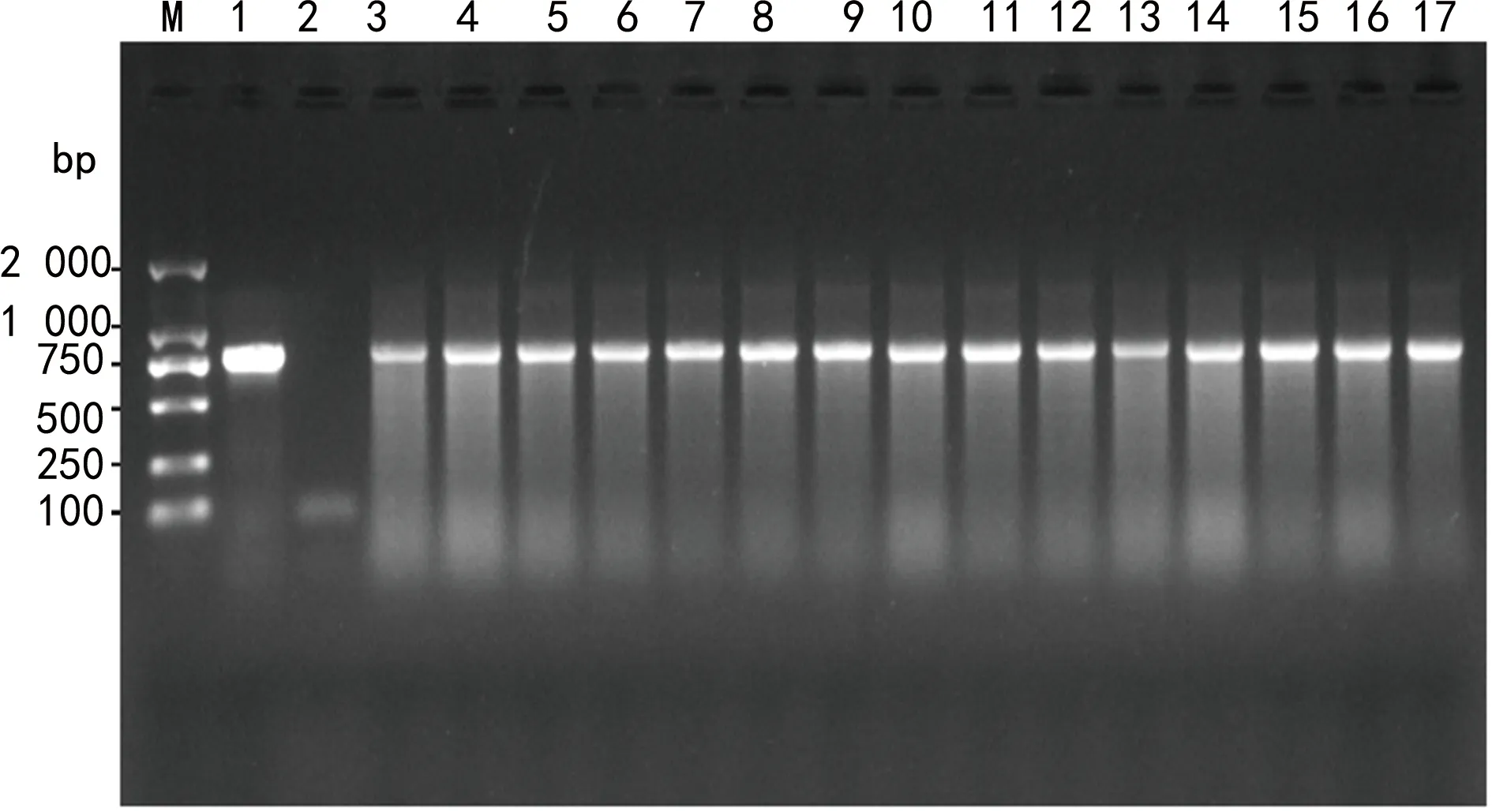
注:M为DL2000 DNA标志物;1为blaKPC阳性对照;2为blaKPC阴性对照;3~17为临床菌株blaKPC阳性。图2 PCR扩增菌株blaKPC基因的电泳图
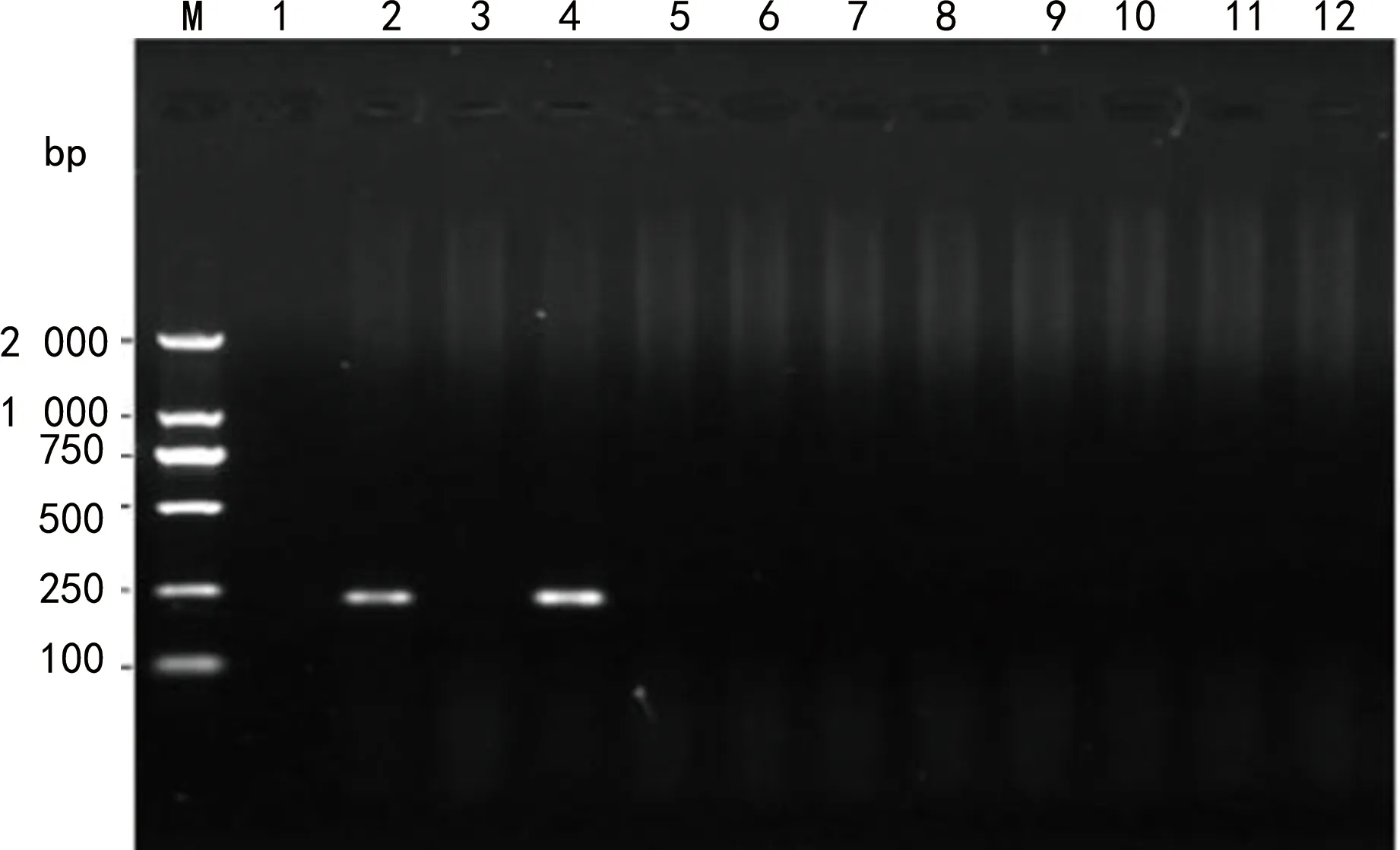
注:M为DL2000 DNA标志物;1为blaIMP阴性对照;2为blaIMP阳性对照;4为临床菌株blaIMP阳性;3、5~12为临床菌株blaIMP阴性。图3 PCR扩增菌株blaIMP基因的电泳图
2.4碳青霉烯酶表型试验结果 74株携带碳青霉烯酶基因的CRE菌株,其中71株mCIM试验阳性,3株mCIM试验均阴性,mCIM筛选碳青霉烯酶菌株的灵敏度为95.9%,特异度为100.0%。mCIM阳性菌株中,肺炎克雷伯菌32株,大肠埃希菌15株,阴沟肠杆菌12株,弗劳地枸橼酸杆菌7株,奇异变形杆菌2株,产气肠杆菌1株,产酸克雷伯菌1株,雷氏普罗威登斯菌1株。mCIM结合eCIM试验初步判断产金属β-内酰胺酶51株(mCIM阳性,eCIM阳性),产丝氨酸蛋白酶20株(mCIM阳性,eCIM阴性)。
2.5基因测序 耐药基因扩增结果将与目的基因、阳性对照条带位置的扩增产物送上海生工生物工程有限公司完成测序,基因序列在http://blast.ncbi.nlm.nih.gov/blast.cgi进行比对,确定耐药基因型为blaKPC-2、blaNDM-1、blaIMP-4。
3 讨 论
CRE是当前最受关注的耐药威胁之一,我国CRE的流行情况也比较严重。中国CHINET细菌耐药性监测数据表明,2005年碳青霉烯类抗菌药物对肠杆菌目细菌保持着较高的抗菌活性,耐药率低于2%;到2010年,耐药率明显上升,达到5%;肺炎克雷伯菌的耐药率已高达10%[6]。2018年肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药率全国平均为10.1%[7],2021年肺炎克雷伯菌耐药率上升到23.1%[8],肠杆菌目细菌对碳青霉烯类抗菌药物最常见的耐药机制为产碳青霉烯酶[9]。因此,快速、准确地检测本院耐药菌是否产碳青霉烯酶,了解CRE菌株基因分型对于临床治疗和医院感染控制至关重要。
本研究77株CRE菌株中,肺炎克雷伯菌占42.9%,大肠埃希菌占19.5%,阴沟肠杆菌占15.6%,其他肠杆菌目细菌占22.0%,与陆书华等[10]、崔超琼等[11]的研究结果接近;主要碳青霉烯酶基因型中NDM占66.2%(49/74),KPC占32.4%(24/74),IMP占1.4%(1/74)。CRE菌株主要分离自痰液、尿液、胸腔积液,也可分离自脑脊液、血液、穿刺液等,说明耐药株引起的感染并不仅限于呼吸、泌尿系统,还可能引起颅内、血流、胸腔等多部位感染,其感染的广泛性应引起临床重视。CRE菌株科室分布主要是颅脑外科、重症医学科、脑卒中监护室,这与重症监护室患者病因的复杂性、病情危重、免疫力低下、糖皮质激素和高效广谱抗菌药物长期应用,以及侵入性操作治疗较多有关。本研究药敏试验结果显示,77株CRE菌株对青霉素类、头孢菌素类、头霉素类耐药率均为90%以上,与王珍珍等[12]研究结果一致,临床应慎重经验用药,对替加环素、阿米卡星、复方磺胺甲噁唑耐药率分别为2.6%、55.8%、61.0%[13],临床可选择这些药物治疗感染者。
按照Ambler分子分类方法可将碳青霉烯酶分为3类:(1)A类丝氨酸碳青霉烯酶,以KPC为主,该酶活性可被阿维巴坦抑制,产酶菌株通常仅对替加环素、多黏菌素或头孢他啶/阿维巴坦敏感;(2)B类金属β-内酰胺酶,以NDM型金属酶为主,该酶活性不能被阿维巴坦抑制,产酶菌株通常仅对替加环素、多黏菌素敏感,少数菌株对氨曲南敏感;(3)D类丝氨酸碳青霉烯酶,以OXA-48为主,常见于儿童患者分离的肺炎克雷伯菌,该酶活性可被阿维巴坦抑制,产酶菌株通常仅对替加环素、多黏菌素或头孢他啶/阿维巴坦敏感。CRE感染的治疗具有挑战性,应根据药敏试验结果、耐药表型或基因分型、感染的严重程度,选择有效的治疗方案。本研究利用CLSI推荐的mCIM和eCIM试验联合检测碳青霉烯酶表型,mCIM筛选碳青霉烯酶菌株的灵敏度为95.9%,特异度为100.0%[1],与之符合,结合eCIM试验初步判断产金属β-内酰胺酶51株,产丝氨酸蛋白酶20株。mCIM试验操作简单,成本低,不需要特殊试剂,灵敏度和特异度高,适合所有微生物室开展。mCIM与eCIM联合检测筛选碳青霉烯酶表型,对临床选择用药具有重要意义。
PCR扩增结果显示,77株CRE菌株中74株产碳青霉烯酶,3株未检出,而ESBLs的检出率为100.0%,可能为高产头孢菌素酶(AmpC)或高产ESBLs合并外膜孔蛋白缺失或变异以及细菌外排泵系统改变所致[14]。目前常见的碳青霉烯酶为KPC、VIM、NDM、IMP和OXA,国内以KPC、NDM和IMP为主[15]。本研究77株菌株主要流行的碳青霉烯酶基因型依次为NDM(66.2%)、KPC(32.4%)和IMP(1.4%),以NDM和KPC为主[16]。河南部分地区和海南省5家综合医院收集的CRE菌株中,主要的耐药基因型也是NDM[17-18],本研究耐药基因KPC的检出率低于NDM,77株CRE菌株中,仅有1株耐碳青霉烯产酸克雷伯菌检出IMP基因。97.0%(32/33)的肺炎克雷伯菌、100.0%(15/15)的大肠埃希菌,100.0%(12/12)的阴沟肠杆菌携带碳青霉烯酶基因。碳青霉烯类耐药肺炎克雷伯菌主要携带KPC-2基因[19],碳青霉烯类耐药大肠埃希菌和阴沟肠杆菌主要携带NDM-1基因,与陆书华等[10]报道一致。KPC和NDM耐药基因均可由质粒介导,通过菌株自身克隆以及不同菌种间水平转移,是CRE流行激增的主要原因。KPC-2和NDM-1可水解绝大多数β-内酰胺药物,包括碳青霉烯类,不同之处在于KPC-2为丝氨酸蛋白酶,水解氨曲南,能被新型酶抑制剂阿维巴坦所抑制,而NDM-1为金属酶,不水解氨曲南,不被阿维巴坦、韦博巴坦等抑制。
总之,CRE呈现广泛耐药甚至全耐药的特征,使临床抗感染治疗面临无药可用的困境,导致感染患者病死率高。实验室应快速鉴别产碳青霉烯酶菌株,选择早期快速筛查的方法,加快开展联合药敏试验,有效降低CRE感染患者的病死率[20]。临床医生应掌握医院CRE临床分布特征及耐药基因、细菌耐药情况,根据药敏试验结果合理选用抗菌药物;院感防控部门需加强监督检查,共同遏制CRE菌株在不同患者和不同区域间流行播散,降低医院CRE感染发生率。

