肺癌外周血MMP-7mRNA与肿瘤免疫微环境特征的相关性研究*
梁 晶,陈立军,于津生,李加丽,邓为民,王海龙
天津市滨海新区大港医院肿瘤科,天津 300270
根据2020年全球癌症报告,肺癌的发病率仅次于乳腺癌,是世界上最常见的癌症死亡原因[1]。我国肺癌的发病率、病死率仍居所有恶性肿瘤第一位,大约90%肺癌死亡是由于肺癌转移[2]。肿瘤细胞内在基因组学、蛋白质组学的改变决定了肺癌特质,而肿瘤微环境的改变也显著影响着肺癌的发生、发展,肿瘤基质细胞在肺癌侵袭、转移级联过程中每一个环节都有参与[3]。肿瘤基质细胞如肿瘤相关成纤维细胞与肿瘤免疫微环境相关性成为近年来的研究热点之一。肿瘤相关成纤维细胞被肿瘤细胞分泌的细胞因子激活,诱导产生大量的基质金属蛋白酶(MMPs)。基质金属蛋白酶-7(MMP-7)是MMPs家族中相对分子质量最小的分泌型蛋白,它可以:(1)通过降解内皮基底膜和细胞外基质,减少细胞间黏附;(2)通过促进血管生长因子的分泌,诱导血管生成;(3)通过裂解 proMMP-2及proMMP-9以活化MMP-2、MMP-9;(4)通过促进细胞生长及抑制凋亡等途径促进肺癌的侵袭、转移[4]。另有研究证实MMP-7和热休克蛋白90在调节获得性耐药和肿瘤进展中相互作用[5]。但关于MMP-7对肺癌免疫微环境的影响还少见报道。本文通过检测肺癌患者外周血MMP-7 mRNA水平,分析其与各类免疫细胞亚群的相关性,旨在为MMP-7 促进肿瘤进展的机制研究提供新的思路,为肺癌免疫治疗寻求新靶点和方向。
1 资料与方法
1.1一般资料 选择2018年5月至2022年12月本院收治的125例确诊为肺癌的患者作为肺癌组。纳入标准:全部病例均具有完整的临床、影像学资料;经病理或细胞学检查证实且首次入院;未接受过任何相关治疗。排除标准:转移到肺部的其他肿瘤患者;伴有精神类疾病患者;伴有高血压、冠心病等心脑血管疾病,免疫系统疾病,糖尿病、肾功能不全引起的相关疾病等。另外收集同期在本院体检的70例健康人作为对照组。两组的年龄和性别差异无统计学意义(P>0.05),见表1。本研究经过本院医学伦理委员会批准。

表1 两组一般资料比较
1.2试剂与仪器 Trizol、Quantscript RT Kit Quant cDNA第一链合成试剂盒、Real Master Mix(SYBR Gree公司)试剂盒(天根生物科技有限公司)。所有引物由上海基康生物技术有限公司合成。兔抗人CD3-PerCP、兔抗人CD4-FITC、兔抗人CD8-PE、兔抗人CD19-PE、小鼠抗人CD56-FITC、小鼠抗人NKG2D-PE,均购自美国BD公司;FACS Calibur流式细胞仪(美国BD公司),ABI PRISM7000荧光定量PCR分析仪(美国Applied Biosystems公司),BioPhotometer Plus核酸蛋白测定仪(德国Eppendorf公司),全自动酶标仪(奥地利Biocell公司)。
1.3方法
1.3.1外周血T细胞、B细胞、NK细胞受体NKG2D检测 B细胞检查采用双色免疫荧光染色(CD3-FITC/CD19-PE)。CD4+T细胞、CD8+T细胞、NK细胞受体NKG2D检查采用三色免疫荧光染色(CD3-PerCP/CD4-FITC/CD8-PE,CD3-PerCP/CD56-FITC/NKG2D-PE)。根据说明书,取20 μL荧光标记的单克隆抗体加入EP管,设相应的同型对照,然后加入乙二胺四乙酸(EDTA)钾盐抗凝全血100 μL,混匀,孵育,冲洗。加入1 000 μL裂解液,孵育,冲洗,样品上机。采用流式细胞术检测CD4+T细胞、CD8+T细胞、B细胞及NKG2D比例。
1.3.2外周血MMP-7 mRNA的检测 标本的采集及RNA提取:用EDTA抗凝真空采血管采集研究对象空腹外周静脉血3 mL。分离淋巴细胞,吸取淋巴细胞悬液置于1.5 mL无菌EP管中,清洗,离心去上清液,用Trizol法提取总RNA。
cDNA的合成:在20 μL反应体系中取2 μL/g总RNA反转录成cDNA。该反应体系组成如下:10×RTmix 2 μL,oligo(dT)15 2 μL,dNTP 2 μL,RNA 2 μg,Quant Reverse Transcripase 1 μL,最后加入DEPC处理水补至20 μL。37 ℃温育60 min,-20 ℃保存备用。
实时荧光定量PCR的扩增与检测:PCR反应体系为25 μL,以无菌纯H2O代替DNA模板作为阴性对照。PCR反应体系包括:上、下游引物(10 μmol/L)各1.25 μL,2.5×RealMaster Mix/20×SYBR solution 11.25 μL,模板5 μL,其余用无菌去离子液补足。每个样品设3个复孔。反应条件:95 ℃预变性5 min,94 ℃ 45 s,60 ℃ 30 s,共40个循环,在ABI PRISM7000荧光定量PCR分析仪上进行反应。MMP-7 基因及内参引物序列见表2。

表2 MMP-7 基因及内参引物序列
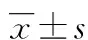
2 结 果
2.1两组外周血MMP-7 mRNA水平比较 肺癌组外周血MMP-7 mRNA水平为36.420±11.339,高于对照组的14.631±4.858,差异有统计学意义(P<0.05)。
2.2不同临床资料肺癌患者外周血MMP-7 mRNA水平比较 不同性别、病理分型、分化程度的肺癌患者外周血MMP-7 mRNA水平比较,差异均无统计学意义(P>0.05)。不同临床分期的肺癌患者外周血MMP-7 mRNA水平比较,差异有统计学意义(P<0.05),其中ⅢB期、Ⅳ期肺癌患者外周血MMP-7 mRNA水平均高于Ⅰ~ⅢA期(P<0.05),ⅢB期与Ⅳ期肺癌患者外周血MMP-7 mRNA水平比较,差异无统计学意义(P>0.05)。见表3。
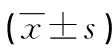
表3 不同临床资料肺癌患者外周血MMP-7mRNA水平比较
2.3两组外周血CD4+T细胞、CD8+T细胞、B细胞、NKG2D比例比较 与对照组相比,肺癌组外周血CD4+T细胞、B细胞、NKG2D比例均明显降低(P<0.05),CD8+T细胞比例明显升高(P<0.05)。见表4。
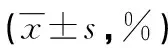
表4 两组外周血CD4+T细胞、CD8+T细胞、B细胞、NKG2D比例比较
2.4肺癌患者外周血MMP-7 mRNA水平与CD4+T细胞、CD8+T细胞、B细胞、NKG2D比例的相关性分析肺癌患者外周血MMP-7 mRNA水平与CD4+T细胞、B细胞、NKG2D比例呈负相关(r=-0.190、-0.237、-0.329,P<0.05),与CD8+T细胞比例呈正相关(r=0.230,P<0.05)。见图1。
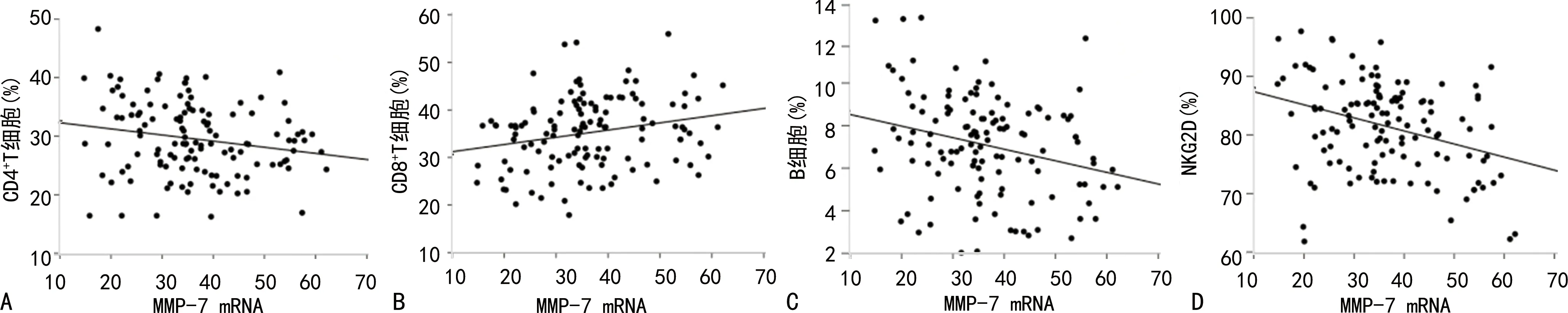
注:A表示MMP-7 mRNA与CD4+T细胞的相关性;B表示MMP-7 mRNA与CD8+T细胞的相关性;C表示MMP-7 mRNA与B细胞的相关性;D表示MMP-7 mRNA与NKG2D的相关性。图1 肺癌患者外周血MMP-7mRNA水平与CD4+T细胞、CD8+T细胞、B细胞、NKG2D比例的相关性散点图
3 讨 论
肿瘤微环境包括肿瘤细胞、细胞外基质、成纤维细胞、内皮细胞、免疫细胞、微血管,以及浸润其中的信号分子[6]。肺癌微环境中免疫细胞的功能及其信号交流与肿瘤微环境有关时,被称为肺癌免疫微环境[7]。MMPs是维持肺癌细胞外基质平衡最重要的一类蛋白水解酶,目前人类有23种 MMPs 家族成员,其中MMP-7(基质溶解素)的编码基因定位于人 11q21~q22,其 cDNA 长 1 094 bp,由 267个氨基酸、4个 MMPs 特征区域组成,基质中的蛋白多糖和糖蛋白是其发挥作用的主要底物,因MMP-7缺乏c端血红蛋白结构域,结构精简,能够特异性识别底物的结构部分很少,所以MMP-7能够降解几乎所有的细胞外基质[8]。另有研究表明,MMP-7通过切割细胞生长因子、细胞表面受体、细胞黏附分子等途径,改变肿瘤细胞生物学行为,同时,被切割掉的这些因子可以诱导 MMP-7 调节抗凋亡细胞的产生,反过来促进肿瘤细胞繁殖,使肿瘤具有更强的侵袭性[9]。有研究证实MMP-7高表达于肺癌上皮组织[4]。本研究通过实时荧光定量PCR对肺癌患者外周血MMP-7 mRNA进行定量检测,结果发现:肺癌患者外周血MMP-7 mRNA水平升高,ⅢB期、Ⅳ期肺癌患者外周血MMP-7 mRNA水平明显高于Ⅰ~ⅢA期,间接证明MMP-7在肺癌侵袭、转移过程中发挥的作用及潜在的临床意义。提示外周血MMP-7 mRNA可作为肺癌诊断和预后判断的肿瘤标志物,MMP-7有望成为肺癌治疗的新靶点。
本研究结果显示:与对照组相比,肺癌组外周血CD4+T细胞、B细胞、NKG2D比例明显降低(P<0.05),CD8+T细胞比例明显升高(P<0.05),提示肺癌微环境处于免疫抑制状态。有研究发现,黑色素瘤中的肿瘤相关性成纤维细胞中MMPs、转化生长因子(TGF)-β、白细胞介素(IL)-6、IL-10、血管内皮生长因子和细胞程序性死亡-配体1在低氧条件下表达和分泌增加,而这些蛋白质组学的变化加强了肿瘤相关性成纤维细胞对T细胞介导的细胞杀伤的抑制作用[10]。由于MMPs家族的蛋白酶活性使NKG2D从癌细胞表面脱落产生可溶性NKG2D,导致肿瘤细胞表面NKG2D下调,介导肿瘤免疫逃逸[11]。MMP-7会让syndecan-1/CXCL1蛋白质复合体脱落,脱落的 CXCL1会趋化并活化肿瘤相关中性粒细胞,从而产生免疫抑制微环境[12]。本研究结果显示:肺癌患者外周血MMP-7 mRNA水平与CD4+T细胞、B细胞、NKG2D比例呈负相关,与CD8+T细胞比例呈正相关。这间接提示MMP-7可能调节免疫细胞的表达,与肺癌免疫微环境相关,与以往研究结论一致。说明MMP-7不但具有降解细胞外基质的功能,为肿瘤侵袭铺平道路,而且MMP-7还调节与炎症、血管生成、细胞增殖、凋亡和迁移有关的几种癌症信号传导途径,具有独特的免疫调节能力,参与介导肿瘤免疫逃逸。另有基础研究发现,cMMP-7 DNA疫苗免疫在BALB/c小鼠中诱导了强烈的CD8+细胞毒性T细胞和Th1型反应,并产生高水平的γ-干扰素[13]。这项实验从另一个角度也证实了MMP-7与肿瘤免疫相关。另有研究表明,许多生长因子、细胞因子如IL-6、TGF-β、β-干扰素可调节MMPs的表达,这些生长因子、细胞因子与免疫细胞也交互联系,因此免疫细胞和基质细胞的募集、激活、重新编程是肿瘤微环境中免疫细胞相互调控和交流的结果[14],结合本研究结果,推断免疫细胞可能通过细胞因子传递信息或者间接激活MMP-7相关信号通路促进其表达。
综上所述,本研究证实了肺癌患者存在肿瘤免疫抑制微环境特征,发现MMP-7 mRNA可能参与肺癌免疫微环境的形成,同时肺癌免疫抑制微环境也可能激活了MMP-7 mRNA的表达,为MMP-7促进肺癌转移的机制研究提供了新方向,MMP-7有望成为肺癌免疫治疗的新靶点。

