基于TLR4/NF-κB通路探究调控MIP-2对肺炎老龄大鼠的干预效果
鲍敏 甄海宁 何芳 丁敏 林玫 袁竹青 陈亚隽 薛欣欣
(武汉市第三医院呼吸与危重症医学科,湖北 武汉 430060)
老年肺炎首发症状为呼吸困难、嗜睡、脱水等,严重危害老年人健康〔1~4〕。相关统计显示,肺炎在各种致死病因中居第5位,而在老年人中致死率高居首位,因此,提高该疾病检出率,及早作出针对治疗,可提高临床疗效,减少死亡率,改善预后〔5~7〕。临床研究认为,肺炎的发生与多种因素相关,巨噬细胞炎症蛋白(MIP)-2在肺炎发病过程中起重要作用,MIP-2属于趋化因子家族成员,可活化中性粒细胞参与炎症反应,其被证实与肺炎发病相关〔8,9〕。本研究建立肺炎老龄大鼠模型,分析下调MIP-2对肺炎老龄大鼠Toll样受体(TLR)4/核转录因子(NF)-κB信号通路的影响,明确MIP-2是否经TLR4/NF-κB信号通路参与该病的发生发展。
1 材料与方法
1.1材料 选取健康雄性老龄大鼠60只〔北京维通利华实验动物技术有限公司,使用许可证号:SYXK(京)2017-0033〕,鼠龄22~25个月,平均(23.5±1.6)个月;体质量337~352 g,平均(344.5±6.0)g。在相对湿度45%~65%、温度(22.6±2.4)℃的环境中适应性喂养1 w。本试验获得医院伦理委员会审批。主要试剂:MIP-2慢病毒载体(上海吉玛公司)、小鼠抗大鼠白细胞介素(IL)-6、IL-1β、肿瘤坏死因子(TNF)-α抗体(Hyclone公司)、大鼠抗小鼠CD3+、CD4+、CD8+抗体(Invitrogen公司)、兔抗大鼠TLR4、NF-κB、内参磷酸甘油醛脱氢酶(GAPDH)抗体(Selleck公司)。
1.2分组及建模 60只健康雄性老龄大鼠,随机选取15只作为健康组,将剩余的45只大鼠麻醉后,固定四肢和牙齿,止血钳夹住舌头固定,上中牙切点悬挂,使用钝圆针头经口插入气管,滴入感染液0.28 ml/kg,保持原位20 min,以便感染液充分流入肺泡,从而引起肺部感染。第2天若老龄大鼠出现体温升高、呼吸急促、弓背、四肢瘫软、饮水降低等症状说明肺炎老龄大鼠建模成功。最终43只老龄大鼠建模成功,随机分为模型组15只,上调组、下调组各14只。
1.3MIP-2慢病毒载体构建及滴定 使用GenBank查找序列获得MIP-2序列,构建MIP-2上调、下调转染质粒,做慢病毒滴度测定。建模完成后上调组尾部注射MIP-2上调病毒悬液10 μl,下调组尾部注射MIP-2下调慢病毒悬液10 μl。健康组、模型组大鼠不做处理,1 w后观察老龄大鼠变化。
1.4miRNA-208转染效率鉴定 在MIP-2转染完成24 h后,实时荧光定量PCR检测MIP-2转染效率,每组随机挑选5只老龄大鼠,麻醉后处死,迅速取肺组织,提取肺组织RNA,逆转录获得cDNA。以GAPDH为内参照,MIP-2上游序列5′-CAGAGTCCTGATGCTCCTTGC-3′,下游:5′-CCAGTCTTATCTTGG GGTCGA-3′;GAPDH上游序列5′-GAACTAAATCAAGATTGTCAGCAA-3′,下游:5′-GGCATGGACTGTGGTCATGA-3′。
1.5肺系数、肺含水量检测 各组大鼠禁食12 h,称体质量并记录,麻醉大鼠,腹主动脉取血,静置30 min,2 000 r/min离心10 min,-37 ℃保存。处死大鼠,摘取肺组织,称质量,计算肺系数。肺系数=〔肺质量(mg)/体质量(g)〕×100%。取各组各3只大鼠肺组织,烘干箱烘干,称量干肺重量,计算肺含水量。肺含水量=〔(肺质量-干肺质量)/体质量〕×100%。剩余肺组织放入4%的多聚甲醛中固定,石蜡包埋保存,以便后续检测。
1.6苏木素-伊红(HE)染色 取出包埋后肺组织标本,流水冲洗20 min,不同浓度酒精脱水,二甲苯透明,切片机连续切片,温水烫平,置于载玻片上,恒温箱烘干,二甲苯脱蜡,苏木素染色,氨水分色,自来水冲洗40 min,伊红染色,酒精脱水,树胶封片,置于显微镜下(北京莱博联泰科技有限公司,型号:E200)观察其肺组织病理学变化。
1.7酶联免疫吸附试验检测炎症因子水平 稀释待检血清,每孔加60 μl待测血清,封反应孔,37 ℃温育50 min,弃反应液,每孔注满洗涤液,浸泡1 min,甩干,每孔加30 μl生物素化抗体,封反应孔,37 ℃温育30 min,洗涤,每孔加30 μl酶标抗体,37 ℃温育30 min,避光加显色剂显色15 min,加终止液,检测IL-6、IL-1β、TNF-α水平。
1.8流式细胞仪检测免疫功能因子水平 抗凝处理待测标本,分为两管,分别加入CD3+、CD4+、CD8+单克隆抗体,室温孵育30 min,两管分别加融血剂,完全溶血后离心处理,弃上清液,洗涤液清洗,两管分别加固定剂,加仪器缓冲液悬浮细胞,置入FACS专用管,流式细胞仪(北京中科盟科技有限公司,型号:BD FACSAriaⅡ)检测CD3+、CD4+、CD8+水平。
1.9Western印迹法检测TLR4/NF-κB通路蛋白相对表达量 细胞裂解液裂解蛋白样品,测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),水浴加热至蛋白变性充分,冷却至室温,电泳,聚偏氟乙烯(PVDF)膜转模,洗涤,加封闭液,室温封闭60 min,加1∶1 000比例稀释的Western一抗,4 ℃孵育60 min,回收一抗,洗涤,加1∶1 000稀释并由辣根过氧化物酶(HRP)标记的二抗,4 ℃孵育60 min,回收二抗,洗涤,显色、成像,以GAPDH为内参,计算TLR4、NF-κB蛋白表达量。
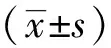
2 结 果
2.1各组肺部组织病理学观察 如图1所示,健康组肺组织结构正常,无病变;模型组、上调组肺组织受损,肺泡失去含气状态,炎性浸润明显,纤毛上皮出现坏死、脱落;下调组肺泡寒气状态、炎性浸润现象明显改善。

图1 各组肺部组织病理学(HE染色,×200)
2.2转染效率鉴定 与健康组(0.27±0.06)比较,模型组、上调组、下调组MIP-2表达量(0.62±0.11、0.87±0.15、0.38±0.09)升高,有统计学差异(F=35.668,P<0.05,n=5);与模型组比较,上调组MIP-2表达量升高,下调组MIP-2表达量降低,有统计学差异(t=3.005、3.776,P<0.05),说明MIP-2转染成功。
2.3各组肺系数、肺含水量比较 与健康组比较,模型组、上调组、下调组肺系数、肺含水量水平较高,具有统计学差异(P<0.05);与模型组比较,上调组肺系数、肺含水量水平较高,下调组肺系数、肺含水量水平较低,具有统计学差异(P<0.05);与上调组比较,下调组肺系数、肺含水量较低,有统计学差异(P<0.05)。见表1。

表1 各组肺系数、肺含水量、炎症因子水平、免疫功能比较
2.4各组炎症因子水平比较 与健康组比较,模型组、上调组、下调组IL-6、IL-1β、TNF-α水平较高,具有统计学差异(P<0.05);与模型组比较,上调组IL-6、IL-1β、TNF-α水平较高,下调组IL-6、IL-1β、TNF-α水平较低,具有统计学差异(P<0.05);与上调组比较,下调组IL-6、IL-1β、TNF-α水平较低,具有统计学差异(P<0.05)。见表1。
2.5各组免疫功能比较 与健康组比较,模型组、上调组、下调组CD3+、CD4+水平较低,CD8+水平较高,具有统计学差异(P<0.05);与模型组比较,上调组CD3+、CD4+水平较低,CD8+水平较高,下调组CD3+、CD4+水平较高,CD8+水平较低,具有统计学差异(P<0.05);与上调组比较,下调组CD3+、CD4+水平较高,CD8+水平较低,有统计学差异(P<0.05)。见表1。
2.6各组TLR4/NF-κB通路蛋白相对表达量对比 与健康组比较,模型组、上调组、下调组TLR4、NF-κB蛋白表达量较高,具有统计学差异(P<0.05);与模型组比较,上调组TLR4、NF-κB蛋白表达量较高,下调组TLR4、NF-κB蛋白表达量较低,有统计学差异(P<0.05);与上调组比较,下调组TLR4、NF-κB蛋白表达量较低,有统计学差异(P<0.05)。见表2、图2。

表2 各组TLR4/NF-κB通路蛋白相对表达量对比
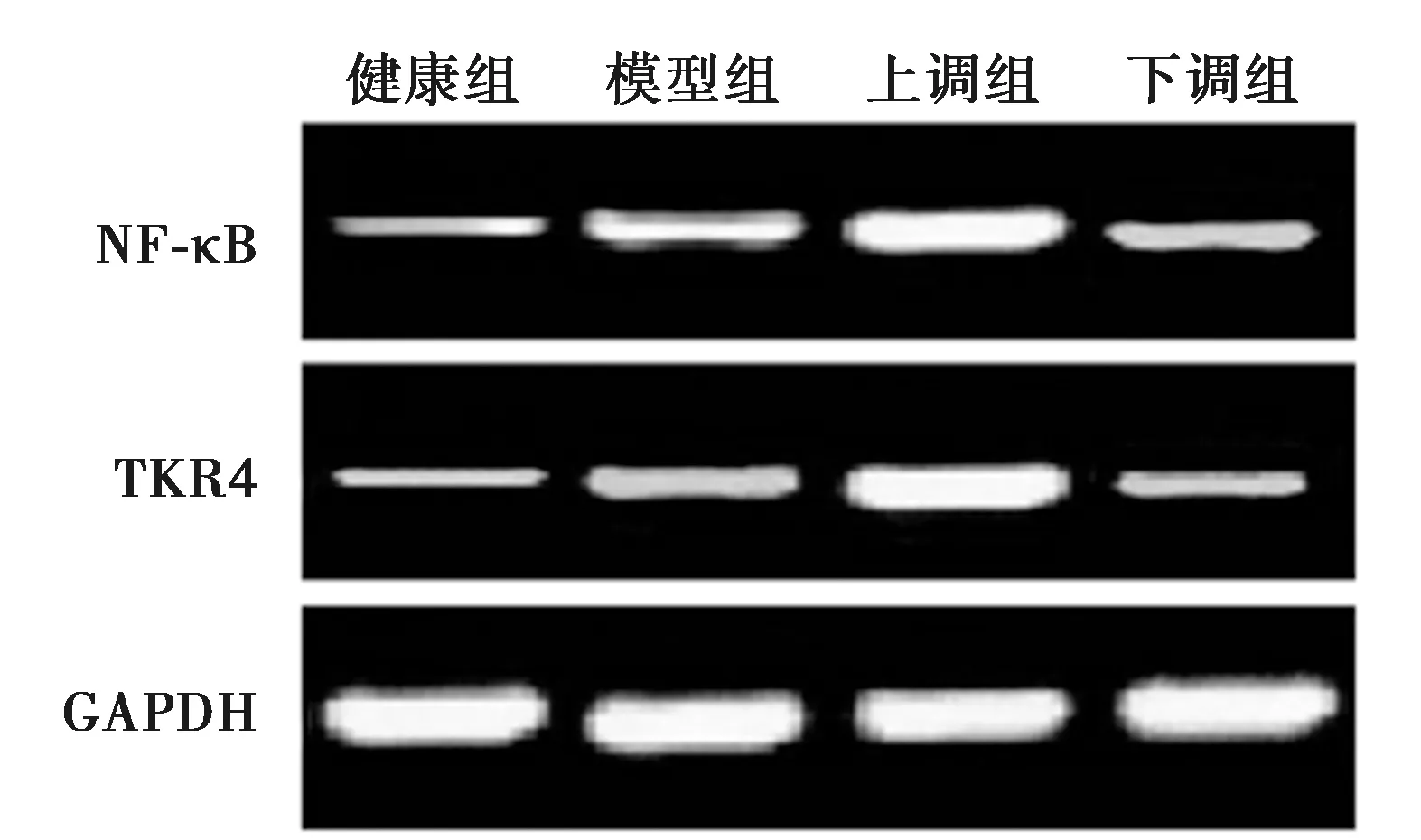
图2 Western印迹检测各组TLR4/NF-κB通路蛋白表达
3 讨 论
肺系数、肺含水量是评估肺功能修复的重要指标,肺系数、肺含水量越低,说明其肺功能修复程度越好。有研究显示,肺炎大鼠经下调MIP-2干预后,肺系数降低,可能是MIP-2下调后可促进肺组织细胞修复〔10〕。本文研究表明,下调MIP-2处理肺炎老龄大鼠,能有效降低肺系数、肺含水量,从而起到肺保护作用。
MIP-2是一种碱性蛋白质,由巨噬及血管内皮细胞分泌,属于C-X-C亚族,可通过其趋化与活化的作用参与机体炎症反应〔11,12〕。相关报道显示,MIP-2可调控IL-6、IL-1β、TNF-α等炎症因子水平,从而参与肺炎的炎症表达,当炎症反应诱发非功能损伤后,可趋化中性粒细胞调控促进炎症因子表达,从而损伤机体肺功能,与本文研究结果一致〔13,14〕。还有研究认为,调控MIP-2表达可改善肺炎老龄大鼠的肺组织CD3+、CD4+等免疫因子水平,可能是MIP-2可促进T细胞的增殖与活化,从而调控机体免疫功能〔15〕。本文研究结果表明,对文中老龄大鼠MIP-2做下调处理,肺炎老龄大鼠的肺功能损伤明显被修复,表现为老龄大鼠肺组织炎症反应被抑制、免疫功能提升,分析其原因可能是MIP-2下调后因其诱发的炎症因子的合成被抑制、免疫细胞因子合成增加,从而抑制肺组织进一步损伤,促进肺功能恢复。
TLR4/NF-κB是一种重要的信号通路,可介导炎症反应、先天性免疫,另在自噬中也有重要作用〔16〕。TLR4是TLR家族重要成员,是一种膜受体“门户”,可识别各种外源性病原体,其活化后,可放大机体炎症反应,从而加重炎症损伤;NF-κB是调节核转录的因子,可抑制蛋白的结合,从而调节免疫应答,当其被激活后,可诱导促炎因子分泌,加重机体炎症反应〔17,18〕。已有研究显示,TLR4/NF-κB信号通路参与肺组织损伤过程,如在肺炎中其被激活,可介导肺泡壁增厚,导致支气管黏膜充血、水肿,进一步加剧肺组织损伤〔19,20〕。另有报道显示,在肺组织损伤过程中,肺组织可经调控MIP-2的表达,调控一些关键的信号通路活性,参与细胞增殖、凋亡,最终导致肺功能损伤〔21〕。本研究结果显示,经下调MIP-2干预后TLR4/NF-κB信号通路活性被抑制明显,下调MIP-2可能经促进TLR4/NF-κB信号通路失活,从而发挥对肺组织的损伤修复作用。
综上所述,下调MIP-2对肺炎老年大鼠进行干预,能有效改善肺系数、肺含水量,减轻炎症反应,提升机体免疫能力,其作用机制可能与抑制TLR4/NF-κB信号通路活性相关。

