代谢工程改造微生物合成生物基单体的进展与挑战
高聪,陈城虎,陈修来,刘立明
(江南大学食品科学与技术国家重点实验室,江苏 无锡 214122)
目前的塑料制品主要是通过化石燃料合成或半合成的。在塑料生产、应用、回收和焚烧的每个阶段,都涉及了温室气体的排放与严重的环境污染[1]。为减少环境污染,消除对化石燃料的依赖,生物塑料作为化石塑料的替代品越来越受到人们的关注。生物塑料是由可再生资源(如纤维素、淀粉、木质素等)制成的生物基聚合物。与化石塑料相比,生物塑料可实现资源回收,具有更低的碳足迹,并表现出良好的材料性能,在创建低碳循环经济中发挥着关键作用[2]。
根据2021 年欧洲生物塑料协会的报告,目前市场上代表性的生物塑料主要包括聚己二酸对苯二甲酸丁二醇酯(PBAT)、聚乳酸(PLA)、聚丁二酸丁二醇酯(PBS)、聚酰胺(PA)、聚对苯二甲酸丙二醇酯(PTT)和聚对苯二甲酸乙二醇酯(PET)等,上述生物塑料约占总生物塑料市场份额的65%。而构成这些生物塑料的单体主要包括1,4-丁二醇(1,4-BDO)、1,3-丙二醇(1,3-PDO)、己二酸、丁二酸、戊二胺、戊二酸、乳酸、对苯二甲酸等。
利用微生物生产塑料单体具有条件温和、环境友好、操作简便等优点。预计到2025 年,生物塑料的年市场份额将增加到总塑料市场份额的18%[3]。随着合成生物学技术的进步,已经开发了各种微生物细胞工厂用于高值化合物生产(图1)。其中一些产品,如丁二酸,已经进入了商业化生产。然而,由于部分单体的经济可行性较低,实现工业规模的微生物生产仍然具有挑战性[4]。这些挑战包括:①原材料利用效率低,在单体生产过程中,提高可再生原料的利用效率对于避免使用粮食作物或降低生产成本至关重要;②单体合成效率差,微生物代谢网络非常复杂,导致单体合成途径效率较低;③环境耐受程度较弱,发酵过程中的各种因素,如pH、渗透压和高浓度代谢物均会对微生物单体生产的过程造成不利影响。
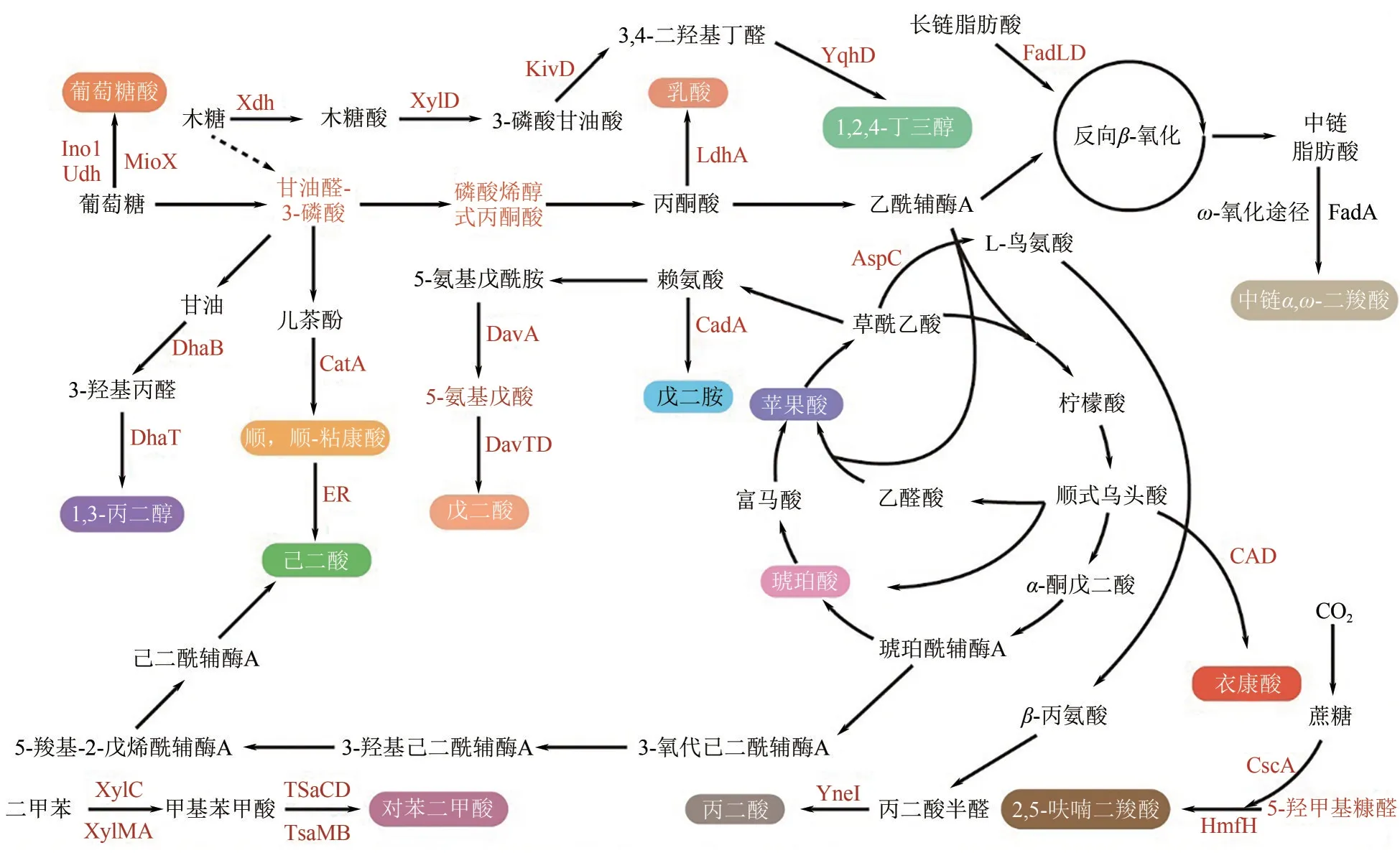
图1 微生物合成塑料单体的代谢途径
本文从底物利用能力、单体合成性能、胁迫环境耐受三个方面综述了提高微生物塑料单体生产效率的方法和策略。同时,对微生物细胞塑料单体存在的挑战和未来发展方向进行了展望。
1 廉价底物的高效利用
自然界中有丰富的可再生资源,如CO2、木质纤维素、葡萄糖等,但对这些底物的高效利用仍具有挑战性。为了解决这一问题,提高工程菌株塑料单体合成效率,目前主要有:设计底物利用途径、提高底物利用能力、优化底物转化过程等三种方法。
1.1 设计底物利用途径
设计底物利用途径可以改善廉价底物向高附加值生物基单体的转化过程。设计底物利用途径根据途径的来源可分为挖掘内源性底物利用途径、构建人工底物利用途径、整合内源和人工底物利用途径和偶联多菌底物利用途径等四种类型。
(1)挖掘内源性底物利用途径。模式异养微生物,如大肠杆菌和酵母,经改造后可生产多种生物基单体。但这些微生物难以利用CO2和甲烷等C1底物。通过招募具有天然C1底物利用能力的微生物,可以产生强大的代谢驱动力,驱动碳流合成目标单体。例如,对光自养微生物细长聚球藻进行启动子挖掘和基因组水平代谢途径改造,使其合成赖氨酸。在此基础上,引入尸胺和戊二酸异源合成途径,实现从CO2直接光合生产生物基单体[5]。类似的,通过在甲烷氧化菌OB3b 中引入赖氨酸脱羧酶、天冬氨酸激酶和内消旋-二氨基庚二酸脱羧酶,最终工程菌株可直接利用甲烷为底物,产生283.63mg/L尸胺[6]。
(2)构建人工底物利用途径。对于一些特殊的底物,如化学或餐饮废弃物,微生物可能没有天然的底物利用途径。为此,可以设计人工途径使工程菌株利用这些非代谢底物,以获得所需的化学物质。例如,通过酶挖掘和多酶级联反应设计,在台湾假单胞菌VLB120中构建了利用环己烷合成己二酸的代谢途径。经途径酶表达优化和生物反应器优化,工程菌株以环己烷为底物可生产10.2g/L 己二酸[7]。类似的,本文作者团队通过模块优化β-氧化途径和ω-氧化途径,在大肠杆菌构建了以废弃食用油为底物生产中链α,ω-二羧酸的代谢途径。经实验室适应进化,该菌株以废弃食用油为唯一碳源,可生产15.26g/L中链α,ω-二羧酸[8]。
(3)整合内源和人工底物利用途径。虽然微生物可以通过天然途径利用大多数底物,但其效率普遍较低,通过结合人工途径可以提高底物利用效率。例如,大肠杆菌本源羧化酶固碳效率较低,为解决这一问题,本文作者团队开发了自组装硫化镉纳米颗粒来改善CO2固定过程,并设计了CO2减排开关来弱化CO2释放过程。通过整合CO2固定和释放模块,工程大肠杆菌可以协同利用葡萄糖和CO2生产1.48mol/mol葡萄糖的苹果酸[9]。
(4)偶联多菌底物利用途径。在菌株中引入多酶参与的异源底物代谢途径会引起细胞负荷,影响细胞生长性能和单体合成效率[10]。为解决这一问题,可以设计共培养策略:一种细胞用于降解复杂底物,而另一种细胞用于单体合成。例如,通过共培养可分解纤维素的里氏木霉和可生产乳酸的戴尔根霉,该混菌培养策略以微晶纤维素为底物,合成了乳酸[11]。与纯菌株相比,混菌体系可以结合不同菌株的功能来实现对一些特殊底物(如CO2)的直接利用。最近,通过共同培养工程细长聚球藻和恶臭假单胞菌设计了一个混菌体系[图2(a)],在该体系中,细长聚球藻可以固定CO2产生蔗糖,而所产生的蔗糖可以支持恶臭假单胞菌的生长,以催化5-羟甲基糠醛转化为2,5-呋喃二羧酸[12]。
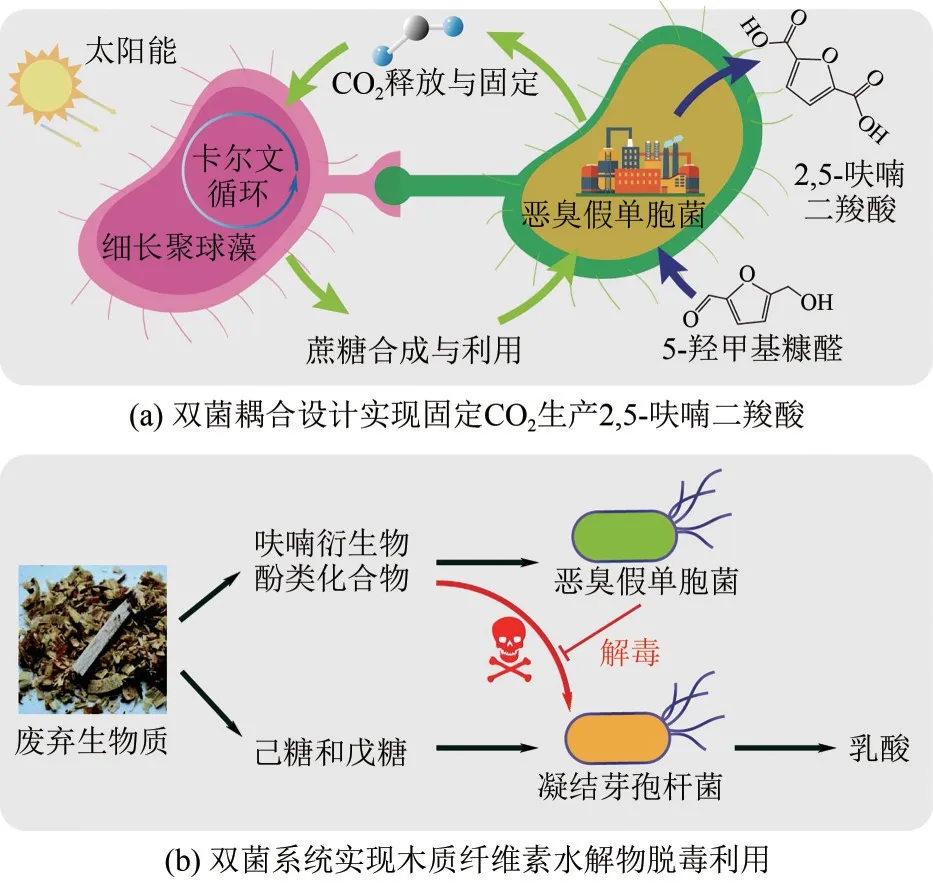
图2 廉价底物的高效利用
1.2 强化底物利用能力
实现微生物利用廉价和丰富的底物生产高附加值化合物降低生产成本的重要策略。然而,并不是所有的底物都可以不经预处理直接利用[13]。因此,加强底物的利用能力尤为重要。为实现这一目标,目前主要有:优化传质效率、促进底物解聚、扩大底物谱、实现底物脱毒等四种策略。
(1)优化传质效率。微生物对底物利用能力的提高往往伴随着底物传质效率的提高。可以通过开发提高界面传质效率的水-有机双相转化体系,提高底物传质效率。例如,对二甲苯(PX)和对苯二甲酸(TPA)都是易挥发的化合物,几乎不溶于水。为了提高传质效率,采用具有生物相溶性的油醇作为有机相进行两相转化。PX 可以溶解在油醇中,并允许以特定的分配系数分配到水相中。在该双相转化体系中,工程大肠杆菌经过46h的生物转化可获得6.9g/L 的TPA[14],通过将合成路径整合到基因组上并进行转化工艺优化,TPA产量进一步提升到了38.3g/L[15]。
(2)促进底物解聚。微生物可以高效利用五碳和六碳基质。然而,大部分微生物难以高效利用高度聚合的生物质原料,需要将这些聚合底物解聚为单糖后才能被微生物吸收利用。为了降解这些底物,可以采用多种物理或化学的底物解聚方法。例如,最近设计了一种共溶剂(NaOH/ChCl:TH/Water),可以在温和条件下有效降低甘蔗渣的聚合度。工程大肠杆菌可以直接利用预处理后的甘蔗渣水解物生产己二酸,产率达0.39g/g 葡萄糖,具有较高的成本效益[16]。
(3)扩大底物谱。微生物在利用不同糖类底物时存在偏好性,导致资源浪费[17]。通过扩大微生物的底物谱,可大大降低整体生产成本。例如,野生型谷棒杆菌菌株不能直接利用低聚木糖。为解决这一问题,可利用细胞表面展示技术,借助PorH 锚定蛋白在谷棒杆菌细胞表面表达β-木糖苷酶,引入木糖同化途径,使工程谷棒杆菌以低聚木糖为底物生产了11.6mmol/L的戊二胺[18]。类似的,在大肠杆菌细胞表面表达α-淀粉酶,工程菌株能够以淀粉为底物直接生产1,2-丙二醇和1,3-丙二醇[17]。
(4)实现底物脱毒。对底物进行脱毒处理也有助于提高微生物的底物利用能力。预处理木质纤维素生物质的过程中会产生各种化学抑制剂,严重阻碍微生物的生长[19]。为了解决这一问题,可以开发一个微生物群落实现抑制剂的脱毒处理。例如,在由工程恶臭假单胞菌和凝结芽孢杆菌组成的微生物群落中,恶臭假单胞菌被设计用于木质纤维素水解物中有毒底物的脱毒处理,而凝结芽孢杆菌被设计用于从水解物中吸收碳源,并合成了35.8g/L 的乳酸[图2(b)][20]。类似的,通过建立一个由恶臭假单胞菌和大肠杆菌组成的微生物合成群落,以木质纤维素水解物为底物,生产得到1.02g/L 中链聚羟基烷酸酯[21]。
1.3 优化底物转化过程
除了设计底物利用途径以提高底物利用能力外,还可以优化底物转化过程,以促进底物的高效吸收和利用。总的来说,可以提出四种策略:过表达转运蛋白优化底物转运、缓解碳分解代谢抑制、实现一步生物转化、强化能量供给提高底物转运效率。
(1)过表达转运蛋白。底物的利用率会受到底物传输效率的影响。适当过表达转运蛋白可以增强细胞从胞外摄取底物的效率。例如,在解脂耶氏酵母中引入丁二酸合成途径后,工程菌株在甘油培养基中生长速率较低。通过过表达甘油激酶GUT1,工程细胞对甘油的摄取速率较对照菌株提高了13.5%,细胞比生长速率由0.30h-1提高至0.37h-1,丁二酸产量和生产强度分别提高了32%和143%[22]。
(2)缓解碳分解代谢抑制。当多种底物同时存在时,可能会发生碳分解代谢抑制,从而抑制细胞对非偏好性碳源的利用效率[23]。为此,可以发展三种缓解分解代谢抑制效应的方法。首先,删除碳抑制控制(Crc)基因。例如,恶臭假单胞菌可经工程改造转化阿魏酸为黏康酸。然而,培养基中需要添加用于补充能量和细胞生长的葡萄糖,导致碳分解代谢抑制,降低细胞生产性能。通过将菌株的Crc 编码基因删除,可使工程菌株转化阿魏酸为黏康酸的得率提高一倍[24]。其次,筛选木糖分解代谢操纵子XylR突变体。研究发现在XylR中引入R121C和P363S突变,可以激活木糖分解代谢。与野生型菌株相比,突变体菌株使用葡萄糖-木糖混合底物生产乳酸时,产量提高了50%[25]。第三,敲除葡萄糖转运蛋白Crr。敲除肺炎克雷伯菌的葡萄糖转运蛋白Crr,可以增加甘油进入1,3-丙二醇合成途径的当量,缓解葡萄糖对甘油的代谢抑制。工程菌株的1,3-丙二醇浓度从61g/L增加到78g/L,甘油转化率达到59.5%[26]。
(3)实现一步生物转化。在转化利用淀粉、纤维素和木聚糖等聚合底物时,需要涉及多个独立的生物过程,包括水解酶的生产、底物水解成单糖、以及单糖代谢成目标产品。为降低生产成本和简化过程,可以招募一些具有同时水解和发酵底物能力的菌株,以实现一步生物转化过程[27]。例如,食木薯乳杆菌DSM13343具有分泌α-葡萄糖苷酶和蛋白酶并同时合成乳酸的能力,利用该特性,菌株可降解食物废弃物直接发酵得到18.69g/L乳酸[28]。
(4)强化能量供给。优化生物转化过程中能量供给,能使微生物以更低的能量消耗来利用底物,进而提高底物的利用效率。为了实现这一目标,可以提高细胞内ATP 浓度,以补偿底物吸收和运输过程(如碳固定和木糖运输)中消耗的能量。例如,本文作者团队[29]在改造大肠杆菌合成苹果酸时,通过在大肠杆菌中过表达磷酸烯醇式丙酮酸羧激酶与CO2固定途径,苹果酸生物合成途径的CO2固定效率提高了110%。
综上所述,通过设计底物利用途径、提高利用能力、优化转化过程,底物利用在生物基单体生物合成中起着重要作用。开发高效的底物利用策略具有多种优势:①降低生产成本,建立高效利用廉价丰富底物的策略对于提高生物基单体相对于石油化工基单体的市场竞争力是非常重要的;②环境保护,生活垃圾往往造成资源浪费和环境污染,发展废弃物高效利用策略是实现绿色生物制造的关键[8];③微生物合成性能提高,通过缓解碳分解代谢抑制、加强能量供给等一系列策略,可以提高工程菌株在生物基单体生产中的效率。
2 提高生物基单体合成效率
通过对廉价底物的高效利用,可以大幅降低微生物基材料的生产成本。此外,为了促进底物转化为目标产物,还可以从酶、途径、细胞等不同调控水平发展精细调控策略,以提高微生物细胞工厂的合成效率。这些策略根据调控层次可以划分三大类:强化关键酶性能、优化合成途径效率以及调节细胞代谢网络。
2.1 强化关键酶性能
强化关键酶的性能以提高微生物细胞工厂合成塑料单体的效率是一种常见的策略。可以从四个方面对途径酶的性能进行改善:筛选异源酶以获得最佳酶、促进蛋白质正确折叠最大化酶活、提高蛋白表达水平促进更多代谢通量、酶定向进化改变酶的特性。
(1)筛选异源酶。在合成途径中,途径酶的性能往往对合成效率和反应方向起着至关重要的作用。在微生物合成途径中,当内源酶活性不够高或缺乏能发挥特定作用的酶时,可通过筛选具有高催化效率的异源酶进行优化。例如,对不同来源的苹果酸脱氢酶(MDH)进行了筛选,并在产琥珀酸曼氏杆菌中进行表征。结果表明,来源于谷棒杆菌的MDH 具有最高的酶活性,并进一步用于取代产琥珀酸曼氏杆菌内源MDH,使丁二酸浓度达到134.25g/L[30]。在一项类似的研究中,将来源于凝结芽孢杆菌的烯酸还原酶引入酿酒酵母,通过三段发酵工艺优化,最终工程菌株可直接以葡萄糖为底物生产己二酸[31]。
(2)促进蛋白质正确折叠。酶的正确折叠也在一定程度上增强酶的性能。通过正确的蛋白质折叠,可以提高途径酶的表达水平和催化活性,加快生物合成过程。通常,蛋白质折叠可以通过优化蛋白质表达条件、表达宿主、表达质粒、信号肽、分子标签和伴侣蛋白来调节[32]。例如,通过在赖氨酸脱羧酶中引入两性离子肽来促进其正确折叠,工程型赖氨酸脱羧酶的酶活性是野生型赖氨酸脱羧酶的两倍[33]。
(3)提高蛋白表达水平。提高路径酶的表达量是强化代谢效率、消除代谢瓶颈、调节代谢物分布的一种简单方法。随着组学技术和表征技术的发展,已经获得了许多可用于调控基因表达的基因元件,如启动子元件、RBS元件、终止子元件等。例如,为了减少工程大肠杆菌细胞中戊二胺的积累和抑制,可以使用高拷贝质粒提高双向戊二胺转运蛋白PotE 的表达量,以驱动戊二胺到目标化合物戊二酸的转化[34]。
(4)酶定向进化。途径酶活性容易受到外部环境和内部环境的影响。因此,有必要对酶催化活性、稳定性和立体选择性进行改造,以提高微生物细胞的性能[35]。例如,赖氨酸脱羧酶在转化赖氨酸为戊二胺的过程中易受到pH 的影响,阻碍了其在工业生产中的应用。为此,通过对赖氨酸脱羧酶的pH 稳定性进行蛋白质定向进化。在pH 为10.0 时,突变体M3 的戊二胺产量比对照菌株提高了6 倍,工程菌株在15h内可产生418g/L戊二胺,这是迄今为止报道的最高浓度[36]。利用蛋白质定向进化可以同时对酶的不同特性进行改造。例如,结合定向进化和计算引导的虚拟筛选可以提高赖氨酸脱羧酶的热稳定性和碱性稳定性。含有最佳突变体的工程菌株在50℃条件下,不经pH 调节可产生160.7g/L 戊二胺[37]。
2.2 优化合成途径效率
微生物单体合成途径往往存在代谢反应步骤长、副产物积累多等挑战。因此,通过优化合成途径效率,可使底物更高效地转化为目标产物。目前用于优化合成途径效率的策略主要包括平衡酶表达水平、重定向目标代谢通量、缩短空间距离、动态通路调节等。
(1)平衡酶表达水平。多种酶参与的合成途径普遍存在代谢瓶颈,导致中间代谢物积累,影响代谢途径的催化效率。为此,可以通过调控各酶的表达水平来提高代谢途径的整体催化效率[图3(a)]。常见的酶表达水平优化策略包括质粒优化[38]、启动子工程[39]和核糖体结合位点工程[40]。例如,本文作者团队[38]利用不同拷贝数质粒组合优化戊二酸生物转化途径中涉及的七种酶,提高了戊二酸的合成效率。类似的,通过不同强度的启动子和核糖体结合位点优化,工程大肠杆菌以赖氨酸为底物可转化合成77.62g/L戊二酸[32]。
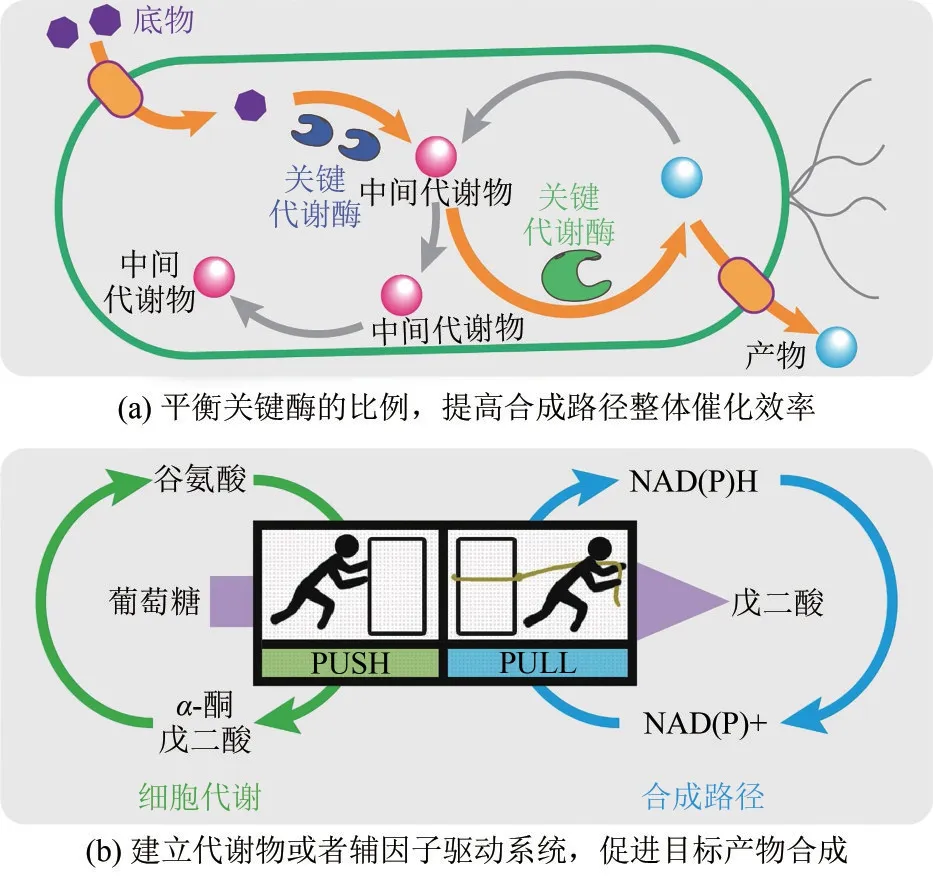
图3 提高路径合成效率
(2)重定向目标代谢通量。微生物代谢网络存在广泛的调控和复杂的相互作用,导致目标产物合成效率低下。可以采用两种方法将代谢通量重定向到目标产物合成。首先,过表达合成途径关键酶以增加前体浓度。例如,通过优化酿酒酵母中丙二酰辅酶A 的合成途径来改善前体丙二酰辅酶A 的供应,使丙二酸产量达到1.62g/L[41]。同样的,通过增加合成前体5-氨基戊酸的积累量,工程谷棒杆菌的戊二酸产量达到22.7g/L[3]。其次,阻断副产物合成途径减少代谢损失。例如,本文作者团队[42]通过引入CRISPRi、稳定期启动子和蛋白质降解标签等功能元件,构建了一个用于重定向代谢通量的自主调节回路。通过设置向导RNA,同时靶向抑制不同副产物合成途径,戊二酸生产菌株的乙酸、乳酸和甲酸等副产物浓度分别比对照菌株降低了40%、41%和35%。
(3)缩短空间距离。构建底物通道是减少中间代谢物逸出、提高多酶级联反应效率的重要方法之一。基于支架策略,可以将不同的途径酶固定在DNA、RNA 或蛋白质支架上,缩短空间距离,提高合成途径催化效率[43]。例如,通过将磷酸烯醇式丙酮酸羧化酶和苹果酸脱氢酶排列在工程大肠杆菌合成蛋白质支架复合物上,苹果酸的产量提高了3.6倍[44]。
(4)动态通路调节。动态控制化学品生产与细胞生长是提高化学品合成效率的有效手段。通过动态途径调控,碳通量可以在特定时间或代谢物浓度下定向到目标产品合成[45]。例如,通过设计一种传感器调节器和基于RNAi 的双功能动态开关,实现了目标生物合成模块的上调和竞争通路基因的下调,使工程大肠杆菌菌株生产1.8g/L黏康酸,显著高于静态对照菌株[46]。此外,还可根据外界环境变化设计各种动态开关。例如,利用低pH 诱导的启动子Pgas动态控制顺式乌头酸脱羧酶基因的表达,使工程菌株的衣康酸浓度提升到4.92g/L[47]。
2.3 调控细胞代谢网络
通过优化细胞内碳通量和氧化还原平衡,可以提高工程微生物的合成效率。常用的策略包括组学辅助关键目标识别、代谢驱动设计、工程转录因子和调节氧化还原稳态。
(1)组学辅助关键靶点识别。为了适应复杂多变的外界环境,微生物进化出了多种反馈调控网络,降低了理性代谢工程的成功率。为解决这一问题,可以采用基因组组、转录组和代谢组的方法筛选关键的调控靶点。例如,基于谷棒杆菌的基因组代谢网络模型和组学分析,获得了11 个与戊二酸生物合成相关的关键基因。将这些基因组合改造后,工程菌株戊二酸产量达105.3g/L[48]。第二种方法是建立高通量的筛选文库,用于识别工程靶点,增强塑料单体生产效率。例如,为了获得与戊二胺生产相关的关键基因,构建了67 个可抑制基因表达的sRNAs 库,并在大肠杆菌中进行了测试。最优工程菌株能生产13.7g/L的尸胺[49]。
(2)代谢驱动设计。微生物细胞工厂中的辅因子和前体物质在目标产物的生物合成中起着至关重要的作用。通过偶联辅因子或前体的再生和消耗反应,可以产生代谢驱动力,从而提高目标产物的合成效率。例如,在工程大肠杆菌中,通过将赖氨酸分解代谢途径产生的多余NADP+和α-酮戊二酸循环到大肠杆菌中消耗NADP+和α-酮戊二酸的戊二酸生物合成途径中,可以驱动戊二酸的高效生物合成,产量达54.5g/L[34][图3(b)]。类似的,通过引入强制ATP消耗途径来降低胞内过量的ATP,更多的碳通量被重定向到2,3-丁二醇合成途径,使工程大肠杆菌2,3-丁二醇浓度提高了10倍[50]。
(3)工程转录因子。转录因子可以调控多个基因甚至全局代谢网络基因,因此可以作为提高微生物单体合成效率的重要靶点。例如,基于转录组学分析,确定了删除需钠弧菌中的全局转录调控因子ArcA和GlpR可增强1,3-丙二醇合成途径的碳通量,最终工程菌株的1,3-丙二醇的得率提高到0.50mol/mol甘油[51]。
(4)调节氧化还原稳态。氧化还原稳态可以通过调节ATP 或NAD+浓度来实现,调节微生物细胞工厂的氧化还原平衡,可以提高单体合成效率。例如,通过调节大肠杆菌胞内ATP 浓度[52]和NADH/NAD+浓度比[53]以适配丁二酸生物合成的需求,工程菌株丁二酸浓度可分别提高282%和39%。类似的,本文作者团队[54]在大肠杆菌中开发了基于生物被膜杂合CdS纳米的策略,使胞内NADH浓度提高83.3%,NADH 依赖性L-苹果酸产量提升至45.93g/L。
综上所述,通过强化关键酶的性能、优化合成途径的效率、调控细胞代谢网络等一系列的调控策略,可以显著提高微生物细胞工厂的效率。未来,通过整合逻辑门和生物传感器遗传元件,塑料单体的合成途径可以实现定时、定量、定需的表达,以提高细胞活性和生产效率[55]。
3 强化细胞环境耐受性
在微生物发酵生产过程中,塑料单体的持续合成会引起渗透压、酸碱胁迫,使微生物细胞受到损伤或抑制,影响细胞的生长和生产[55]。因此,提高微生物对环境胁迫的耐受性显得尤为重要。可以从三个方面加强底盘细胞的耐受性:增强酸碱胁迫耐受能力、提高渗透胁迫耐受性和增强代谢物耐受胁迫能力。
3.1 增强酸碱胁迫耐受性
随着产物的积累,发酵体系的pH 也会发生变化。因此,有必要提高细胞的酸碱耐受性,以减少酸碱胁迫对微生物细胞的毒副作用。常用的解决策略包括:引入保护剂、工程细胞膜、表达耐酸基因、筛选耐受菌株。
(1)引入保护剂。维持细胞稳态的常见调节策略是引入pH 中和剂,以维持发酵环境的稳定。例如,使用赖氨酸作为底物生产戊二胺时,为了防止发酵体系pH 持续增加,可以对生物反应器进行修改,以重新捕获赖氨酸脱羧过程中释放的CO2。通过招募CO2作为pH 中和剂,并将其重新溶解到发酵液中,降低了发酵系统的pH,使戊二胺的转化得率达到0.99mol/mol 赖氨酸[56][图4(a)]。类似的,在丁酸梭菌发酵生产1,3-丙二醇的过程中,通过建立CO2原位捕集技术稳定生产体系pH,工程菌株的1,3-丙二醇产量达到88.6g/L[57]。
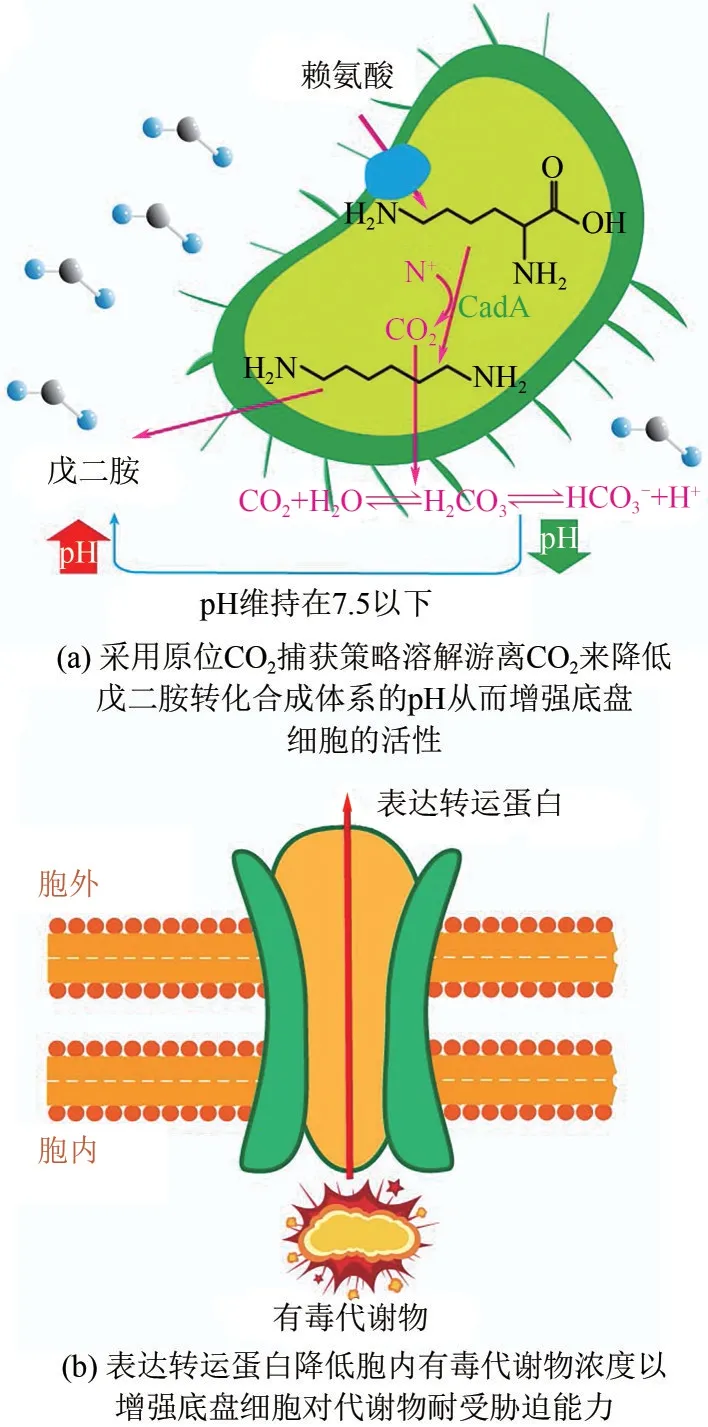
图4 提高底盘细胞环境适应性
(2)工程细胞膜。虽然添加保护剂可以促进微生物的生长和生产,但它也增加了生产总成本。细胞膜作为抵御环境压力的第一道屏障,可以通过改造其流动性和完整性,来增强细胞的环境抗性[58]。例如,通过增加反式不饱和脂肪酸的含量来改变细胞膜的流动性,可以提高产琥珀酸曼氏杆菌的产物耐受性,从而使丁二酸产量比对照菌株增加[59]。除了改变膜组部,也可以设计膜转运蛋白来提高细胞的酸碱胁迫耐受性。例如,在乳酸乳球菌中过表达膜转运蛋白ZitP和ZitQ,对提高细胞耐酸能力有显著作用[60]。
(3)表达耐酸基因。基因工程也是提高细胞胁迫耐受能力的有效的策略。具体改造靶点包括过表达负责胞内质子转化的基因或一些关键耐酸基因。例如,在大肠杆菌中,通过过表达氢化酶附属蛋白HypB-HypC 催化质子还原生成氢[61]或通过引入三种质子消耗诱导的耐酸系统[62],工程大肠杆菌可以在极低的pH 条件下存活。过表达某些关键基因可用于提高细胞的耐酸能力。例如,通过在酿酒酵母中过表达耐酸基因IoGAS1[63]或在大肠杆菌中过表达耐酸基因RecT[64],这两种工程菌株在高浓度乳酸下都表现出良好的细胞生长和生产性能。
(4)筛选耐受菌株。除了理性代谢工程方法外,非理性菌株筛选方法也可以提高菌株的胁迫耐受能力。例如,产丁二酸放线杆菌在低pH 条件下的产酸能力很差。通过适应性实验室进化,获得了在弱酸条件下细胞生长和丁二酸合成能力强化的突变菌株BC-4,在pH=4.0厌氧条件下,突变菌株的比生长速率和丁二酸产量分别较出发菌株提高了2.95倍和5.8倍[65]。
3.2 提高渗透胁迫耐受
在微生物生产过程中,渗透应激会随着目标产物的积累而增加,导致细胞代谢活性降低,甚至细胞死亡。因此,提高细胞对渗透胁迫的耐受性,可促进细胞的可持续生长和生产。常用的策略包括:强化外排系统、突变关键蛋白、强化全局调控、添加保护剂。
(1)强化外排系统。通过加强工程菌株的外排系统,可以提高菌株的渗透胁迫耐受性。例如,在丁二酸生物生产过程中,随着产物丁二酸的积累,导致高浓度的Cu(Ⅰ)会积聚在细胞周质中,引起高渗透胁迫。为了解决这一问题,研究人员筛选获得了一种Cus铜外排系统,可用于激活CusCFBA的表达,将Cu(Ⅰ)运输出细胞以减轻毒性。引入CusS突变后,在添加30g/L 丁二酸二钠的培养基中,产丁二酸菌株的生物量增加了36%[66]。
(2)突变关键蛋白。一些关键蛋白在提高细胞抗渗透胁迫能力中起着重要作用。因此,理性调节它们的表达,可以获得所需的细胞表型。例如,通过对关键耐受调节蛋白RNA 聚合酶RpoB 进行突变,细胞生长和丁二酸产量都可以增加40%以上[67]。非理性的菌株筛选也可以提高微生物的渗透耐受胁迫。例如,作者团队在前期的研究中,通过对一株牛瘤胃筛选获得的丁二酸高产菌株进行联合诱变(ARTP 和60Co-γ 辐照)筛选,所获得的突变菌株丁二酸产量增加了3.3倍[40]。
(3)强化全局调控。渗透压的调控涉及多个基因的共表达,难以通过调节单个基因来实现细胞表型改变。全局转录因子可以影响与高渗有关的多种基因表达,因此可以作为调控微生物渗透胁迫的靶点。例如,通过过表达大肠杆菌全局调控因子IrrE,可以强化内源性渗透保护剂(如海藻糖和甘油)的合成,使工程大肠杆菌能在100%海水培养基中生产24.5g/L丁二酸[68]。
(4)添加保护剂。添加保护剂是提高细胞渗透压耐受性的有效策略。在发酵后期,由于渗透胁迫的增加,导致部分途径酶活性下降,影响细胞生产性能。为此,可以在培养基中加入一些保护剂。例如,在产琥珀酸放线杆菌发酵生产丁二酸的发酵后期添加脯氨酸时,丁二酸代谢网络中的所有关键酶都表现出更高的比活性,促使工程细胞的渗透压耐受性提高,使丁二酸浓度提高了22%[69]。
3.3 增强代谢物胁迫耐受
发酵后期代谢产物积累会引起代谢物胁迫,抑制微生物活性。为此,可以开发不同的方法来提高微生物的代谢物胁迫耐受能力,例如:适应性实验室进化、建立细胞诱变、表达转运蛋白、原位产物分离。
(1)适应性实验室进化。适应性实验室进化可通过逐渐增加产物浓度以增加进化压力,辅助高通量筛选方法,快速获得具有目标表型的进化菌株。例如,通过适应性实验室进化获得了具有高乳酸耐受性的酿酒酵母[70]。适应性实验室进化存在的挑战是如何建立一种遗传工具来快速获得所需的表型。为此,可以通过设计合适的遗传电路来实现上述目的[71]。例如,将pH传感器与核糖开关集成,设计了一种可自主控制应变进化的数字pH传感系统RiDE,可用于快速获得耐丁二酸或耐乳酸表型菌株[72]。
(2)建立细胞诱变。目前已发展出多种菌株诱变策略,如化学诱变技术或物理诱变技术。例如,通过结合化学(NTG)和等离子体诱变(ARTP)技术,获得了一株耐受高浓度1,3-丙二醇的丁酸梭菌突变株,产量达到37g/L,比野生型菌株高29.48%[73]。有机酸的积累会抑制细胞生长和目标产物的生成。通过电子束辐照诱变,获得了一个有机酸能力耐受能力提高18.6%的罗伊氏乳杆菌突变体。该突变株产生1,3-丙二醇达93.2g/L,比野生型菌株高34.6%[74]。
(3)表达转运蛋白。通过表达转运蛋白,可以降低细胞内代谢物的浓度,从而减少细胞的损伤和死亡[36]。例如,通过上调特异性多药耐药转运蛋白Qdr3p的表达,己二酸对酿酒酵母细胞的毒副作用大幅下降[75][图4(b)]。
(4)原位产物分离。提高微生物代谢产物耐受能力的第四种方法是原位产物分离。该方法可迅速降低生物反应器中代谢物的浓度,从而提高微生物菌株的存活率和产量。目前主要通过膜分离和介质交换两种方法来实现这一目标。例如,通过开发膜分离-耦合发酵技术,降低发酵液中副产物丙酸积累对产丙酸杆菌的反馈抑制作用,工程菌株的丁二酸产量提高了48.54%[76]。通过建立培养基交换策略以消除丁二酸的产物抑制作用,有效提高了集孢藻PCC6803的存活率和丁二酸产量[77]。
在发酵过程中,各种内外部因素,如pH变化、温度胁迫、渗透压、氧化应激、代谢物积累等,都会影响塑料单体的高效生物生产。通过建立添加保护剂、膜工程、表达转运蛋白等不同策略,有助于提高细胞存活率、代谢活性和微生物适应度,为高效微生物生物合成奠定坚实的基础。
4 结语
基于微生物代谢工程策略的应用,目前许多塑料单体已经实现了微生物制造(表1)。本综述总结了塑料单体细胞工厂的最新研究进展。尽管代谢工程策略和合成生物学工具在促进微生物生物基单体生产方面展示了巨大的潜力,但仍有一些挑战需要解决。
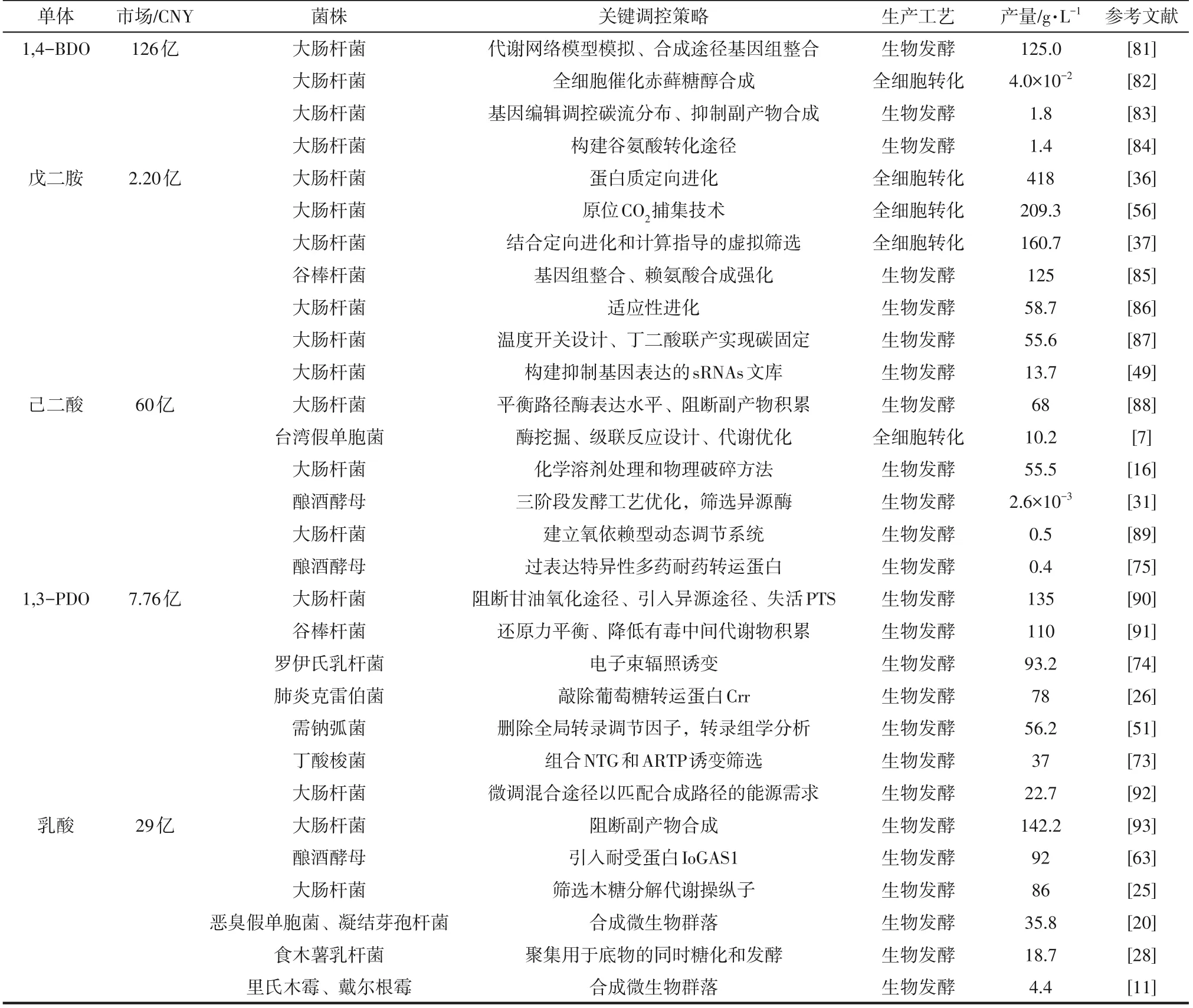
表1 部分塑料单体的代谢工程策略
(1)如何提高塑料单体的得率。微生物在生产二羧酸和二元胺类塑料单体的过程中,由于存在脱羧反应,产物得率普遍较低。为了解决这个问题,可以通过多种方法来节省丢失的碳原子。首先,挖掘新型固碳酶元件[78],通过将这些固碳酶元件在微生物中进行过表达或者基因组替换,可以将环境中的游离碳原子重新引入到胞内,提高底物到产物的碳得率;其次,设计塑料单体的新合成途径,解决天然合成途径中存在的CO2释放问题;最后,构建CO2减排分子开关,精准平衡细胞生长和产物合成所需的碳流,减少不必要的CO2排放[9]。
(2)如何发挥非模式菌株优势。部分非模式菌株相较于模式菌株在底物利用、培养周期、环境耐受性等领域展示出明显优势,因此可以用于改造合成塑料单体。挖掘非模式菌株资源的方向主要有两个。第一,目标产品为导向。例如,某些微生物对高浓度二羧酸具体良好的耐受性,可通过筛选优势菌株直接合成塑料单体;第二,生产工艺为导向。某些微生物对于极端环境,如高温、高盐等表现出良好的适应性,也可以被用于生物塑料单体的生产。例如,通过提高培养基中的盐浓度,工程改造后的盐单胞菌可以在开放的环境下,合成聚羟基脂肪酸酯[79]和戊二胺[80],有效降低了设备投入成本,简化了生产工艺。通过为这些非模式菌株建立遗传操作工具,可以建立高效的微生物细胞工厂,解决当前模式菌株改造过程中存在的挑战。

