生物成像用二氧杂环丁烷余辉发光体系的研究进展
吕程远,张函,杨明旺,杜健军,樊江莉,2
(1 大连理工大学智能材料化工前沿科学中心,精细化工国家重点实验室,辽宁 大连 116024;2 大连理工大学宁波研究院,浙江 宁波 315016)
光学成像具有实时性、无创性和高时空分辨率等优势,在生物医学领域有着广泛应用[1-3]。作为光学成像方式的一种,余辉发光成像不依赖于外界给予的实时激发光,能够实现激发光照射和信号采集过程的分离[4],因此余辉发光成像能有效地减少生物组织自体荧光的干扰,是改良成像质量,提高成像信噪比和灵敏度的重要手段[5]。开发生物成像用有机长余辉材料逐渐受到人们的关注。
目前已开发出的余辉试剂包括无机余辉材料[6-7]、有机长时间室温磷光和热激活延迟荧光材料[8-9]等。然而,上述试剂仍然存在一些不足之处,无机余辉材料,特别是包含稀土金属元素的无机纳米粒子,存在潜在的生物毒性和生物代谢等问题[10],影响了其生物相容性;而有机长时间室温磷光等易被生物体内富水含氧环境猝灭,提升了体系构建难度[9,11]。近年来,基于二氧杂环丁烷中间体的有机长余辉材料成为研究热点。该余辉发光过程涉及光化学级联反应,其关键步骤在于二氧杂环丁烷中间体的生成并通过化学反应产生电子激发态的物质,最终由之发出光子辐射[12]。此类余辉发光体系具有较好的生物相容性、可分解性,并且拥有广泛的修饰位点,能够实现多功能生物成像的需求,是生物应用的首选[13]。本文主要就此类光化学反应介导的二氧杂环丁烷余辉体系发光机理、体系的构建和近期在生物成像领域的研究进展进行论述,并对未来发展方向进行展望。
1 二氧杂环丁烷型余辉发光机理
从能量的角度来看,余辉发光体系可以储存激发光的能量,并且在移除激发光后一段时间内,可以通过光子辐射的方式将能量缓慢地释放出来。不同余辉发光体系储存能量的方式也不尽相同。无机余辉发光材料依赖于入射光子导致材料中电子-空穴对的产生[5,7,14],有机长时间室温磷光材料和热激活延迟荧光材料则依赖于三重激发态分子的产生与利用[15-17]。
二氧杂环丁烷余辉发光体系,是近年来新兴的一类有机余辉发光的范式[12-13]。不同于以往的余辉发光体系,在二氧杂环丁烷余辉发光过程中,涉及一个光化学级联反应,产生二氧杂环丁烷中间体;随后该中间体通过化学分解产生一部分处于电子激发态的分子,激发态分子通过光子辐射的方式释放能量,产生余辉发光。具体过程如下。
1.1 余辉发光的引发
单线态氧(1O2)对富电子烯烃或杂环之间发生环加成反应(图1)是二氧杂环丁烷产生的主要途径[18]。其中,单线态氧由光敏剂经光照后敏化氧气产生。由于氧气参与级联反应,因此相对于容易被氧气猝灭的长时间室温磷光与热激活延迟荧光余辉发光体系,其更适合于机体中的含氧环境。

图1 单线态氧[2+2]环加成机制
1.2 激发态产物的生成
二氧杂环丁烷活性中间体多数不稳定,通常会发生化学分解产生羰基化合物。二氧杂环丁烷通过直接热解的方式而产生单重激发态产物的量子产率很少,较难发出高强度的光。一般认为,二氧杂环丁烷通过化学引发的电子交换发光(chemically initiated electron exchange luminescence,CIEEL)机制,能够较高效地产生激发态分子[19-20]。如图2所示,在CIEEL过程中,体系中存在的电子给体(electron donor,ED)会同二氧杂环丁烷之间发生电荷转移,随后发生分子解离并产生羰基自由基阴离子,该阴离子自由基向ED 的阳离子自由基进行反向电子转移时,产生激发态分子产物。
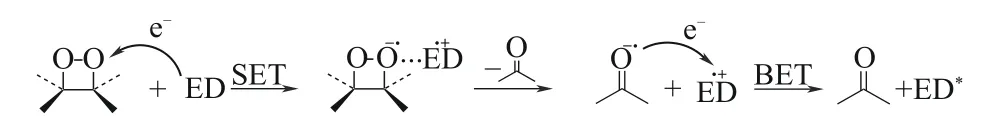
图2 CIEEL发光机制
1.3 能量转移与余辉发光的产生
通过化学反应产生的激发态物种可以自身以光子辐射的方式弛豫,另外也可以通过能量转移的方式转移到体系中其他能量受体中。有机荧光团具有可调节的发射,较高的荧光量子产率,通常作为余辉发光的能量受体出现。与荧光能量共振转移(förster resonance energy transfer,FRET)过程类似,化学发光能量共振转移(chemiluminescence resonance energy transfer,CRET)过程指代化学反应类型的自发光体系(如化学发光、生物发光和余辉发光)中的能量转移过程[13]。影响CRET 效率的主要因素包括:①能量供体和受体之间的距离[21];②能量供体的发射光谱与能量受体的吸收光谱相重叠[22-23];③能量受体自身的荧光量子产率[22]。因此,为了提高能量转移效率,需要最小化缩短能量供体与受体之间的距离,尽量保证能量供体、受体之间的能量匹配并最大化受体的发射效率。
上述余辉发光中涉及的单线态氧产生、二氧杂环丁烷中间体的产生与分解和后续能量转移过程,在级联反应体系中,分别由三部分完成(图3):①光敏引发剂;②余辉发光底物;③余辉发光能量受体。从能量角度来看,二氧杂环丁烷余辉发光体系是通过将激发光能量以化学能的形式储存,在去除激发光后,体系通过化学激发过程产生光子辐射,实现在激发光停止后仍可在一段时间内持续发光。

图3 基于光氧化级联反应的二氧杂环丁烷余辉发光体系发光机理
2 二氧杂环丁烷余辉发光体系的构建
2.1 光敏引发剂
作为余辉发光的引发剂,要求其有较高的单线态氧量子产率,以提高引发效率。通常使用的光敏剂包括重原子取代的荧光团,卟啉、酞菁类化合物,聚集诱导发光(aggregation-induced emission,AIE)分子(AIEgens)等。
2.1.1 含重原子的光敏剂
将重原子引入荧光团中,受到重原子效应的影响,荧光团的系间窜越能力显著提高。传统光敏剂如玫瑰红[12](rose bengal,RB)、溴、碘代氟化硼二吡咯[24](BDP)等由于其具有出色的单线态氧量子产率,可作为余辉发光的引发剂(如图4所示)。然而,此类分子也面临吸收、发射波长较短和重原子的引入造成的光稳定性差等不利因素。
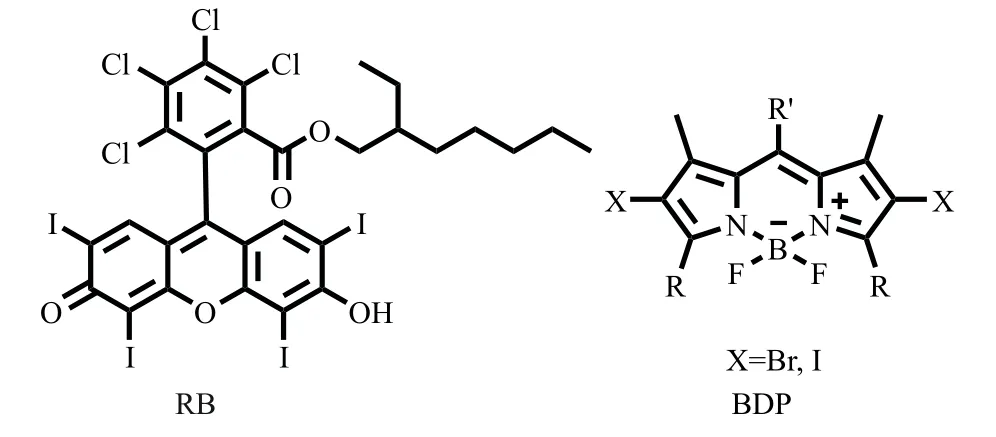
图4 作为光敏引发剂的重原子光敏剂
2.1.2 卟啉、酞菁类光敏剂
卟啉、酞菁类光敏剂有特殊的π电子结构,具有更长的吸收、发射波长,对光、热稳定性更高,部分卟啉和酞菁的衍生物具有较高的单线态氧量子产率[25-27]。此外,由于近红外光在生物组织内的光散射和光吸收作用较弱,因此近红外光具有更高的组织穿透性。所以,卟啉和酞菁衍生物(图5)也常作为光敏剂来引发余辉发光。
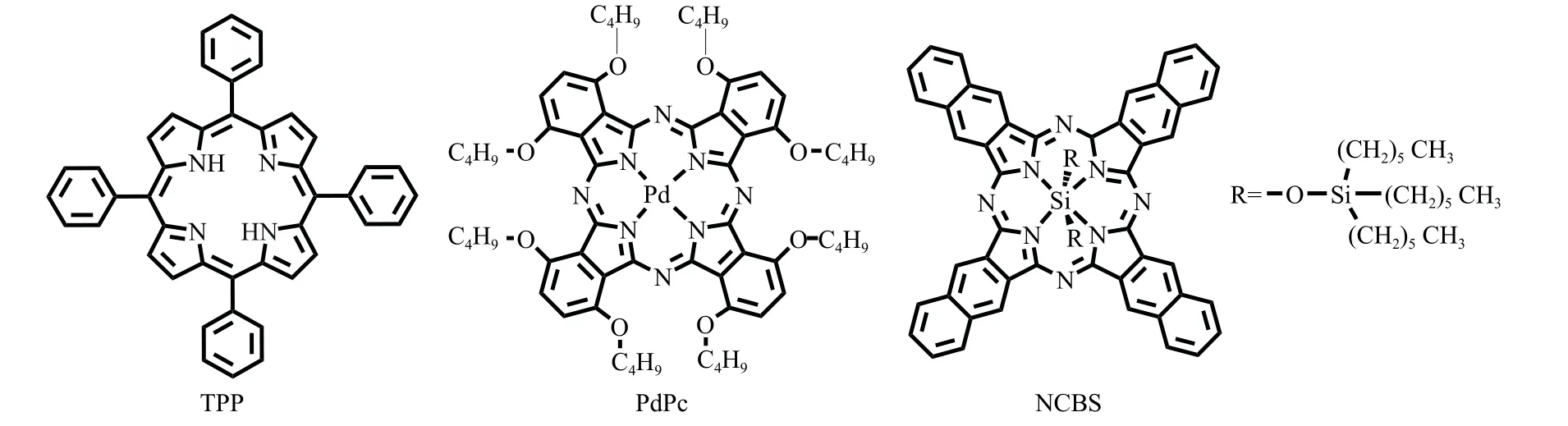
图5 作为光敏引发剂的卟啉、酞菁衍生物
2.1.3 聚集诱导发光分子
具有平面刚性结构的光敏剂,在高浓度或聚集态下由于分子间π-π堆积效应会引起典型的聚集引发猝灭现象(aggregation-caused quenching,ACQ),并降低余辉发光效率。因此余辉发光纳米体系只能维持较低染料负载量以规避ACQ。不同于具有刚性共轭平面的荧光团,聚集诱导发光分子AIEgens通常螺旋或扭曲的空间结构[28],在聚集状态下,由于限制了分子内自由旋转或振动,AIEgens 在聚集态表现出更强的亮度,因此可允许以较高浓度负载在纳米颗粒中。AIEgens 同时具有光稳定性强、生物相容性好和大斯托克斯位移等特点,部分AIEgens具有更强的活性氧量子产率(图6),因此可作为光敏剂使用[29-31]。

图6 作为光敏引发剂的AIE分子
2.2 余辉发光底物
余辉发光底物通常具有富电子的烯烃或杂环结构,容易同单线态氧发生环加成反应而产生二氧杂环丁烷产物。余辉发光底物主要包括有机半导体聚合物和小分子化学发光底物等。下面介绍一下常见的余辉发光底物。
2.2.1 有机半导体聚合物类
有机半导体聚合物材料因其优良的光物理性质,在光电材料、生物荧光传感等领域有着广泛应用[32-33]。近年来,研究者发现某些半导体聚合物可作为自发光试剂[34-36],产生余辉发光(图7)。2015年,Rao 等[34]首次报道了基于半导体聚合物MEHPPV 的余辉发光现象。2017 年,Pu 等[37]通过对PPV 系列衍生物的光氧化分解产物的质谱与红外表征,证实了该余辉发光过程涉及二氧杂环丁烷的产生与分解,并且通过筛选不同聚合物的余辉发光强度,发现取代基的电子效应是半导体聚合物余辉发光的关键因素之一。具有供电子基团的PPV聚合物,包括BOPPV、MDMOPPV 和MEHPPV 检测出余辉发光,而弱供电子(POPPV)或强吸电子取代(MEHCPV)等衍生物则没有。这是由PPV 中的碳碳双键对单线态氧的反应活性决定的,即单线态氧容易同电子云密度高的双键进行环加成反应,产生二氧杂环丁烷活性中间体。
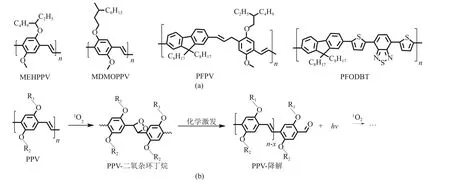
图7 半导体聚合物余辉发光底物(a)和余辉发光机理(b)
2.2.2 金刚烷-二氧杂环丁烷化学发光前体
金刚烷-二氧杂环丁烷类化合物是常见的化学发光体系,而未形成过氧键的发光前体可作为余辉发光底物。如图8 所示,金刚烷-二氧杂环丁烷发光前体可被单线态氧氧化,生成金刚烷-二氧杂环丁烷化学发光分子。当酚羟基保护基团PG 被目标分析物特异性去除时,产生不稳定的酚氧负离子中间体,随后通过分子内CIEEL机制分解产生激发态的中间体苯甲酸酯类化合物[38-39],最后以光子辐射的方式回到基态或通过能量传递的方式激发其他荧光团能量受体[40]。2017 年,Shabat 等[41-42]通过在金刚烷-二氧杂环丁烷体系中引入吸电子基团,构建分子内推-拉电子体系,实现发光效率近三千倍的提升。目前Shabat 改性的金刚烷-二氧杂环丁烷化学发光分子作为余辉发光底物被广泛地应用于余辉发光体系构建中[12,43]。
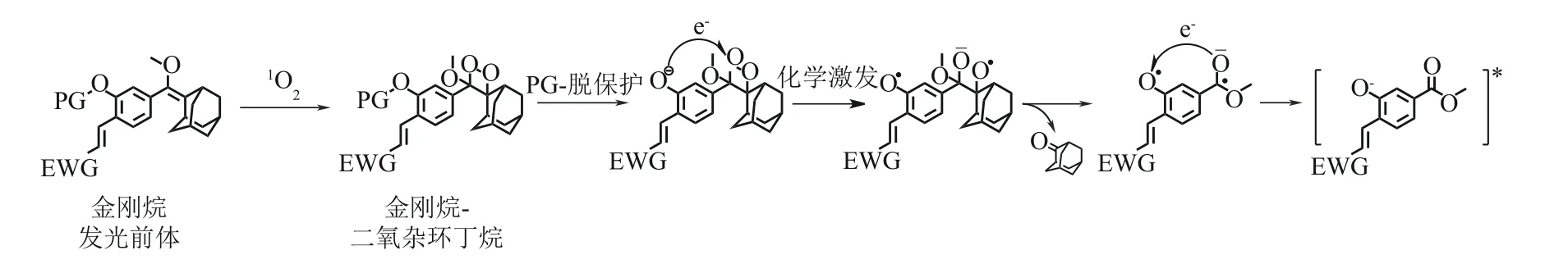
图8 金刚烷发光前体余辉发光机理
2.2.3 氧杂环己烯和硫氧杂环己烯类发光前体
氧杂环己烯(DO)和硫氧杂环己烯(SO)类发光前体可被单线态氧氧化,生成二氧杂环丁烷活性中间体(图9)。此类余辉发光分子在化学激发过程中具有较高的激发态量子产率,具有较高的亮度,然而其发射波长较短,在生物组织中容易受到光散射和光吸收等影响,成像穿透深度不佳。

图9 DO与SO的结构式(a)和发光机理(b)
Li 等[44-50]针对DO、SO 体系系统地进行分子改性,并开发出一系列余辉发光平台。2021 年,为了实现余辉发光的可调节性,并提高能量转移效率,研究者将SO 分子与BDP 分子共轭连接,并通过对BDP 分子改性,实现发射波长调节至500~700nm的较宽范围内。由于分子内能量转移效率显著高于分子间的能量传递效率,因此相对于以往纳米体系中物理包埋的方式,该策略以共价连接的方式使得余辉发光强度提高了近百倍[49]。
除了上述常见的余辉发光底物外,一些化学发光分子同样可被活性氧氧化而发光,近期报道的海萤荧光素[51]、过氧化草酸酯[52]等也作为余辉发光底物用于余辉发光体系构建之中。
2.3 作为余辉发光能量受体的发射团
很多余辉发光底物的光氧化分解产物本身具有一定荧光性质,因此处于激发态的分解产物本身可以通过光子辐射的方式发光。然而,可设计通过进一步引入荧光染料作为能量受体,使发光体系具有发射可调节性,并且在生理环境下拥有更高的发光效率。因此,为了提高余辉发光强度,实现发射波长的红移或实现可激活型的余辉发射,研究者通常会额外引入改性的荧光团(如图10 所示)作为能量受体,以满足不同成像需求。此类荧光染料包括半导体聚合物、小分子荧光团、量子点等。
图10 作为余辉发光能量受体的荧光团
某些情况下,作为余辉发光引发剂的光敏剂具有较高的荧光量子产率,因此同样可以作为能量受体单元。此类分子包括卟啉和酞菁的衍生物(如NCBS 等)和AIEgens 等。特别是AIEgens,在聚集态下荧光量子产率高,并且可以以较高浓度负载在纳米体系中。此外,其吸收波长可以很好地匹配发射波长较短的余辉发光分子,又因其具有较大的斯托克斯位移,能够有效地延长发射波长,使其达到近红外区。
另一方面,通过分子修饰手段赋予染料与发射团可响应激活的特性,在同目标分析物反应前后出现染料吸收波长的变化,或荧光团荧光的开启等(图11)。如此可以实现响应余辉发光和比例型余辉发光检测,并进一步提高成像的准确度。

图11 响应型受体染料
2.4 单分子余辉发光基团
某些荧光团具有活性烯烃或杂环结构,并拥有合适的活性氧量子产率,此类荧光团本身可同时作为光敏剂和余辉发光底物,因此单分子余辉发光团(图12)可以在激发光照射下发生自氧化过程,并伴随着余辉发光的产生。目前报道的单分子余辉发光基团包括:改性的SO 发光前体[48]、喹啉腈改性的金刚烷发光前体[53]、卟啉[54-55]和半菁染料[56]。
图12 具有余辉发光性质的单分子荧光团
2.5 表面活性剂
为了保证余辉发光体系中涉及的光化学级联反应和不同组分之间能量转移过程的高效进行,各组分应尽可能地保持在一个较近的距离,因此,通常将不同组分包裹在纳米胶束中。在体系构建过程中,引入表面活性剂,并通过π-π 堆积效应、静电相互作用、氢键和亲疏水相互作用等将各个组分包裹起来,以自组装等方式形成纳米胶束[57]。在纳米胶束中,各个组分充分混合,大大缩短了不同组分之间的距离。常用的表面活性剂(图13)包括嵌段聚合物胶束、脂质体等[12,33]。此外,形成的纳米胶束也可以改善成像试剂在体内的分布与代谢。

图13 构建纳米胶束的两亲性表面活性剂
3 二氧杂环丁烷余辉发光体系在生物成像方面的应用
生物样本组成复杂,很多生物活性分子都具有固有荧光[58],因此对生物样本进行荧光成像时,生物组织的自体荧光对背景信号的干扰尤为严重[59]。而生物自体荧光发光寿命极短,因此拥有较长时间的余辉发光成像方式,可实现激发过程与信号采集过程的分离,最大程度降低生物自体荧光干扰,提升成像质量。二氧杂环丁烷余辉发光体系具有良好的生物相容性和降解性,改善了传统无机余辉发光材料的生物代谢、毒性等问题;另一方面,该体系具有更好的水氧耐受性,且易于进行分子改性与制备。更重要的是,该体系可以进一步与疾病治疗手段相结合,精细地引导治疗过程并把控治疗效果,实现疾病的诊疗一体化。
二是夯实“党政同责、一岗双责”制度,划定生态环保“责任田”。强化生态环境保护主体责任,健全完善纵向到底、横向到边的责任体系。明确地方党委政府是生态环境保护的责任主体,市委、市政府与各县(区)党政“一把手”签订生态环境保护目标责任书,向市直有关部门下达年度环保目标责任书,形成一级抓一级、层层抓落实、责任明晰、整体联动的工作格局。
3.1 肿瘤示踪与手术导航
生物修饰的纳米颗粒往往具有肿瘤靶向作用,这是实体瘤代谢性质决定的。由于肿瘤处往往伴随着血管丰富、血管壁间质较大的特性,这造成了相对于正常组织,纳米颗粒更容易进入肿瘤部位;加上肿瘤部位淋巴回流较差,纳米颗粒能够在肿瘤区域停留较长时间,即所谓实体瘤的高通透性和长滞留效应(enhanced permeability and retention,EPR)[60-61]。依靠EPR 效应,余辉纳米颗粒能够实现对肿瘤部位的示踪,充分利用高的信噪比成像优势,可服务于癌症诊断与手术治疗过程。特别地,由于癌细胞转移是癌症死亡的主要原因之一[62-63],因此对转移性癌症组织的检测非常重要。
2017年,Pu等[37]报道了一例基于半导体聚合物的余辉发光纳米颗粒,并用于小鼠肿瘤和肝炎模型的成像。他们对导电聚合物余辉发光性能做了一个初步的筛选,并通过单线态氧抑制实验和余辉发光后的产物分析,提出该余辉发光过程涉及一个二氧杂环丁烷中间体的生成。在构建体内成像纳米颗粒过程中,为了实现更高效的单线态氧产生能力和更长波段的余辉发射,引入NCBS(图14)作为余辉发光引发剂和能量受体单元,并将其同MEHPPV(图15)在两亲性三嵌段共聚物F127包裹下制备余辉发光纳米颗粒SPN-MEHPPV。该纳米颗粒粒径在40nm 左右,并且可以实现780nm 的近红外余辉发射,发光半衰期为6min。淋巴结定位对于指导肿瘤切除手术具有重要意义,在小鼠肿瘤成像过程中,该纳米颗粒可以清晰地对肿瘤进行定位。体内实验表明,该有机半导体聚合物材料余辉强度相对于无机余辉材料提高了近100倍,同时相对于近红外荧光成像,信噪比提高了127倍。

图14 SPPVN与PPVP纳米颗粒制备与纳米粒径[64]

图15 手术导航用AGL-AIE-dots余辉发光纳米点(改编自文献[66])
余辉发光底物MEHPPV 是一个高度疏水的聚合物,同两亲性共聚物与其共沉淀生成的水溶性纳米颗粒,其胶束粒径较大,影响材料的生物分布,不利于对肿瘤被动靶向聚集。2018 年,Pu 等[64]对PPV聚合物进行改性,将亲水性PEG链接枝在疏水性的PPV链上,得到水溶性PPV链(PPV-PEGL),改性之后的聚合物可以在水溶液中自组装形成纳米颗粒SPPVN(图14)。此类自组装纳米颗粒相较于多组分共沉积形成的纳米颗粒,具有更小的纳米粒径(24nm)。SPPVN具有最强且相对持久的余辉发光,最大发射波长为780nm,发光半衰期为4.8min。小鼠肿瘤成像,在808nm、0.3W/cm2的激发光预照射1min后,分别将SPPVN 与PPVN 进行静脉给药。结果发现,SPPVN相对于PPVN在肿瘤部位的余辉发光信号更强,肿瘤部位SPPVN 余辉成像信噪比值为306,相较于荧光提高了11倍。在小鼠乳腺癌腹膜转移模型中,SPPVN 能够对微小肿瘤病灶区进行检测,微小转移肿瘤灶处的余辉发光强度相对于背景提升了6.1倍。
2020 年,Zhang 等[65]报道了一例基于半导体聚合物PFPV(图15)余辉发光底物,AIE分子TTMN(图14)作为光敏剂引发余辉发光体系P-TNPs。P-TNPs 的平均水合粒径为120nm,荧光光谱证明PFPV 与TTMN 之间有一个良好的能量转移过程。在小鼠荷瘤模型成像实验中,P-TNPs 主要通过肝脏代谢,然而受纳米颗粒EPR效应影响,注射12h之后,肿瘤处余辉发光最强,且相对于荧光,余辉发光成像信噪比更高,使肿瘤区域边界清晰可见。另外,P-TNPs 可通过多次光照激活余辉发光,再次激活后,其余辉强度没有明显衰弱。
肿瘤附近生长、转移的微小肿瘤(直径<1mm),不容易被察觉,且往往造成术后肿瘤复发;加之处于肿瘤早期阶段,一些生物标志物,如H2O2、相关酶等,相对于附近组织并无明显的高表达,这些都是实现特定的肿瘤成像和引导手术过程中亟待解决的问题。2019年,Ding等[66]报道了一例的余辉发光纳米体系AGL-AIE-dots,该体系使用AIE 分子TPE-Ph-DCM 作为光敏剂,金刚烷-二氧杂环丁烷发光前体作为余辉发光底物(图15)。TPE-Ph-DCM在聚集态时大大降低了激发态非辐射的损耗,并且拥有较高的单线态氧量子产率和荧光量子产率;同时,金刚烷-二氧杂环丁烷的发射光谱,与TPE-Ph-DCM 吸收光谱之间的光谱重叠,保证了一个有效的能量转移过程,余辉发光发射>650nm,达到近红外区。体外实验表明,AGL-AIE-dots 在0.2W/cm2的白光照射2min 后,其余辉发光可达10 天之久。小鼠荷瘤成像实验显示,网状内皮系统(肝、脾和肾)器官余辉发光信号衰减较快,2h后基本完全消失;而作为对比,癌症组织余辉信号能保持较长时间。由于AGL-AIE-dots 具有癌症组织-正常组织高对比度的余辉发光信号,适合于成像引导癌症切除手术过程中的精确肿瘤识别过程。而小鼠腹膜癌模型中,根据经验切除大部分肿瘤之后再进行余辉监测。然而,余辉发光显示术后腹腔中仍残留着亚毫米级的肿瘤结节。再经由余辉发光实时成像下进行的手术,几乎切除了所有微小肿瘤。因此,借助于余辉发光高信噪比优势,ALG-AIEdots可以作为手术协助,提供更精确的肿瘤检测。
基于三苯胺(TPA)或四苯乙烯(TPE)结构的AIE光敏剂,具有扭曲的空间结构,限制了分子在聚集态的自由运动,同时也避免了π-π 堆积造成的荧光猝灭。然而,也因为其扭曲结构影响了分子共轭,造成光敏剂的摩尔消光系数较低,对外界激发光利用率不高的缺点。2023年,Liu等[67]通过将三苯胺结构中的氮原子单元替换为三氮唑结构单元,得到TPT衍生分子。三氮唑结构加强了分子的平面性,分子的消光系数得以提高。产物的单晶结构证明,TPT具有较弱的π-π堆积效应,此外,存在的多个分子间氢键抑制了分子内运动。因此,TPT平衡了分子扭曲与分子共轭之间的关系,使得作为光敏剂的TPT衍生物TPT-DCM在聚集态时具有更强的亮度和活性氧产生能力。他们使用丙烯腈取代的金刚烷发光前体AGL为余辉发光底物,TPT-DCM作为光敏剂,并通过脂质体进行包裹,得到余辉发光纳米颗粒TPT-DCM/AGLNPs。体外测试发现,在0.2W/cm2的白光预照射2min 后,能够发出最大发射波长为630nm的近红外余辉发光。TPT-DCM/AGLNPs可以实现深度穿透深度(1.6cm),高肿瘤-肝脏余辉成像信号强度比(187 倍),并成功地应用于余辉引导下的手术导航(图16)。
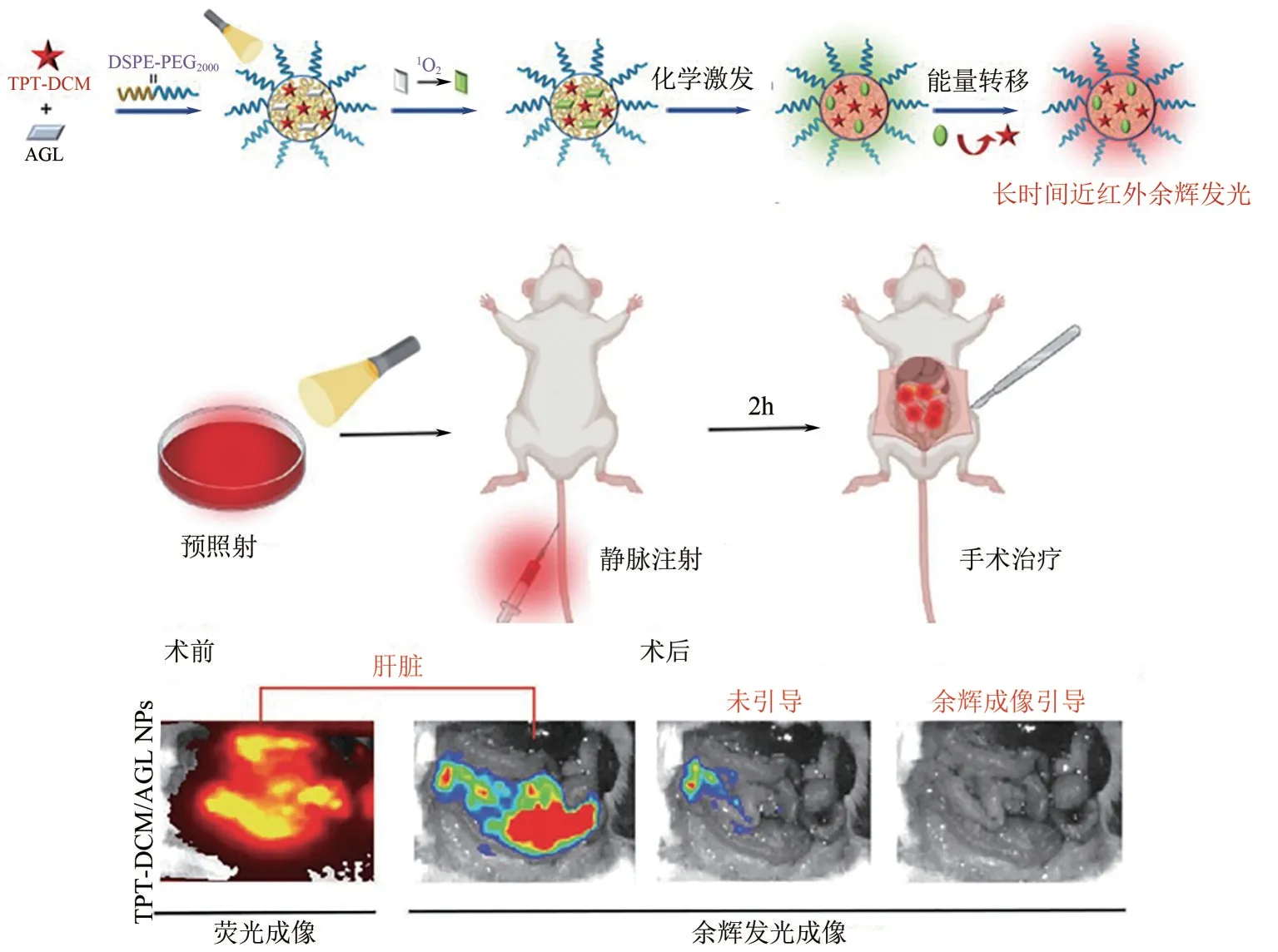
图16 用于手术导航的高信噪比余辉发光成像TPT-DCM/AGL纳米探针(改编自文献[67])
3.2 生物活性分子成像
在机体急性炎症过程中,中性粒细胞会被招募到炎症部位并释放促炎因子,产生大量活性氧、活性氮物种;此外,由于免疫细胞的浸润和细胞代谢,炎症微环境还伴随着pH的降低。2022年,Ding课题组[70]报道了一例过氧亚硝酰离子(ONOO—)和微环境pH 双响应激活型近红外余辉纳米探针,用于检测中性粒细胞相关疾病(图17)。他们合成了苯硼酸酯保护的金刚烷-二氧杂环丁烷发光前体AGL作为余辉发光底物和TPE-TV-CyP 染料作为能量受体。如前文所述,AGL 具有较高的发射效率;而TPE-TV-CyP 是一个具有扭曲结构的AIE 分子,其在水溶液中的聚集态限制了染料的非辐射跃迁能量消散,具有较高的荧光量子产率;另外,AGL 与TPE-TV-CyP之间光谱重叠较好,能量转移效率较高。通过纳米共沉积的方式,利用两亲性片段DSPE-PEG2000包封AGL 和TPE-TV-CyP,得到了近红外余辉发光纳米探针(PA-AGL NPs)。体外实验表明,NPs 同ONOO—有良好的响应能力,在光强为0.25W/cm2的白光预射5min 后且在ONOO—孵育条件下,15min余辉发光达到最强,且余辉发射有近553 倍的提升。NPs 可以对中性粒细胞浸润和酸化的炎症环境进行响应,区分局部过敏和急性炎症组织。另外,探针还可以根据局部中性粒细胞招募情况,对促免疫原性死亡(immunogenic cell death,ICD)药物治疗效果进行实时监控。
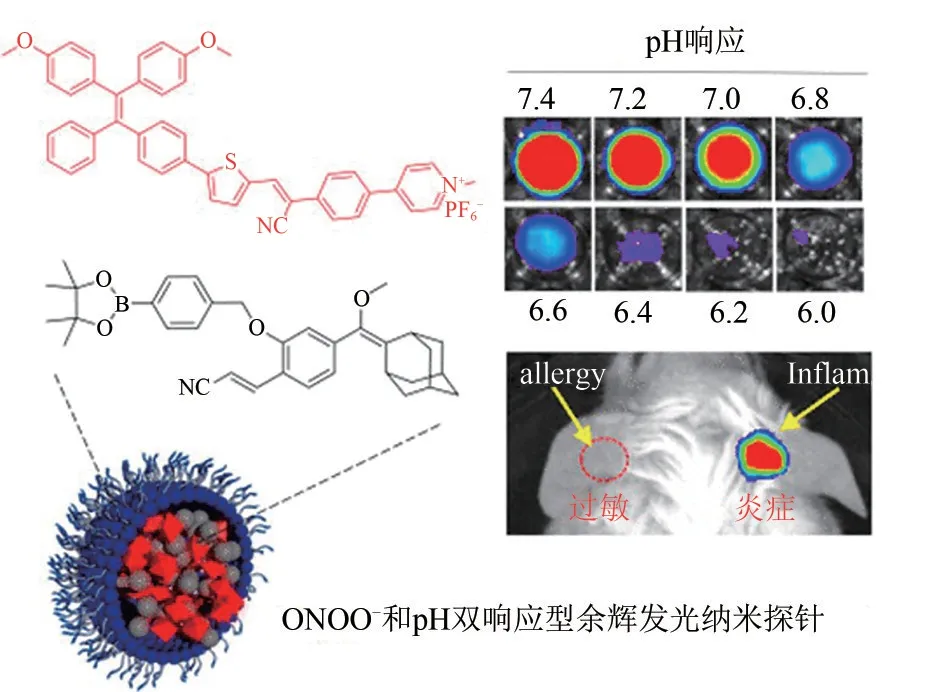
图17 用于检测中性粒细胞相关炎症的双响应余辉发光纳米探针(改编自文献[70])
早期肝炎常伴随肝脏硫化氢(H2S)水平的显著上升,这可能是炎症过程中H2S产生酶表达量上调引起的,因此H2S 可作为早期肝脏炎症的标志物。2022 年,Ye 课题组[71]报道了一例多功能纳米探针F1-GdNP,可进行H2S响应的余辉发光和磁共振(magnetic resonance imaging,MRI)双模态成像(图18)。F1-GdNP 是由电致变色材料EM F12+、近红外光敏剂NIR775、余辉发光底物MEHPPV、顺磁两亲性钆配合物DTPA-BSA-Gd 和阳离子脂质体PC-DPPC 与DSPE-PEG2000组成。EM F12+是该组先前报导的一例H2S 特异性响应染料[72],F12+在可见光区(550nm)和近红外区(760nm)有强烈的吸收,可以猝灭MEHPPV 和NIR775 的发光;而在H2S存在的条件下,EM F12+被还原为F2,吸收显著蓝移至500nm以下,从而开启余辉信号。具有阳离子性质的脂质体和F12+染料容易通过静电相互作用,使生理条件下的HS—更容易富集,这加快了探针与H2S 的反应动力学过程。由DTPA-BSA-Gd 提供始终开启的MRI信号,可以通过其来追踪NPs在体内的分布;而余辉发光信号则可以追踪体内H2S的水平。纳米探针在808nm(1W/cm2)预光照1min,并同NaHS 共孵育后,余辉发光强度有126 倍的提升。此外,根据细胞胱硫醚裂解酶(CSE)介导的半胱氨酸-H2S 通路,纳米探针对CSE 检出限达0.21nmol/L。在小鼠脂多糖诱导的肝脏炎症成像中,相对于正常肝脏,炎症组余辉发光信号的信噪比有2.08倍的提升。
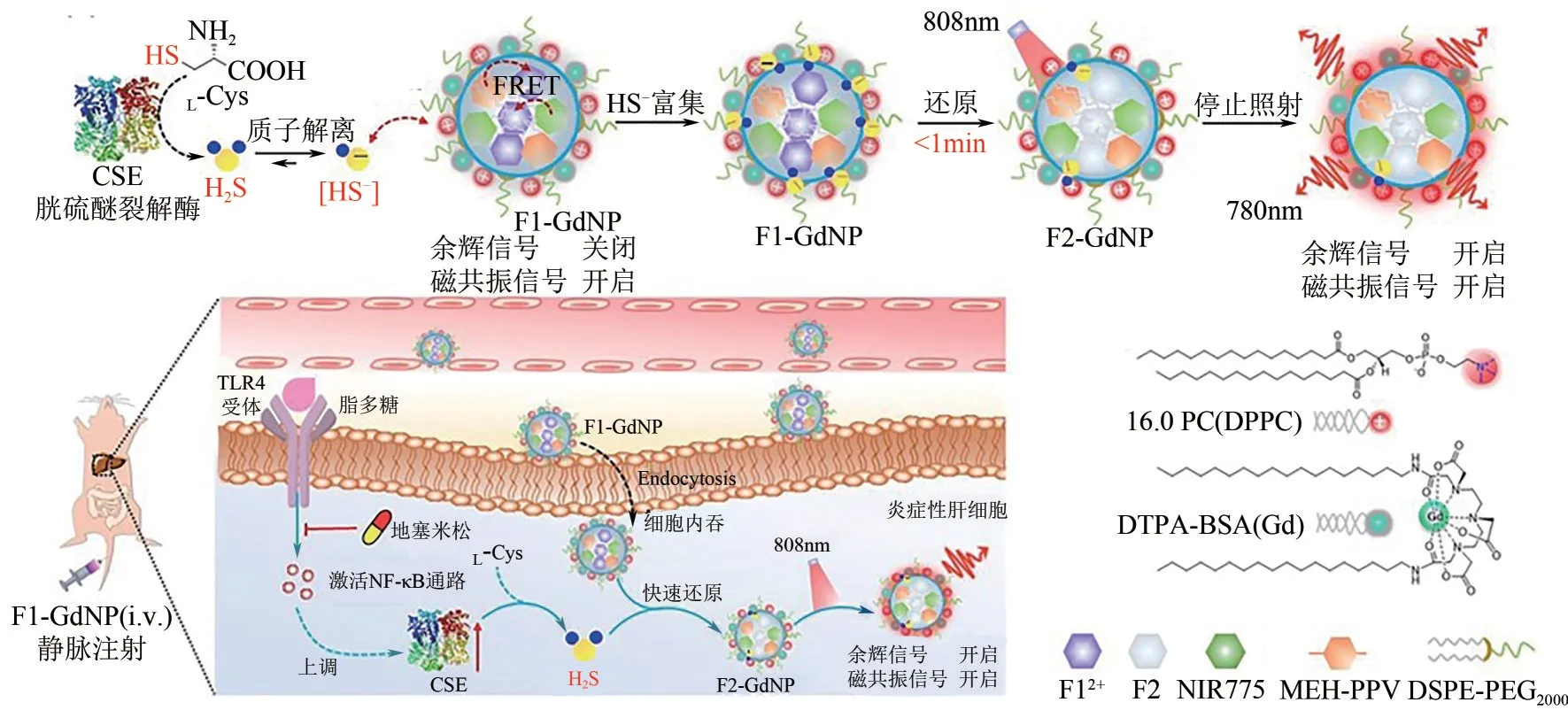
图18 肝损伤检测用H2S激活型余辉-磁共振双模式成像纳米探针(改编自文献[71])
局部一氧化氮(NO)含量的上升,是巨噬细胞M1型极化并发挥抗肿瘤免疫活性的标志之一[73]。目前,现有的余辉发光分子存在的缺点包括:①余辉发光强度伴随着时间的推移而下降,这不利于对分析底物的定量测量[74];②由于缺乏相关反应位点,构建响应性余辉发光探针难度较大[75]。2022 年,Zhang等[24]提出了一种余辉发光能量共振转移策略,根据反应前后能量给体和受体发光信号强度的比例,对分析底物进行定量测定。他们采用余辉发光聚合物MEHPPV 作为能量供体,NO 反应型荧光探针NRM 作为能量受体,光敏剂BDP 作为余辉发光引发剂,多种组分通过两亲性聚合物F127 包裹形成纳米探针(RAN1)。其中,在NRM 中,带有二氨基的苯并噻二唑会被NO氧化成吸电子能力更强的苯并噻二唑-三氮唑结构(NRM-NO),从而导致分子内电荷转移效应增强,吸收和发射波长明显红移。RAN1 在同NO 共孵育下,600nm 处的余辉发光AF1 减弱,而830nm 处的余辉发光AF2 增强,并且二者余辉比例(AF2/AF1)同NO 浓度呈现一个良好的线性关系。值得注意的是,基于该比例型余辉发光策略,可以有效降低因激发光功率、照射时间的不同,而引起的发光强度变化造成的不利影响,从而提高余辉传感的可靠性。为了验证该设计策略的有效性,他们使用多种调节剂(IFN-γ,BLZ945,培西达替尼和氯喹)对RAW264.7巨噬细胞极化过程进行成像。结果表明,RAN1 可以根据细胞内源性NO 含量的波动,来评估细胞极化过程。
3.3 余辉发光监控药物释放
2019 年,Pu 课题组[76]报道了一例余辉发光纳米自组装体APtN,可对肿瘤微环境中高表达的H2O2水平进行响应,同时在伴随余辉发光信号的开启,化疗前药随即释放至患处,实现对癌症的精准治疗与诊疗一体化。在该策略中,他们合成了连接有H2O2激活型化疗前药5-DFUR的金刚烷余辉发光底物,同时该底物接枝两亲性PEG 长链。此外,引入了近红外染料NCBS作为余辉发光引发剂。溶液中,两亲性大分子PEG-AE- 5-DFUR与NCBS可自组装形成纳米颗粒APtN。APtN可通过EPR效应在静脉注射给药后被动靶向肿瘤区域,同时,通过对肿瘤微环境中H2O2的响应,不仅化疗药物可由生物标志物触发,而且其余辉发光信号也同药物释放状态有关。体外实验证明,5-DFUR释放比例同余辉发光强度有一个很好的线性关系(R2=0.9857)。APtN 的精准释药性质在细胞和小鼠层面得到进一步验证。2022年,Ding等[77]将化疗药物喜树碱(HCPT)与ONOO—激活的金刚烷余辉底物通过自消除基团相连接,光敏剂(TPE-DPA)2-Py 则作为光敏剂与余辉发光能量受体出现(图19)。在ONOO—作用下,HCPT被释放,同时进行一系列级联反应,近红外余辉发光开启。该纳米探针可响应光动力治疗过程引发的ICD过程中,肿瘤部位高表达的ONOO—水平,实现余辉发光监测肿瘤治疗中的ICD过程与药物HCPT的释放。
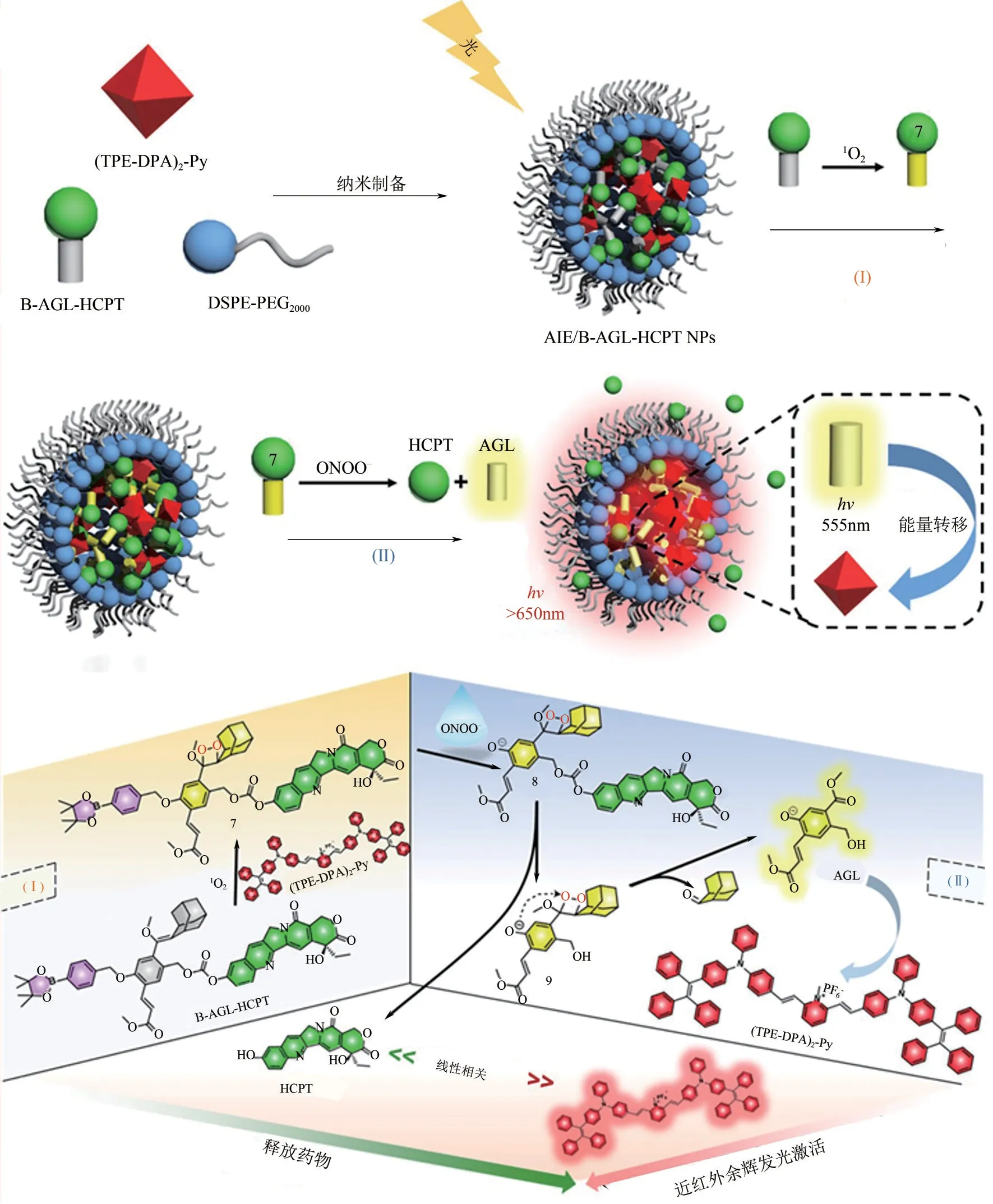
图19 ONOO—激活喜树碱释放与余辉发光监控释药(改编自文献[77])
4 结语
综上所述,基于光氧化级联反应的二氧杂环丁烷余辉发光体系,具有良好的生物相容性、水氧耐受性和易于制备和修饰等优点。然而,在实际应用上仍然面临诸多挑战,其中包括以下几种问题应予以解决。
(1)部分余辉发光体系发光效率较低,其原因之一是能量转移过程中造成的损失。未来,构建激活型单分子余辉发光材料是研究的热点。
(2)相对于处于近红外一区(600~900nm)波段的光来说,近红外二区(1000~1700nm)波段的光具有更深的组织穿透能力[78-79]。然而目前近红外二区的余辉发光体系的研究较少,属于亟待开发的领域。此外,近红外二区荧光团通常受限于相对较低的荧光量子产率,发光强度较弱[13]。因此开发出能够在近红外二区拥有较高发光效率的余辉发光体系是未来研究的方向。
(3)目前二氧杂环丁烷余辉发光体系所需激发光的光强较大,且针对于较深成像部位,使用原位照射的方式面临激发光穿透深度和安全光剂量的问题。可以采取其他激活方式,如X-射线[80]和超声激活[81]自发光的形式,实现深层组织成像。相信随着研究的深入,此类余辉发光体系将会在成像领域有着更为广泛的应用。

