高温高湿环境对大鼠血尿酸水平的影响及其作用机制研究
程雅欣,李佳,刘明玉,谭文彬
(1.中国人民解放军南部战区总医院内分泌科,广州 510010;2.广州中医药大学研究生院,广州 510405)
高尿酸血症(hyperuricemia,HUA)是一种以血清尿酸水平升高为特征的代谢性疾病[1]。原发性多由先天嘌呤代谢异常所致,常与肥胖、脂代谢异常、高血压、动脉粥样硬化等聚集发生有关;继发性则由其他疾病、药物、膳食产品等引起的尿酸盐生成过量或肾清除减少所致。而新的研究表明,高温高湿环境可显著影响户外工作人群,甚至当地普通居民血尿酸水平,增加HUA 患病率[2-3]。然而,该环境引起血尿酸水平升高的相关基础研究较少,其分子机制尚未完全阐明。
在生理情况下,内源性细胞分解代谢产生的大量核酸占尿酸生成的80%,其余则由饮食外源性摄入;尿酸的排泄75%由肾调节,其余经肠道排泄(25%)[4]。肾中尿酸盐排泄包括4 个步骤:肾小球的滤过、近端小管重吸收、肾小管的分泌和分泌后的重吸收[5]。肾小球滤过的尿酸98%以上被肾小管重吸收、分泌,所以肾小管是影响尿酸排泄的重要部位[6]。而尿酸在肾的滤过、排泄由近端小管上的一组尿酸转运蛋白控制,包括将尿酸盐从管腔运输入细胞的尿酸转运蛋白1(urtae transporter 1,URAT1)、有 机 阴 离 子 转 运 体 4 (organic anion transporter 4,OAT4)、OAT10 和葡萄糖转运蛋白9(glucose transporter 9,GLUT 9),以及负责分泌尿酸盐的ATP 结合转运蛋白G2(ATP-binding cassette superfamily G2,ABCG2)、ABCC4 和钠依赖性磷酸转运蛋白1(Na+-dependent phosphate co-transporters 1,NPT1)等,其中ABCG2 和URAT1 功能障碍与全球范围内高尿酸血症和痛风发病关系最为密切[7]。本课题组前期成功模拟高温高湿环境建立了高尿酸血症大鼠模型,基于此,本实验进一步从肾尿酸转运蛋白的角度探究上述环境影响大鼠血尿酸水平升高的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF 级雄性健康SD 大鼠30 只,6~ 7 周龄,体重150~ 200 g,购自广州锐格生物科技有限公司【SCXK(粤)2021-0059】。正式实验前大鼠适应性喂养1 周,期间正常饮食、饮水,12 h/12 h 昼夜交替照明,温度(24 ± 2)℃,相对湿度40%~ 60%。实验动物的饲养和标本采集均在中国人民解放军南部战区总医院实验动物中心SPF 级屏障环境进行【SYXK(粤)2019-0100】,实验方案经过中国人民解放军南部战区总医院实验动物中心伦理委员会审批(SYDW2022007)。
1.1.2 主要试剂与仪器
羧甲基纤维素钠(sodium carboxymethyl cellulose Na,CMC-Na,上海麦克林生化科技有限公司)、98%氧嗪酸钾(上海麦克林生化科技有限公司),CMCNa 采用蒸馏水煮沸配置成0.5% CMC-Na 溶液,置于4℃冰箱内,可保存1 周;氧嗪酸钾通过0.5%CMC-Na 溶液制备成PO 混悬液,浓度为50 mg/mL,现配现用。20%酵母饲料(广东省实验动物中心制作),方法为将酵母膏(北京索莱宝科技有限公司)按照1 ∶4 的比例均匀拌入碾碎的普通鼠类维持饲料中混匀,并重新压制成型,60Co 辐射灭菌15 d。
尿酸检测试剂盒、肌酐测定试剂盒(南京建成生物工程研究所),蛋白质定量试剂盒(BCA 法)、ECL 发光液、封闭血清(上海碧云天生物技术有限公司),10% PAGE 凝胶快速制备试剂盒(上海雅酶生物医药科技有限公司),PVDF 膜(德国Millipore公司),URAT1、ABCG2 多克隆抗体(武汉三鹰生物技术有限公司),β-肌动蛋白(β-actin)内参抗体、二抗(江苏亲科生物研究中心有限公司),免疫组化兔二步法检测试剂盒(北京中杉金桥生物技术有限公司),载玻片、盖玻片(江苏世泰实验器材有限公司),中性树胶(北京索莱宝科技有限公司)。
动物肛温计(山东尚农电子科技有限公司),电子体重秤(上海瑶新电子科技有限公司),微量移液枪(德国Eppendorf 公司),920 恒温培养箱(宁波戴维医疗器械股份有限公司),冷冻台式高速离心机(美国Thermo Scientific 公司),Multiskan Go 酶标仪(美国Thermo Scientific 公司),电泳及转膜套装设备(美国Bio-rad 公司),全自动化学发光成像系统(中国广州广仪生物公司),石蜡切片机(德国Leica 公司),电热恒温病理烤箱(上海精宏实验设备有限公司),BX-51 正置荧光显微镜(日本Olympus 公司)。
1.2 方法
1.2.1 实验分组
30 只SPF 级SD 大鼠采用随机数字表法分为正常对照(control group,CON)租、氧嗪酸钾(potassium oxonate group,PO)组、高嘌呤饮食(high purine diet group,HPD)组、高温高湿(high temperature-humidity group,HTH)组和高嘌呤饮食+高温高湿(HPD +HTH group)组,每组6 只,分笼饲养。
1.2.2 造模方法
CON 组大鼠每日予以0.5% CMC-Na 溶液灌胃1 次,普通饲料喂养;PO 组每日予以250 mg/kg PO混悬液灌胃1 次,普通饲料喂养;HTH 组在每日予以250 mg/kg PO 混悬液灌胃的基础上,采用特定恒温培养箱照射,参照文献[8-10]和本课题组预实验结果设置培养箱内温度为(37.0 ± 0.5)℃、相对湿度为(80 ± 1)%,时长1 h/d。HPD 组予以250 mg/kg PO 混悬液灌胃,20%酵母饲料喂养;HPD+HTH 组在同等剂量氧嗪酸钾灌胃和酵母饲料喂养的基础上,采用恒温培养箱照射,温度、湿度和时长同HTH 组。
所有大鼠在每日9:00 灌胃,15:00 将HTH 组和HPD+HTH 组大鼠转运至恒温培养箱照射。照射期间所有5 组大鼠统一禁食禁水,每20 min 测量1 次肛温,测量深度为3 cm,测量时长至少1 min,保证培养箱内氧气充足,并持续观察箱内大鼠精神状态,生命体征。照射结束后,使用脱脂纱布将体表水分擦拭干净,称重并计算脱水率,运回常温动物实验室。脱水率=(照射前体重-照射后体重)/照射前体重。
1.2.3 标本采集方法
实验持续12 周,第0、4、8、12 周时所有大鼠禁食不禁饮12 h,于尾部采血0.5 mL,以检测血尿酸、肌酐水平。血液标本于室温静置30 min 后,进行离心(4℃,3500 r/min,15 min)取上层血清,采用尿酸和肌酐测定试剂盒,按照说明书及生产厂家指导检测其水平。实验12 周后所有大鼠予以30 mg/kg 的3%戊巴比妥钠麻醉,解剖取出双肾,选取左侧切取包括肾皮质在内的同一部位浸泡于10%福尔马林中,右侧立即放入液氮中并随后转运至超低温冰箱冻存。
1.2.4 免疫蛋白印迹法检测肾尿酸转运蛋白表达情况
取出超低温冷冻的肾组织0.1 g 放入匀浆器中,加入1 mL 含有蛋白酶抑制剂的RIPA 裂解液,充分研磨后置于冰上裂解30 min,离心(12 000 r/min,15 min,4℃)取上清液。采用蛋白质定量试剂盒测出上清液蛋白浓度,取30 μg 配上样缓冲液煮沸变性后在PAGE 凝胶缓冲系统中进行电泳,其后将凝胶上的蛋白转移到聚偏二氟乙烯膜上。经TBST 溶液清洗5 min × 3 次后用5%脱脂奶粉溶液进行封闭,时间为2 h。再次清洗后4℃过夜孵育一抗(ABCG2 抗体稀释比例为1 ∶1000,URAT1 抗体稀释比例为1 ∶1000,β-actin 抗体稀释比例为1 ∶10 000)。次日经TBST 溶液清洗10 min × 3 次后孵育二抗(1 ∶8000),2 h,再次清洗。取出滴加ECL发光液,于化学发光仪内曝光显影、采集图片,通过Image J 软件分析条带灰度,以β-actin 为内参,计算目的蛋白相对表达量。
1.2.5 免疫组织化学法检测肾尿酸转运蛋白定位情况
将浸泡在福尔马林中的肾组织进行石蜡包埋,晾干后连续切片,厚度为3 μm,于烤箱60℃烤片2 h 后立即浸入二甲苯中脱蜡。经常规脱蜡水化后,采用过氧化物酶阻断剂处理10 min,PBS 溶液洗涤5 min × 3 次,放入柠檬酸钠溶液中于沸水中煮10 min 进行抗原修复,继续在该溶液中冷却至室温,采用10%山羊血清室温封闭30 min,甩去血清无需洗片直接滴加URAT1 或ABCG2 一抗(1 ∶100)于4℃孵育过夜。次日用PBS 溶液清洗5 min × 3 次,滴加反应增强液37℃孵育20 min,PBS 洗5 min × 3次,后用辣根过氧化物酶标记的二抗37℃孵育20 min,PBS 清洗5 min × 3 次。滴加DAB 显色液室温下孵育8 min,滴加苏木素染色液反应1.5 min,1%盐酸酒精分化5 s,自来水返蓝5 min,后采用常规方法脱水透明封片,晾干后于显微镜下观察、拍照。
1.3 统计学分析
应用IBM SPSS 25.0 统计学软件进行数据分析,计量数据采用平均值± 标准差()表示,治疗前后及两组间各项指标的均数比较采用t检验分析方法,多组间血尿酸、肌酐等指标平均值的比较采用单因素方差分析One-way ANOVA 分析方法,P<0.05 表示组间差异具有统计学意义。若多组间比较差异有统计学意义,再采用LSD-t检验进行组间多重比较,采用Graphpad Prism 8.0 进行曲线图和条形图的绘制。通过Image J 软件对免疫蛋白印迹条带灰度值进行测算。
2 结果
2.1 各组大鼠肛温和脱水率变化情况
本实验在使用培养箱高温高湿照射期间,同时测量所有组别大鼠肛温,随着照射时间增加,HTH组和HPD+HTH 组肛温逐渐上升,经照射60 min后,HTH 组和HPD+HTH 组大鼠肛温达到41℃左右,明显高于其他三组(P<0.05),见图1。照射结束后可见上述两组大鼠且足垫部位和身体背部毛发潮湿,照射后体重较照射前明显减少,经计算脱水率高于其他三组(P<0.05),见图2。尽管HTH组和HPD+HTH 组大鼠持续接受了12 周的高温高湿处理,但每日照射结束后均可观察到所有大鼠都保持良好的生命体征,未显示出中暑的迹象(体温过高超过42℃,动脉压下降到约30 mmHg),未出现肌肉痉挛、刻板行为以及强烈应激反应等。连续造模实验12 周后,5 组大鼠存活率均为100%,高温高湿处理的两组大鼠存活率无明显下降。
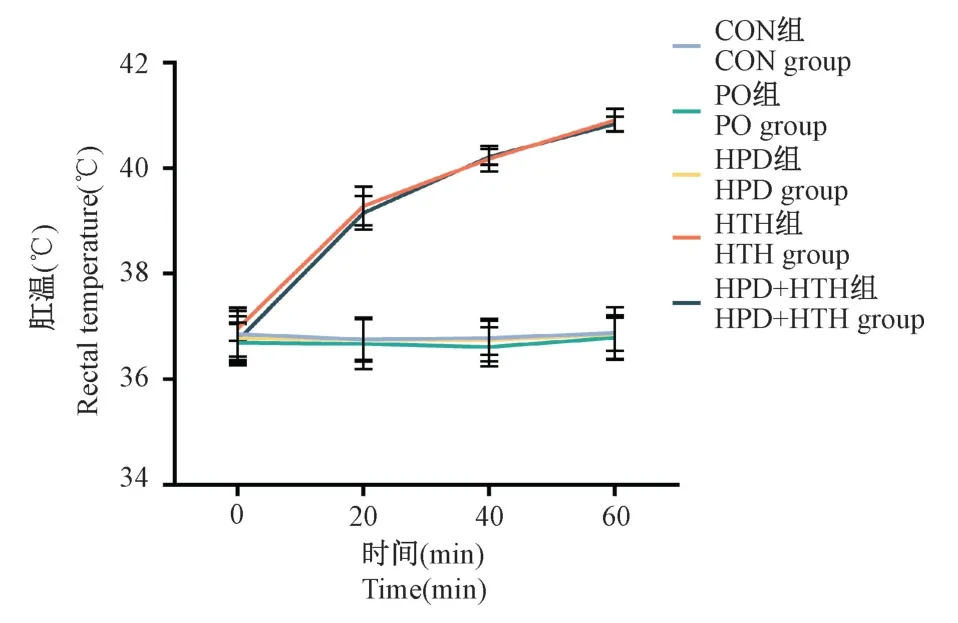
图1 肛温变化Figure 1 Changes of rectal temperature of the rats

图2 脱水率变化Note.Compared with CON group,∗P <0.05.Figure 2 Changes of rectal temperature of the rats
2.2 血清尿酸检测结果
实验开始前检测所有大鼠血尿酸基线水平,多组间比较其差异不具有统计学意义(P=0.620 >0.05)。实验4 周后,除CON 组外,其余各组血尿酸值均显著上升,且HTH 组显著高于PO 组、HPD +HTH 组高于HPD 组(P<0.05)。随着实验时间的持续,本实验观察到HTH 组和HPD+HTH 组大鼠血尿酸水平更为稳定,直至第12 周时均保持在相对较高的水平。相反,PO 组大鼠血尿酸水平从第4 周起开始下降,至12 周时已降至基线水平以下。总体而言,高温高湿环境建立的高尿酸血症大鼠模型较传统的药物诱导高尿酸血症大鼠模型,更为稳定,高尿酸状态持续更久,见图3。

图3 实验不同时间点各组大鼠血尿酸值变化折线图Figure 3 Line chart of serum uric acid value of rats in different time points in the experiment
2.3 血清肌酐检测结果
血清肌酐上升是出现肾损伤的标志。随着实验时间持续,各组大鼠血肌酐值均有所上升,至第8周时最高,且与CON 组相比,其他四组血肌酐值显著升高(P=0.002 <0.05)。但第12 周时PO、HPD、HTH 和HPD+HTH 组血肌酐值均有所下降,HTH 和HPD+HTH 组血肌酐值与其他组别无明显差异(P>0.05),见表1。因此,本实验造模12 周后,各实验组大鼠肾功能均有所下降,但HTH 组和HPD+HTH 组大鼠的肾功能损伤情况并未显著重于CON 组、PO 组和HPD 组(P>0.05)。

表1 实验不同时间点各组大鼠血肌酐值变化表(μmol/L)Table 1 Changes of serum creatine level in rats of different time points in the experiment(μmol/L)
2.4 Western Blot 检测HTH 和HPD+HTH 组尿酸转运蛋白表达变化
与CON 组相比,HPD、HTH 组和HPD+HTH组ABCG2 蛋白水平均显著降低(P=0.006、0.001、0.001 <0.05);HTH 组 与PO 组 相 比,ABCG2 蛋白水平显著降低(P=0.000 <0.05);与HPD 组相比,HPD+HTH 组ABCG2 蛋白水平显著降低(P=0.001 <0.05)。对于URAT1 蛋白水平,HPD 组、HTH 组和HPD+HTH 组均显著高于CON组(P=0.043、0.001、0.001 <0.05);更为重要的是,HTH 组URAT1 水平显著高于PO 组(P=0.001<0.05),HPD+HTH 组URAT1 水平显著高于HPD组(P=0.001 <0.05),见图4。

图4 免疫蛋白印迹实验结果Figure 4 Results of Western Blot experiment
2.5 免疫组织化学法观察实验各组大鼠肾尿酸转运蛋白定位表达变化
本实验通过免疫组化法检测造模12 周后各组大鼠肾上尿酸转运蛋白ABCG2 和URAT1 定位表达情况。光镜下可见尿酸转运蛋白ABCG2 和URAT1均位于肾近曲小管上皮细胞上。ABCG2 是负责尿酸分泌的蛋白,在本实验CON 组中该蛋白定位清洗,颜色正常,PO 组和HPD 组同样也有表达,颜色仍较为明显,而HTH 组和HPD+HTH 组ABCG2 表达显著下降,颜色明显变浅,分布面积少,见图5A。URAT1 是尿酸重吸收转运蛋白,在本实验中,CON组、PO 组和HPD 组该蛋白均有表达,电镜下可见部分肾小管呈棕褐色,而HTH 组和HPD+HTH 组大鼠肾小管中呈棕褐色的管腔数量显著增多,颜色加深,分布面积更广泛,见图5B。
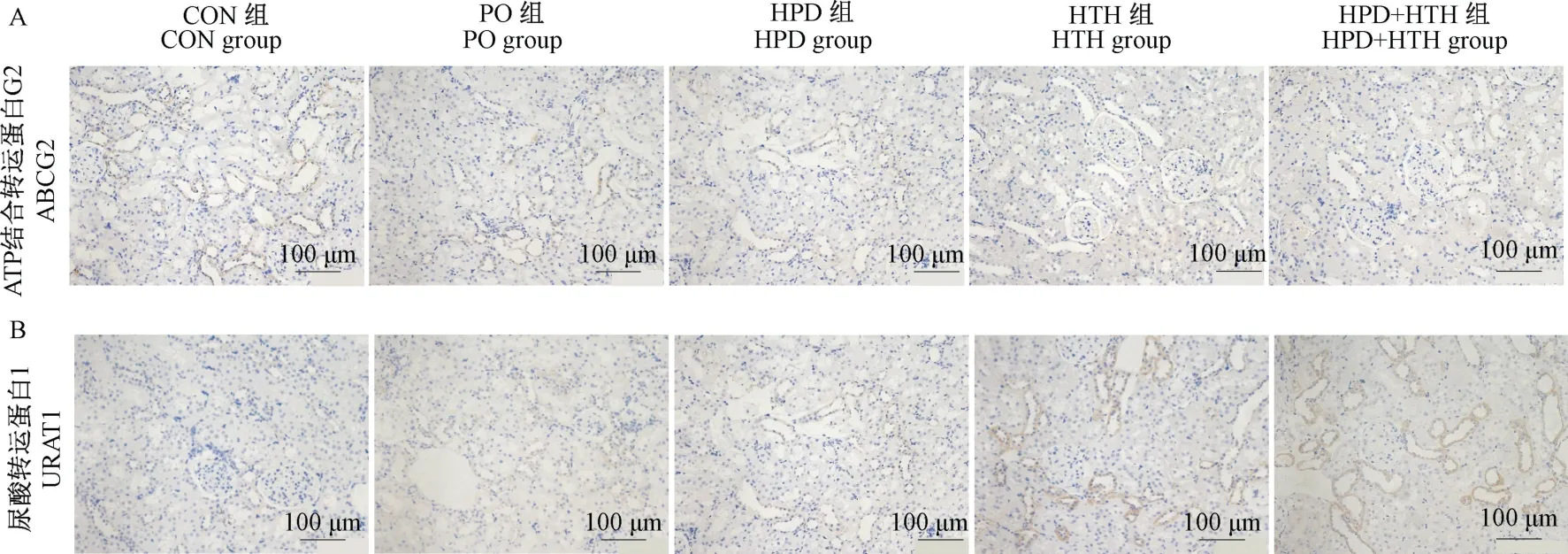
图5 免疫组织化学实验结果Note.A.Expression of ABCG2 in the kidney tissue.B.Expression of URAT1 in the kidney tissue.Figure 5 Results of immunohistochemistry experiment
3 讨论
高温高湿环境是工作环境温度在32℃以上和生活环境温度在35℃以上、相对湿度在60%以上的环境。随着全球气候变暖对人类健康构成的威胁与日俱增,高温高湿环境显著增加全球住院率、病死率,造成包括传染病、心肺系统疾病、消化系统疾病、不良妊娠结局以及内分泌系统疾病等在内的多种健康问题[11]。在此背景下,新的流行病学调查发现,我国南方沿海地区居民HUA 患病率已高达49.11%、痛风患病率为8.26%[12],远超我国总体水平(HUA 患病率13.3%、痛风患病率1.1%)[13],而该地域患病率升高与其高温高湿的气候特征关系密切[14]。
当环境温度高于35℃时,人体只有通过汗液蒸发才能降低体温,而汗液蒸发会将体内的水和电解质带走,使细胞外液丢失[15]。从生理上讲,机体通过排汗和增加流向皮肤的血液流量来适应炎热的环境,热量将跟随汗液和血液传导到体表从而促进其代谢。肾在体温调节的生理代偿机制中发挥着关键作用,例如调节血压、维持水钠平衡、钾和磷等身体化学物质的整体平衡。在正常情况下,肾通过自身调节机制保持肾血流量相对稳定,从而使肾小球滤过率和终尿的生成量保持相对恒定,而肾小球的滤过、肾小管和集合管的重吸收、分泌尿液,都受到神经和体液因素的调节[16]。
因此,一方面,当机体面临高温环境而处于热应激状态时,肾交感神经兴奋,传出冲动使肾小球滤过率减少,尿液生成减少。另一方面,高热情况下,机体由于大量出汗等原因出现脱水,血浆晶体渗透压升高,视上核及其周围区域渗透压感受器受刺激,使神经垂体释放抗利尿激素,肾集合管管腔对水的通透性增加,水的重吸收增多,尿液浓缩,尿量减少[17]。本实验中HTH 组和HPD+HTH 组大鼠血尿酸水平显著高于未经培养箱高温高湿处理的组别,且随着照射时间延长其肛温持续增长,并可见足垫部位及身体背部毛发明显潮湿。经称量体重后发现,该两组大鼠脱水率明显高于其他组,说明其血尿酸水平升高与高温高湿环境下脱水关系密切。而长期的高尿酸血症,高温大量的汗液和血液流向体表引起的慢性脱水和肾动脉血流量减少,高渗诱导的肾素-血管紧张素-醛固酮系统的激活,很有可能进一步导致肾组织损害,造成罹患急、慢性肾病风险显著增加[18],从而加重高尿酸血症的病程进展。
健康SD 大鼠的血尿酸水平一般在70~ 100 μmol/L[19],但由于已有的高尿酸血症模型造模动物、造模方法的选择众多,导致啮齿类动物高尿酸血症诊断标准难以界定,尚缺少公认的血尿酸高值作为诊断标准,因此,目前以模型组血尿酸水平高于空白对照组为造模成功的标准[20]。根据上述标准本实验在造模4 周即成功建立高尿酸血症大鼠模型。SD 大鼠血肌酐的正常水平在30 μmol/L 以内,本实验中除空白对照组外,其余模型组均自第4 周血肌酐水平即开始逐步上升。而造模12 周时模型组大鼠血尿酸水平有所回落,本课题组考虑与尿酸在大鼠体内形成刺激,反馈性增强尿酸酶的表达,导致对尿酸的分解增强有关。12 周时血肌酐水平的回落可能与大鼠适应性和血尿酸水平下降有关。
人体中2/3 的尿酸是由肾在排尿过程中代谢出体外的,肾小球滤过的尿酸98%以上被肾小管重吸收、分泌,所以肾小管不仅是尿液生成和排出的重要部位,也是影响尿酸排泄的重要部位。肾对尿酸的排泄过程是通过尿酸转运蛋白将血液中尿酸经过肾小球的滤过、近端小管重吸收、肾小管的分泌及分泌后的重吸收等过程转运至肾小管管腔内,从而与尿液一起排出体外[3]。其中起作用的尿酸转运蛋白包括URAT1、OAT4、OAT10、GLUT9、ABCG2等,URAT1、OAT4、OAT10、GLUT9 位于肾近端小管上皮细胞顶端膜上,介导尿酸盐从管腔转运到细胞中,调控尿酸盐的重吸收,URAT1 发挥最主要的作用;ABCG2 介导尿酸盐从细胞转运至肾小管管腔中,是调控尿酸分泌的关键尿酸转运蛋白[7,21]。
本实验通过免疫组织化学法明确观察到大鼠ABCG2 表达在肾近端小管上皮细胞中。多项研究表明,ABCG2 功能障碍可导致血尿酸水平的升高,促进HUA 和痛风的发生发展,并可能进一步导致肾小球滤过率的加速下降[22-23]。笔者在光镜下观察到HTH 组和HPD+HTH 组大鼠在高温高湿环境下ABCG2 蛋白表达量显著降低,不仅免疫组化阳性表达区域较对照组显著减少,颜色更浅;且结合Western Blot 发现,上述两组蛋白条带更浅,几乎无表达,提示在高温高湿环境下,极有可能导致ABCG2 蛋白功能障碍,减少肾小管对尿酸的排泄,促进HUA 的发生发展。
URAT1 蛋白是由SLC22A12 基因编码的有机阴离子转运体(OAT/SLC22)家族成员之一,负责在近曲小管基底膜外侧重吸收50%尿酸的功能,因此被认为是调节机体尿酸水平的主要转运蛋白[24]。Liu等[25]关于高原缺氧气候舱内大鼠URAT1 表达进行研究,发现其URAT1 表达较对照组明显上升,且实验4 周时是1 周时的1.5 倍,并同时观察到大鼠血尿酸水平的上升(P<0.05)。本研究中通过对HTH 组和HPD+HTH 组进行了为期12 周的高温高湿处理,发现其URAT1 表达量显著上升,高于未接受照射的其他3 组,提示高温高湿的环境可能通过上调URAT1 的表达量,促进肾小管对尿酸的重吸收,从而增加HUA 患病率。
4 结论
高温高湿环境会明显升高大鼠肛温、脱水率及血尿酸水平,并降低肾组织中分泌型尿酸转运蛋白ABCG2 的表达,上调重吸收型尿酸转运蛋白URAT1的表达。本研究对高温高湿环境引起血尿酸水平升高的机制提供了新的见解,后续仍需要进一步探究上述尿酸转运蛋白相关的信号转导通路,为降低该环境下作业工人的血尿酸水平,甚至预防尿酸性肾病的发生发展提供更多科学证据。

