新疆阿克苏地区猪场optrA/lsa(E)阳性粪肠球菌的耐药情况及传播特点分析
王东,陈万昭,李宏博,秦蕾,徐琦琦,刘泽鹏,夏利宁
新疆阿克苏地区猪场/阳性粪肠球菌的耐药情况及传播特点分析
王东,陈万昭,李宏博,秦蕾,徐琦琦,刘泽鹏,夏利宁
新疆农业大学动物医学学院/新疆草食动物新药研究与创制重点试验室,乌鲁木齐 830052
【目的】了解新疆阿克苏地区猪源粪肠球菌中和的流行及传播特点,并探明和阳性粪肠球菌的耐药情况,为评估两个耐药基因对公共卫生的影响和危害提供科学依据。【方法】对新疆农业大学兽医药理学实验室分离保存的322株粪肠球菌采用PCR的方法进行和筛查,根据CLSI推荐药物及方法采用琼脂稀释法测定和阳性菌株对氨苄西林、红霉素、泰乐菌素、四环素、多西环素、利奈唑胺、氟苯尼考、万古霉素、左氧氟沙星、恩诺沙星、庆大霉素和沃尼妙林的最小抑菌浓度(MIC)并进行耐药判定,利用PCR方法筛查相应的耐药基因,包括和。选取31株不同来源的和阳性粪肠球菌进行MLST分子分型和接合转移试验。【结果】共193株粪肠球菌检出和/或,其中38株和共存,9株仅携带,146株仅携带。这193株粪肠球菌对红霉素、泰乐菌素、四环素、多西环素、庆大霉素和沃尼妙林的耐药率均达到100%,虽然检出率远低于,但阳性菌株总体耐药程度明显高于仅携带的菌株以及、双阴性的菌株,其耐药基因的检出结果也呈现相同趋势。和共存和仅携带菌株的多重耐药谱集中在8耐和10耐,占比分别为84.6%和100.0%,而仅携带的菌株和、双阴性菌株的多重耐药谱主要集中在6—8耐,占比为89.4%和90.7%。进一步分析、与耐药性之间的关系发现,耐药较为严重的猪场和的检出率也相对较高。耐药基因检出结果显示:193株菌均不同程度地携带、、、、、--、,并且、共存的菌株及仅携带菌株的耐药基因检出率总体上也高于仅携带的菌株和、双阴性菌株。MLST和接合转移试验结果提示,/(E)菌株遗传环境复杂、可能既存在克隆传播又存在水平转移的现象。【结论】新疆阿克苏地区猪源粪肠球菌中和的高携带率以及高耐药水平表明该地区耐药形势严峻,对当地生猪养殖业甚至于公共卫生安全都造成威胁,应及时采取措施以防控耐药性的进一步发展。
阿克苏地区;猪场;粪肠球菌;optrA基因;lsa(E)基因;耐药
0 引言
1 材料与方法
1.1 材料
1.1.1 试验菌株来源 从新疆农业大学药理实验室前期于2018年11月在阿克苏地区周边4个猪场共采集样品1 023份,样品包括肛拭子及环境样,其中A猪场269份、B猪场234份、C猪场121份、D猪场399份。1 023份样品共分离粪肠球菌322株,其中A猪场44株、B猪场81株、C猪场35株、D猪场162株)。
1.1.2 标准菌株及培养基 粪肠球菌的标准质控菌(ATCC29212)、金黄色葡萄球菌的标准质控菌株(ATCC29213)接合转移工程菌(JH2-2)均购自杭州天和微生物试剂有限公司;肠球菌选择琼脂、BHI肉汤、MH肉汤培养基购自北京奥博星有限公司。
1.1.3 药品 红霉素(有效含量98%)、泰乐菌素(有效含量100%)、利奈唑胺(有效含量98%)、四环素(有效含量98%)、多西环素(有效含量100%)、万古霉素(有效含量98%)、氟苯尼考(有效含量98%)、左氧氟沙星(有效含量99%)、恩诺沙星(有效含量99%)、庆大霉素(有效含量590 μg·mg-1)和沃尼妙林(有效含量98%),上述药物购自上海源叶生物科技有限公司。
1.2 方法
试验在新疆乌鲁木齐市新疆农业大学动物医学学院药理实验室完成,试验时间为2019年10月至2022年1月。
1.2.1 PCR检测粪肠球菌中的和将实验室前期保存的322株粪肠球菌使用BHI肉汤及肠球菌选择琼脂培养基进行复苏,并使用水煮法提取菌株DNA模板,根据文献[15]合成和引物序列,使用PCR的方法筛选携带和的菌株,并将有目的条带的菌株PCR产物送往生工进行和测序,测序结果输入网站NCBI(BLAST: Basic Local Alignment Search Tool (nih.gov))进行比对以验证PCR结果的准确性,引物序列详见表1。

表1 optrA和lsa(E)引物序列、片段大小及退火温度
1.2.2 药物敏感性试验 除沃尼妙林外,其余药物均根据美国临床实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)发布的抗微生物抗菌药物敏感性试验的标准[16],对阳性菌株使用琼脂稀释法进行大9类12种药物的最小抑菌浓度测定(minimum inhibitory concentration,MIC),采用粪肠球菌标准菌株ATCC29212作为对照,结果为便于统计以敏感(S)、耐药(R)两种形式表示,其中中介(低水平耐药)计算为耐药。由于CLSI并未收录沃尼妙林MIC值,也未查阅到相关标准的文献,根据粪肠球菌ATCC29212、接合转移工程菌JH2-2及实验室不携带沃尼妙林耐药基因的菌株的MIC均小于等于64 μg·mL-1的现象,统计判定试验菌株MIC值≥128 μg·mL-1时,存在细菌对该药物出现敏感性明显下降的现象,初步判定为耐药(使用金黄色葡萄球菌标准菌株ATCC29213作为对照)。
1.2.3 PCR检测部分相关耐药基因 根据文献[15, 17]合成相关耐药基因引物,引物序列见表2,对携带、的粪肠球菌进行其他耐药基因检测,其包括和,并将有目的条带菌株PCR产物送往生工进行对应基因测序,测序结果输入Basic Local Alignment Search Tool 网站(https:// blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对以验证PCR结果的准确性。
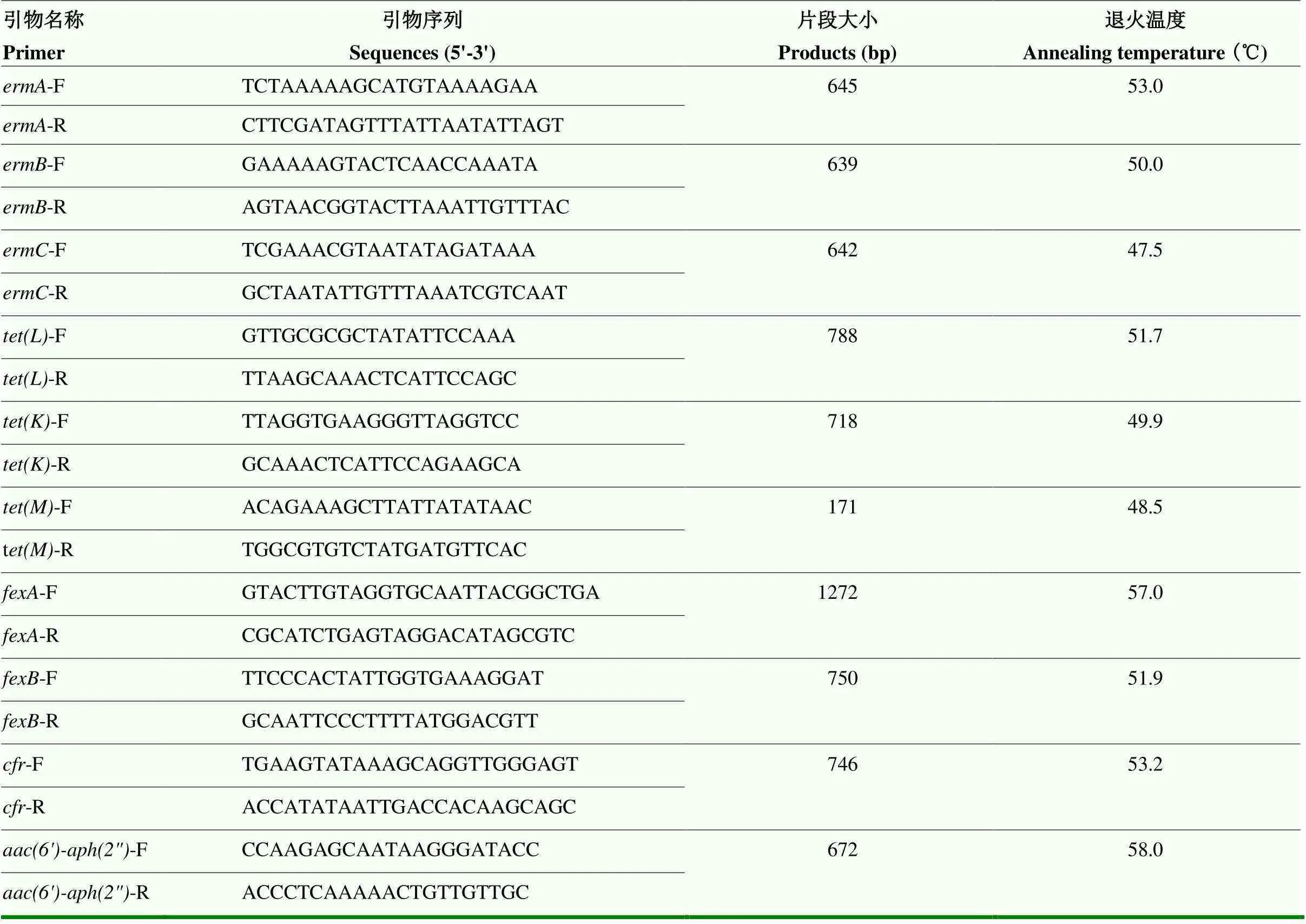
表2 相关耐药基因引物序列、片段大小及退火温度
1.2.4 MLST分型 对同时携带和两种基因、仅携带和仅携带这3种情况的菌株随机挑选,挑选原则是保证每个猪场、每个生长阶段及环境源均有所覆盖。通过PubMLST(https:// pubmlst.org/)网站获取粪肠球菌7对管家基因的引物序列(、、、、、和),送至生工进行引物合成,根据其条件对阳性粪肠球菌进行PCR检测后将扩增产物送往生工进行测序后,将7个等位基因序列输入PubMLST网站获得其ST型,并使用phyloviz2.0软件进行MLST图谱的绘制。
1.2.5 接合转移试验 接合转移试验[18]使用肉汤接合法进行,受体菌使用粪肠球菌JH2-2,氟苯尼考浓度为64 μg·mL-1,林可霉素为256 μg·mL-1,利福平和夫西地酸均采用128 μg·mL-1,并将疑似接合子使用微量肉汤稀释法进行MIC的测定,测定其相关耐药基因并测序,测序结果输入网站NCBI进行比对,以验证接合子的可靠性。
1.2.6 统计学分析 使用IBM SPSS Statistics 26.0进行数据分析,对药敏结果和多重耐药结果使用卡方或Fisher精确检验进行非参数检验,<0.05为差异显著。
2 结果
2.1 携带目标基因的菌株检测
322株粪肠球菌中检出携带目标基因的菌株193株,包括和基因共存、仅检出以及仅检出三种情况,其检出结果见表3,由表可知,其中仅检出基因的阳性菌株的占比最高,共检出146株,检出率为45.3%,其中A猪场检出率为11.4%(5/44)、B猪场检出率为33.3%(27/81)、C猪场检出率为22.9%(8/35)、D猪场检出率为63.0%(102/162),其次为和共存菌株共检出38株,检出率为11.8%(38/322),总体检出率为11.8%,其中A猪场检出率为4.5%(2/44),B猪场检出率为27.2%(22/81),C猪场检出率为0(0/35),D猪场检出率为8.6%(14/162);仅检出菌株最少,共9株,总体检出率为2.8%,其中A猪场检出率为4.5%(2/44)、B猪场检出率为8.6%(7/81)、C和D猪场检出率均为0。
2.2 携带目标基因的菌株药敏结果
根据表4药敏结果显示:322株菌对红霉素、泰乐菌素、四环素、多西环素、庆大霉素沃尼妙林耐药率均在98%以上,对利奈唑胺、氟苯尼考、左氧氟沙星、恩诺沙星的耐药率在14.3%—42.5%之间,未检出对氨苄西林和万古霉素耐药的菌株。不同养殖场之间B猪场利奈唑胺、氟苯尼考、恩诺沙星和左氧氟沙星的粪肠球菌耐药率均显著高于A、C、D 3个猪场(<0.05),A、D猪场在利奈唑胺、氟苯尼考、恩诺沙星和左氧氟沙星的粪肠球菌耐药率均同时或部分显著高于C猪场。
根据表5药敏结果可知,和共存菌株对氟苯尼考、利奈唑胺和庆大霉素的耐药率均达到100%,其中和共存菌株对利奈唑胺及氟苯尼考的耐药率显著高于只携带的菌株和、阴性菌株(<0.05),同时或部分携带、的菌株对左氧氟沙星和恩诺沙星耐药率显著高于、阴性菌株(<0.05),其余菌株和药物之间差异不显著。
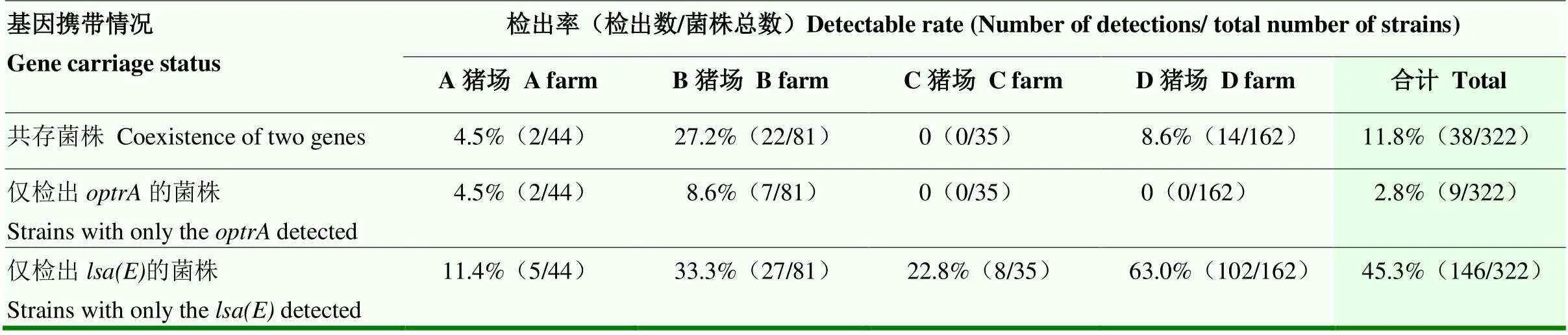
表3 粪肠球菌中携带optrA、lsa(E)的阳性菌株检出结果
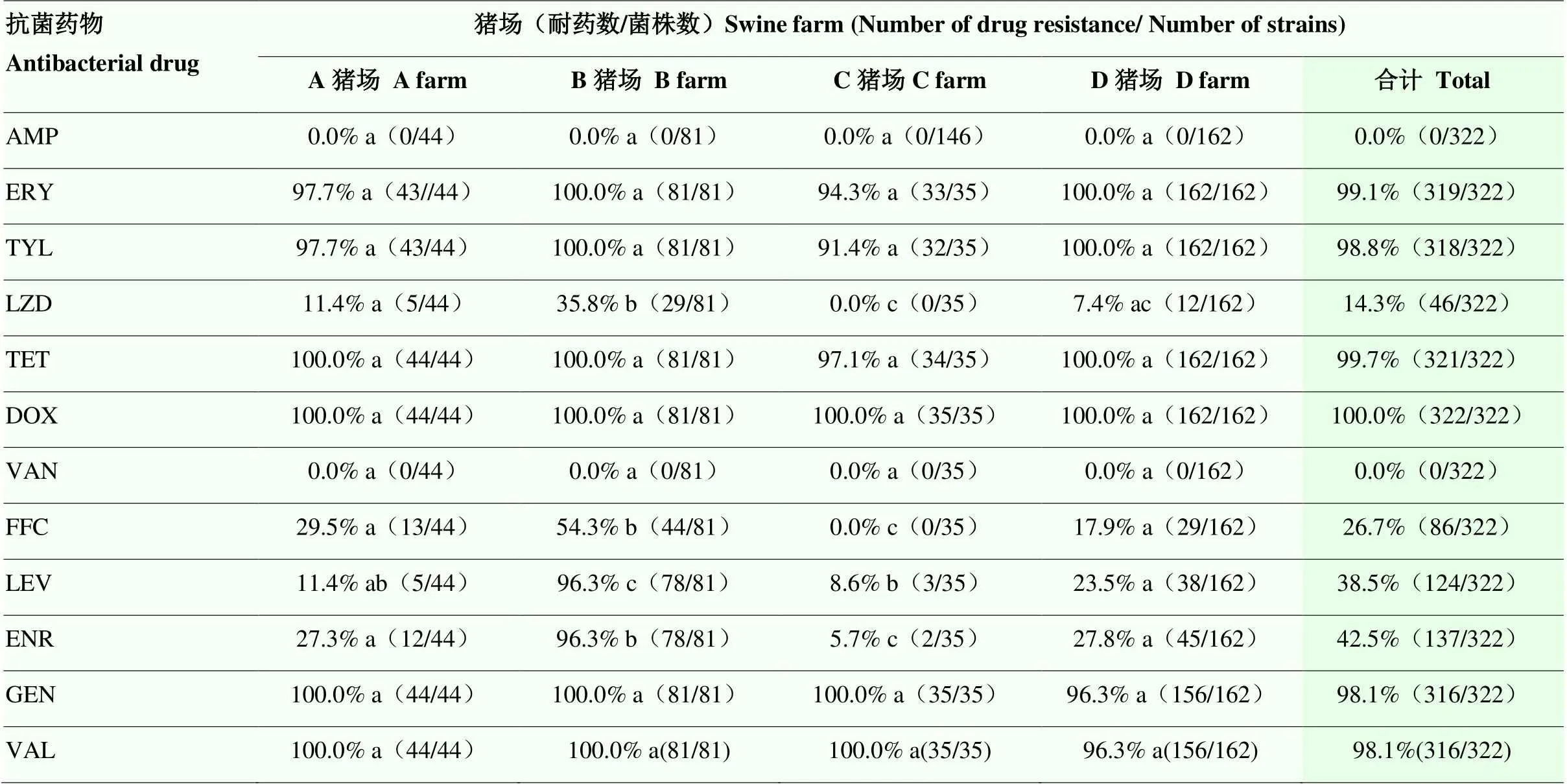
表4 不同养殖场粪肠球菌药敏试验
AMP:氨苄西林;ERY:红霉素;TYL:泰乐菌素;LZD:利奈唑胺;VAL:沃尼妙林;TET:四环素;DOX:多西环素;VAN:万古霉素;FFC:氟苯尼考;LEV:左氧氟沙星;ENR:恩诺沙星;GEN:庆大霉素。表中同一行数字后不同字母表示差异显著(<0.05),下表同
AMP: ampicillin; ERY: erythromycin; TYL: tylosin; LZD: linezolid; VAL: vernamycin; TET: tetracycline; DOX: doxycycline; VAN: vancomycin; FFC: florfenicol; LEV: levofloxacin; ENR: enrofloxacin; GEN: gentamicin. Different letters after the numbers in the same row in the table indicate significant differences (<0.05), as in the following table
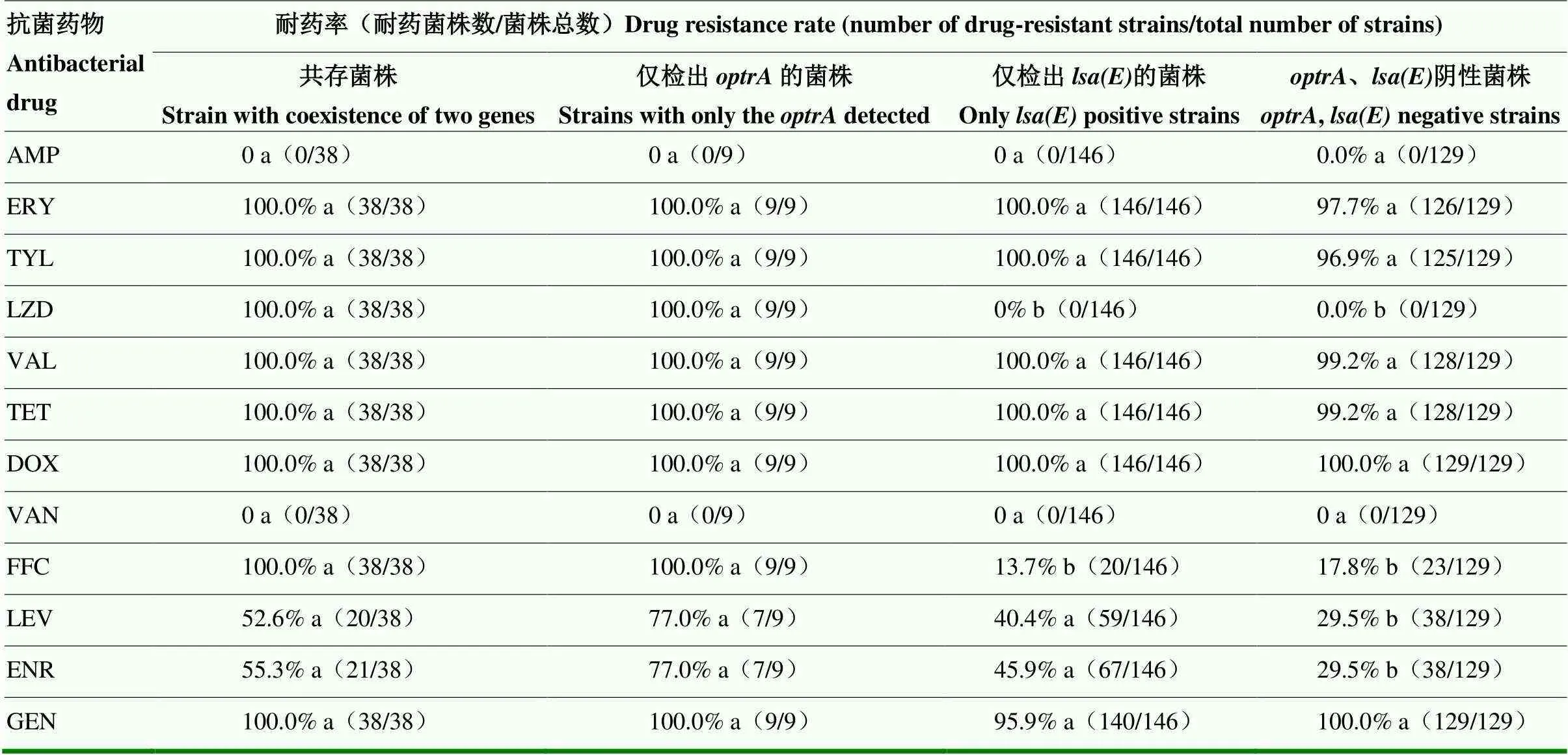
表5 携带目标基因粪肠球菌药敏试验
2.3 携带optrA和/或lsa(E)粪肠球菌的多重耐药
由图1可知,携带和/或的猪场粪肠球菌的多耐谱型分布在5—8耐以及10耐,共存菌株和仅检出菌株的多重耐药谱型主要为8耐和10耐,仅携带的菌株8耐和10耐占比达到100%,和共存菌株的8耐和10耐占比为84.6%,其余多耐菌株在6耐和7耐有少量分布,只携带的菌株和、阴性菌株主要多重耐药谱为6—8耐,占比为89.4%和90.7%,其余菌株少量分布于5耐和9耐,阴性菌株6耐占比相对较高。
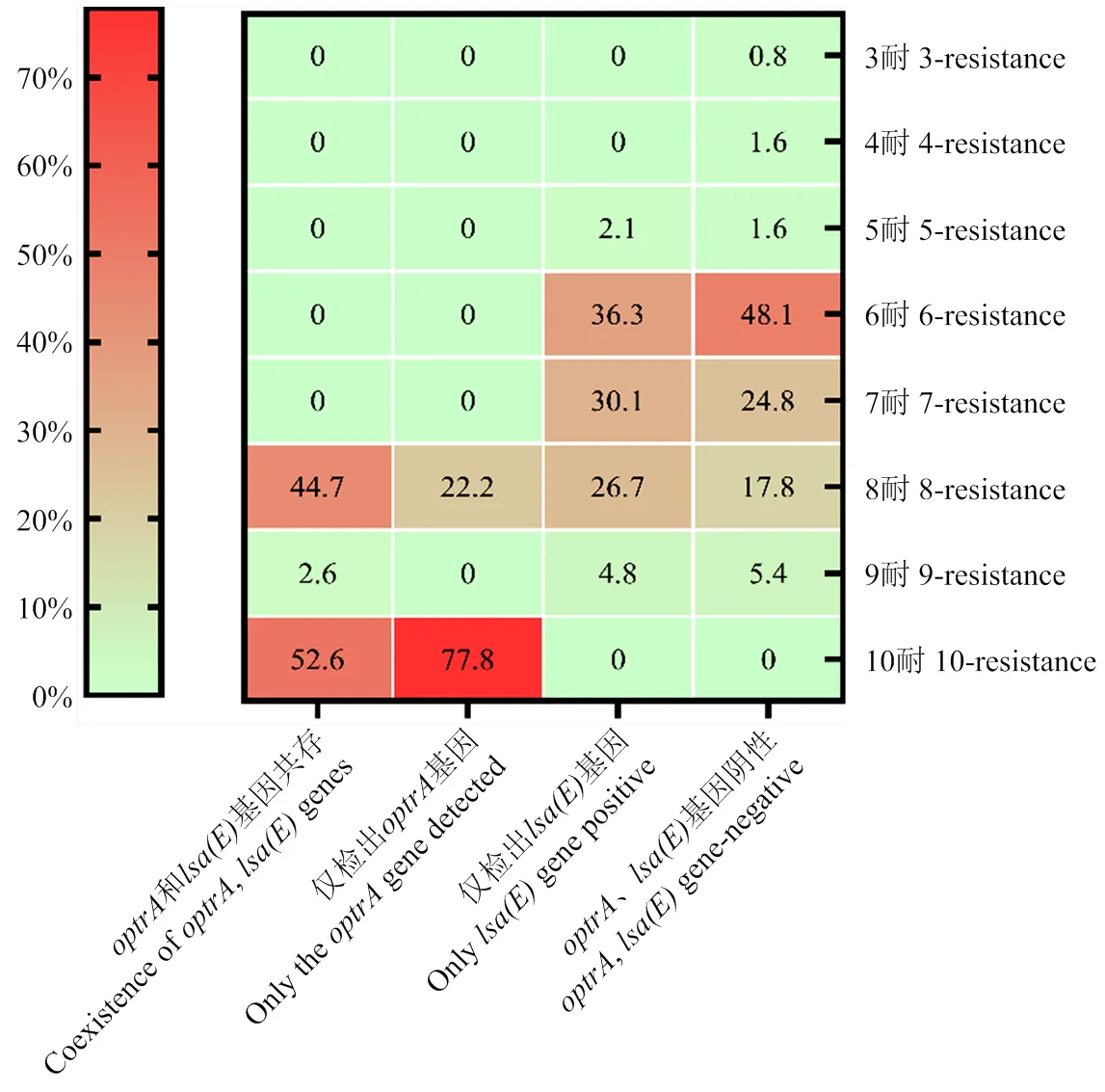
图1 携带optrA和/或lsa(E)粪肠球菌的多重耐药结果
2.4 携带optrA和/或lsa(E)粪肠球菌中其他耐药基因的检测
阿克苏地区耐药基因检出结果与药敏试验结果相符,其结果详见表6,携带和/或粪肠球菌中红霉素耐药基因以及四环素耐药基因、的检出率均在80%以上,其中和的检出率甚至高达100%。值得注意的是和共存菌株和仅检出菌株中、以及氟苯尼考相关耐药基因的检出率也均达到80%以上,显著高于仅检出菌株(<0.05)。和共存菌株和仅检出菌株中庆大霉素耐药基因的检出率均达到95%以上,显著高于仅检出菌株和、阴性菌株(<0.05)。
2.5 部分携带optrA和/或lsa(E)基因粪肠球菌的MLST分型
由表7及图2可知挑选的31株菌,总体分为7个单独型,分别为ST32、ST81、ST369、ST532、ST632、ST633和ST1007以及两个克隆群(clonal complex,CC)CC16(包括ST16、ST1061)和CC480(包括ST480、ST1058)。其中CC480(9株)和CC16(9株),其中CC480型菌株大多都携带,CC16型菌株大多都携带。和共存菌株和仅检出的菌株共有的ST型为ST369、ST1058以及ST1061;和共存菌株和仅检出的菌株共有的ST型为ST16;此外和共存菌株具特有的ST型为ST32型,只有仅检出的菌株特有的ST型为ST633,而仅检出菌株具有特有的ST型较多,包括ST81、ST480、ST532、ST632、ST1007。A猪场和B猪场均含有CC480型菌株,A、B和C 3个猪场均含有CC16型菌株,且各养殖场之间也含有各自特有的ST型,D猪场粪肠球菌与A、B、C 3个猪场ST型没有交叉。以上结果表明阿克苏地区携带和/或猪场粪肠球菌中的和遗传形式多样,可能既存在克隆传播也存在水平转移的现象。
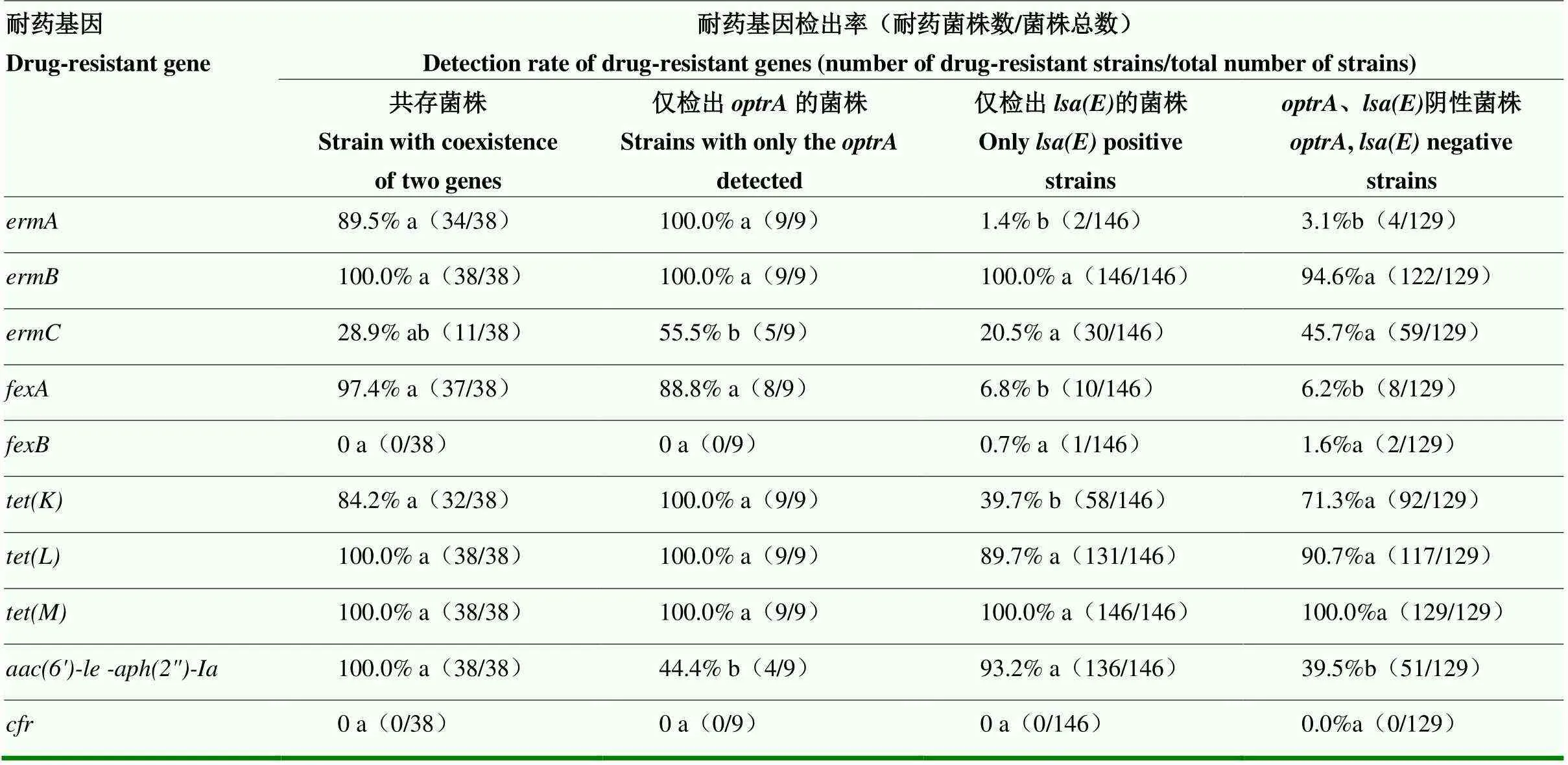
表6 携带optrA和/或lsa(E)粪肠球菌中其他耐药基因的检出情况
2.6 部分携带optrA和/或lsa(E)粪肠球菌接合转移试验
对选取的31株菌进行接合转移试验,通过药敏试验和PCR电泳检测共得到2株接合子,通过药敏试验和PCR电泳检测得到2株接合子,接合效率和ST型结果见表8,受体菌、供体菌和接合子药敏结果见表9,菌株JH2-2是受体菌,菌株B101为携带和的供体菌、B101-1为B101的接合子、D105为携带的供体菌,D105-1为D105的接合子。从电泳图可以看出,D105和D105-1均可检出,条带大小与预期相符(图3)。D105-1菌株相较于JH2-2菌株氟苯尼考的MIC值由4 μg·mL-1提升至64 μg·mL-1,利奈唑胺MIC值由1 μg·mL-1提升至4 μg·mL-1。B101和B101-1均可检出,条带大小与预期相符。B101菌株相较于JH2-2菌株,沃尼妙林MIC值由64 μg·mL-1提升至256 μg·mL-1。B101-1未检出,结合B101和B101-1的药敏结果,表明未从B101菌株转移至B101-1中。16S测序结果表明两株接合子与受体菌同源性为100%,和测序结果相似性也均达到99%以上。

表8 接合转移试验
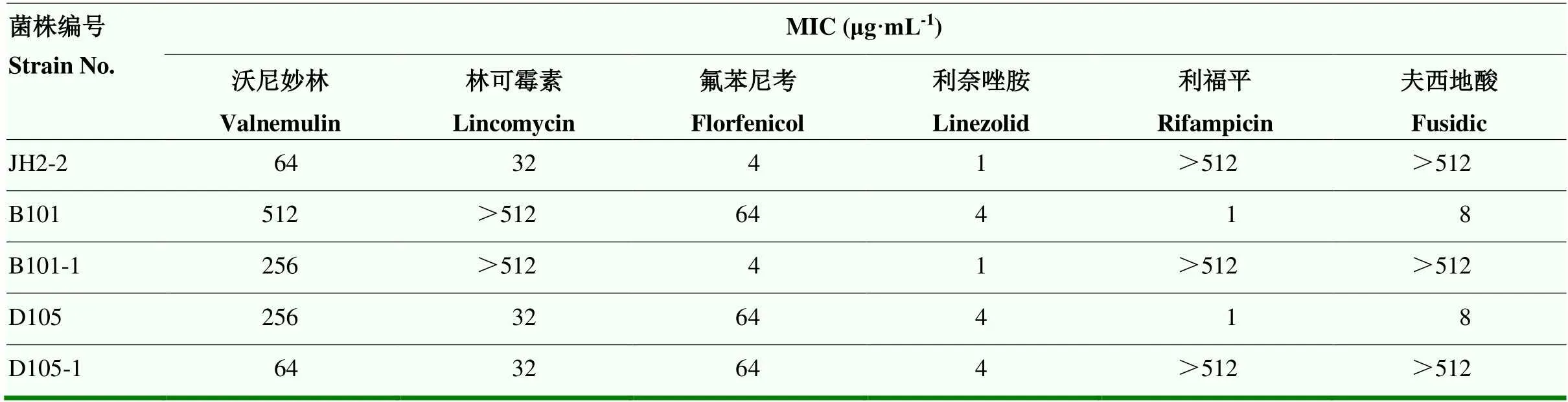
表9 接合转移试验药敏结果
3 讨论
研究表明粪肠球菌对头孢菌素类、氨基糖苷类、林克胺类等多种药物存在固有耐药导致其可选择的抗菌药物范围收窄,随着肠球菌不断从外源捕获耐药基因,使其耐药性防控变得愈加困难[19]。随着继发感染引起的死亡率逐渐升高,加之其耐药基因易传播的特性,人们逐渐意识到肠球菌耐药所带来的危害。早在2000年欧洲VRE的感染率就达到了5.8%,在美国2013的报告中VRE的分离率竟然高达30.3%,而我国2015关于西南地区的一份调查显示,其耐药率也达到了9.7%[20]。这提醒我们如果治疗VRE感染的一线用药耐药性进一步发展,人和动物很有可能面临无药可用的局面。
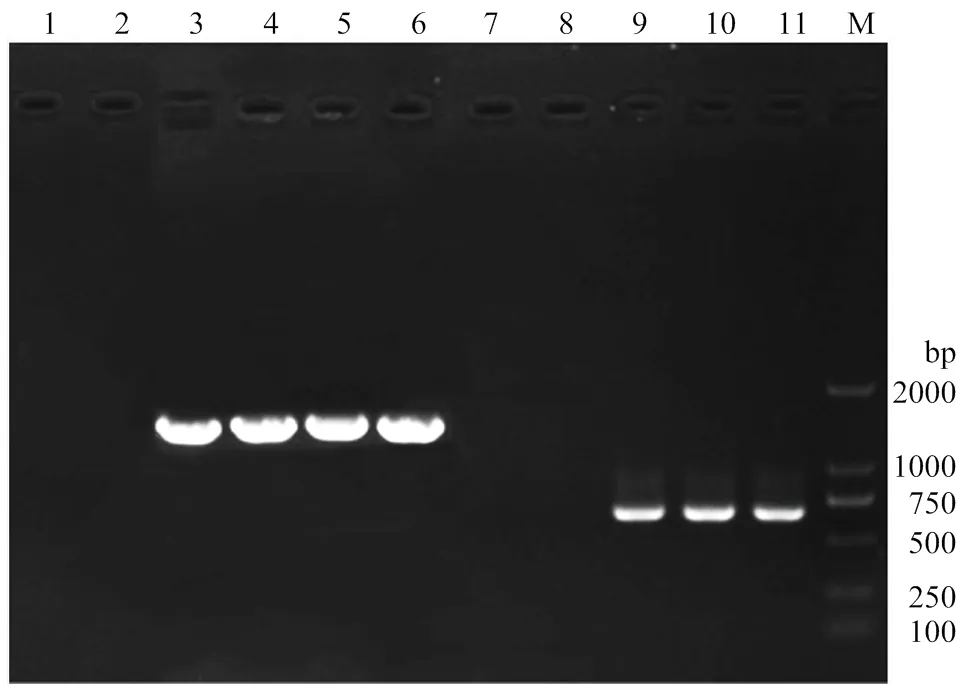
1:JH2-2-optrA;2:JH2-2-lsa(E);3:B101-optrA;4:D105-optrA;5:D105-1-optrA;6:optrA阳性对照;7:B101-1-optrA;8:阴性;9:B101;10:B101-1-lsa(E);11:lsa(E)阳性对照;M:DL2000
3.1 阿克苏地区猪场粪肠球菌耐药表型特征分析
本研究中携带的菌株相对于不携带的菌株对氟苯尼考和利奈唑胺的耐药率均显著提升,与前人研究结果一致。虽然对粪肠球菌所检药物的耐药率并没有显著提升,可能是由于肠球菌固有耐药以及有其他耐药基因介导所致,但也不可忽视其通过水平转移传递给其他种属的菌株,导致其耐药风险扩大。
本研究检测结果表明,携带菌株的总分离率为14.6%,低于伊思达调查的江苏苏北地区的猪源粪肠球菌分离率(21.5%)。携带菌株的总分离率为55.8%,低于商艳红报道的河南新乡等地区的猪源粪肠球菌分离率(62.3%)[21-22]。虽然这两个基因的检出率总体数据低于江苏、河南部分地区,但阿克苏地区的猪场粪肠球菌的耐药形势仍然严峻。阿克苏地区不同猪场之间耐药严重程度也有所不同,以B猪场最为严重,A猪场其次,C猪场相对较轻,而和检出率与耐药程度呈现一定正相关性,这表明阿克苏地区猪场的饲养管理水平不一,而这种抗菌药物耐药越严重,多重耐药基因出现的概率就越高,为了避免这种情况发生,应合理选择抗菌药物,避免抗菌药物的不规范使用。
3.2 阿克苏地区猪场粪肠球菌耐药基因特征分析
本研究中阿克苏地区携带的猪场粪肠球菌的耐药严重程度远高于携带的菌株,且的出现往往会伴随的出现,多重耐药结果和耐药基因检出情况也呈现相同的趋势。菌株的出现相较于菌株的出现频率较低,但是和共存菌株中携带的其他耐药基因更多,故带来的危害也较大。氨苄西林和万古霉素是为数不多能治疗携带菌株和仅携带菌株感染的药物,仅携带的菌株还能使用氟苯尼考、利奈唑胺、恩诺沙星等药物进行治疗,但是其造成的影响也不容忽视。
阿克苏地区猪场中分离的粪肠球菌携带的耐药基因型、、的检出率均在80%以上,其中和的检出率甚至高达100.0%,与顾欣2013年于上海地区猪源肠球菌中分离的肠球菌、基因的检出率相近(和的检出率依次为95.5%和91.0%)[23],高于齐亚银2014年于新疆地区分离的动物源、的检出率(和基因检出率为依次为50.0%和45.0%)[24],其次阿克苏地区猪场中分离的粪肠球菌中酰胺醇类相关耐药基因、的检出率分别为29.1%、0.5%,远低于高懿2016— 2017年在江苏北部地区分离的猪源粪肠球菌的检出结果(和基因检出率依次为89.1%和1.7%)[25],造成这样的原因可能是随着大环内酯类、四环素类药物在临床上的广泛使用,导致耐药性逐年递增,其次地域性原因也会导致耐药性有一定差异。
3.3 MLST分子分型及接合转移结果分析
4 结论
相对于对于阿克苏地区粪肠球菌带来的威胁更大,虽然危害相对较小,但是不排除其可通过水平转移的方式传递给其他种属的细菌的可能,使得其他种属的细菌危害进一步扩大。阿克苏地区粪肠球菌的总体耐药情况不容乐观,如不加以重视很有可能对当地养猪业带来沉重打击。猪肉作为人类餐桌上的主要肉类,需要对多重耐药粪肠球菌的传播引起足够重视,如果多重耐药粪肠球菌通过食物链传递给人类,对公共卫生安全带来的危害不可低估。
[1] MAGIORAKOS A P, SRINIVASAN A, CAREY R B, CARMELI Y, FALAGAS M E, GISKE C G, HARBARTH S, HINDLER J F, KAHLMETER G, OLSSON-LILJEQUIST B, et al. Multidrug-resistant,extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance. Clinical Microbiology and Infection, 2012, 18(3): 268-281.
[2] BONTEN M J, WILLEMS R, WEINSTEIN R A. Vancomycin- resistant: Why are they here, and where do they come from? The Lancet Infectious Diseases, 2001, 1(5): 314-325.
[3] BOUCHER H W, COREY G R. Epidemiology of methicillin-resistant. Clinical Infectious Diseases, 2008, 46 (Supplement_5): S344-S349.
[4] LIU H, FEI C, ZHANG Y, LIU G, LIU J, DONG J. Presence, distribution and molecular epidemiology of multi-drug-resistant Gram-negative bacilli from medical personnel of intensive care units in Tianjin, China, 2007–2015. Journal of Hospital Infection, 2017, 96(2): 101-110.
[5] FREITAS A R, TEDIM A P, NOVAIS C, LANZA V F, PEIXE L. Comparative genomics of global-carryinguncovers a common chromosomal hotspot foracquisition within a diversity of core and accessory genomes. Microbial Genomics, 2020, 6(6): e000350.
[6] LI X S, DONG W C, WANG X M, HU G Z, WANG Y B, CAI B Y, WU C M, WANG Y, DU X D. Presence and genetic environment of pleuromutilin–lincosamide–streptogramin A resistance geneinof human and swine origin. Journal of Antimicrobial Chemotherapy, 2014, 69(5): 1424-1426.
[7] WANG Y, LÜ Y, CAI J C, SCHWARZ S, CUI L Q, HU Z D, ZHANG R, LI J, ZHAO Q, HE T, WANG D C, et al. A novel gene,, that confers transferable resistance to oxazolidinones and phenicols and its presence inandof human and animal origin. Journal of Antimicrobial Chemotherapy, 2015, 70(8): 2182-2190.
[8] WENDLANDT S, LOZANO C, KADLEC K, GÓMEZ-SANZ E, ZARAZAGA M, TORRES C, SCHWARZ S. The enterococcal ABC transporter geneconfers combined resistance to lincosamides, pleuromutilins and streptogramin A antibiotics in methicillin-susceptible and methicillin-resistant. Journal of Antimicrobial Chemotherapy, 2013, 68(2): 473-475.
[9] LI D X, WANG Y, SCHWARZ S, CAI J C, FAN R, LI J, FEßLER A T, ZHANG R, WU C M, SHEN J Z. Co-location of the oxazolidinone resistance genes optrA and cfr on a multiresistance plasmid from. Journal of Antimicrobial Chemotherapy, 2016, 71(6): 1474-1478.
[10] VAN DEN BOGAARD A E, STOBBERINGH E E. Epidemiology of resistance to antibiotics. Links between animals and humans. International Journal of Antimicrobial Agents, 2000, 14(4): 327-335.
[11] ENNAHAR S, CAI Y M. Biochemical and genetic evidence for the transfer ofCollins et al. 1989 to the genusascomb. nov. International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt 2): 589-592.
[12] 南海辰, 底丽娜, 夏利宁. 新疆多源喹诺酮类耐药大肠杆菌耐药基因检测及分析. 中国农业科学, 2014, 47(20): 4096-4108. doi:10. 3864/j.issn.0578-1752.2014.20.018.
NAN H C, DI L N, XIA L N. Detection and analysis of resistance genes in quinolone-resistantisolates from different livestocks in Xinjiang. Scientia Agricultura Sinica, 2014, 47(20): 4096-4108. doi:10.3864/j.issn.0578-1752.2014.20.018. (in Chinese)
[13] 陈朝喜, 贺冬梅, 汤承. 川西北高原2009—2016年牦牛源大肠杆菌耐药性变迁和整合子携带分析. 中国农业科学, 2017, 50(9): 1705-1713. doi:10.3864/j.issn.0578-1752.2017.09.016.
CHEN C X, HE D M, TANG C. Vicissitude of drug resistance and integron-carrying ofisolated from yak between 2009 and 2016 in northwest Sichuan Plateau. Scientia Agricultura Sinica, 2017, 50(9): 1705-1713. doi:10.3864/j.issn.0578-1752.2017.09.016. (in Chinese)
[14] 轩慧勇, 宋强强, 刘雪连, 宋超慧, 徐琦琦, 秦蕾, 夏利宁. 2015—2017年新疆动物源鼠伤寒沙门菌耐药性分析. 中国农业大学学报, 2021, 26(2): 88-97.
XUAN H Y, SONG Q Q, LIU X L, SONG C H, XU Q Q, QIN L, XIA L N. Drug resistance ofTyphimurium isolated from animals in Xinjiang, 2015-2017. Journal of China Agricultural University, 2021, 26(2): 88-97. (in Chinese)
[15] 李君. 猪源耐甲氧西林金黄色葡萄球菌流行病学特征及遗传进化分析[D]. 北京: 中国农业大学, 2017.
LI J. Epidemiological characteristics and phylogenetic analysis of pig associated methicillin-resistant[D]. Beijing: China Agricultural University, 2017. (in Chinese)
[16] CLSI. Performance Standards for Antimicrobial Susceptibility Testing [EB/OL]. [2021/3/23]. https://clsi.org/standards/products/microbiology/ documents/m100/.
[17] 李德喜. 恶唑烷酮类耐药基因cfr和optrA在猪源MRSA和CoNS中流行及传播机制的研究[D]. 北京: 中国农业大学, 2016.
LI D X. The epidemiological study on the oxazolidinones resistance genesandand theirs transmission mechanism among MRSA and CoNS isolates from swine[D]. Beijing: China Agricultural University, 2016. (in Chinese)
[18] 刘志远, 许淑珍, 马纪平. 高耐庆大霉素粪肠球菌质粒接合转移试验的方法探讨. 中华医院感染学杂志, 2005, 15(6): 608-610.
LIU Z Y, XU S Z, MA J P. Plasmid conjugation method for high level gentamicin resistant. Chinese Journal of Nosoconmiology, 2005, 15(6): 608-610. (in Chinese)
[19] 杜蓉, 冯萍. 肠球菌的耐药机制研究进展. 华西医学, 2006, 21(2): 395-396.
DU R, FENG P. Research progress on drug resistance mechanism of. West China Medical Journal, 2006, 21(2): 395-396. (in Chinese)
[20] 许建文, 史道华. 万古霉素耐药肠球菌耐药机制的研究进展. 中国抗生素杂志, 2016, 41(5): 329-334.
XU J W, SHI D H. Progress of vancomycin resistance mechanism ofspp. Chinese Journal of Antibiotics, 2016, 41(5): 329-334. (in Chinese)
[21] 伊思达, 高懿, 陈丽, 黄金虎, 王晓明, 王丽平. 猪源粪肠球菌对常用抗菌药物的耐药性分析及其酰胺醇类耐药基因的检测. 畜牧与兽医, 2021, 53(10): 83-88.
YI S D, GAO Y, CHEN L, HUANG J H, WANG X M, WANG L P. Antimicrobial susceptibility and phenicols resistance genes inisolated from swine. Animal Husbandry & Veterinary Medicine, 2021, 53(10): 83-88. (in Chinese)
[22] 商艳红. 耐药基因和在猪源肠球菌和链球菌中流行及传播机制的研究[D]. 杨凌: 西北农林科技大学, 2019.
SHANG Y H. The epidemiological characteristics and dissemination mechanism of resistance gene OptrA and lsa(E) amongandfrom swine[D]. Yangling: Northwest A & F University, 2019. (in Chinese)
[23] 顾欣, 商军, 张文刚, 姜芹. 猪源分离粪肠球菌的耐药性及基因型分析. 中国抗生素杂志, 2017, 42(3): 225-229.
GU X, SHANG J, ZHANG W G, JIANG Q. Analysis of genotype and antimicrobial resistance ofisolates from pigs. Chinese Journal of Antibiotics, 2017, 42(3): 225-229. (in Chinese)
[24] 齐亚银. 动物源粪/屎肠球菌抗生素耐药表型及耐药基因型的检测.中国畜牧兽医学会2014年学术年会论文集. 广州, 2014: 524.
QI Y Y. Detection of antibiotic resistance phenotype and genotype of/from animals. Proceedings of the 2014 academic annual meeting of the Chinese Association of Animal Science and Veterinary Medicine. Guangzhou, 2014: 524. (in Chinese)
[25] 高懿. 江苏猪源肠球菌的耐药性调查及其酰胺醇类/噁唑烷酮类和磷霉素耐药基因的水平传播机制分析[D]. 南京: 南京农业大学, 2019.
GAO Y. Antimicrobial susceptibility and the epidemiological characteristics of amphenicols/oxazolidinones and fosfomycin resistance genes infrom swine in Jiangsu Province[D]. Nanjing: Nanjing Agricultural University, 2019. (in Chinese)
[26] 蒋逸凡, 李岱霞, 鲍翔宇, 黎满香. 湖南省部分地区猪、鸡源粪肠球菌耐药性及多位点序列分型分析. 中国动物传染病学报, 2020, 28(6): 102-107.
JIANG Y F, LI D X, BAO X Y, LI M X. Drug resistance and multi-locus sequence typing ofstrains isolated from pigs and chickens in Hunan Province. Chinese Journal of Veterinary Parasitology, 2020, 28(6): 102-107. (in Chinese)
[27] ZHENG B W, XU H, YU X, JIANG X W, ZHANG J, CHEN Y B, HUANG J W, HUANG C, XIAO Y H. Low prevalence of MCR-1-producingin bloodstream infections in China. Clinical Microbiology and Infection, 2018, 24(2): 205-206.
[28] BAI B, HU K T, LI H, YAO W M, LI D Y, CHEN Z, CHENG H, ZHENG J X, PAN W G, DENG M G, LIU X J, LIN Z W, DENG Q W, YU Z J. Effect of tedizolid on clinical:activity, distribution of virulence factor, resistance genes and multilocus sequence typing. FEMS Microbiology Letters, 2018, 365(3): fnx284.
[29] KUCH A, WILLEMS R J L, WERNER G, COQUE T M, HAMMERUM A M, SUNDSFJORD A, KLARE I, RUIZ- GARBAJOSA P, SIMONSEN G S, VAN LUIT-ASBROEK M, et al. Insight into antimicrobial susceptibility and population structure of contemporary humanisolates from Europe. Journal of Antimicrobial Chemotherapy, 2012, 67(3): 551-558.
[30] RUIZ-GARBAJOSA P, BONTEN M J M, ROBINSON D A, TOP J, NALLAPAREDDY S R, TORRES C, COQUE T M, CANTÓN R, BAQUERO F, MURRAY B E, et al. Multilocus sequence typing scheme forreveals hospital-adapted genetic complexes in a background of high rates of recombination. Journal of Clinical Microbiology, 2006, 44(6): 2220-2228.
[31] YAN X M, WANG J, TAO X X, JIA H B, MENG F L, YANG H, YOU Y H, ZHENG B, HU Y, BU X X, ZHANG J Z. A conjugative MDR pMG1-like plasmid carrying thegene ofwith potential transmission to. Frontiers in Microbiology, 2021, 12: 667415.
[32] HE T, SHEN Y B, SCHWARZ S, CAI J C, LV Y, LI J, FEßLER A T, ZHANG R, WU C M, SHEN J Z, WANG Y. Genetic environment of the transferable oxazolidinone/phenicol resistance geneinisolates of human and animal origin. Journal of Antimicrobial Chemotherapy, 2016, 71(6): 1466-1473.
Analysis of Drug Resistance and Epidemic Characteristics of/infrom Pig Farms in Aksu Area of Xinjiang
WANG Dong, CHEN WanZhao, LI HongBo, QIN Lei, XU QiQi, LIU ZePeng, XIA LiNing
College of Veterinary Medicine, Xinjiang Agricultural University/Xinjiang Key Laboratory of New Drug Study and Creation for Herbivorous Animal, Urumqi 830052
【Objective】 The purpose of this study was to investigate the prevalence ofandgenes inisolates from pig farms in Aksu region of Xinjiang and the resistance profiles of these/-carrying isolates, which would provide scientific data for evaluating the impact and hazard of these two important resistance genes. 【Method】PCR screening ofandgenes were conducted for the collected 322isolates in laboratory of veterinary pharmacology from Xinjiang Agricultural University. The minimum inhibitory concentrations (MICs) of doxycycline, linezolid, florfenicol, vancomycin, levofloxacin, enrofloxacin, gentamicin and valnemulin were determined by agar dilution method recommended by CLSI documents. Corresponding resistance genes, including,,,,,,,,, and, were detected by PCR method. 31 strains with different backgrounds were selected to determine the MLST types and subjected to conjugation transfer experiments. 【Result】A total of 193isolates were positive forand/or, of which 38 strains co-harboredand, 9 strains produced onlygene, and 146 strains contained onlygene. The 193strains showed 100% resistance to erythromycin, tylosin, tetracycline, doxycycline, gentamicin and valnemulin. Although the detection rate ofgene was much lower than that of, the bacterial resistance degree in-carrying isolates was significantly higher than that in strains carrying onlygene andand-negative strains. The detection rates of resistance genes also showed similar trend.strains carrying bothandand strains carrying onlyshowed multiresistance to 8 and 10 antibiotics, accounting for 84.6% and 100.0%, respectively.strains carrying onlyandand-negative strains were mainly resistant to 6-8 antibitoics, accounting for 84.6% and 100.0%, respectively. Further analysis showed that detection rates ofandgenes were higher in the pig farms with high resistance degree. Screening of resistance genes showed that,,,,t,(6')(2"), and(A) genes were presented in the 193strains. In general, the detection rates of resistance genes instrains carrying bothandand singlegenes were higher than that in strains carrying singleandand-negative strains. The results of MLST and conjugation transfer experiments indicated that/-producingstrains were genetically complex and clonal and horizontal transfer co-existed in these pig farms. 【Conclusion】The high carriage rate ofandgenes and the high level of drug resistance inin pig farms in Aksu region of Xinjiang indicated that antibiotic resistance was serious in this region, which could threaten not only pig industry, but also public health.Preventive and control actions should be taken immediately to prevent further deterioration of antibiotic resistance.
Aksu area; pig farms;; OptrA gene; Lsa(E) gene; drug resistance

10.3864/j.issn.0578-1752.2023.16.013
2022-05-18;
2023-02-14
国家自然科学基金-地区基金项目(31860714)
王东,E-mail:1005621397@qq.com。通信作者夏利宁,E-mail:xln750530@163.com
(责任编辑 林鉴非)

