基于非靶向代谢组学分析StLAC2和StLAC6差异影响玉米大斑病菌的机制
邹金鹏,岳浩峰,李海笑,刘峥,刘宁,曹志艳,董金皋
基于非靶向代谢组学分析StLAC2和StLAC6差异影响玉米大斑病菌的机制
邹金鹏1,2,岳浩峰2,李海笑1,2,刘峥3,刘宁1,2,曹志艳,董金皋1,2
1河北农业大学植物保护学院,河北保定 071001;2河北省植物生理与分子病理学重点实验室/华北作物改良与调控国家重点实验室,河北保定 071001;3保定市教育科学研究所,河北保定 071066
【背景】漆酶作为多酚氧化酶,在真菌生长发育及次级代谢等多方面发挥重要的作用。玉米大斑病菌()基因组中含有多个漆酶基因,其中和对玉米大斑病菌生长发育及致病性具有差异的影响。【目的】明确StLAC2和StLAC6对玉米大斑病菌的差异作用机制,挖掘差异代谢物,为开发新的杀菌剂及病害防控新策略提供靶点。【方法】利用无缝克隆的方法将和pHZ100-GFP质粒连接,构建的回补表达载体。利用PEG介导的原生质体转化法,将构建好的载体转入到基因缺失突变体的原生质体中,并利用PCR、RT-qPCR和GFP荧光验证,对所获得的阳性转化子进行鉴定,成功构建回补菌株,并分析敲除及回补和对玉米大斑病菌胞内外黑色素合成及抗氧化性的影响。以野生型、和基因敲除突变体为试验材料,利用非靶向代谢组学分析其差异代谢物,并利用KEGG分析StLAC2和StLAC6差异作用的机制。【结果】StLAC2和StLAC6对病菌菌丝内和分泌到培养基中的黑色素合成具有差异影响,且StLAC2影响病菌的抗氧化性。代谢组分析发现与玉米大斑病菌野生型菌株相比,敲除后无论菌丝中或分泌到培养基中的差异代谢物数量更多,KEGG分析发现差异代谢物主要为脂类尤其是磷脂,的缺失造成多种黄酮多酚类代谢物下调。而1,8-二羟基萘型黑色素合成途径的中间代谢物小柱孢酮和柱孢酮含量在Δ中显著增加,在Δ中显著降低。【结论】StLAC2参与黑色素的聚合,StLAC6负调控玉米大斑病菌黑色素合成,StLAC2和StLAC6差异影响玉米大斑病菌中脂类代谢物和黑色素合成途径的中间代谢物,缺失造成多种黄酮多酚类代谢物下调,导致抗氧化性降低。
玉米大斑病菌;漆酶;代谢组学;差异代谢物;黑色素
0 引言
【研究意义】漆酶(EC1.10.3.2)是一类在催化中心含有多个铜离子的多酚氧化酶,也被称为多铜氧化酶[1],在真菌中发挥重要作用。玉米()是我国重要的粮食及经济作物之一,玉米病害的暴发严重影响我国粮食安全和国民经济发展[2]。玉米大斑病(northern corn leaf blight,NCLB)是玉米的重要叶部病害之一,广泛存在于世界各玉米产区,在大发生的年份减产可达20%左右,严重时减产50%以上[3-6]。其病原菌玉米大斑病菌()主要侵染玉米叶片,造成的病斑沿叶脉扩展开,表现为棕褐色坏死条纹,周围有黄色或淡褐色褪绿圈,严重影响玉米光合作用导致产量下降[7]。研究玉米大斑病菌致病相关基因的功能及其调控病菌生长发育、侵染致病及次生代谢的机制可为科学有效防治玉米大斑病提供参考。【前人研究进展】玉米大斑病菌基因组中含有多个漆酶基因,研究显示漆酶参与了1, 8-二羟基萘(1, 8-DHN)黑色素和L-3, 4-二羟基苯丙氨酸(L-DOPA)黑色素的合成,催化其单体聚合形成无定形黑色素高聚物,影响病菌致病性等[8]。例如黄瓜炭疽病菌()中的漆酶基因缺失突变体的分生孢子颜色与野生型菌株相比明显较浅,同时突变体的附着胞在黑化方面存在缺陷[9]。同样桑椹菌核病菌()中漆酶基因是影响黑色素合成的重要酶,在致病性中起关键作用[10]。漆酶还影响菌体的形态建成[11],例如松杉灵芝()中的漆酶基因在菌丝发育和子实体成熟过程中的表达量最高,其促进松杉灵芝子实体成熟过程中色素的沉着和菌柄的伸长[12]。在灰葡萄孢()中,致病性相关的漆酶可以降解其侵染过程中葡萄产生的多种植物抗毒素,从而有利于灰葡萄孢的侵染定殖[13]。因此,对漆酶作用机制的深入研究有利于解析植物病原菌的致病机制。代谢组学根据研究目的的不同,可进一步分为非靶向和靶向代谢组学,非靶向代谢组学是指采用LC-MS、GC-MS、NMR等技术无偏向性地检测全部代谢物的动态变化,并通过生物信息学分析筛选差异代谢物,对差异代谢物进行通路分析,揭示其变化的生理机制[14]。【本研究切入点】本实验室前期研究发现玉米大斑病菌中存在9个漆酶同工酶,其中StLAC2和StLAC6对玉米大斑病菌生长发育及致病性等方面的影响存在差异,但具体机制尚不清楚,利用代谢组学检测生物体内代谢物的含量和种类变化,并推断基因的表达与相关代谢物和代谢通路的关系。【拟解决的关键问题】在继续构建回补菌株的基础上,验证和在玉米大斑病菌黑色素合成及抗氧化性等方面的差异作用,并进一步利用LC-MS分析野生型和2个基因敲除突变体的菌丝及分泌到培养基中的差异代谢物,以期明确漆酶同工酶差异作用方式,为解析玉米大斑病菌致病机制提供参考。
1 材料与方法
试验于2021—2022年在河北农业大学真菌毒素与植物分子病理学实验室完成。
1.1 供试菌株及培养基
玉米大斑病菌野生型菌株01-23(WT)、基因缺失突变体(Δ)基因回补菌株(Δ)和基因缺失突变体(Δ)均由河北农业大学真菌毒素实验室保存。接种于PDA(potato dextrose agar)培养基,于25 ℃黑暗培养,培养基组成:马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 L。液体培养使用改良的完全培养基[15](complete medium,CM)。
1.2 StLAC6回补菌株的构建
1.2.1回补载体的构建及转化子的获得 根据和pHZ100-GFP载体序列,设计带有I、R I酶切位点的特异性引物(表1),扩增全长,通过无缝克隆的方法与pHZ100-GFP载体连接,构建pHZ100-载体,并进行测序鉴定。利用PEG介导法,将构建好的pHZ100-载体转化到Δ的原生质体中。挑取再生培养基上获得的单菌落,接种于含有遗传霉素G418抗性的PDA培养基上,筛选3代以上,获得抗性稳定的转化子。
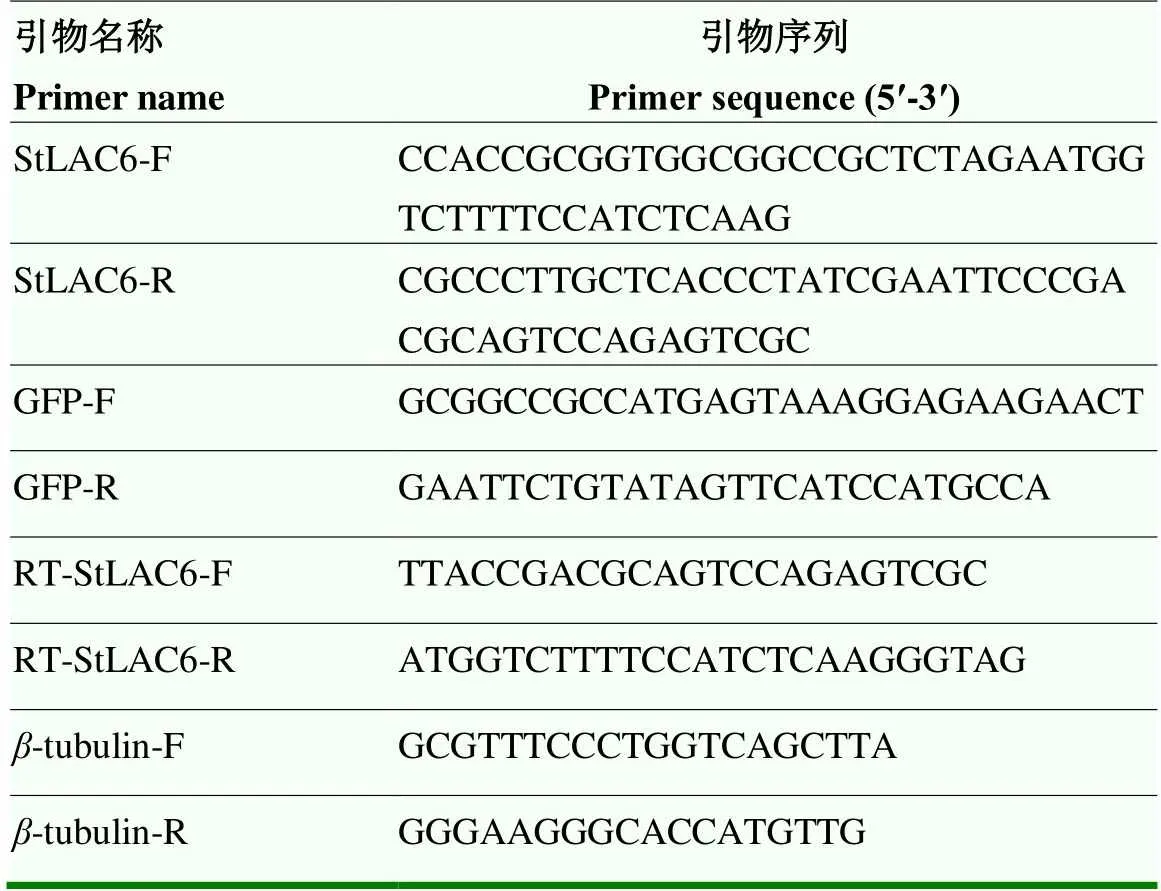
表1 试验中所用引物
1.2.2 转化子的验证 转化子的PCR鉴定:以转化子基因组DNA为模板,用特异引物StLAC6-R/F和GFP-R/F(表1)扩增目的片段及GFP,扩增程序:95 ℃ 30 s,94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,34个循环;72 ℃ 5 min,4 ℃∞,PCR产物通过1%琼脂糖凝胶电泳进行检测。
转化子的荧光定量RT-qPCR验证:按照真菌总RNA提取试剂盒的方法分别提取野生型、敲除突变体及转化子的总RNA并反转录cDNA,以为内参,野生型菌株01-23、突变体Δ和转化子的cDNA为模板,以RT-StLAC6-F/RT-StLAC6-R为特异引物(表1)分别检测各菌株中的表达量。
1.3 菌株黑色素含量测定
液体CM培养基25 ℃静置培养野生型菌株01-23、Δ和Δ,取培养8 d的菌丝及胞外培养基,根据黑色素在碱性环境下溶解,在酸性环境下沉淀且不溶于有机溶剂的特性,提取黑色素[16]并进行定量分析,确定和基因缺失后对病菌胞内外黑色素含量的影响。
1.4 菌株抗氧化性测定
选取同等生长状况的野生型菌株01-23、Δ、ΔΔ和Δ分别接种到含有30 mmol·L-1H2O2的普通PDA培养基平板上,黑暗培养7 d,观察菌落形态以明确和对病菌抗氧化性的影响。
1.5 代谢组学分析StLAC2和StLAC6的差异代谢产物
1.5.1 代谢组学分析样品的采集及提取 将野生型菌株01-23、Δ和Δ接种于CM液体培养中,25 ℃静置培养8 d。过滤收集菌丝,将带有样品的滤纸置于液氮中速冻5 min后利用冷冻干燥机(Labconco,美国)冻干24 h,-80 ℃保存;将胞外培养液利用冷冻干燥机冻干至恒重,-80 ℃保存,用于后续质谱数据的采集。将野生型菌株01-23、Δ、Δ的菌丝样品分别命名为WT_IN、LAC2_IN和LAC6_IN,将野生型菌株01-23、Δ、Δ分泌到培养基的样品分别命名为WT_OUT、LAC2_OUT和LAC6_OUT。
吸取适量液体样本于1.5 mL离心管中,加入400 μL乙腈﹕甲醇=1﹕1的提取液,涡旋混匀30 s后,低温超声提取30 min,将样品静置于-20 ℃,30 min,4 ℃,13 000×离心15 min,移取上清液,氮气吹干,加入100 μL乙腈﹕水=1﹕1复溶,低温超声萃取5 min,4 ℃,13 000×离心5 min,移取上清液用于LC-MS分析。取等体积的所有样本代谢物混合制备成质控样本(quality control,QC),以考察整个分析过程的重复性,非靶向代谢组学检测在上海美吉生物医药科技有限公司开展。
1.5.2 LC-MS检测条件 LC-MS分析的仪器平台为赛默飞公司的超高效液相色谱串联傅里叶变换质谱UHPLC-Q Exactive系统。色谱条件和质谱条件见XIE等[17]。
1.5.3 差异代谢物分析 对预处理后的矩阵文件进行差异分析。R软件包ropls(version 1.6.2)进行主成分分析(PCA),并使用7次循环交互验证来评估模型的稳定性。此外,进行student’s检验和差异倍数分析。基于VIP>1,<0.05得到的变量权重值VIP和student’s检验值来确定代谢物为差异代谢物。差异代谢物通过KEGG数据库(https: //www.keggjp/ kegg/pathway.htm1)进行代谢通路注释,获得差异代谢物参与的通路。Python软件包scipy.stats进行通路富集分析,并通过Fisher精确检验获得与试验处理最相关的生物学途径。
2 结果
2.1 StLAC6回补菌株的构建及亚细胞定位
将构建好的pHZ100质粒通过原生质体转化法转入野生型和Δ菌株原生质体中,G418抗性筛选并进行PCR验证,的片段大小为1 803 bp,筛选回补菌株Δ(图1-A)。利用RT-qPCR验证转化子中的表达水平,结果显示,与野生型菌株相比,的表达量在Δ中显著降低,Δ中表达量恢复,与野生型差异不显著(图1-B)。利用荧光显微镜观察GFP标签的绿色荧光发现转化子相较于野生型有明显的绿色荧光,并且定位于细胞壁上(图1-C)。
2.2 StLAC2和StLAC6差异影响病菌黑色素的合成及抗氧化性
在PDA培养基上接种野生型菌株、ΔΔΔ和Δ,7 d后观察发现菌落形态基本一致,菌落近圆形,边缘整齐。野生型菌株菌落颜色呈现灰黑色,气生菌丝较多,菌落较为茂密、蓬松;Δ菌落颜色呈现灰白色,气生菌丝减少,菌丝致密平伏;Δ菌落颜色呈现黑褐色,气生菌丝较多;Δ菌落气生菌丝比较稀疏平坦,菌落颜色为灰色;Δ菌落边缘比较整齐有规则,气生菌丝比较茂盛菌落颜色为灰褐色,基本恢复到野生型菌株的形态(图2)。
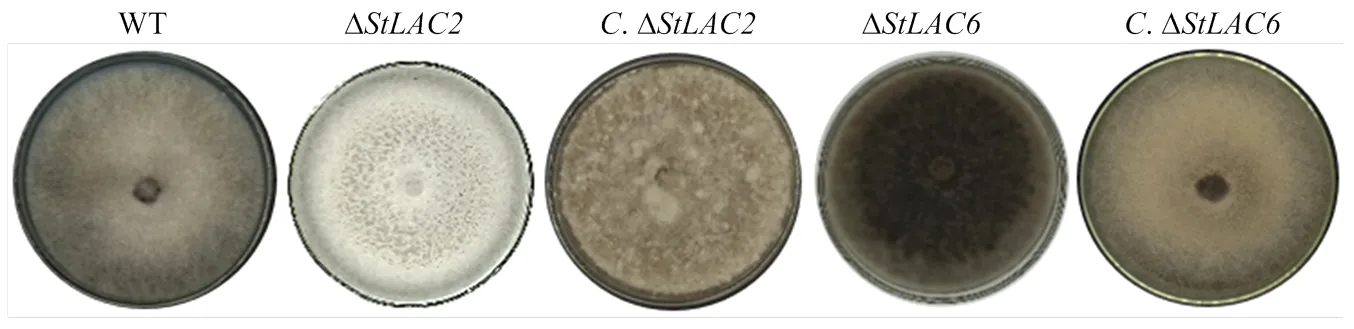
图2 不同菌株菌落形态
对培养8 d的野生型菌株、Δ和Δ的胞内外黑色素进行提取及含量测定,结果显示Δ胞内外黑色素含量显著下降,Δ胞内外黑色素含量显著增加(图3)。漆酶差异影响黑色素合成及菌丝形态的机制需要进一步通过比较差异代谢物进行分析。
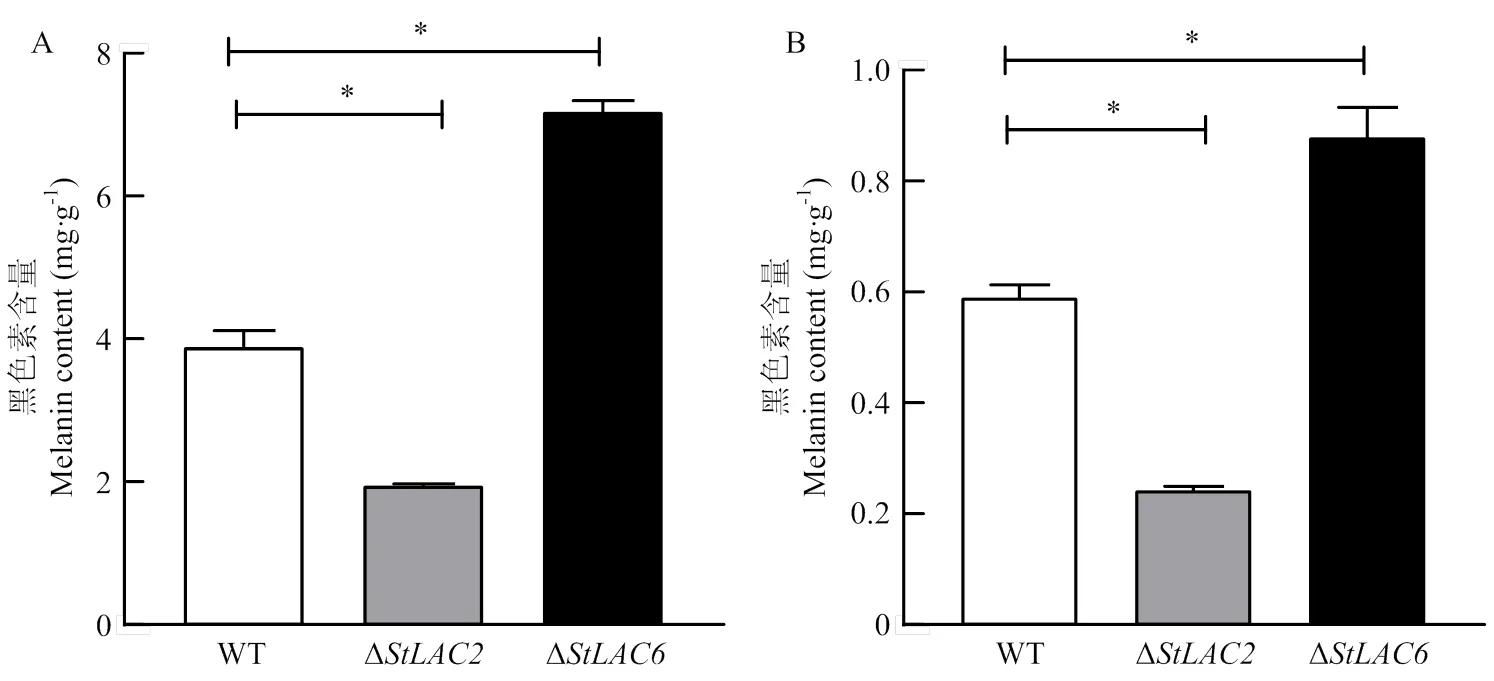
A:菌丝黑色素的含量the melanin content in the mycelium;B:细胞外培养液黑色素的含量the melanin content in the extracellular culture medium
在培养基中添加30 mmol·L-1H2O2培养野生型菌株和各突变菌株,分析StLAC2和StLAC6对抗氧化性的影响。结果显示缺失后对H2O2更加敏感,缺失后对H2O2不敏感,可以正常生长,和回补后对H2O2的敏感程度与野生型相似(图4),表明StLAC2影响了玉米大斑病菌的抗氧化性。
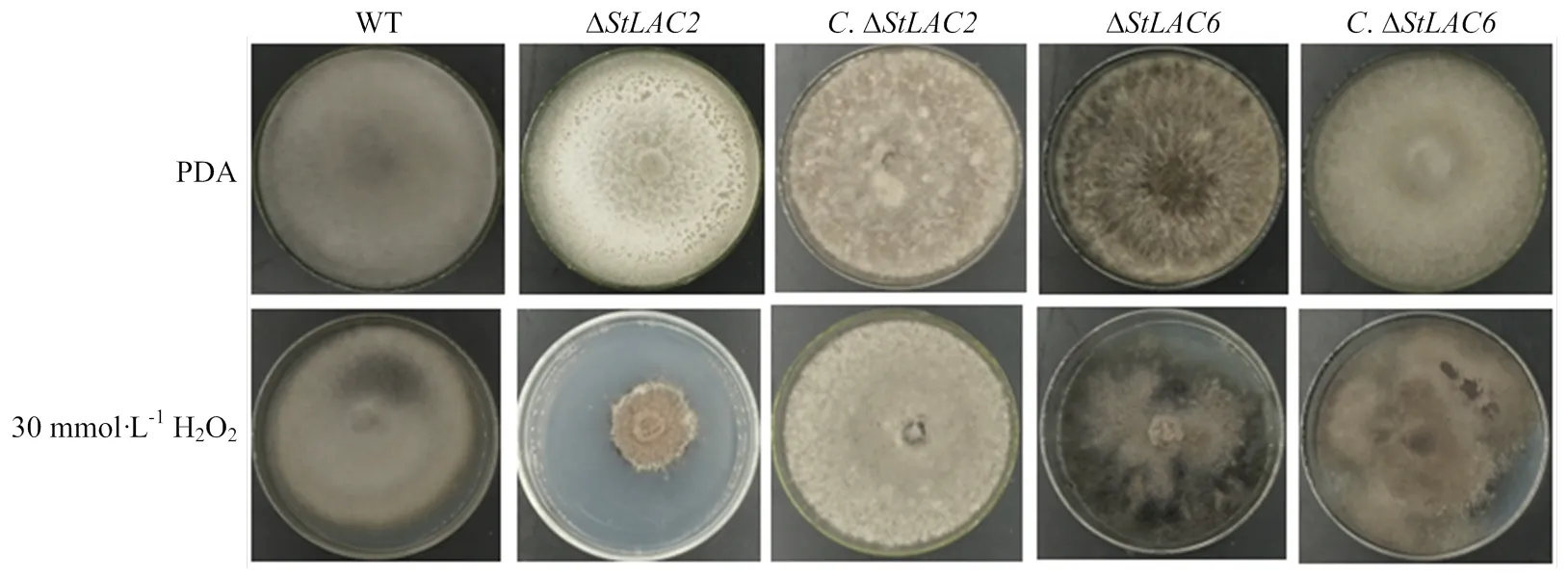
图4 野生型和各突变菌株的抗氧化性测定
2.3 代谢组样品质控分析
利用代谢组学分析培养8 d的野生型菌株、Δ和Δ菌丝内代谢物和分泌的代谢物,在各样品鉴定出的2 779种代谢物中,正离子模式下有1 519种,负离子模式下有1 260种。对各菌株菌丝内和分泌到培养基的两组样品进行PCA分析,结果显示QC聚合度高,说明QC重复性良好,检测结果可靠,各组内样本间聚合度高,组内重复性好;组间样本代谢物呈现分离趋势,说明各菌株菌丝内和分泌到培养基的代谢物具有明显差异(图5)。
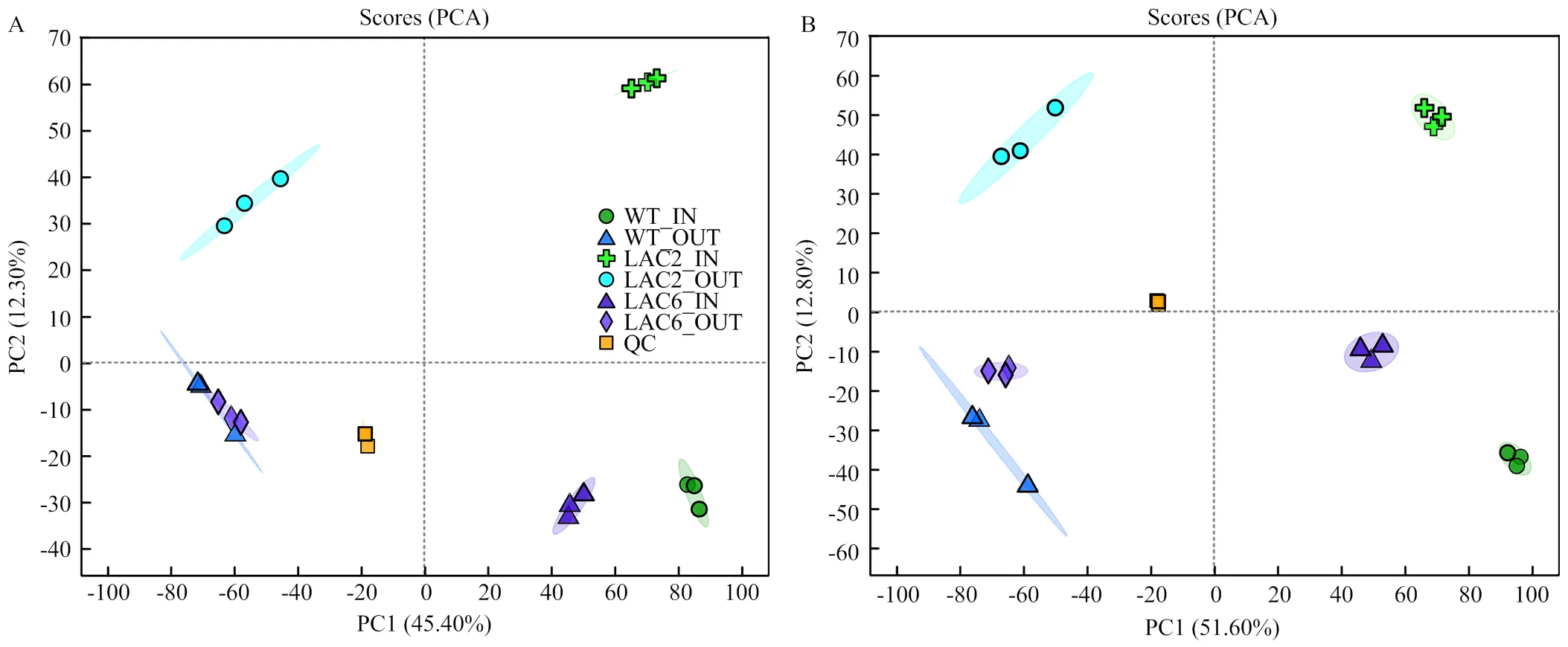
A:阳离子模式Cationic mode;B:阴离子模式Anion mode
2.4 差异代谢物分析
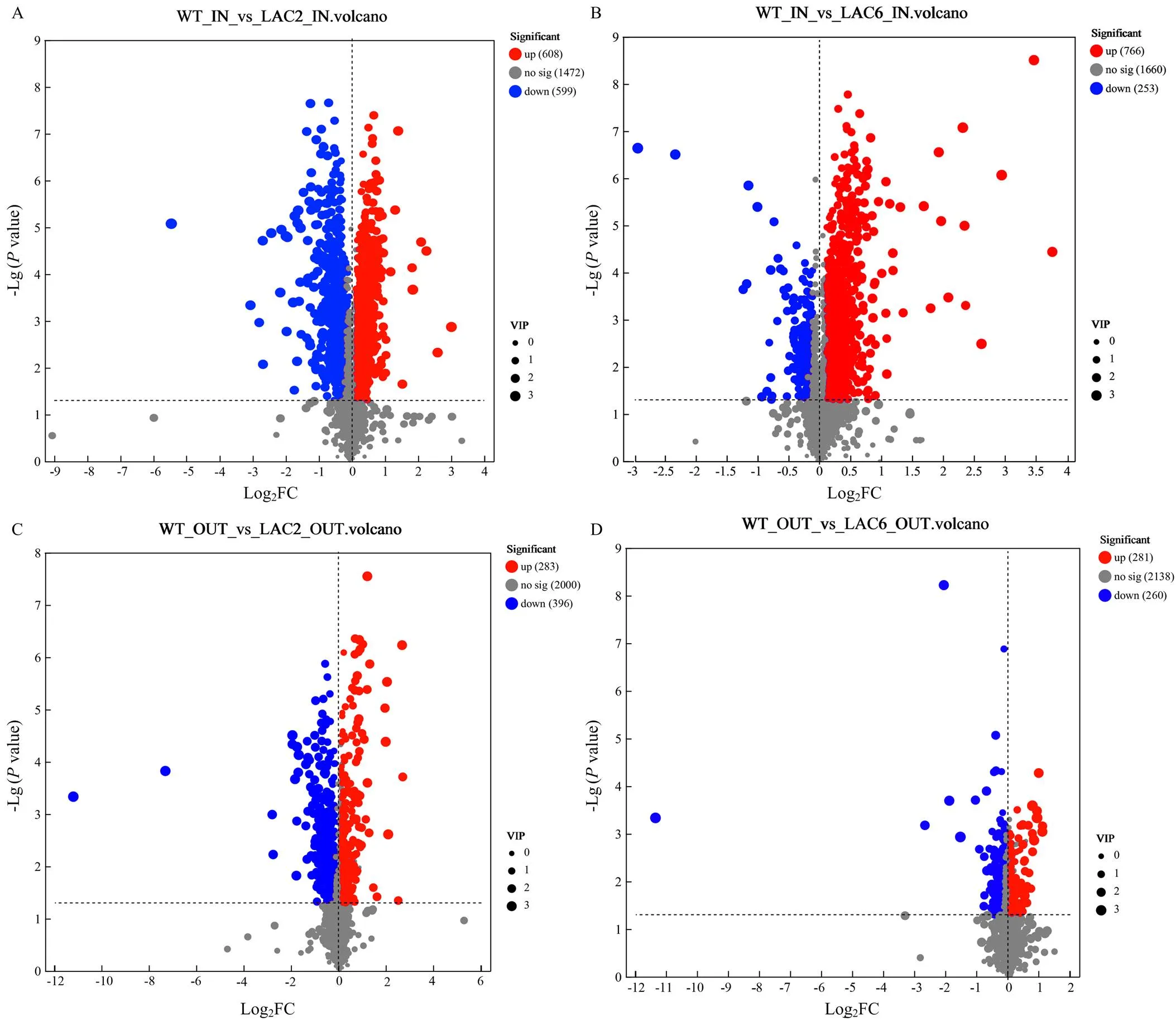
2.4.1 整体分析 对野生型菌株、Δ和Δ菌丝内和分泌到培养基的差异代谢物进行统计分析,结果显示与野生型菌株相比,Δ菌丝内的差异代谢物有608个显著上调,有599个显著下调;Δ分泌到培养基的差异代谢物有283个显著上调,有396个显著下调;Δ菌丝内的差异代谢物有766个显著上调,有253个显著下调;Δ6分泌到培养基的差异代谢物有281个显著上调,有260个显著下调(图6)。
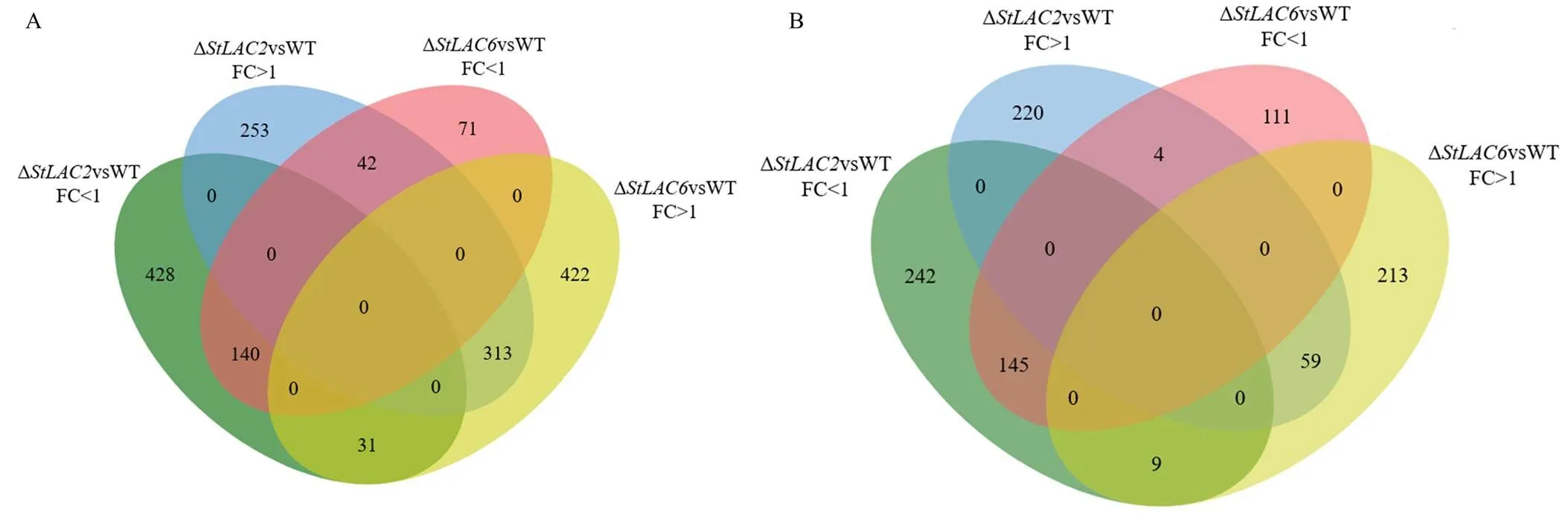
进一步对已知结构的化合物进行Venn分析,以明确同工酶影响代谢物的重叠关系,鉴别和缺失导致的共有和特有的差异代谢物,在菌丝内所有上调代谢物中,其中两个基因共同影响的代谢物313个,253个为Δ所特有,422个为Δ所特有;在菌丝内所有下调代谢物中,其中共同下调的有140个代谢物,428个为Δ所特有,71个为Δ所特有。在分泌到培养基中的所有差异代谢物中,其中共同上调的有59个代谢物,220个为Δ所特有,213个为Δ所特有;其中共同下调的有145个代谢物,242个为Δ所特有,111个为Δ所特有(图7)。以上结果表明敲除主要导致病菌代谢物合成受阻,而敲除更多的导致了菌丝内代谢物含量增加,且两个基因影响的代谢物具有明显的区别。
2.4.2 KEGG功能通路富集和分类分析 利用KEGG数据库对敲除和敲除引起的差异代谢物进行代谢通路富集分析,结果显示,敲除后菌丝内差异代谢物主要富集在ABC转运蛋白、嘌呤代谢、嘧啶代谢、花生四烯酸代谢等通路,分泌到培养基的差异代谢物主要富集在甘油磷脂代谢、苯丙氨酸代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、酪氨酸代谢等通路;敲除后菌丝内差异代谢物主要富集在ABC转运蛋白、半胱氨酸和甲硫氨酸代谢、花生四烯酸代谢、甘油磷脂代谢、谷胱甘肽代谢等通路,分泌到培养基的差异代谢物主要富集在酪氨酸代谢、亚油酸代谢、甘油磷脂代谢、半胱氨酸和甲硫氨酸代谢等(图8)。
A:ΔStLAC2菌丝内差异代谢物ΔStLAC2 differential metabolites in mycelium;B:ΔStLAC6菌丝内差异代谢物ΔStLAC6 differential metabolites in mycelium;C:ΔStLAC2分泌到培养基差异代谢物ΔStLAC2 differential metabolites secreted into the culture medium;D:ΔStLAC6分泌到培养基差异代谢物ΔStLAC6 differential metabolites secreted into the culture medium。图8同The same as Fig. 8
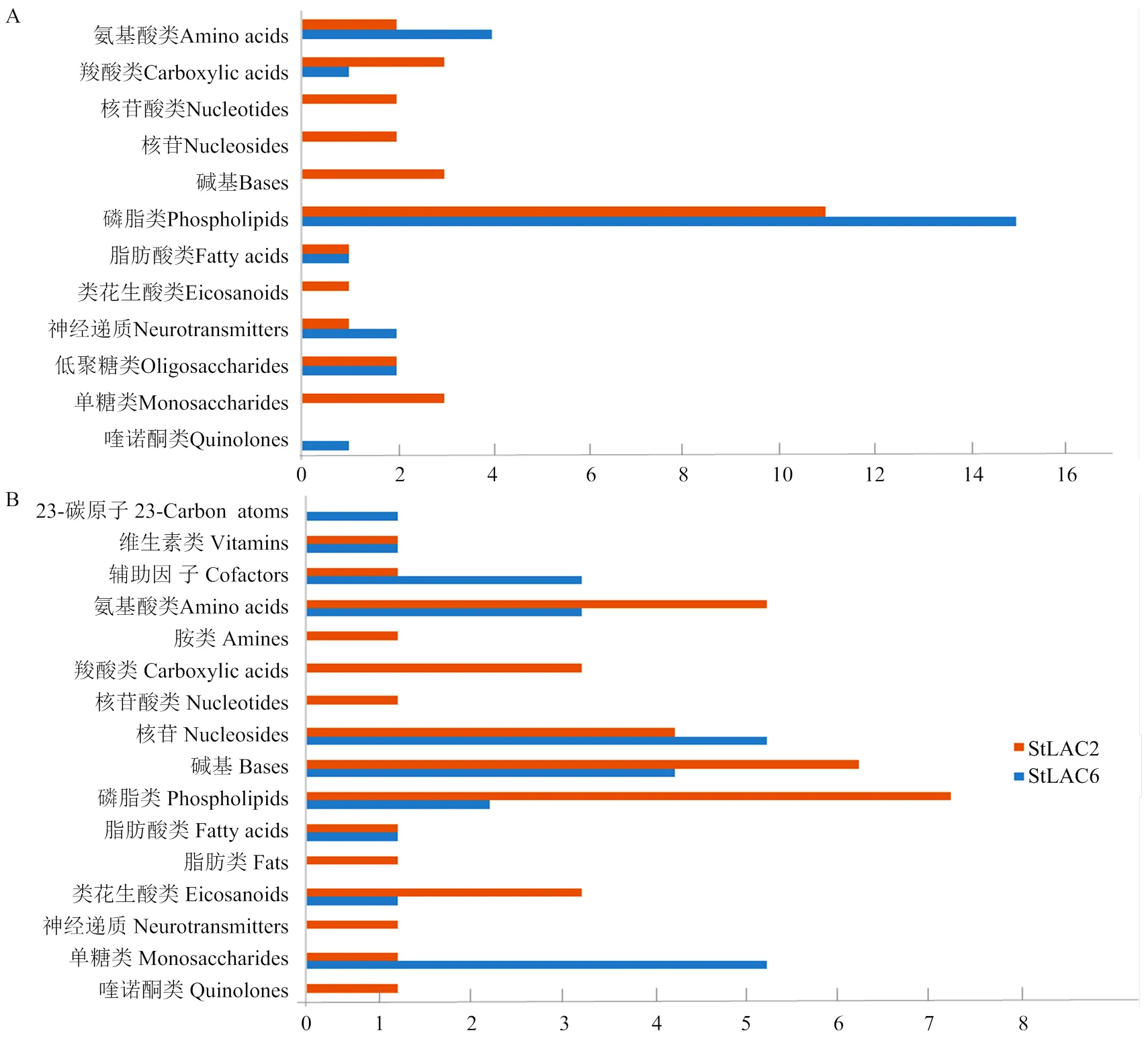
将差异代谢物进行KEGG化合物分类,结果显示在上调的差异代谢物中磷脂类代谢物数量最多(图9-A),而下调的代谢物包括磷脂、氨基酸、核苷类和单糖类化合物富集较多(图9-B)。同时发现敲除导致多种核酸类化合物上调,敲除还导致多种单糖类化合物下调。
由于发现差异代谢物中含有磷脂、脂肪酸、类二十烷酸等多种脂类物质发生变化,进一步对代谢组结果中的脂类差异代谢物进行分析,发现二酰甘油、磷脂等多种代谢物在两种突变体中的差异有明显区别,包括鞘磷脂类、磷脂酰胆碱、磷脂酰甘油等。在Δ中二酰甘油类代谢物含量增加,在Δ中磷脂酰甘油和鞘磷脂类代谢物含量明显增加而Δ中变化较小或差异不显著(表2)。
2.5 StLAC2影响黄酮皂苷类代谢物的生物合成
由于Δ的抗氧化性降低,因此分析了代谢组结果中抗氧化活性物质含量的变化,结果显示缺失导致3, 7-二羟基黄酮、甘草黄酮A、5-羟基-4’, 7, 8-三甲氧基黄酮和6-羟基-4’-甲氧基黄酮等多种黄酮皂苷类代谢物下调(图10)。黄酮类代谢物主要影响生物的抗氧化性,其含量在Δ中含量降低,推测StLAC2参与了黄酮类物质的合成。
A:菌丝内差异代谢物Differential metabolites in mycelium;B:分泌到培养基的差异代谢物Differential metabolites secreted into the culture medium

2.6 StLAC2和StLAC6差异影响DHN黑色素中间代谢产物
由于StLAC2和StLAC6差异影响了玉米大斑病菌黑色素的合成,进一步检测代谢组结果中DHN黑色素途径中间代谢物小柱孢酮和柱孢酮的含量,发现小柱孢酮和柱孢酮在中含量增加,在中含量降低(图11)。由此可以推测漆酶基因参与了黑色素的聚合,但敲除导致DHN黑色素合成中间代谢产物减少并促进了其聚合物黑色素的合成。
3 讨论
3.1 玉米大斑病菌漆酶同工酶StLAC2和StLAC6具有明显的功能差异
漆酶属于多铜氧化酶,作用底物广泛可以催化多种多酚类物质,在真菌中漆酶的主要功能涉及色素合成、生长发育、致病性以及防御作用。研究发现许多生物编码多个漆酶同工酶基因且不同漆酶同工酶氨基酸序列存在较大差异,其基因功能也存在差异。例如对拟南芥漆酶基因家族功能的研究发现,漆酶可以抑制根的伸长,可以使其更早开花,使其种子颜色变成淡黄色,说明漆酶基因在不同植物器官的发育方面具有不同作用[18]。番茄枯萎病菌()的3个漆酶基因、和被敲除后不影响其致病性,其中调控菌丝的生长、氧化胁迫和碳源代谢等[19]。本实验室前期发现在玉米大斑病菌基因组中存在9个漆酶样多铜氧化酶基因,其同源性介于19.79%—48.70%,其中和聚类在一起,且为主要表达的漆酶[20],本研究发现敲除后黑色素含量降低,相反敲除后黑色素含量增加;而且敲除后对H2O2更加敏感,而不影响病菌抗氧化性,表明两个漆酶同工酶行使不同功能。前期研究表明StLAC2和StLAC6氨基酸序列的同源性仅为36.99%[20],因此笔者推测可能是由于蛋白同源性较低,在蛋白结构上存在较大差异,导致StLAC2和StLAC6在功能上有明显差异,有必要对其进行深入研究以明确同工酶功能差异的原因。本研究中和基因回补后并没有完全恢复到野生型的表型,在菌落形态上有一定的差异,推测其回补时使用带有强启动子的质粒,导致其表达与野生型菌株存在区别。
A:上调差异代谢物Up-regulated differential metabolites;B:下调差异代谢物Down-regulated differential metabolites
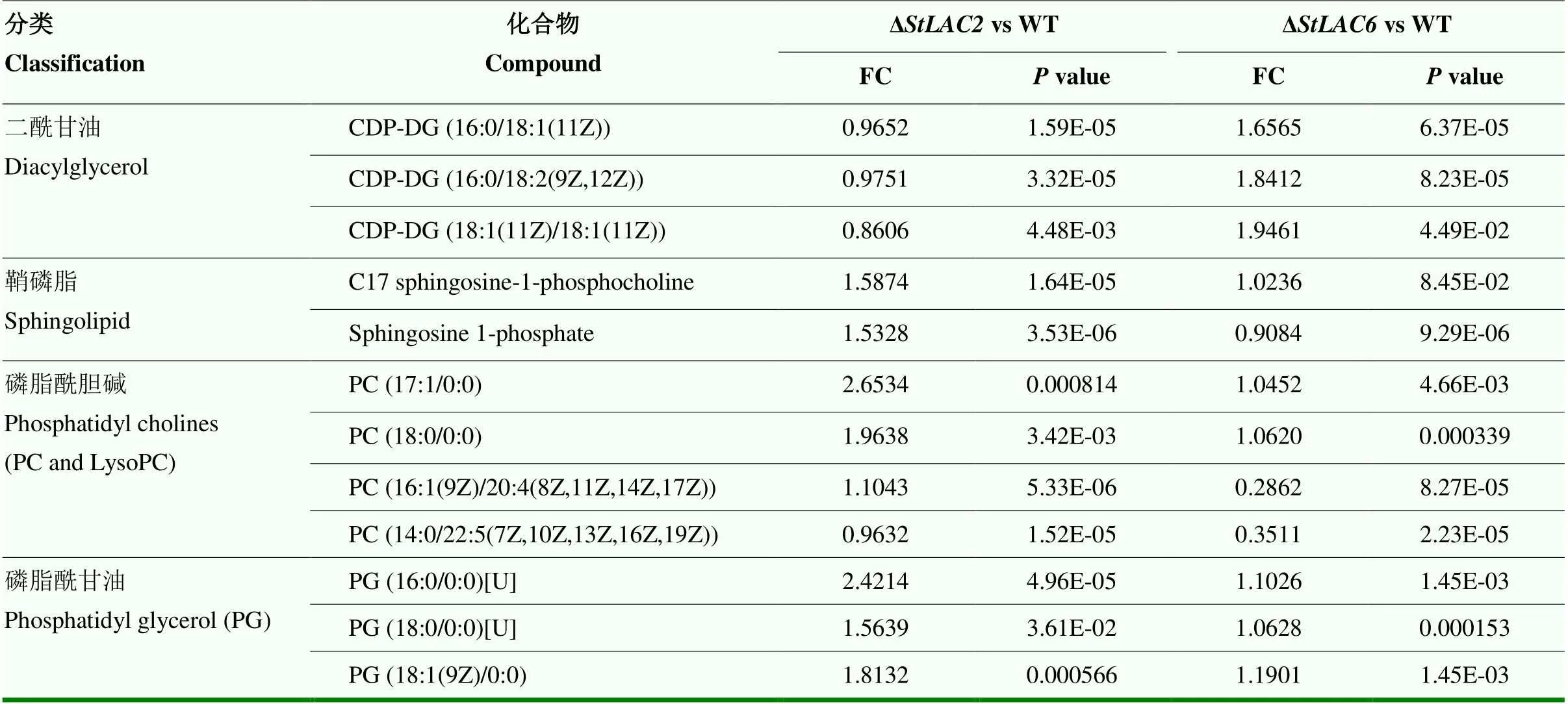
表2 主要影响的脂类差异代谢物
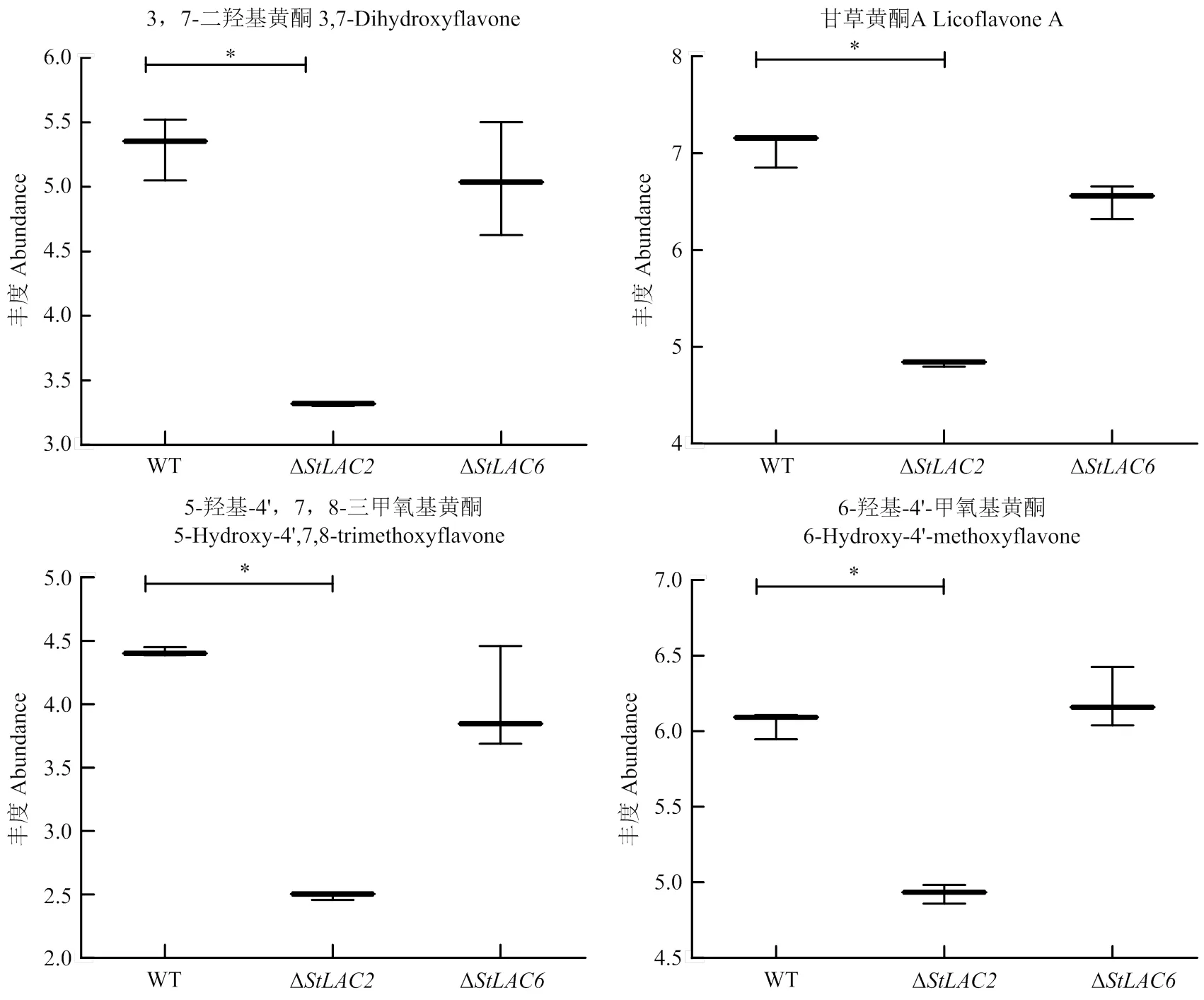
图10 注释为黄酮类代谢物的箱式图
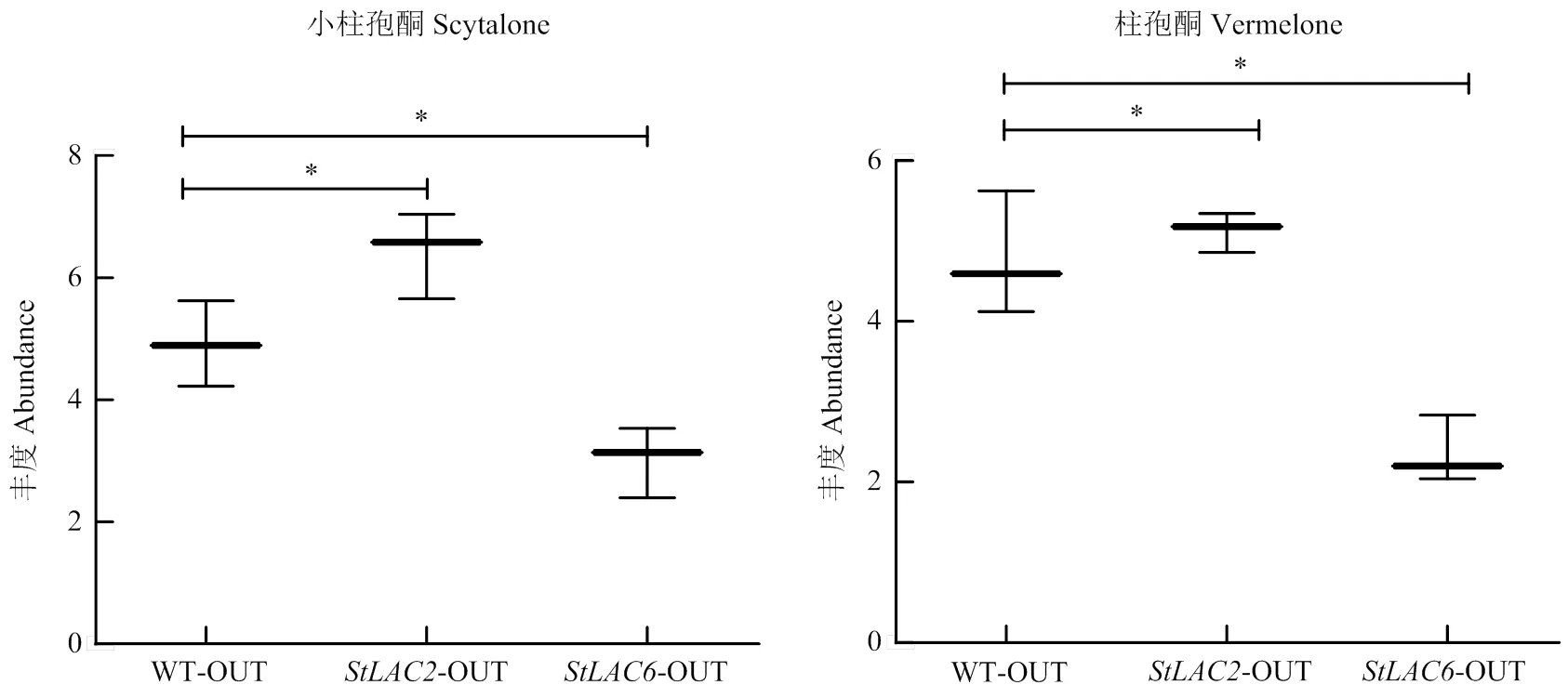
图11 黑色素合成中间代谢产物的箱式图
3.2 StLAC2和StLAC6通过不同的机制对黑色素合成产生相反的影响
玉米大斑病菌能够产生黑色素,黑色素在附着胞侵入寄主表皮细胞的过程中起关键作用[21]。DHN黑色素被认为是重要的毒力因子,通过让附着胞积累足够的膨压从而机械穿透寄主细胞,黑色素缺乏的突变菌株不能形成具有正常侵染能力的附着胞,丧失了侵染能力,最终导致致病性丧失[22-23]。在稻瘟病菌()、灰葡萄孢中DHN黑色素合成以丙二酰辅酶A或乙酰辅酶A为前体物质[24],通过聚酮合酶催化醋酸盐合成1, 3, 6, 8-4THN,然后经还原酶(1, 3, 6, 8-tetra-HN reductase)催化生成小柱孢酮,在小柱孢酮脱水酶催化的下合成1, 3, 8 THN,经还原酶(1, 3, 8-tetra-HN reductase)催化合成柱孢酮,在脱水酶的催化下合成1, 8-DHN,最后经漆酶氧化聚合形成1, 8-DHN黑色素[25],本文通过代谢组分析发现上述中间代谢物中的小柱孢酮和柱孢酮含量在中增加,表明敲除导致DHN合成中间代谢产物的积累,StLAC2直接参与了玉米大斑病菌黑色素的聚合。
磷脂类代谢物中鞘磷脂是重要的信号物质,介导了肌醇磷酰神经酰胺生成二酰甘油。有报道显示在新生隐球菌中二酰甘油通过激活蛋白激酶C调控漆酶的表达,并且激活黑色素合成,参与致病[26]。本研究发现在玉米大斑病菌敲除导致了黑色素合成增加,通过代谢组分析发现缺失突变体中二酰甘油类化合物含量增加,推测其通过激活蛋白激酶C,促进了黑色素的合成,但具体作用机制尚需进一步验证。
3.3 StLAC2影响玉米大斑病菌抗氧化性及脂类代谢
的缺失主要影响黄酮皂苷类等多酚化合物。赵珊等[27]测定了多酚、黄酮、抗坏血酸等功能成分的含量及对应较高的抗氧化活性,证明黄酮类多酚物质影响甘薯叶的抗氧化能力。黄酮类差异代谢物主要在Δ中降低,如3, 7-二羟基黄酮、甘草黄酮A等,黄酮类代谢物属于多酚类,漆酶可以催化黄酮类多酚物质,因此推测StLAC2通过影响黄酮类物质的合成导致Δ抗氧化能力下降。
前期研究表明,基因缺失突变体中线粒体数量更多,且不产生分生孢子[28]。线粒体的完整性依赖于内质网对脂质的摄取,线粒体在脂质代谢中起着核心作用,并与其他细胞器如脂滴或过氧化物酶体连接[29],线粒体是磷脂和磷脂酰甘油合成所必需的[30],而Δ中代谢物磷脂酰甘油含量明显增加。磷脂酰甘油类化合物是细胞膜的主要成分,而且在信号转导等生理过程中发挥重要作用,与病菌菌丝形态直接相关,同时对于分生孢子的形成具有重要作用[31-32]。本文通过代谢组分析发现敲除导致磷脂酰胆碱及其水解产物LysoPC含量发生不同程度的变化,表明的缺失可能通过影响磷脂信号转导造成分生孢子的合成受到抑制。
4 结论
1, 8-二羟基萘型黑色素合成途径的中间代谢物小柱孢酮和柱孢酮含量在∆中增加,在中降低,StLAC2和StLAC6对玉米大斑病菌黑色素合成具有相反的影响;StLAC2和StLAC6差异影响玉米大斑病菌中脂类代谢物,同时的缺失造成多种黄酮多酚类代谢物下调,导致抗氧化性降低。
[1] WILLIAMSON P R. Biochemical and molecular characterization of the diphenol oxidase of: identification as a laccase. Journal of Bacteriology, 1994, 176(3): 656-664.
[2] ABERA W, SHIMELIS H, DERERA J, WORKU M, LAING M. Northern leaf blight response of elite maize inbred lines adapted to the mid-altitude sub-humid tropics. Cereal Research Communications, 2016, 44(1): 141-152.
[3] DONG J G, FAN Y S, GUI X M, AN X L, MA J F, DONG Z P. Geographic distribution and genetic analysis of physiological races ofin northern China. American Journal of Agricultural and Biological Sciences, 2008, 3(1): 389-398.
[4] TANG L, GAO Z G, YAO Y, LIU X. Identification and genetic diversity of formae speciales ofin China.Plant Disease, 2015, 99(4): 482-487.
[5] NAVARRO B L, HANEKAMP H, KOOPMANN B, VON TIEDEMANN A. Diversity of expression types ofgenes conferring resistance in maize to. Frontiers in Plant Science, 2020, 11: 607850.
[6] NIEUWOUDT A, HUMAN M P, CRAVEN M, CRAMPTON B G. Genetic differentiation in populations offrom maize and sorghum in South Africa. Plant Pathology, 2018, 67(7): 1483-1491.
[7] 杨耿斌. 黑龙江省北部玉米大斑病菌小种鉴定与育种材料抗大斑病特性分析[D]. 北京: 中国农业科学院, 2014.
YANG G B. Resistance analysis of breeding lines to northern corn leaf blight and identification ofraces in northern of Heilongjiang Province[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. (in Chinese)
[8] PEREZ-CUESTA U, APARICIO-FERNANDEZ L, GURUCEAGA X, MARTIN-SOUTO L, ABAD-DIAZ-DE-CERIO A, ANTORAN A, BULDAIN I, HERNANDO F L, RAMIREZ-GARCIA A, REMENTERIA A. Melanin and pyomelanin in: from its genetics to host interaction. International Microbiology, 2020, 23(1): 55-63.
[9] LIN S Y, OKUDA S, IKEDA K, OKUNO T, TAKANO Y.encoding a secreted laccase is involved in appressorial melanization and conidial pigmentation in. Molecular Plant-Microbe Interactions, 2012, 25(12): 1552-1561.
[10] LÜ Z Y, KANG X, XIANG Z H, HE N J. Laccase geneis involved in the growth and melanin biosynthesis of. Phytopathology, 2017, 107(3): 353-361.
[11] EISENMAN H C, CASADEVALL A. Synthesis and assembly of fungal melanin. Applied Microbiology and Biotechnology, 2012, 93(3): 931-940.
[12] JIN W S, LI J H, FENG H C, YOU S, ZHANG L Y, NORVIENYEKU J, HU K H, SUN S J, WANG Z H. Importance of a laccase gene () in the development of. International Journal of Molecular Sciences, 2018, 19(2): 471.
[13] SBAGHI M, JEANDET P, BESSIS R, LEROUX P. Degradation of stilbene-type phytoalexins in relation to the pathogenicity ofto grapevines. Plant Pathology, 1996, 45(1): 139-144.
[14] RUBERT J, RIGHETTI L, STRANSKA-ZACHARIASOVA M, DZUMAN Z, CHRPOVA J, DALL’ASTA C, HAJSLOVA J. Untargeted metabolomics based on ultra-high-performance liquid chromatography-high-resolution mass spectrometry merged with chemometrics: A new predictable tool for an early detection of mycotoxins. Food Chemistry, 2017, 224(1): 423-431.
[15] TALBOT N J, EBBOLE D J, HAMER J E. Identification and characterization of, a gene involved in pathogenicity from the rice blast fungus. The Plant Cell, 1993, 5(11): 1575-1590.
[16] 刘宁. 玉米大斑病菌漆酶基因家族鉴定及关键基因的功能解析[D]. 保定: 河北农业大学, 2019.
LIU N. Identification and functional analysis of laccase genes family in[D]. Baoding: Hebei Agricultural University, 2019. (in Chinese)
[17] XIE M D, CHEN W Q, LAI X C, DAI H B, SUN H, ZHOU X Y, CHEN T B. Metabolic responses and their correlations with phytochelatins inunder cadmium stress. Environmental Pollution, 2019, 252: 1791-1800.
[18] CAI X N, DAVIS E J, BALLIF J, LIANG M X, BUSHMAN E, HAROLDSEN V, TORABINEJAD J, WU Y J. Mutant identification and characterization of the laccase gene family in. Journal of Experimental Botany, 2006, 57(11): 2563-2569.
[19] CANERO D C, RONCERO M I. Functional analyses of laccase genes from. Phytopathology, 2008, 98(5): 509-518.
[20] LIU N, CAO Z Y, CAO K K, MA S X, GONG X D, JIA H, DAI D Q, DONG J G. Identification of laccase-like multicopper oxidases from the pathogenic fungusand their expression pattern during growth and infection. European Journal of Plant Pathology, 2019, 153(4): 1149-1163.
[21] 吴楠, 李青为, 曹志艳, 张娇, 郝志敏, 董金皋. 玉米大斑病菌的胞外黑色素种类及影响其产量的因素. 中国农业科学, 2013, 46(5): 927-933. doi: 10.3864/j.issn.0578-1752.2013.05.007.
WU N, LI Q W, CAO Z Y, ZHANG J, HAO Z M, DONG J G. Determination and characterization of extracellular melanin fromand influencing factors of its production. Scientia Agricultura Sinica, 2013, 46(5): 927-933. doi: 10.3864/j.issn.0578- 1752.2013.05.007. (in Chinese)
[22] 曹志艳, 贾慧, 朱显明, 董金皋. DHN黑色素与玉米大斑病菌附着胞膨压形成的关系. 中国农业科学, 2011, 44(5): 925-932. doi: 10.3864/j.issn.0578-1752.2011.05.008.
CAO Z Y, JIA H, ZHU X M, DONG J G. Relationship between DHN melanin and formation of appressorium turgor pressure of. Scientia Agricultura Sinica, 2011, 44(5): 925-932. doi: 10.3864/j.issn.0578-1752.2011.05.008. (in Chinese)
[23] THOMPSON J E, FAHNESTOCK S, FARRALL L, LIAO D I, VALENT B, JORDAN D B. The second naphthol reductase of fungal melanin biosynthesis in. The Journal of Biological Chemistry, 2000, 275(45): 34867-34872.
[24] DULAL N, ROGERS A M, PROKO R, BIEGER B D, LIYANAGE R, KRISHNAMURTHI V R, WANG Y, EGAN M J. Turgor-dependent and coronin-mediated F-actin dynamics drive septin disc-to-ring remodeling in the blast fungus. Journal of Cell Science, 2021, 134(5): jcs251298.
[25] 贾慧, 郭丽婕, 曹志艳, 郑云梅. 玉米大斑病菌黑色素合成调控基因回复载体的构建. 江苏农业科学, 2015, 43(8): 24-27.
JIA H, GUO L J, CAO Z Y, ZHENG Y M. Construction ofrestorer vector of melanin synthesis regulatory gene of. Jiangsu Agricultural Sciences, 2015, 43(8): 24-27. (in Chinese)
[26] SHEA J M, DEL POETA M. Lipid signaling in pathogenic fungi. Current Opinion in Microbiology, 2006, 9(4): 352-358.
[27] 赵珊, 仲伶俐, 秦琳, 黄世群, 李曦, 郑幸果, 雷欣宇, 雷绍荣, 郭灵安, 冯俊彦. 不同干燥方式对甘薯叶功能成分及抗氧化活性的影响. 中国农业科学, 2021, 54(21): 4650-4663. doi: 10.3864/j.issn. 0578-1752.2021.21.014.
ZHAO S, ZHONG L L, QIN L, HUANG S Q, LI X, ZHENG X G, LEI X Y, LEI S R, GUO L A, FENG J Y. Effects of different drying methods on functional components and antioxidant activity in sweet potato leaves. Scientia Agricultura Sinica, 2021, 54(21): 4650-4663. doi: 10.3864/j.issn.0578-1752.2021.21.014. (in Chinese)
[28] MA S X, CAO K K, LIU N, MENG C, CAO Z Y, DAI D Q, JIA H, ZANG J P, LI Z Y, HAO Z M, GU S Q, DONG J G. Thegene is required for cell wall integrity, DHN-melanin synthesis and the pathogenicity of. Fungal Biology, 2017, 121(6/7): 589-601.
[29] SCHARWEY M, TATSUTA T, LANGER T. Mitochondrial lipid transport at a glance. Journal of Cell Science, 2013, 126(23): 5317-5323.
[30] HIDALGO-VICO S, CASAS J, GARCÍA C, LILLO M P, ALONSO-MONGE R, ROMÁN E, PLA J. Overexpression of the white opaque switching master regulator wor1 alters lipid metabolism and mitochondrial function in. Journal of Fungi, 2022, 8(10): 1028.
[31] 高欣. 磷脂类系列化合物对UGT酶抑制及其机制的研究[D]. 北京: 中国人民解放军军事医学科学院, 2015.
GAO X. The study of phosphatidylcholines (PCs) and lysophosphatidylcholines (LPCs) components inhibition to UDP- glucuronosyltransferases (UGTs) isoforms[D]. Beijing: Academy of Military Medical Sciences, 2015. (in Chinese)
[32] CHEN Y, LI B, CEN K, LU Y, ZHANG S, WANG C. Diverse effect of phosphatidylcholine biosynthetic genes on phospholipid homeostasis, cell autophagy and fungal developments in. Environmental Microbiology, 2018, 20(1): 293-304.
Mechanism of StLAC2 and StLAC6 differentially affectingbased on non-targeted metabonomics analysis
ZOU JinPeng1,2, YUE HaoFeng2, LI HaiXiao1,2, LIU Zheng3, LIU Ning1,2, CAO ZhiYan1,2, DONG JinGao1,2
1College of Plant Protection, Hebei Agricultural University, Baoding 071001, Hebei;2Key Laboratory of Hebei Province for Plant Physiology and Molecular Pathology/State Key Laboratory of North China Crop Improvement and Regulation, Baoding 071001, Hebei;3Academy of Educational Sciences of Baoding, Baoding 071066, Hebei
【Background】As a polyphenol oxidase, laccase plays an important role in fungal growth, development and secondary metabolism. A plurality of laccase genes are encoded in the genome of, among whichandhave differential effects on the growth, development, and pathogenicity of.【Objective】To clarify the differential mechanisms of StLAC2 and StLAC6 onand explore new targets for developing new fungicides and disease control strategies by mining differential metabolites.【Method】was connected with pHZ100-GFP plasmid by seamless cloning, and the complementary expression vector ofwas constructed. Using PEG-mediated protoplast transformation method, the constructed vector was transferred into the protoplast ofgene knockout mutant, and the positive transformants were identified by PCR, RT-qPCR and GFP fluorescence verification, and therevertant strain was successfully constructed. The effects of knocking out and revertingandon melanin synthesis and oxidation resistance in and out ofwere analyzed. Taking wild-type (WT),andgene knockout mutants as experimental materials, the differential metabolites were analyzed by non-targeted metabonomics, and the mechanism of the differential action of StLAC2 and StLAC6 was analyzed by KEGG.【Result】StLAC2 and StLAC6have differential effects on melanin synthesis in mycelium and secreted into culture medium, and StLAC2 also affects antioxidant activityof. Metabolomic analysis found that compared with the WT strain of, there were more differential metabolites in the mycelium or secreted into the culture medium after knocking out, and KEGG analysis showed that the differential metabolites were mainly lipids, especially phospholipids. Meanwhile, the absence of thecaused down-regulation of various flavonoids and polyphenols. The contents of intermediates of the 1, 8-dihydroxynaphthalene melanin biosynthesis pathway, scytalone and vermelone, significantly increased in Δand decreased in Δ.【Conclusion】TheStLAC2 participates in melanin polymerization, the StLAC6 negatively regulates melanin biosynthesis in, and the differential effects of StLAC2 and StLAC6 affect lipid metabolism and intermediates of the melanin biosynthesis pathway in. The absence ofcaused down-regulation of various flavonoids and polyphenols, leading to decreased antioxidant activity.
; laccase; metabonomics; differential metabolite; melanin

10.3864/j.issn.0578-1752.2023.16.006
2023-05-11;
2023-06-06
国家自然科学基金(31901827,32072370)、河北省自然科学基金(C2020204039,C2021204136)、国家现代农业产业技术体系(CARS-02-25)、中央引导地方科技发展资金(226Z6502G)
邹金鹏,E-mail:17338233032@163.com。通信作者刘宁,E-mail:lning121@126.com。通信作者曹志艳,E-mail:caoyan208@126.com
(责任编辑 岳梅)

