洋葱离体雌核诱导与单倍体愈伤再生体系建立的研究
李威亚,潘美红,惠林冲,陈 微,张仕林,缪美华,陈振泰,何林玉,杨海峰
(连云港市农业科学院,江苏 连云港 222000)
洋葱(Allium cepaL.)是百合科(Liliaceae)葱属(Allium)中以肉质鳞片和鳞芽构成产品器官的二年生草本植物,20世纪初传入我国。目前中国的洋葱种植面积与总产量均居世界第1位[1-2]。我国洋葱栽培历史较短,种质资源相对匮乏,育种水平与国际先进水平相比尚有很大的差距。我国洋葱育种目前仍以常规选育为主,主要通过引种、杂交、选种等手段选育新品种,存在周期长、工作量大等问题。现在国内生产上应用的洋葱主要杂交种仍以引进为主,每年需要花费大量的外汇从国外进口种苗,并且一些进口品种由于适应性等问题,常给生产造成不必要的损失,对进一步扩大洋葱的生产规模产生了不利的影响。因此选育具有自主知识产权的洋葱杂交种,解决进口依赖问题,是我国洋葱生产的当务之急。
洋葱为典型的异花授粉作物,其常规的亲本选育方法具有育种周期长、工作量大、育种效率低等弊端[3-5]。并且与其他植物相比,洋葱带有不利的隐性基因,在经过长期异交后其自交系衰退严重,通常只能自交2~3次。目前常采用在少量全同胞子代内混合授粉的方法培育洋葱自交系,这种自交系由于其本身的基因具有一定的杂合度,因此,将其作为杂交亲本会在一定程度上影响杂种优势的表现,而育成1个优良的洋葱自交系需要6~10 a。洋葱离体雌核诱导与单倍体愈伤再生技术是直接利用离体花蕾进行诱导培养的方法,促进胚珠内的雌配子发育成单倍体植株,所培养植株的基因型和表现型是相同的,可以方便地鉴定出所需要的个体;同时结合愈伤再成苗技术,可以快速地形成单倍体纯系群体,便于加倍诱导、筛选和相关研究利用,而且能够应用于优质材料的快速繁育[6-7]。单倍体群体通过自然加倍或者人工加倍可以得到正常双单倍体群体,采用该方法仅需2~3 a时间就可以得到稳定、纯合的洋葱株系;经品质性状筛选,目标株系既能作为常规种使用,也可以作为亲本材料配制杂交种,结合传统育种方法可大幅提高我国洋葱的育种效率和水平。此外,采用该技术获得的双单倍DH系群体由于不存在基因间显隐性作用,还是基因多效性分析、目标基因分离、基因精细定位和克隆等研究的理想材料。
本研究以不同熟期、皮色、球型的中日照洋葱品种为试验材料,经不同预处理后,采用不同的培养基诱导培养洋葱的离体花蕾,以获得单倍体植株;通过比较不同单倍体的诱导率,进一步对洋葱离体雌核单倍体诱导技术中的材料处理、技术操作及培养基成分进行了优化,以提高诱导出苗率。同时探究了洋葱单倍体的组培快繁技术,以期为后续加倍诱导等研究提供材料保障。
1 材料与方法
1.1 试验材料
试验材料为连云港市农业科学院自有的5个中日照洋葱品种,如表1所示。

表1 洋葱雌核诱导材料
1.2 预处理及培养方法
2019年9月将试验材料种植于连云港市农业科学院东辛试验基地,2020年5月收获鳞茎;将收获的鳞茎存放在库房,至2020年10月时再次种植。2021年5月取部分花蕾开放的花薹作试材,用塑料袋包装后放入4 ℃冰箱,进行2 d的冷藏预处理。选取直径为3.0~5.5 mm、未开放的花蕾,剪切(留2~3 mm的花梗),用作外植体;用纱布包裹外植体,先用自来水冲洗20 min,然后用70%酒精消毒30 s,最后用超纯无菌水冲洗2次。继续按以下2个方案对外植体进行消毒:(1)放入浓度为10%的NaClO溶液消毒7~10 min,然后用超纯无菌水冲洗3次;(2)放入0.1% HgCl2溶液消毒7 min,然后用超纯无菌水冲洗3次。消毒完成后,将外植体接种在含有NAA(或2,4-D)和6-BA等不同激素配比的B5培养基中,每个培养瓶接种10个花蕾。每升培养基均加100.0 g蔗糖和6.5 g琼脂,用1% NaOH调其pH值至6.0;用240 mL规格的培养瓶分装50 mL培养基,拧上配有透气孔的瓶盖后,将培养瓶放入120 ℃高压锅内灭菌20 min,冷却后备用。外植体消毒及移植均按组织培养操作规范于超净工作台内完成。将接种的试验材料放置于25 ℃恒温、0~35 μmol/(m2·s)光强、16 h/d光照时间的组培室内,诱导培养5个月。
培养的花蕾裂开长出胚状体后,将胚状体接种在含不同配比激素(2,4-D和6-BA)的MS培养基中,于25 ℃恒温、黑暗条件下进行愈伤诱导、扩繁,每20 d继代培养1次。50 d后,将愈伤组织接种在含不同配比激素(2,4-D和6-BA)的MS培养基上进行再生芽诱导,30 d后将生成的小苗接种在含不同配比激素(2,4-D和6-BA)的MS培养基上进行生根诱导。生成完整植株后,将植株接植于无激素的MS培养基中自由生长。再生芽诱导、生根诱导和植株培养的条件均为25 ℃恒温、0~35 μmol/(m2·s)光强、16 h/d光照时间。培养基均加30.0 g蔗糖和6.5 g琼脂,用1% NaOH调其pH值至6.0。胚状体及生根诱导用直径240 mL规格的培养瓶分装30 mL培养基,植株生长培养用250 mL锥形瓶分装30 mL培养基,均于120 ℃高压锅内灭菌20 min。试材移植、继代培养均按组织培养操作规范于超净工作台内完成。
1.3 倍性鉴定、炼苗及定植
再生植株生长至3叶1心后,取植株的新鲜叶片0.5 cm2,置于10 cm直径的培养皿内,加入1.0 mL Kiwifruit Buffer裂解液,随后快速用刀片切碎叶片,静置萃取60 s;将样品用30 μm孔径的小滤网过滤至1.5 mL离心管,放置于4 ℃冰箱冷藏5 min。取出样品离心5 min,倒去上清液,分别加入60 μL预冷的PI染色液和600 μL解离液,于4 ℃黑暗条件下染色15 min。然后采用Beckman Colour流式细胞仪进行测定,以正常二倍体植株为对照,由仪器直接绘制出DNA曲线图,其纵坐标代表细胞数量,纵坐标峰值的高低反映细胞比例的不同。纵坐标峰值对应的荧光强度X-Mean(横坐标)与细胞DNA含量成正比,所以可以根据各样本X-Mean值的比例关系判断倍性,例如,将对照的二倍体峰调整在横坐标200位置,则四倍体峰会出现在400位置,三倍体峰会出现在300位置,而峰值仍出现在200位置的则为二倍体。
在倍性检测完成后,将准备的基质分装入营养钵,将鉴定筛选的单倍体植株移栽至营养钵中,放置于玻璃温室驯化生长15 d,然后将4~5叶1心的幼苗移栽至大田,观察单倍体植株在大田的开花结籽情况,以进一步验证其倍性。
2 结果与分析
2.1 不同消毒方法对离体花蕾培养污染率的影响
从表2可以看出:5个洋葱品种花蕾外植体经0.1% HgCl2溶液消毒后,在培养后第30天,其污染率为32.3%~48.3%,明显低于经10% NaClO溶液消毒后的污染率,说明前者的消毒效果明显优于后者,重金属汞离子的渗透性较好,可以穿透花蕾萼片等进行深层次消毒。
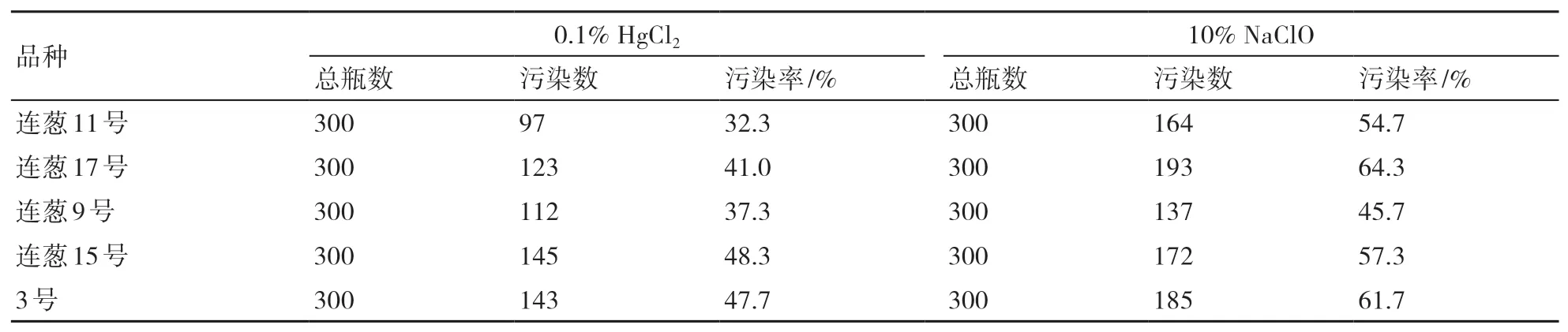
表2 NaClO和HgCl2溶液对不同洋葱品种花蕾的消毒效果(培养30 d时)
将未开放的花蕾移植于培养瓶,于组培室培养,第3天开始观察到污染现象(图1、图2);在培养后7~15 d污染发生最多,在此期间的污染主要是由外植体消毒不彻底或试验操作不当引起的;此后的污染数慢慢变少,在30 d之后较少出现污染。

图1 霉菌污染
2.2 离体花蕾的诱导培养发育过程
将离体花蕾接种在含不同配比激素(NAA或2,4-D+6-BA)的B5诱导培养基中培养,从第2天开始有部分花蕾开放。由于培养瓶内气体环境稳定,花药和花粉很难接触到柱头,第5天花药开始萎蔫消失。后续花蕾逐渐膨大饱满,个别花蕾出现脱分化现象或基部出现愈伤组织。培养60 d后花蕾开始萎缩转黄,个别裂开而长出胚状体,在培养70~100 d期间胚状体出现最多,后续逐渐减少(图3)。

图2 细菌污染
2.3 不同激素组成对胚状体诱导效果的影响
含不同配比激素的B5培养基对洋葱离体花蕾的诱导效果如表3、表4所示。含不同配比激素NAA+6-BA的B5培养基对离体花蕾的诱导成功率(出胚率)明显低于含不同配比2,4-D+6-BA的,说明2,4-D与6-BA搭配较适合于洋葱离体雌核胚状体的诱导。
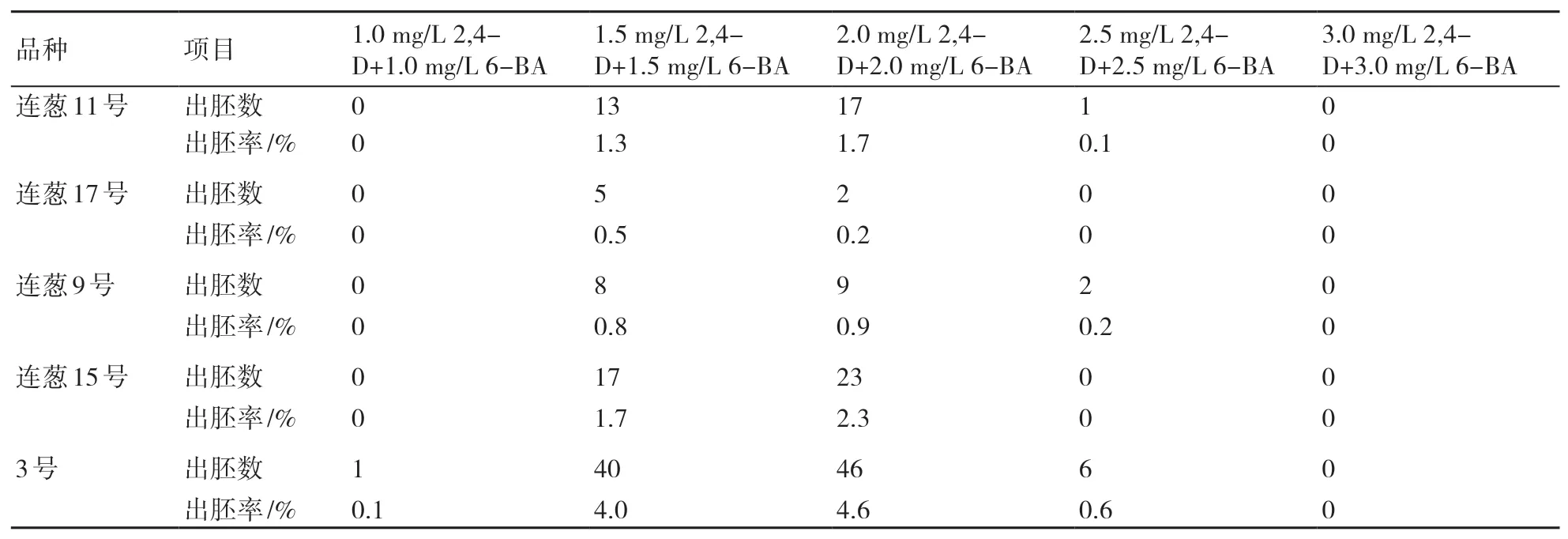
表3 B5培养基中2,4-D和6-BA浓度对洋葱离体雌核胚状体诱导的影响
连葱11号、连葱9号、连葱15号、3号这4个洋葱品种在2,4-D和6-BA浓度均为2.0 mg/L的B5培养基中诱导率最高,在2,4-D和6-BA浓度均为1.5 mg/L的B5培养基中诱导率次之。连葱17号在2,4-D和6-BA浓度均为1.5 mg/L的B5培养基中诱导率最高,在2,4-D和6-BA浓度均为2.0 mg/L的B5培养基中诱导率次之。说明在B5培养基中2.0 mg/L 2,4-D+2.0 mg/L 6-BA的激素配比最适于洋葱离体花蕾雌核胚状体的诱导发育,1.5 mg/L 2,4-D+1.5 mg/L 6-BA的激素配比次之。
2.4 不同品种胚状体诱导率的差异
据表3、表4数据,3号材料相较于其他品种诱导率最高,在2,4-D和6-BA浓度均为2.0 mg/L的B5培养基中成功诱导出46个胚状体,出胚率达4.6%;而连葱17号的诱导率在5个品种中最低,在含1.5 mg/L 2,4-D+1.5 mg/L 6-BA 或2.0 mg/L 2,4-D+2.0 mg/L 6-BA的B5培养基中出胚率只有0.5%或0.2%。在含不同配比NAA+ 6-BA的B5培养基中,只有连葱15号和3号诱导出胚状体,且后者的出胚率明显高于前者的,3号材料在含1.5 mg/L NAA+1.5 mg/L 6-BA的B5培养基中出胚率最高,达1.0%。以上结果说明不同基因型洋葱离体雌核胚状体诱导对激素种类和浓度的要求不同。
2.5 愈伤扩繁与植株再生
将胚状体移植在含不同配比2,4-D和6-BA的MS培养基上进行愈伤扩繁和成苗诱导培养,供试培养基及其激素配比如表5所示。
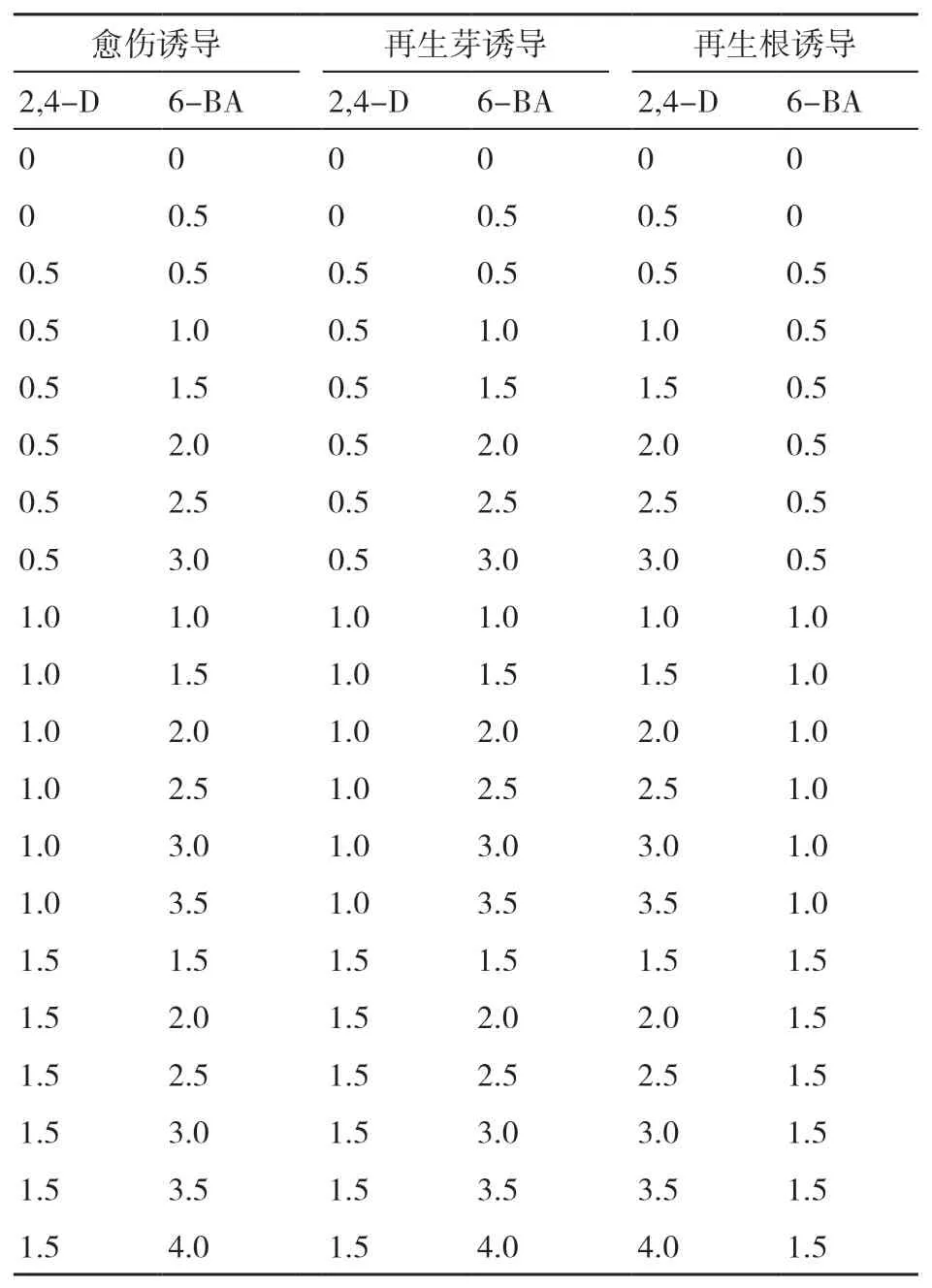
表5 MS培养基中2,4-D和6-BA的浓度设置 mg/L
胚状体在2,4-D和6-BA均未添加的MS培养基上生长成正常植株,但无愈伤出现。5个品种材料在含1.5 mg/L 2,4-D+2.5 mg/L 6-BA的MS培养基上均诱导出愈伤组织,且愈伤诱导率均接近100%,说明该培养基组成较适于离体雌核胚状体的愈伤诱导。
连葱9号、连葱17号和连葱11号产生的愈伤组织在2,4-D和6-BA均未添加的MS培养基上再生芽诱导成功率最高,均在75%左右。3号材料的愈伤组织在2,4-D和6-BA均未添加的MS培养基上再生芽诱导成功率在30%左右,而连葱15号在此培养基上未产生再生芽。
连葱9号、连葱17号、连葱11号和3号的再生芽在只含0.5 mg/L 2,4-D的MS培养基上培养,1周内均产生了根系;这4个品种材料在未添加任何激素的MS培养基上也产生了正常根系,但所需时间较长,说明一定浓度的2,4-D能促进再生芽的根系产生(图4)。
2.6 倍性鉴定及炼苗定植
取3叶1心的洋葱胚状体再生幼苗叶片,以二倍体正常植株为对照,利用流式细胞仪进行倍性检测。如图5所示:仅有2个3号材料的离体花蕾诱导植株群体显现出二倍体波峰;其余材料均显现出单倍体波峰,单倍体诱导率达97%以上。与染色体计数等传统方法相比,流式细胞仪倍性检测方法简便、迅速,可应用于再生诱导植株大群体的倍性检测。
将筛选得到的单倍体植株移栽至装有基质的营养钵中,放置于玻璃温室进行炼苗;待幼苗生长至4~5叶1心时将其移栽至大田。按照该炼苗、定植步骤,洋葱单倍体植株在大田的定植存活率在90%以上。
3 讨论
单倍体育种作为一种新的育种途径,与常规选育法相比,其在较短时间内便可以选育出整齐一致的纯系,在育种时间和成本上都有很大的优势,因此日益受到研究人员与育种家们的重视。迄今,已经成功建立了多种作物的单倍体育种技术体系,并育成了相应的新品种,如辣椒、茄子、大白菜、水稻、玉米等[8-14]。本研究以建立洋葱单倍体育种技术体系为目标,利用洋葱的离体花蕾进行雌核单倍体的诱导,结果胚状体的诱导成功率最高达4.6%,单倍体的诱导成功率达97%。单倍体再生植株的大田存活率达90%以上,并提高了鉴定、筛选优质材料的效率和准确性,解决了洋葱育种周期长、选育品种性状整齐度差等问题。
本研究的5个洋葱品种材料在熟期、皮色等性状特征上有较大的区别,它们的雌核诱导和愈伤、扩繁结果也有较大的差异,说明不同基因型材料对培养基和激素配比的适应性不同。今后拟进一步筛选、优化适于不同基因型材料的特定培养基,以进一步提高洋葱单倍体育种的效率。
今后有必要进一步研究洋葱单倍体植株形成的分子、细胞、生物学机制,建立切实可行的双单倍加倍技术体系,完善洋葱单倍体育种技术体系。同时,应研究不同染色体倍性对洋葱特定表型性状、物质合成的影响,以及单个基因不同倍性的作用机制及其表达效应,填补国内外在该研究领域的空白。
4 结论
洋葱的离体花蕾外植体适宜采用0.1% HgCl2溶液消毒。在B5培养基中,2.0 mg/L 2,4-D+2.0 mg/L 6-BA的激素配比最适于洋葱离体花蕾雌核胚状体的诱导,出胚率最高达4.6%;在MS培养基中,1.5 mg/L 2,4-D+2.5 mg/L 6-BA的激素配比最适于洋葱雌核胚状体的愈伤诱导,诱导率接近100%;在不含任何激素的MS培养基中,再生芽的诱导成功率最高,达75%左右;在只含0.5 mg/L 2,4-D的MS培养基中,再生芽均能诱导出根系。
经流式细胞仪鉴定,采用以上外植体消毒、培养基和激素配比等培养条件,洋葱离体雌核单倍体的诱导成功率达97%。洋葱单倍体植株移栽至装有基质的营养钵中,放置于玻璃温室进行炼苗,在大田定植后存活率在90%以上。

