大葱雄性不育花药败育的形态学特征和细胞学研究
岳丽昕 王清华 刘泽洲 孔素萍 高莉敏
〔山东省农业科学院蔬菜研究所,国家蔬菜改良中心山东分中心,山东省设施蔬菜生物学重点实验室,农业部黄淮地区蔬菜科学观测实验站(山东),山东济南 250100〕
大葱(AlliumfistulosumL.)是百合科(Liliaceae)葱属(Allium)二、三年生植物,是我国最具特色、广泛种植的香辛类蔬菜,在我国蔬菜出口创汇中占据重要地位(高莉敏,2005;刘贺娟 等,2019;乔立娟 等,2021)。大葱具有显著的杂种优势,但自交衰退明显,加上其生长周期长、开花期短、花器官小、人工去雄难等因素(冯大领 等,2016),大葱育种研究工作受到限制、进展缓慢。1972 年,日本学者Nishimara 等首次在大葱自然群体中发现了雄性不育株(王晓静 等,2007;康香辉 等,2021)。随后,张启沛等(1987)进一步研究发现我国大葱地方品种中雄性不育株广泛存在,这使得利用雄性不育系配制杂交种成为可能。
植物雄性不育主要表现为雄蕊退化、花粉败育和功能不全等;在细胞学水平上,研究发现减数分裂、绒毡层形成、小孢子营养供应和花粉外壁发育等方面发育异常均可导致雄性不育(Chen & Liu,2014;Lu et al.,2014;Zhang et al.,2014; 蒋会兵 等,2020;王芳权 等,2020)。植物花药败育的细胞学研究作为雄性不育分子水平与个体水平的重要联系,为深入了解植物雄性不育的机理奠定基础(谢潮添 等,2006)。植物花药由表皮、药室内壁、中层和绒毡层等4 层不同的细胞层组成,而小孢子产生于被绒毡层包围的腔室中(Cheng et al.,2019)。花粉发育在很大程度上依赖于构成花药壁的周围组织,特别是绒毡层(Cheng et al.,2019)。绒毡层发育异常会影响小孢子发育,最终导致雄性不育(Ariizumi & Toriyama,2011;Xu et al.,2020)。此外,众多研究表明不同类型的植物雄性不育材料,发生花粉败育的时期和方式也不尽相同(Ariizumi & Toriyama,2011)。Laser 等提出双子叶植物花粉败育高峰时期一般处于造孢时期至四分体形成时期,而单子叶植物花粉败育高峰期略晚,多发生在单核至双核小孢子期间(Laser &Lesrten,1972;李六林,2007;王婵 等,2014)。现阶段,拟南芥、水稻、玉米等作物中已发现种类丰富的雄性不育材料,其花粉发育的细胞学研究及败育的分子机理研究较为深入,可为大葱雄性不育机理研究提供重要的参考(Zhang et al.,2007;Shi et al.,2015;Kim et al.,2019;Wan et al.,2019)。
大葱花器官小,不适合人工去雄选育杂交种,目前利用雄性不育系配制杂交种是唯一高效途径。尽管大葱的雄性不育对杂交育种非常重要,迄今为止,关于大葱雄性不育机理的研究却非常有限。相比其他作物,大葱雄性不育的研究起步较晚,研究基础薄弱,对不同类型大葱雄性不育花药发育的细胞学观察仍是一项基础而重要的工作。前人对大葱雄性不育材料的细胞学研究一般通过石蜡切片、扫描电镜等来观察花药发育的过程。本试验以出口保鲜大葱雄性不育系FCY-A 和保持系FCY-B 为试材,通过花粉活力染色实验、石蜡切片、扫描电镜和透射电镜等技术手段,比较不育系和保持系的花药发育外观特征、细胞发育过程与超微结构差异,明确不育系FCY-A 花粉败育时期和方式,对大葱雄性不育系选育与杂种优势利用具有重要意义。
1 材料与方法
1.1 试验材料
供试材料为山东省农业科学院蔬菜研究所大葱课题组选育的出口保鲜大葱不育系FCY-A 与相应保持系FCY-B。2021 年7 月8 日播种,9 月10日不育系和保持系分别定植约500 株于核心试验基地纱网棚内,2022 年5 月在抽薹开花期进行相关试验。
1.2 试验方法
1.2.1 大葱花药采集与育性观察 在大葱盛花期,于晴天10:00 以后采集不育系FCY-A 和保持系FCY-B 盛开的花序,利用体视显微镜(NIKON SMZ2800)观察不育系与保持系雄蕊外部形态特征。1.2.2 花粉活力染色与鉴定 采用镊子剖开成熟花药,挤出花粉粒,分别采用I2-KI 染色法和TTC 染色法鉴定花粉活力(郭元元 等,2020;梁露 等,2022)。花粉活力鉴定依据如下:通过I2-KI 染色,被染成蓝色的花粉活力较强,未被染色的花粉则视为无活力;通过TTC 染色,被染成红色的花粉活力较强,未被染色的花粉则视为无活力。
1.2.3 石蜡切片制备与观察 参照王婵等(2014)的方法,以花蕾长度作为衡量不同发育时期的指标,采集不同发育时期的可育及不育花蕾(花蕾长度分别约为 2.0、3.0、4.0、5.0 mm),分别置于50% FAA 固定液中固定24 h。将固定好的材料依次放入环保型脱蜡透明液和乙醇系列梯度浓度中进行脱蜡至水。将切片放入植物番红染色液中染色2 h →自来水冲洗掉多余染料→依次放入50%、70%、80%梯度酒精中各3~8 s →放入植物固绿染色液中染色6~20 s →无水乙醇脱水→放入干净的二甲苯透明5 min →中性树胶封片(蔡亚明,2021;唐雨,2021)。处理好的切片放置于光学显微镜(NIKON ECLIPSE E100)观察,通过成像系统(NIKON DS-U3)拍照,CaseViewer 2.4 软件查看图像。
1.2.4 花药和花粉扫描电镜观察 取不育系和保持系不同发育时期的花蕾(花蕾长度分别约为 2.0、3.0、4.0、5.0 mm),快速剥开花蕾,剥出花药,迅速投入电镜固定液(有效成分为2.5% 戊二醛),室温固定2 h,再转移至4 ℃冰箱保存。固定好的样品经0.1 mol · L-1磷酸缓冲液PB(pH 7.4)漂洗3 次,每次15 min。依次放入30%、50%、70%、80%、95%、100%乙醇中进行脱水,每次15 min。将样本放入Quorum-K850 型临界点干燥仪内进行干燥,再将样本紧贴于导电碳膜双面胶上,放入HITACHI-MC1000 型离子溅射仪样品台上喷金30 s 左右(蔡亚明,2021;Dong et al.,2022)。利用HITACHI-SU8100 型扫描电子显微镜观察并选取有代表性的视野进行拍照。
1.2.5 透射电镜观察 选取不育系和保持系不同发育时期的花蕾(花蕾长度分别约2.0、3.0、4.0、5.0 mm),快速剥开花蕾,取出花药。迅速投入电镜固定液(有效成分为2.5% 戊二醛),室温固定2 h,再转移至4 ℃冰箱保存。参照前人(唐雨,2021;Dong et al.,2022;Yuan et al.,2022)研究方法,对透射电镜样本依次进行后固定、脱水、渗透包埋、聚合、超薄切片、染色等处理后,将其置于透射电子显微镜(HT7700)下进行观察和采集图像。
2 结果与分析
2.1 花器官形态特征分析
采集不育系和保持系的花蕾各3 个,置于体视显微镜下观察发现,大葱保持系的一朵花上可观察到6 个雄蕊,3 长3 短,花药饱满且正常开裂,表面可观察到大量的花粉(图1-a);而不育系的花器官明显小于保持系,雄蕊较短,花药干瘪,表面未见花粉(图1-b)。
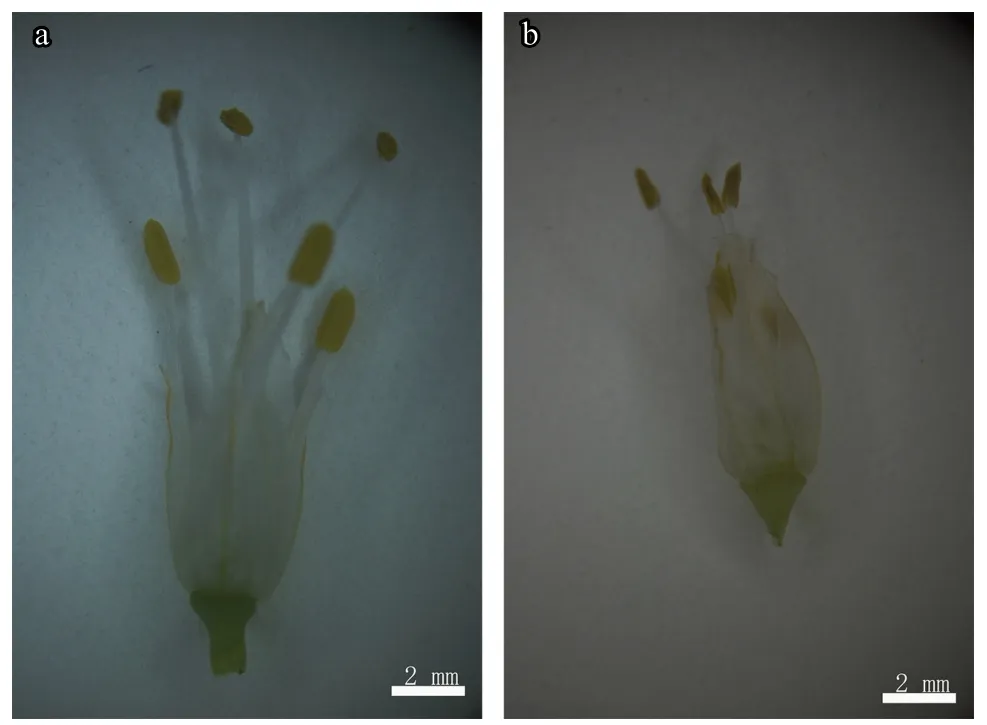
图1 大葱保持系FCY-B 和 不育系 FCY-A 的花器官形态
2.2 花粉活力检测
I2-KI 染色试验结果发现,不育系释放的花粉粒数量较少、着色浅(图2-a);保持系可释放大量的花粉粒,其形状规则,被均匀染成深蓝色或黄褐色(图2-b)。同时,TTC 染色结果显示,不育系花粉粒呈淡红色或无色(图2-c);保持系花粉呈红色,部分花粉粒着色较浅(图2-d)。表明不育系花粉发育不良或无活力,保持系花粉具有较强的花粉活力。
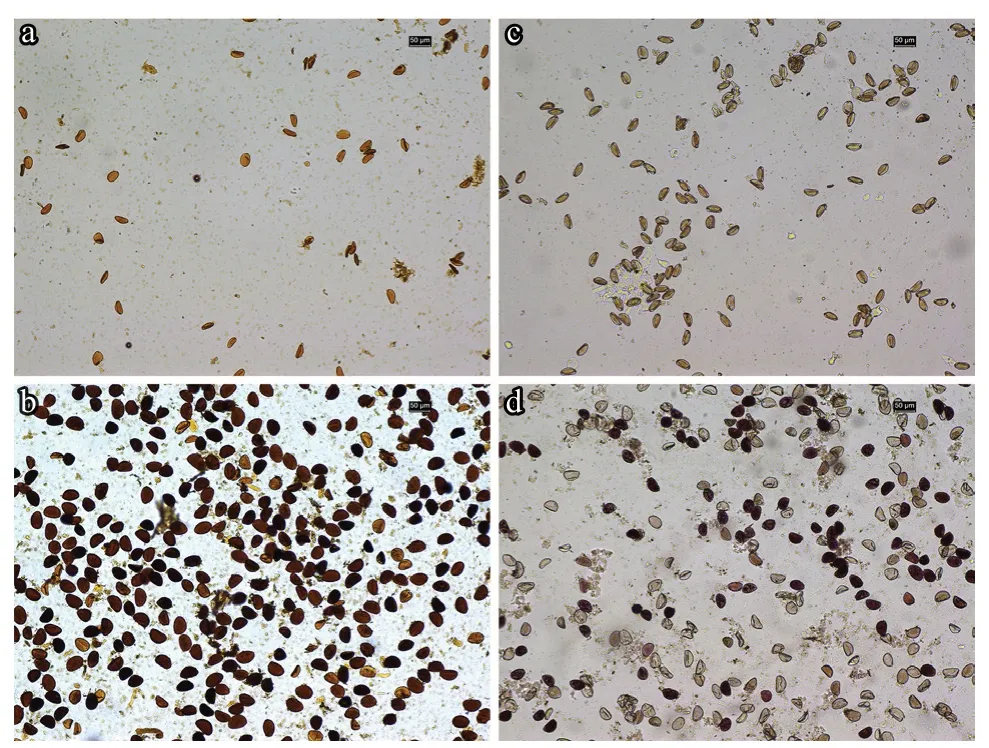
图2 大葱不育系FCY-A 和保持系FCY-B 花粉活力检测
2.3 花药发育过程观察
通过石蜡切片观察大葱保持系的花药特征(图3),发现大葱花蕾外围由两轮花被组成,每轮3 片,内部具有6 个横切面呈蝴蝶形的花药。每个花药含有4 个花粉囊,沿中轴对称分布,中间由药隔相连。每个花粉囊则由花粉囊壁和药室组成。花粉囊壁由外至内分别为表皮、药室内壁、中层及绒毡层。此外,表型观察发现大葱同一花内6 个雄蕊呈现3 强3 弱;石蜡切片结果也表明同一朵花内不同花药的小孢子母细胞减数分裂不同步,而同一药室的小孢子母细胞减数分裂则大多同步。
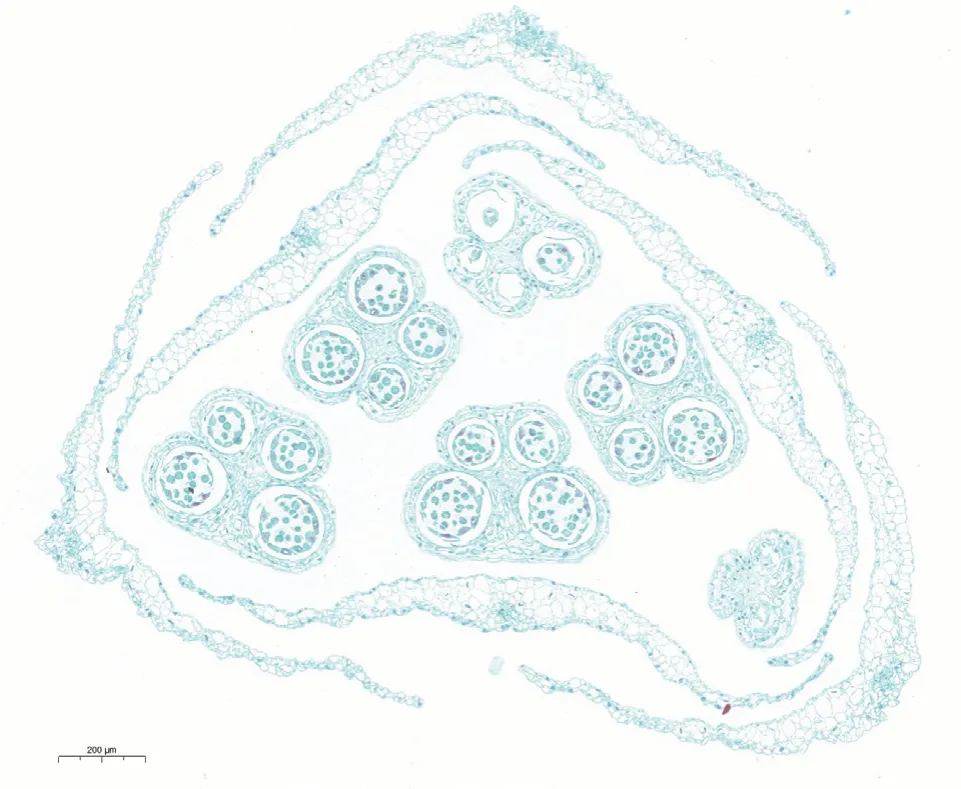
图3 大葱保持系单个花蕾的横切图
2.3.1 造孢细胞时期 圆形雄蕊原基出现,且变为椭圆形,孢原细胞(Ar)分布在椭圆形的4 个角落;孢原细胞通过平周分裂,形成造孢细胞(Sp)。通过比较,发现不育系和保持系在此时期无明显差异(图4-a、e)。
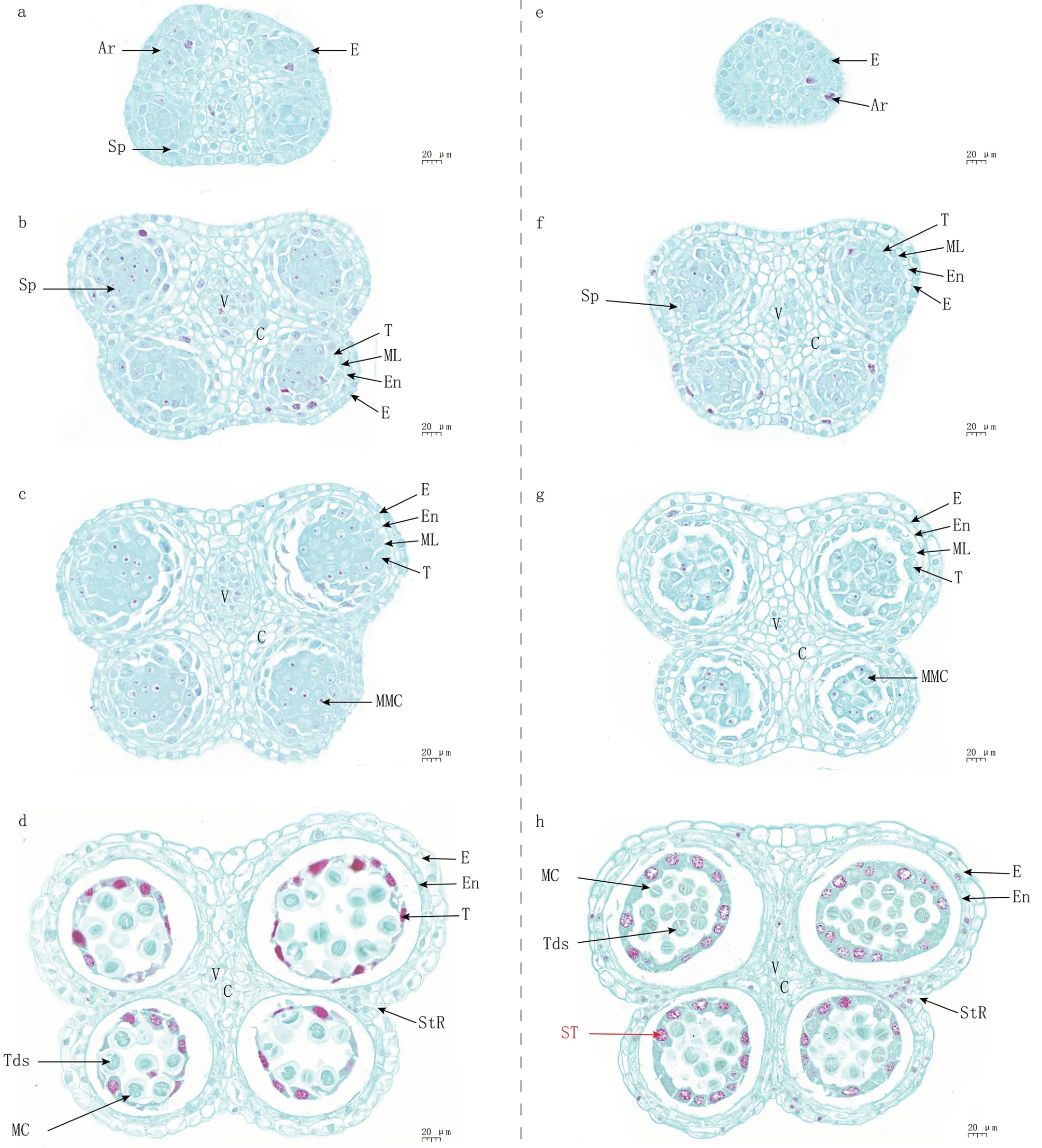
图4 大葱保持系FCY-B 和不育系FCY-A 花药发育过程中的细胞学特征(造孢细胞时期至四分体时期)
2.3.2 花粉母细胞时期 花粉母细胞早期,呈现两个带裂口的“四裂花药”模式,具有4 个药室,可观察到表皮(E)、药室内壁(En)、中层(ML)、绒毡层(T)等不同类型的细胞且细胞间层次清晰;小孢子母细胞(MMC)出现,排列整齐规则,其细胞核染色较深(图4-b、c、f)。花粉母细胞后期,保持系的中层细胞出现部分解体现象(图4-c),不育系则已基本完成解体(图4-g),两者的中层细胞无明显差异。
2.3.3 二分体和四分体时期 此时期,花粉母细胞进入减数分裂阶段,形成二分体和四分体(Tds),中层细胞解体、退化完成,花药明显增大,出现裂口(StR)(图4-d、h)。观察比较不育系和保持系的二分体和四分体外形,发现两者均具有正常形态,无明显差异。进一步比较保持系和不育系的绒毡层细胞,发现保持系花药绒毡层细胞排列规整,细胞核浓密、染色较深(图4-d),不育系绒毡层细胞异常增大,细胞核呈圆球状、染色较深(图4-h)。
轮椅摇走了,女孩一面朝妈妈停车的方向走一面回头看;老徐从鏊子上抬起烤红的脸,突然对女孩展颜笑了,伸出粘有面糊的右手,握拳,再对女孩竖起大拇指,久久地。
2.3.4 单核小孢子时期 该时期保持系花药的绒毡层细胞分泌胼胝质酶,降解四分体周围的胼胝质,释放出单核小孢子。保持系的花药继续生长、扩张,正常小孢子(Msp)呈空泡状,产生外壁(图5-a)。随后,绒毡层细胞开始退化、解体,小孢子呈新月形并进入有丝分裂阶段,形成二核、三核小孢子,药室内壁(En)和连接层细胞(C)增大扩张,裂口(StR)开始分化(图5-b、c)。而不育系绒毡层未发生降解,与小孢子粘连、挤压在一起,导致小孢子发育受限,胞质液泡化,细胞核消失,药室被挤压变形,导致整个花药也发生畸形(图5-e、f、g、h)。
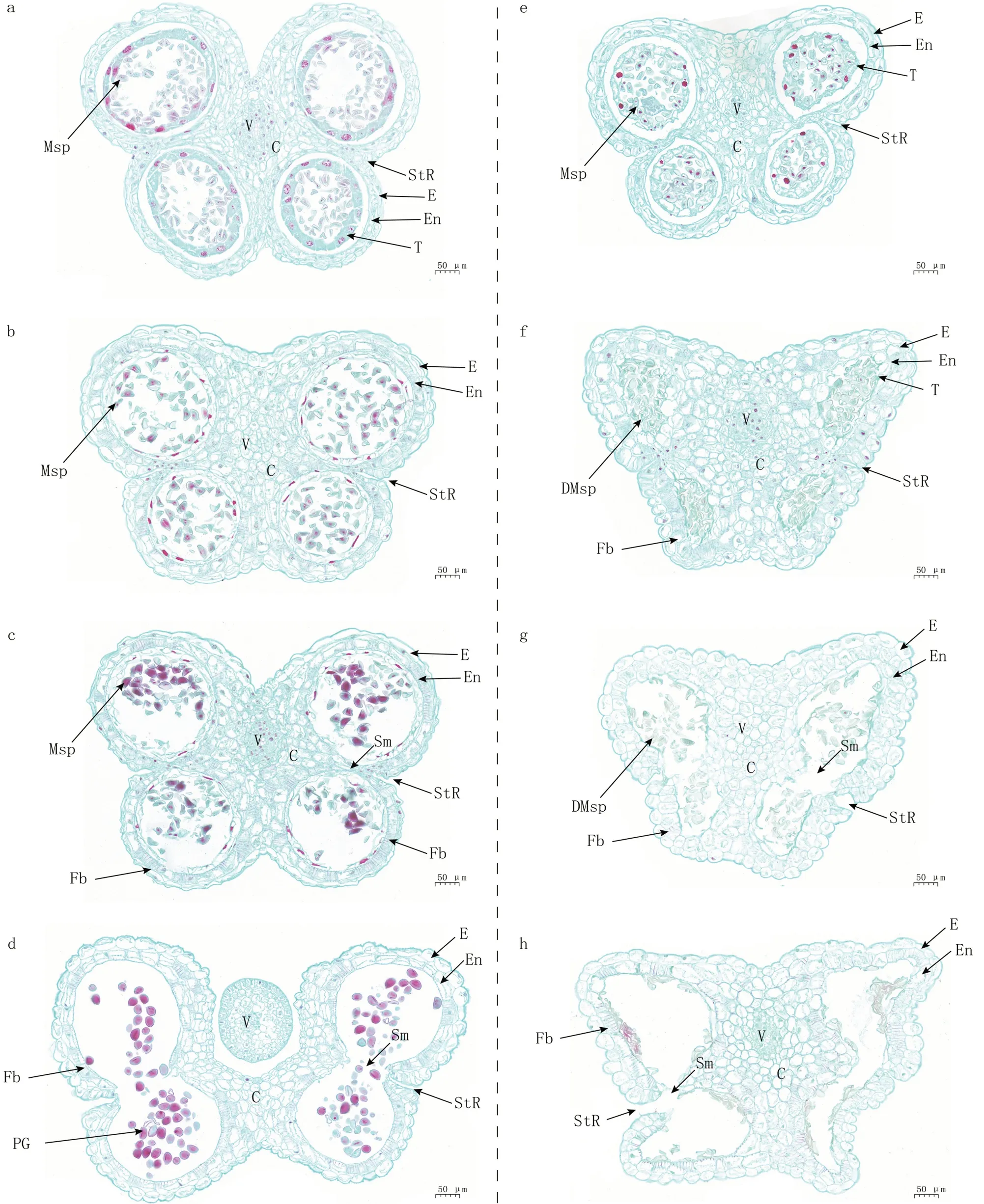
图5 大葱保持系FCY-B 和不育系FCY-A 花药发育过程中的细胞学特征(单核小孢子时期至花粉粒成熟时期)
2.3.5 花粉粒成熟时期 保持系小孢子发育成充满内含物的成熟花粉粒(PG),药室内壁细胞的细胞壁呈纵向条纹加厚状(Fb),细胞质染色较深。隔膜(Sm)裂开,裂口(StR)裂开,成熟花粉粒即将释放(图5-d)。不育系花药整体瘦小,药室发生扭曲变形,花粉粒发育畸形,挤压成团状;释放的花粉粒多为空瘪状,染色较浅(图5-f、g、h)。
2.4 花药及花粉粒表面超微结构观察
从饱满的尚未开放的花蕾(花蕾长度约为6 mm)和完全开放的花朵中取出花药置于电镜固定液中,通过扫描电镜技术观察花药表面超微结构。饱满的尚未开放的花药扫描电镜结果显示,保持系FCY-B 花药形状饱满,近纺锤形,表面纹饰分布均匀(图6-a);花粉形状不规则,形态略显皱缩、扁平,整体不对称(图6-b);萌发沟(GA)细长,纵向延伸至花粉粒两端(图6-c);网眼(M)较浅,均匀分布;脊(R)较窄,凹凸不平;脂滴(LD)数量较多,大量附着花粉颗粒表面(图6-c、d)。与保持系相比,不育系FCY-A 花药明显偏小,花药外形萎缩(图6-e);花粉粒皱缩干瘪,萌发沟严重收缩,发育畸形,呈现典型败育特征(图6-f、g);其表面较为光滑,未见网眼,无脂滴附着(图6-h)。

图6 大葱保持系FCY-B 和不育系FCY-A 花药及花粉扫描电镜
开裂花药及其花粉的扫描电镜结果显示,保持系FCY-B 花药整体呈超长球形,外壁纹饰呈脑纹状、较粗糙,表面遍布深浅不一的微穴(图6-i);扫描电镜下,花药药室中散出大量成熟饱满的花粉粒(图6-j);单个花粉粒近似长球形,其赤道面为扁椭圆形,极面为裂圆形,可见1 条萌发沟(图6-k),外壁表面孔穴密集,呈皱波状(图6-l)。与保持系相比,不育系FCY-A 花药明显扁小,脑纹状外壁纹饰更加清晰(图6-m);成熟的花粉粒间粘连、重叠,未见正常的单粒花粉粒,大多数花粉粒塌陷、变形(图6-n、o);花粉粒表面杂质较多,不光滑且有疣状突起(图6-p)。
2.5 小孢子和绒毡层的超微结构观察
利用透射电子显微镜分析观察不育系和保持系的小孢子和绒毡层的超微结构。与石蜡切片的结果相似,不育系和保持系的花药壁层和小孢子在花粉母细胞时期无明显差异,表皮(E)、药室内壁(En)、中层(ML)、绒毡层(T)等花药壁各层细胞层次清晰,小孢子母细胞(MMC)内含物丰富、细胞核明显(图7-a、b)。绒毡层细胞与小孢子母细胞紧密相连,可观察到细胞核(N)、内质网(ER)、囊泡(Ves)等细胞器(图8-a、b)。
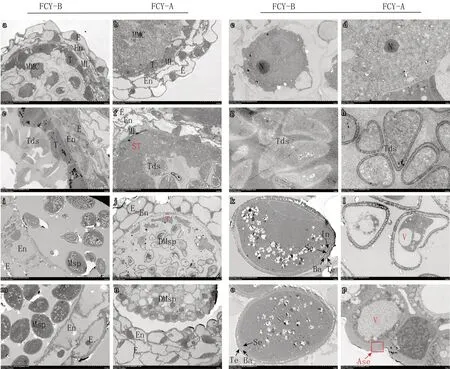
图7 大葱不育系FCY-A 及保持系FCY-B 花粉囊和小孢子的超微结构观察
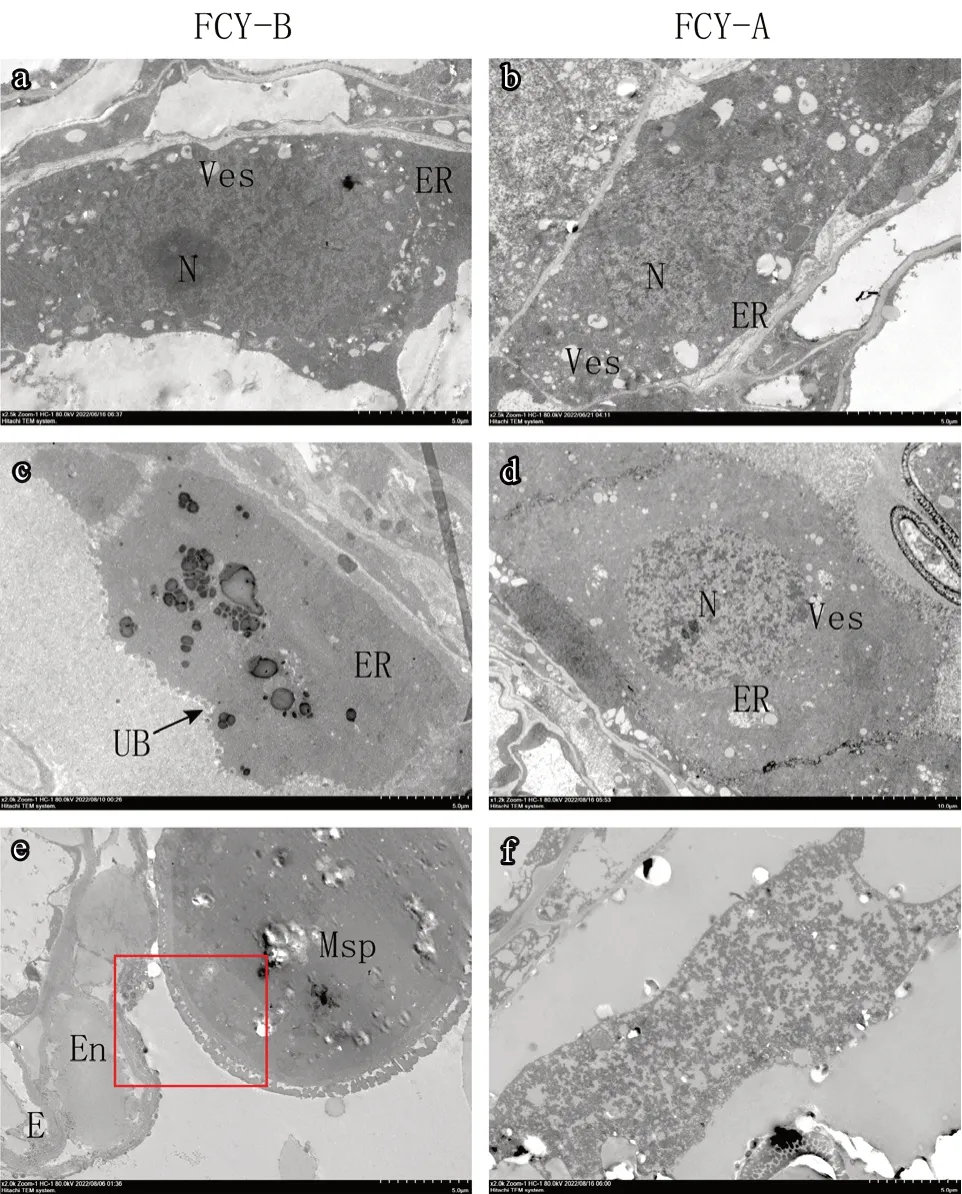
图8 大葱保持系FCY-B 及不育系FCY-A 绒毡层的超微结构观察
小孢子后期:保持系绒毡层细胞已经基本降解完成(图7-i、8-e),而不育系的绒毡层细胞才开始表现出退化,可观察到清晰的轮廓和解体碎片(图7-j、8-f)。进一步对小孢子进行观察,发现保持系小孢子呈扁圆状、内含物丰富,中央含有大液泡,细胞核移向一侧,小孢子壁层次清晰,可明显观察到覆盖层(Te)、柱状层(Ba)、外壁(Se)和内壁(In)(图7-k);不育系的小孢子形状不规则、液泡化严重,出现空泡化(图7-l)。
成熟花粉粒时期:该时期保持系成熟花粉粒形状规则、内含物丰富而饱满(图7-m、o);而不育系的花粉粒挤压成一团,花粉粒外壁变形,发生不正常加厚(图7-n、p)。因此,大葱不育系败育时期发生在四分体时期,败育原因是不育系的绒毡层细胞异常增大,其细胞程序化死亡延迟,不能为小孢子发育提供重要的营养物质,导致小孢子外壁发育异常,花粉败育。
3 讨论
3.1 大葱雄性不育系小孢子的败育时期和原因
许多学者对作物雄性不育花粉败育时期和方式进行了研究,发现不同作物或者同一作物不同类型的雄性不育系之间也有很大差异(康香辉 等,2021)。总结前人的研究发现,大葱雄性不育发生的时期和方式主要有以下几种:一是大葱花粉败育发生在单核小孢子期早期,由于花药绒毡层提早液泡化并解体或绒毡层细胞内的原生质浓度低,无法形成正常小孢子(席湘媛,1991;王晓静 等,2007;冯大领 等,2016);二是单核小孢子期花药绒毡层异常增厚,挤压药室内的小孢子,小孢子内的物质流失,导致花粉败育(王婵 等,2014);三是单核小孢子期中层细胞仍然存在,延迟退化或未解体,且与内缩的药室一同将小孢子挤压成团块状(王晓静 等,2007);四是单核花粉粒发育成熟后期,药隔细胞发生纤维化,无法为花粉粒输送所需的水分和营养物质,从而引起花粉粒败育(冯大领 等,2016)。本试验通过石蜡切片和透射电镜技术确定了出口保鲜型大葱雄性不育系FCY-A 花粉败育时期和方式与前人研究存在差异。大葱不育系FCY-A 花粉败育关键时期始于四分体时期,绒毡层发生异常增厚,导致细胞程序化死亡延迟;而前人研究发现大葱的败育时期多发生在单核小孢子期及其以后的时期。该发现在大葱的雄性不育研究中鲜有报道。因此,花粉败育可能发生在大葱花粉发育的各个阶段,应根据具体的材料类型分析其具体的败育原因。
3.2 绒毡层在雄性不育中的作用
雄配子在花药中的形成需要孢子体和配子体两者的协同参与(Hafidh et al.,2016)。绒毡层作为花药壁最内层的细胞层,在调控花粉发育中起着至关重要的作用(Wu & Cheung,2000;Li et al.,2011)。绒毡层细胞可提供小孢子母细胞减数分裂和小孢子发育所需的营养物质和激素。在四分体时期,绒毡层分泌孢粉素前体物质,并在初生外壁上不断沉积,形成由覆盖层、柱状层和内壁层Ⅰ组成的特殊 T 形结构(Shi et al.,2015)。当小孢子母细胞完成减数分裂后,绒毡层合成胼胝质酶、降解胼胝质,促进单核小孢子的独立释放(Zhang et al.,2007;Li et al.,2011)。随后,绒毡层经历程序性细胞死亡、花粉被膜蛋白和绒毡层降解形成绒毡层细胞碎片,填充花粉外壁形成花粉被膜(Zhang et al.,2016)。因此,绒毡层在任何发育阶段的异常都可能导致花粉壁的发育受损,最终使花粉败育(Li et al.,2006;Li et al.,2011)。
以拟南芥为例,Sanders 等将其花药发育过程划分为15 个时期,并通过石蜡切片技术研究了保持系的绒毡层形态变化规律(Sanders et al.,1999;Yi et al.,2016),本试验结果也与此保持一致。通过石蜡切片和透射电镜技术,对大葱不育系及其保持系小孢子发育过程和绒毡层的超微结构进行了详细观察,发现处于四分体时期早期时,保持系的绒毡层结构致密,晚期时则呈现液泡化;随着小孢子释放,绒毡层收缩致密、颜色加深;单核期时绒毡层基本降解完成,双核期全部降解完成。与保持系相比,不育系绒毡层细胞在四分体时期体积明显增大;当保持系绒毡层细胞基本降解完成时,不育系的绒毡层细胞仍可观察到清晰的轮廓和解体碎片,说明其细胞程序化死亡发生延迟,继而不能为小孢子发育提供重要的营养物质,导致小孢子空泡化、小孢子外壁发育异常,产生了不正常加厚现象,最终花粉发生败育。
3.3 小孢子壁发育异常
花粉壁作为花粉最外层的重要结构,可使雄配子免受各种生物或非生物胁迫(Huang et al.,2009;Xiong et al.,2020)。在花粉发育过程中,花粉壁的正常形成是保证花粉活力和育性的关键过程(Li et al.,2016)。花粉壁由外层孢子体来源的外壁和内层配子体来源的内壁构成;花粉外壁位于成熟花粉粒的最外层,包含覆盖层与柱状层;花粉内壁位于最内层,直接与质膜接触(张江江 等,2019;Xiong et al.,2020)。花粉壁的发育过程中所需的营养物质主要由绒毡层降解提供。花粉粒双核期阶段,绒毡层降解完成,花粉壁也发育完成,花粉粒则发育成熟。本试验通过观察小孢子的超微结构发现,在花粉粒成熟期,保持系小孢子壁层次清晰,可明显观察到覆盖层、柱状层、外壁、内壁等部分;不育系花粉壁层次模糊,外壁变形,发生不正常加厚。结合观察到的绒毡层降解延迟现象,推测绒毡层非正常降解导致了花粉壁的发育异常。然而,由于花粉壁的组成和发育过程十分复杂,而本试验观察的花粉发育时期尚不全面,无法仔细观察到花粉壁发育的每个过程,因此,关于绒毡层降解延迟如何导致花粉壁发育异常还需进一步研究来解析。
4 结论
本试验通过观察大葱雄性不育系和保持系的花器官形态特征和花粉活力,确定该不育系为花粉败育型雄性不育,花药干瘪,表面未见花粉,花粉无活力。通过石蜡切片、扫描电镜和透射电镜分析等方法,发现该不育系花药发育受阻始于四分体时期,绒毡层细胞异常膨大增厚、程序化死亡延迟为导致其不育的主要原因。因此,大葱雄性不育的原因大多与绒毡层细胞的发育异常密切相关。今后在大葱雄性不育分子机理的研究中,应重点以四分体时期为切入点,借助多组学分析手段,进一步加强对大葱花器官发育,特别是绒毡层发育相关基因的发掘和调控机制研究,以期更好地解析大葱雄性不育的机理。

