分子靶向治疗对直肠癌大鼠巨噬细胞极化及PPIA/GRP78的作用机制
孙银平 刘奕明 俞剑伟 林承春
(福建医科大学附属龙岩第一医院消化内科,福建 龙岩 364000)
直肠癌大体可分为溃疡型、隆起型、浸润型,多数直肠癌是腺瘤性息肉病变所致,虽然导致直肠癌发生的具体原因尚不明确,但与饮食(高脂、高蛋白)、遗传因素、年龄、化学接触等因素有关。近年来发现,相关因子的异常表达可参与肿瘤的发展。实体瘤中,由于肿块的快速生长,产生了缺血缺氧的现象,致使营养供应不足,从而导致理葡萄糖调节蛋白(GRP)78水平升高,高表达GRP78可促进癌细胞的生长及血管新生。研究表明〔1〕,GRP78是内质网应激的标志,内质网应激与细胞自噬及凋亡关系密切,能诱导C/EB同源蛋白表达,并通过其表达调控细胞凋亡,参与结肠癌的生物行为。肽基脯氨酰顺反异构酶(PPI)A可调节生物学行为。相关研究提示〔2〕,PPIA对肝癌细胞的凋亡具有一定促进作用,但目前关于PPIA对直肠癌的相关文献较少,具体作用机制尚不明确。研究显示〔3,4〕,肿瘤相关巨噬细胞参与肿瘤产生及发展。巨噬细胞可识别机体内有害物质及衰老细胞等,且在不同情况下,存在不同的表型。在肿瘤中一般分为M1和M2两种类型。M1型具有抗炎、抗肿瘤作用;M2型发挥抑制肿瘤免疫应答作用。阿帕替尼是一种新型的小分子抗血管生成抑制剂,主要通过高度选择性抑制血管内皮生长因子(VEGF)受体(VEGFR)-2酪氨酸激酶活性,阻断VEGF与其受体结合后的信号转导通路,从而强效抑制肿瘤血管生成,发挥抗肿瘤作用。研究发现〔5〕,阿帕替尼对于治疗结直肠癌具有较好的治疗效果及安全性,可延长患者的生存期,为化疗失败患者提供新希望。但阿帕替尼对直肠癌巨噬细胞极化及PPIA、GRP78水平的影响尚不明确,因此,本文研究分子靶向治疗对直肠癌大鼠巨噬细胞极化及PPIA/GRP78的作用机制。
1 材料和方法
1.1实验动物 健康SD大鼠48只购自深圳子科生物公司,动物许可证号:SCXK(粤)2018-0026,6~8月龄,体质量220~300 g。常规饲养,温度25.6 ℃左右,模仿12 h昼夜交替,大鼠自由进食、饮水2 w,按照《实验动物管理条例》规定进行实验。
1.2实验试剂 阿帕替尼(江苏恒瑞医药股份有限公司);植酸钠(深圳乐芙生物公司);PPIA、GRP78一抗(北京百奥莱博生物公司);辣根过氧化物酶二抗(南京全隆生物公司);流式细胞仪(上海沫锦医疗器械公司);聚合酶链反应(PCR)仪(上海士森视觉科技公司,型号:ProFlex96)。
1.3模型建立 48只大鼠随机分为健康组12只,常规饲养;剩余36只建立直肠癌模型。第1天腹腔注射偶氮甲烷(AOM)(10 mg/kg),2.5%葡聚糖硫酸钠(DSS)连续饮水1 w,间隔给予蒸馏水2 w,重复DSS/蒸馏水饮水2个循环,每天观察肿瘤生长情况,当出现肿瘤结节时,则视为建模成功,具体见苏木素-伊红(HE)染色结果。建模成功后24 h:①肠癌组:12只直肠癌模型大鼠常规饲养;②治疗组:给予12只直肠癌模型大鼠45 mg/kg阿帕替尼灌胃,1次/d,共2 w;③对照组:12只直肠癌模型大鼠给予1 g/kg植酸钠灌胃,1次/d,所有大鼠干预2 w后处死。建模过程中,有3只大鼠死亡,最终健康组12只大鼠,肠癌组、治疗组及对照组均为11只大鼠。
1.4检测各组瘤重、抑瘤率 取各组大鼠,麻醉后处死,称重,剥离瘤体,称瘤重。抑瘤率:实验结束后统计各组抑瘤率。抑瘤率=(肠癌组平均瘤重-治疗组平均瘤重)/肠癌组平均瘤重×100%。
1.5HE染色观察病理形态 取各组直肠组织,4%多聚甲醛固定,石蜡包埋,切片,HE染色,显微镜下观察结直肠组织病理变化。
1.6免疫组化检测CD86(M1型巨噬细胞标志)、CD206(M2型巨噬细胞标志)、VEGF表达 取各组直肠组织,用4%多聚甲醛固定,石蜡包埋、切片,脱蜡水化,过氧化氢(H2O2)失活,低火加热1 min修复抗原加血清封闭,加一抗CD86、CD206(1∶200)、VEGF(1∶500),4 ℃过夜,磷酸盐缓冲液(PBS)冲洗,加入二抗,最后应用二氨基联苯胺(DAB)显色剂染色,直肠癌组织中的阳性信号为淡黄色至棕褐色,采用4级计分,无染色均为0分,染色细胞占比为0~5%;浅黄色染色为1分,染色细胞占比为6%~25%;棕黄色染色为2分,染色细胞占比为26%~49%;棕色染色为3分,染色细胞占比为50%~100%。
1.7流式细胞术检测巨噬细胞表型 取各组大鼠直肠组织,剪碎、研磨,消化,经Percoll密度梯度离心分离得到直肠组织中的免疫细胞。将细胞与流式抗体共孵育30 min后,用PBS重悬上流式细胞仪检测。所采用的流式抗体为CD86、CD206的流式抗体。
1.8反转录(RT)-聚合酶链反应(PCR)检测PPIA、GRP78、VEGF mRNA水平 取各组直肠组织,碾磨匀浆,添加1 ml RNA提取试剂Trizol,12 000 r/min离心15 min;在上清液中加入异丙醇,混匀,12 000 r/min离心10 min;RNA为底部的白色沉淀,吸去液体,用75%乙醇1.5 ml洗涤白色沉淀;4 ℃下12 000 r/min离心5 min吸去上清液;沉淀干燥后,溶解RNA。将提取的RNA转录为cDNA,在PCR仪上保温42 ℃ 60 min,之后保持70 ℃ 5 min使反转录酶灭活。反应条件:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环。结束后做溶解曲线,在60 ℃ 95 ℃下做检测,每30 s升温1 ℃。基因相对表达量=2-△△Ct。引物序列:PPIA上游引物:5′-GCCAGGGTGGTGACTTTA-3′,下游:5′-AACTGGGAACCGTTTGTG-3′;GRP78上游引物:5′-GACATCAAGTTCTTGCCGTT-3′,下游:5′-CTCATAACATTTAGGCCAGC-3′;VEGF上游引物:5′-ACCATGGCAGAAGGAGGAG-3′,下游:5′-ACGCGGTCTGTGTTTTTGC-3′;磷酸甘油醛脱氢酶(GAPDH)上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游:5′-TCCACCACCCTGTTGCTGTA-3′。
1.9Western印迹检测PPIA、GRP78、VEGF水平 取各组直肠组织,RIPA裂解液裂解,离心。收集上清液,二喹啉甲酸(BCA)法测定蛋白含量。取适量蛋白质,加入上样缓冲液,95 ℃煮沸5 min,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳后,将分离的蛋白条带转至聚偏氟乙烯(PVDF)膜,5%脱脂牛奶室温封闭2 h之后加入PPIA、GRP78一抗,4 ℃孵育过夜。Tris盐酸缓液吐温(TBST)清洗,加入辣根过氧化物酶二抗,37 ℃孵育2 h,洗膜,电化学发光(ECL)避光显影。ImageJ图像软件分析各蛋白条带的灰度值。
1.10统计学分析 采用SPSS22.0软件进行单因素方差分析、两组间对比采用t检验。
2 结 果
2.1各组瘤重及抑瘤率比较 健康组无瘤重及抑瘤率,肠癌组瘤重显著高于治疗组与对照组(P<0.05),治疗组与对照组瘤重与抑瘤率比较差异无统计学意义(P>0.05)。见表1。

表1 各组瘤重、抑瘤率、CD86、CD206、VEGF阳性率及CD86、CD206表达比较
2.2免疫组化检测 与健康组相比,肠癌组、治疗组及对照组CD86阳性率显著降低,CD206阳性率显著升高(P<0.05)。与肠癌组相比,治疗组与对照组CD86阳性率显著升高,CD206、VEGF阳性率显著降低(P<0.05)。治疗组与对照组CD86、CD206、VEGF阳性率相比差异无统计学意义(P>0.05)。见表1、图1。
2.3流式细胞术检测 与健康组相比,肠癌组、治疗组及对照组CD86水平显著降低,CD206水平显著升高(P<0.05)。与肠癌组相比,治疗组与对照组CD86水平显著升高,CD206水平显著降低(P<0.05)。治疗组与对照组CD86、CD206水平比较差异无统计学意义(P>0.05)。见表1、图2。
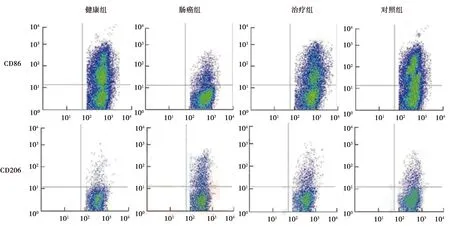
图2 各组流式细胞仪检测
2.4HE染色 健康组结直肠组织黏膜上皮完整,细胞结构正常,排列整齐。肠癌组结直肠组织黏膜上皮大量坏死,肠腔面有溃疡形成,有大量炎性细胞浸润,伴有血管增生,提示直肠癌模型建立成功。与肠癌组相比,治疗组与对照组有所改善。见图3。
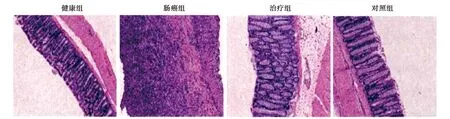
图3 各组结直肠(HE染色,×100)
2.5各组PPIA、GRP78、VEGF mRNA及蛋白水平比较 健康组直肠组织中PPIA、GRP78、VEGF mRNA及蛋白水平显著低于肠癌组、治疗组及对照组(P<0.05)。肠癌组直肠组织中PPIA、GRP78、VEGF mRNA及蛋白显著高于治疗组及对照组(P<0.05)。治疗组与对照组直肠组织中PPIA、GRP78、VEGF mRNA及蛋白相比差异无统计学意义(P<0.05)。见表2、图4。
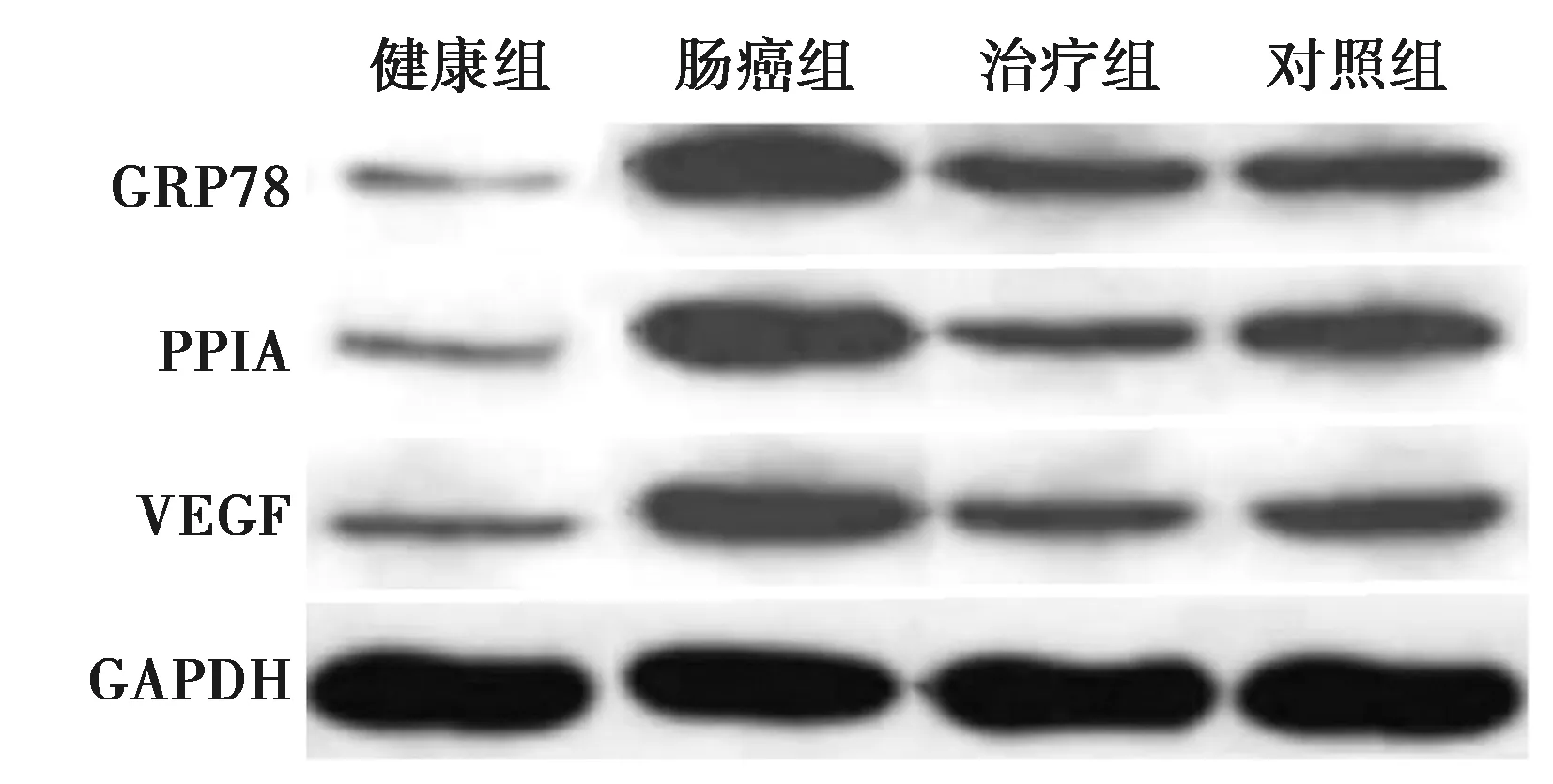
图4 Western印迹检测PPIA、GRP78、VEGF蛋白表达水平

表2 各组PPIA、GRP78、VEGF mRNA及蛋白水平比较
3 讨 论
在我国,直肠癌患者常见的发病年龄在40岁以上,男性直肠癌发病率高于女性,直肠癌威胁患者的生命健康,关于其治疗至关重要〔6〕。
VEGF是一种选择性的内皮细胞有丝分裂原,特异性作用于血管内皮细胞,参与恶性肿瘤的发生发展。研究表明〔7〕,VEGF可促进血管新生,加快肿瘤生长,促进肿瘤向远处转移。另有研究发现〔8〕,VEGF在直肠癌中水平与癌细胞的转移呈正相关,是诊疗结肠癌的重要指标。分子血管靶向药可显著降低血管新生,阻滞肿瘤转移等。研究提示〔9〕,阿帕替尼通过抑制VEGFR-2进而抑制VEGF及其受体通路,发挥抗血管生成作用。已有研究证实,阿帕替尼对肺癌〔10〕、胃癌〔11〕等多种肿瘤具有一定疗效。植酸又名肌醇六磷酸,是一种天然有机化合物,目前已有研究证实〔12〕,其对于治疗直肠癌已较为成熟,本文运用植酸作为阿帕替尼的药物对照,结果提示,阿帕替尼可通过抑制VEGFR-2表达进而下调VEGF水平抑制肿瘤发展。相关研究表明〔13〕,阿帕替尼能够对VEGFR进行有效抑制,在晚期转移性结直肠癌的临床治疗中具有显著疗效,且其耐受性较高,能有效延长患者总生存期。潘妍等〔14〕在对胃癌患者的研究中提出,阿帕替尼通过降低VEGF、白细胞介素(IL)-2R水平,改善患者病情严重情况,提高患者总生存期。本研究与上述研究结果相似。
巨噬细胞与肿瘤的产生与发展联系密切,M1型巨噬细胞具有杀菌、补体介导的吞噬及抑制肿瘤发展的作用;M2型具有促进肿瘤发展的作用。本研究提示,阿帕替尼具有促进巨噬细胞向M1极化,并抑制其向M2极化的作用。研究表明〔15〕,在直肠癌中,巨噬细胞与肿瘤血管形成呈正相关,巨噬细胞通过促进VEGF表达促进肿瘤血管形成。由此,本研究推测阿帕替尼可能是通过抑制VEGF水平,抑制巨噬细胞向M2型极化,并促进其向M1型极化,从而阻滞肿瘤发展。本研究与上述研究结果相似。
PPIA具有调节细胞内信号、生物学行为的作用,参与肿瘤的产生及发展。报道显示〔16〕,高表达PPIA可促进癌细胞增殖,并参与癌细胞转移。GRP78在多种肿瘤中高表达,并促进癌细胞的增殖、血管生成等。研究表明,高表达GRP78存在于多种肿瘤中,包括乳腺癌、肺癌等〔17~19〕。彭娅等〔20〕在对结直肠癌的研究中发现,GRP78与PPIA呈正相关,在结直肠癌中均表达升高,在经过抑制其水平后可显著改善患者预后。目前,关于阿帕替尼对GRP78、PPIA的作用机制尚无相关研究,无法论证本文研究观点,在今后实验中,应增加、完善实验内容,论证本文研究结果。杨宇菲〔21〕通过体外实验研究表明,分泌型GRP78在微环境中可促肿瘤相关血管生成,且与VEGF呈正相关,且采用丹酚酸A干预后可降低VEGF基因活性进一步抑制GRP78蛋白水平,进而抑制瘤体生长。因此,本文推测阿帕替尼可能通过抑制VEGF水平降低GRP78、PPIA表达,进而抑制直肠癌发展。

