不同营养支持途径对恶性肿瘤恶病质患者的治疗效果观察
肖建东
【摘要】 目的 探讨不同营养支持对恶性肿瘤恶病质患者的治疗效果。方法 将采用肠内营养混悬液(TPF,能全力)治疗的60例恶性肿瘤恶病質患者随机分为肠内营养A组(30例),肠外营养B组(30例),检测患者的营养指标、体质量、瘦体质量,评估卡氏功能状态量表(KPS),行相关生活质量量表调查,并观察相关并发症及统计营养支持费用。结果 在白蛋白、前白蛋白及KPS评分改善方面,肠内营养组较肠外营养组的效果更好,且费用更低,可以更有效地改善患者的生活质量(P<0.05);但二者在并发症方面差异无统计意义(P>0.05)。结论 在恶性肿瘤恶病质的患者中,使用肠内营养TPF比肠外营养更有效地改善恶性肿瘤恶病质患者的营养状况及生活质量,且医疗费用更少,可以取得显著的治疗效益。
【关键词】 恶性肿瘤恶病质; 能全力; 肠内营养; 肠外营养; 治疗效果
The therapeutic effect of different nutritional support in patients with cancer cachexiaXiao Jiandong. The Affiliated People's Hosptial of Fujian University of Traditional Chinese Medicine,Fuzhou,Fujian 350000
【Abstract】 Objective To investigate the therapeutic effect of different nutritional support in patients with cancer cachexia. Methods 60 patients with cancer cachexia were randomly divided into group A (30 cases): enteral nutrition, group B (30 cases): parenteral nutrition, measure nutrition, weight, lean weight, functional status (KPS), and observe related complications and statistical nutritional support costs. Results In terms of albumin, prealbumin and KPS improvement, enteral nutrition group has better effect than parenteral nutrition group with lower cost, which can more effectively improve the quality of life of patients (P<0.05),but no significant difference in complications (P>0.05). Conclusion In patients with cancer cachexia, using enteral nutrition can fully improve the nutrition status and quality of life of patients with cancer cachexia more effectively,and have less medical costs,which can achieve significant treatment benefits.
【Key Words】 Cancer cachexia; Nutrison fibre; Enteral nutrition; Parenteral nutrition; Treatment effect
中图分类号:R730.5 文献标识码:A 文章编号:1672-1721(2023)25-0020-03
DOI:10.19435/j.1672-1721.2023.25.007
恶性肿瘤恶病质是与恶性肿瘤相关的营养不良性疾病[1],是一种代谢紊乱综合征,包括蛋白质、碳水化合物、脂质的代谢异常、胰岛素抵抗、厌食症、肌肉蛋白的持续消耗等。常常发生在各种恶性肿瘤终末期[2-3],一般患者表现为消瘦、体质量减轻、厌食、肌肉萎缩、疲劳、低蛋白血症、功能障碍等。因恶病质死亡的恶性肿瘤患者高达30%~50%[4-5]。恶性肿瘤恶病质不仅导致患者化放疗疗效不佳,增加手术并发症的发生,增加患者及其家属的经济、心理压力,而且使患者生活质量下降,生存期缩短。因此,采取对恶性肿瘤恶病质的有效干预措施对于晚期恶性肿瘤患者的长期生存具有深远意义。
本研究拟对恶性肿瘤恶病质的患者实行肠内及肠外营养支持,观察各组的治疗效果,为提升恶性肿瘤恶病质治疗效果提供经验。
1 资料与方法
1.1 病例选择与分组 恶性肿瘤恶病质病例纳入标准:入院时相关检查及病理已明确诊断恶性肿瘤;入组前2周内均未使用白蛋白和(或)免疫增强剂,入组前1周无相关手术及放化疗;营养风险筛查2002评分3~6分;胃肠道消化吸收功能基本正常,无消化道梗阻;入选时测定空腹血糖、血压、体质量、瘦体质量、体质量指数(body mass index,BMI)、肝肾功能、电解质;无意识的体质量下降达到诊断前6个月体质量或理想体质量的5%以上且临床检查与恶病质症状相一致[1];伴或不伴异常的炎症细胞因子水平;生命预期超过4个月,可以接受伴随的抗肿瘤的放化学治疗或者相关的姑息支持治疗。排除标准:精神疾病史、语言障碍,意识不清及阿尔茨海默病;不愿参与;合并严重心、肝、肺、肾疾病等;免疫力低下或者免疫力缺陷;消化道机械性梗阻。
根据上述病例纳入及排除标准,将2019年9月—2021年9月福建中医药大学附属人民医院普外科收治的60例恶性肿瘤恶病质患者纳入本研究,按随机数字表法(由随机软件NDST提取)将患者分为2组,A组为肠内营养组(30例),B组为肠外营养组(30例)。其中A组患者男性19例,女性11例;年龄36~83岁,平均年龄(56.9±8.9)岁;平均体质量(50.51±6.92) kg;其中胰腺癌7例,胆管癌5例,胆囊癌2例,乳腺癌3例,胃癌4例,结直肠癌4例,肝癌5例。B组男性17例,女性13例,年龄38~80岁,平均年龄(51.3±11.2)岁,平均体质量(49.16±9.23)kg,其中胰腺癌6例,胆管癌4例,胆囊癌1例,乳腺癌3例,胃癌6例,结直肠癌5例,肝癌5例。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。该研究得到福建中医药大学附属人民医院医学伦理管理委员会批准,入选病例均对研究的内容能够正确理解,并且知情同意,自愿参加并积极配合。
1.2 研究方法 A组患者在胃镜下将鼻肠管(复尔凯螺旋型鼻肠管,纽迪希亚制药)送至空肠上段。选用肠内营养液百普力(纽迪希亚制药,国药准字H20030011),根据患者具体情况,以125.58 kJ·kg/d的能量标准配置百普力,由鼻肠管注入,并由输注泵控制速度,一般在16~21 h内匀速注入。第1天补充总能量的50%,于第1天上午将0.9%氯化钠注射液300 mL经鼻肠管营养滴入,下午滴入TPF 500 mL,滴速50~60 mL/h;第2~14天予以TPF 2 000 mL,滴速90~100 mL/h。第1天A组能量不足部分由静脉输液补充。B组患者在行营养支持前先行中心静脉置管术,根据患者情况,按125.58 kJ·kg/d计算患者所需热量,将葡萄糖、电解质、氨基酸、微量元素、脂肪乳、胰岛素、维生素等按照一定比例配制,给予完全肠外营养支持。2组每天行等能量支持,持续14 d。试验期间各组其他处理条件无明显差异。
1.3 观察指标 (1)2组患者于营养支持前第1天和营养支持后第14天进行血常规及生化检测,分别监测白蛋白(albumin,ALB)、前白蛋白(prealbumin,PAB)、三酰甘油(triglycerides,TG)水平數值。(2)观察2组患者试验过程中的相关并发症发生情况,包括恶心、呕吐、腹泻、电解质紊乱、发热、血糖异常等。(3)测量2组患者营养支持前1天和营养支持后第14天的体质量、瘦体质量的变化。2项检测时均要求患者着单衣,排空大小便;采用生物电阻抗法Bodystat QuadScan4000人体成份测量仪检测瘦体质量。(4)统计2组患者营养支持的总费用。营养支持费用只是针对其中提供营养支持部分的费用。(5)监测2组患者营养支持前1天和营养支持后第14天的日常生活活动情况。使用Karnofsky功能状态评分标准(Karnofsky performance status,KPS),由主管医生根据患者的功能状态给予0~100分范围的评定。(6)评测2组患者的生活质量(quality of life,QOL)。采用欧洲癌症研究与治疗组织生命质量核心量表(The European Organiza-
tion for Reasearch Treatment of Cencer core quality of life questionnaire,EORTC QLQ-C30)评估。此量表已被广泛应用于恶性肿瘤患者生活质量调查[6],具有临床效度和实用性较好的特点。健康、功能和症状领域标准均为0~100分。其中症状领域得分越高,生活质量越差;健康、功能领域得分越高,生活质量越好。患者于营养支持前1 天、营养支持后第14天填写此量表。采用统一指导语,先向患者做必要解释,取得患者同意,并请患者根据近期各自的实际情况进行填写,完成问卷调查内容,问卷完成后统一收回。
1.4 统计学方法 使用SPSS 25.0统计学软件进行数据分析,计量资料以x±s表示,2组间比较采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
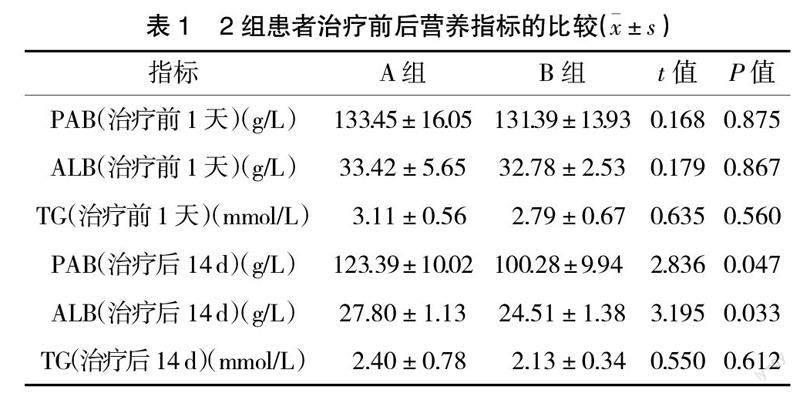
2.1 2组患者治疗前1天、治疗后第14天的PAB、ALB、TG的比较 A组在治疗14 d后,白蛋白及前白蛋白水平明显好于B组(P<0.05),见表1。
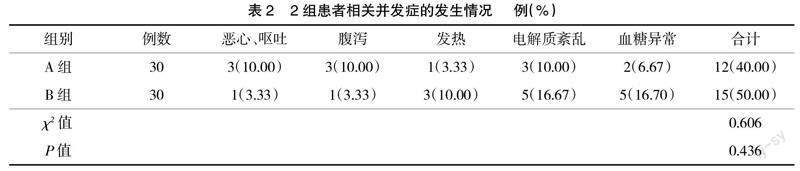
2.2 2组患者相关并发症发生情况比较 2组患者并发症发生率比较,差异无统计学意义(P>0.05);
给予相关对症治疗后,症状均能得到控制,见表2。
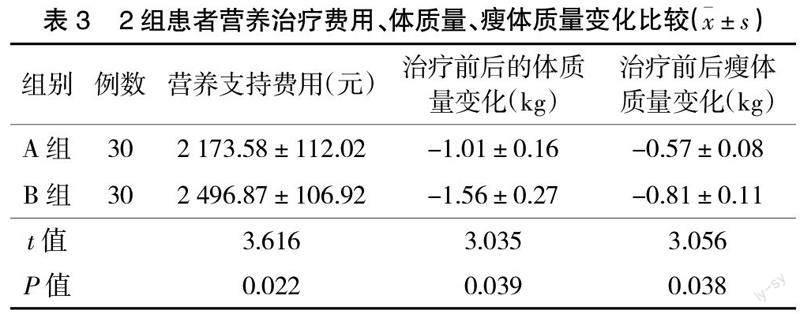
2.3 2组患者营养支持费用、体质量及瘦体质量变化比较 在体质量及瘦体质量的变化方面,A组减少程度少于B组;A组比B组有着更低的费用(P<0.05),见表3。
2.4 2组患者治疗前1天、治疗后第14天的KPS评分的比较 A组在治疗14 d后,KPS评分明显高于B组(P<0.05);B组治疗后KPS评分较治疗前明显下降(P<0.05),见表4。
2.5 2组患者治疗前1天、治疗后第14天QOL评分比较 A组在治疗14 d后相比于B组,可以明显改善患者的生活质量(P<0.05),见表5。
3 讨论
据有关资料显示,恶性肿瘤患者是营养不良的高发人群,发生率为40%~80%[7]。伴有营养不良的恶性肿瘤患者在进行肿瘤手术、化放疗等各种抗癌治疗时,其并发症和病死率均明显增加,导致治疗效果欠佳,恶性肿瘤恶病质是影响患者治疗效果的重要因素。目前,尚无有效的治疗方法可以逆转恶性肿瘤恶病质,但是通过对分子代谢的深入研究,发现在恶性肿瘤持续存在的情况下,阻断恶性肿瘤恶病质的发展,提高患者生活质量,延长患者生存期是有可能实现的。
恶性肿瘤恶病质的患者大多厌食,可能是恶性肿瘤本身、炎症因子、手术及化放疗不良反应、焦虑心理等各种因素交互影响导致[8];恶性肿瘤恶病质由于存在食物摄入减少及蛋白质、脂质、碳水化合物的代谢异常,导致蛋白质及能量的负平衡[9]。厌食是恶性肿瘤患者营养不良及恶病质状态发展的一个重要因素,恶病质状态下的患者往往难以通过口服补充足够的能量。因此本研究分别采用肠内营养、肠外营养治疗恶病质患者,为恶病质患者的营养支持提供治疗经验。
目前临床上对恶性肿瘤恶病质治疗尚无有效的方法,主要的干预措施包括营养支持、药物干预、体力锻炼、心理社会干预等[10]。本研究通过对恶性肿瘤恶病质患者实行肠内或肠外营养支持,观察各组的治疗效果,发现肠内营养组在治疗14 d后,白蛋白及前白蛋白水平明显优于肠外营养组(P<0.05),体质量及瘦体质量的变化方面,肠内营养组减少程度少于肠外营养组(P<0.05);在KPS、QOL评分方面,经过14 d治疗后肠内营养组评分较肠外营养组更优(P<0.05);肠内营养组比肠外营养组有着更低的费用(P<0.05),但二者在并发症方面差异无统计学意义(P>0.05)。本研究发现,采用TPF通过消化道的吸收方式,使用患者功能尚存的胃肠道,以维持胃肠道的结构和生理功能,更符合患者生理特点[11]。恶病质营养干预的最终目标是逆转患者体质量减轻和肌肉丢失趋势,但是本研究发现无论肠内营养或者肠外营养支持,只是促进能量摄入,并没有从根本改变恶性肿瘤恶病质的代谢异常,无法完全阻止恶性肿瘤恶病质患者的体质量减轻,欣慰的是适当地促进营养摄入仍可延续患者KPS及生活质量下降,并给患者及其家属带来心理安慰。本研究发现针对这部分恶性肿瘤恶病质患者的营养治疗应以肠内营养优先,辅予肠外营养;治疗应该主要减轻恶病质的相关症状、提高患者的生存质量。
综上所述,使用肠内营养TPF支持比肠外营养支持可以更有效地延缓恶性肿瘤恶病质的营养状况及生活质量下降,且相比肠外营养花费明显更少的费用,取得显著的治疗效益;最终可使患者机体能够更好地耐受化放疗、手术或者其他治疗手段,为根治肿瘤创造机会,提高患者的生存质量和生存率。
参考文献
[1] 中国抗癌协会肿瘤营养专业委员会,吉林大学第一医院,第三军医大学大坪医院,等.肿瘤恶液质临床诊断与治疗指南(2020版)[J].中国肿瘤临床,2021,48(8):379-385.
[2] TEUNISSEN S C,WESKE R W,KRUITWAGEN C,et al.Symptom prevalence in patients with incurable cancer:a sys-tematic review[J].J Pain Symptom Manage,2007,34(1):94-104.
[3] 孙延东,张波,韩寓嵩,等.消化系统恶性肿瘤患者的恶病质患病率调查及其对临床结局的影响[J].中华胃肠外科杂志,2014,17(10):968-971.
[4] PETERSON S J,MOZER M.Differentiating sarcopenia and cachexia among patients with cancer[J].Nutr Clin Pract,2017,32(1):30-39.
[5] 李玲,马桂霞,司壮丽,等.营养支持治疗联合抗阻运动改善肿瘤恶病质症候群患者生活质量的临床效果研究[J].中国全科医学,2019,22(3):319-323.
[6] 王建平,陈仲庚,林文娟,等.中国癌症病人生活质量的测定:EORTC QLQ-C30在中国的试用[J].心理學报,2000,32(4):438-442.
[7] LEE J L C,LEONG L P,LIM S L.Nutrition intervention approaches to reduce malnutrition in oncology patients:a sys-tematic review[J].Support Care Cancer,2016,24(1):469-480.
[8] 王睿晴,张艳华.胃肠道肿瘤患者与营养支持治疗的相关性研究进展[J].中国药物评价,2018,35(1):43-47.
[9] 崔文霞,黄明敏,郭爱斌,等.癌症与营养[J].实用老年医学,2017,31(4):415-418.
[10] NISHIKAWA H,GOTO M,FUKUNISHI S,et al.Cancer cachexia:its mechanism and clinical significance[J].Int J MolSci,2021,22(16),8491.
[11] 刘斌,宾文凯,陈小梅,等.肠内营养与肠外营养对危重症临床疗效的Meta分析[J].肠外与肠内营养,2017,24(5):277-282.
(收稿日期:2023-06-08)

