基于网络药理学与分子对接探究黄芩有效成分对酒精性肝病的作用机制及效果验证
叶敬榕,刘 瑞,程 成,张凤英,杨 雪*
1承德医学院中药研究所 河北省中药研究与开发重点实验室,承德 067000;2云南中医药大学第一附属医院,昆明 650021;3承德医学院基础医学院,承德 067000
酒精性肝病(alcoholic liver diseases,ALD)拥有着广泛的临床组织学谱系,既包括初期的单纯肝细胞脂肪变性,还包括中、后期的酒精性肝炎、肝纤维化、酒精性肝硬化[1]。当前对于ALD的最佳防治手段仍是戒酒,临床用药皮质类固醇也只能适当缓解部分症状,提供短期生存获益,目前临床仍无相对应的特效药[2]。根据ALD的病因、病机及临床表现,中医将ALD分为:湿热内蕴的“酒痞”前期,气滞血瘀的“酒癖”中期和正气亏虚的“酒臌”后期[3]。处在不同时期其治法也不尽相同,前期主要是疏肝解郁、清热除湿,中期主要是活血化瘀,后期主要是健脾、滋补肝肾[4]。
黄芩(Scutellaria Radix)为唇形科植物黄芩的干燥根,隶属于清热类中药,具有清热燥湿、泻火解毒、止血、安胎的功效,可以较好地应用于ALD前、中期的治疗。同时结合相关黄芩保肝研究可发现,黄芩及其有效成分可通过抑制机体氧化应激反应、抑制炎症因子浸润、减少肝细胞凋亡和调节脂质代谢等对肝细胞起到保护作用、降低肝脏病理损伤程度[5]。但针对黄芩防治ALD的药效物质基础、作用途径及机制尚未明确。本研究采用了网络药理学、分子对接技术和体外细胞实验,初步探究黄芩防治ALD的活性成分以及相应的作用途径,以期为黄芩及其有效成分在防治ALD方面的深入研究、新药开发和临床应用提供参考[6]。
1 材料与方法
1.1 药物与试剂
BRL 3A大鼠肝细胞、BRL 3A细胞专用培养基、胎牛血清(批号分别为:20220608、SA210518,武汉普诺赛);MEM培养基(批号为:8122489,Gibco有限公司);PBS缓冲液(pH7.2~7.4,0.01 mol/L)、胰蛋白酶-EDTA消化液(0.25%)、DMSO培养基、青链霉素混合液(批号分别为:20220723、20220928、710N0317、20220930,Solarbio有限公司);山姜素(CAS号:36052-37-6,纯度≥98%)、药用级无水乙醇(批号分别为:G2226023、B2225811,上海阿拉丁试剂有限公司);0.9%氯化钠溶液(批号为:2105242004,Bebolabs有限公司);CCK-8溶液(批号为:K10182833EF5E,APExBIO有限公司);乳酸脱氢酶(lactate dehydrogenase,LDH)、谷草转氨酶(aspartate transaminase,AST)、谷丙转氨酶(cerealthirdtransaminase,ALT)、总超氧化物歧化酶(superoxide dismutase,SOD)、细胞丙二醛(malondialdehyde,MDA)、蛋白定量(total protein,TP)等试剂盒(批号分别为:20220917、20220930、20220930、20221018、20220825、20221101,南京建成有限公司)。
1.2 黄芩治疗酒精性肝病网络药理学研究
1.2.1 黄芩有效成分检索及化合物靶点筛选
利用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP),以“黄芩”为关键词检索其含有的主要化学成分。传统中药主要采用口服形式,加以胃肠消化吸收、血液循环代谢而发挥作用。故需要对检索获得的化合物进行吸收、分布、代谢和排泄(absorption,distribution,metabolism,excretion,ADME)性质筛选。即以口服生物利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为标准,初步筛选出具有较高活性的化合物。再将获得的化合物分别导入PubChem数据库下载化合物2D Structure的SDF图,并导入SwissADME数据库,以胃肠道吸收度(GI absortion)为“High”、满足类药性五原则预测(Lipinski,Ghose,Veber,Egan,Muegge)结果中有2个及2个以上为“Yes”再次筛选,将最终的结果导出并编号。
药物主要是以所含化合物与相应的靶点结合的形式来发挥药效的,所以需要进一步整理化合物的作用靶点。将筛选得到的化合物2D Structure SDF图导入Swiss Target Prediction数据库中检索相对应的作用靶点,收集靶点信息并进行整理,构建出药物-化合物-靶点数据库。
1.2.2 酒精性肝病相关疾病靶点收集
利用GeneCards、OMIM、DisGeNET、Therapeutic Target Database(TTD)和PharmGKB人类基因综合数据库,以“alcoholic liver disease”为关键词检索相关疾病基因,收集、整理、去重后即为所需要的相关ALD作用靶点。
1.2.3 黄芩药物靶点与酒精性肝病疾病靶点映射
利用在线网站Venny 2.1.0平台,输入黄芩有效化合物作用靶点与ALD疾病靶点,取二者的交集,即为药物-疾病共同作用的关键靶基因。绘制相应的Venn图,导出交集结果。
1.2.4 构建靶点蛋白互作网络
利用String数据库,在选择Multiple proteins后,导入黄芩和ALD共有的靶基因,物种选择“Homo sapiens”,构建蛋白-蛋白相互作用网络(PPI),将最低互相作用阈值调为“highest confidence(0.900)”,重新获得蛋白互作信息图,并导出相应的TSV文件。利用Cytoscape 3.8.0软件和TSV文件绘制优化后的PPI网络图,并利用Network Analysis对网络进行拓扑性质分析,以度值(Degree)进行排序,筛选出关键核心靶点,同时使结果可视化输出。
1.2.5 靶点生物学功能分析
采用在线基因功能分析数据库Metascape对PPI网络中的核心靶点进行京都基因与基因组百科全书(KEGG)信号通路富集分析,通过“All in One Zip File”键下载当前所有文件,即可得到所涉及的主要治疗ALD信号通路;同时分别对生物学过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)进行基因本位(GO)生物过程富集分析,同样通过“All in One Zip File”键下载当前所有文件,即可得到药物有效成分所对应靶点治疗ALD的生物过程,两者均以P<0.01为差异具有统计学意义。并利用在线工具微生信将结果可视化输出。
1.2.6 构建“有效成分-靶点-通路”互相作用网络
选取KEGG富集获得的前20条信号通路,利用Cytoscape 3.8.0软件构建“有效成分-靶点-通路”相互作用网络。网络图中的节点(node)分别代表有效成分、靶点和通路。边(edge)的连接代表有效成分与靶点、靶点与通路或靶点与有效成分之间的相互作用关系。同样采用Cytoscape的插件Network Analysis对网络进行拓扑性质分析,根据度值(degree)进行排序对网络进行编排,以获得可表征成分、靶点与通路关系的网络图。
1.3 靶点蛋白与黄芩有效化学成分分子对接
根据Yang所提出的生物大分子三维结构合理选择六项原则[7],利用RSCB PBD数据库下载“1.2.6”度值前五所对应的受体蛋白并进行均方根偏差(root-mean-square deviation,RMSD)验证。同时利用Chem3D 20.0软件将“1.2.6”筛选得到的高于平均度值的有效成分进行结合能最小化处理。再通过Discovery Studio 2019软件将受体蛋白与筛选得到的黄芩活性成分进行分子对接研究,采用Dock Ligands(Lib Dock)对接模块进行分子对接分析,当配体分子与受体蛋白的结合自由能小于-4.25 kacl/mol则表示具有一定活性,小于-5.0 kacl/mol表示有较好结合活性,而小于-7.0 kacl/mol则可推测其具有强烈结合活性[8]。当结合自由能为正数时,表明键合不能自发形成[9],将最终对接结果可视化输出。
1.4 黄芩治疗酒精性肝病的细胞实验
1.4.1 BRL 3A细胞培养及干预
使用BRL 3A细胞专用完全培养基,将细胞养于37 ℃、5% CO2培养箱中,观察细胞密度达到80%~90%左右后,进行传代,并用于后续实验。使用CCK-8与乳酸脱氢酶试剂盒检测不同时间下,不同浓度的无水乙醇对BRL 3A细胞的损伤程度,再给予不同浓度的山姜素(20、40、60 μg/mL)进行干预,同时分别使用生理盐水和多烯磷脂酰胆碱(polyene phosphatidyl choline,PPC)建立空白对照组和阳性对照组。收集干预后的细胞与上清液用于试剂盒测定。
1.4.2 相关试剂盒检测山姜素对BRL 3A细胞增殖的影响
收集干预后的细胞与上清液后,根据谷草转氨酶(AST/GOT)、谷丙转氨酶(ALT/GPT)、总超氧化物歧化酶(SOD)、细胞丙二醛(MDA)、蛋白定量(TP)等试剂盒的说明书进行操作测定。
1.5 数据分析与制图
数据结果采用SPSS 23.0软件(IBM公司,NY,USA)单因素方差分析。图表采用WPS office(北京金山办公软件股份有限公司)绘制,图中不同的字母表示不同方式处理下的显著性(P<0.05,n=3)。
2 结果
2.1 黄芩治疗酒精性肝病网络药理学研究结果
2.1.1 黄芩有效成分收集、筛选及化合物作用靶点分析
利用TCMSP收集到黄芩的有效成分化合物共143个,以按照OB≥ 30%、DL≥ 0.18作为条件筛选后,得到活性较高的化合物36个。将获得的化合物再次导入SwissADME数据库筛选,共获得黄芩高活性化合物27个,结果见表1。
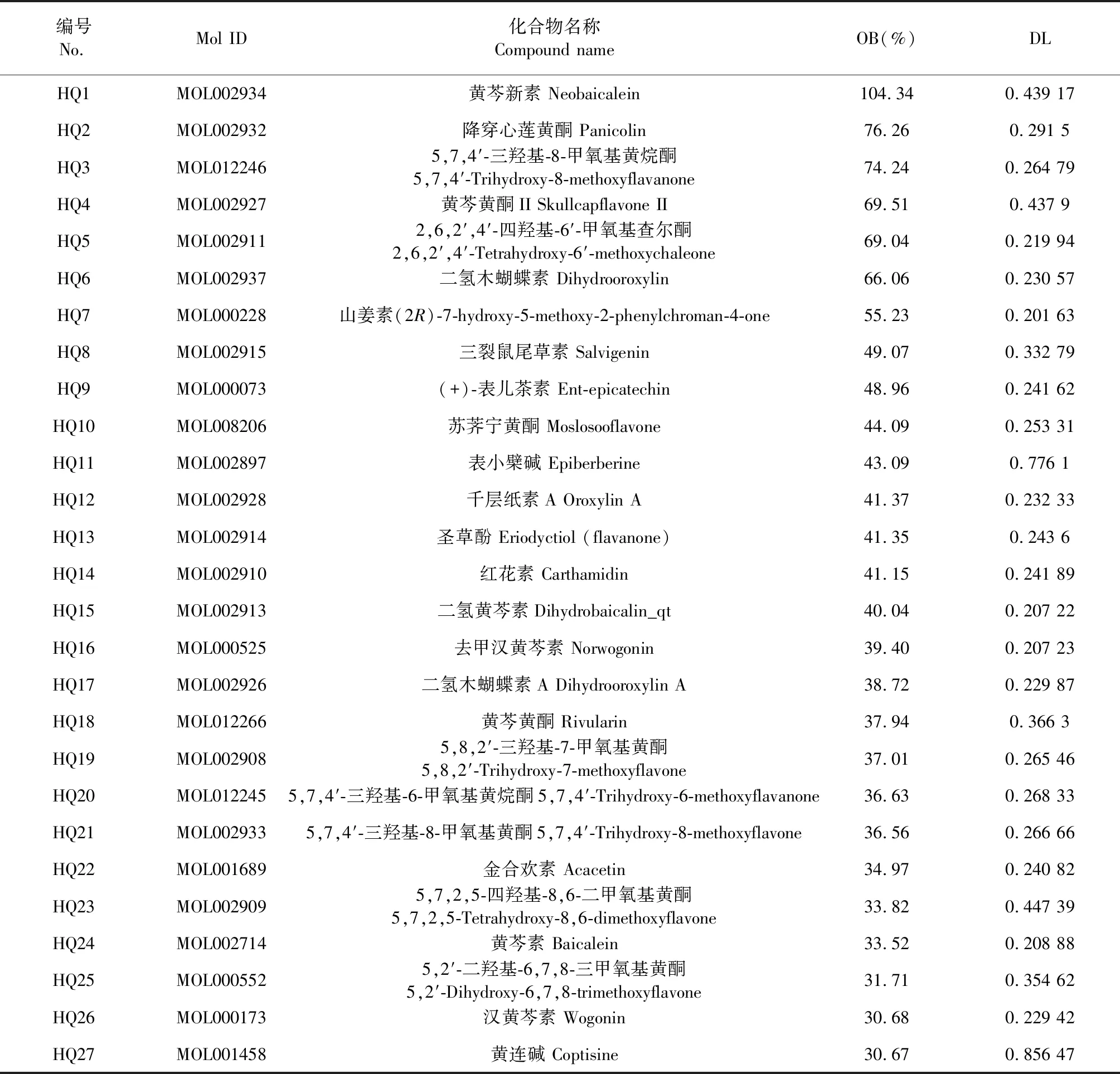
表1 黄芩高活性的27种化合物
将黄芩有效成分2D Structure的SDF图导入Swiss Target Prediction数据库中检索出相对应的作用靶点,将收集到的靶点信息按Probability值从大到小排序,选取前100个且同时满足Probability>0.1。黄芩化合物作用靶点信息经过整理、去重后,结果共获得289个有效靶点信息。其中黄芩有效成分HQ9(ent-Epicatechin)在Swiss Target Prediction数据库中无法预测到相应靶点。
2.1.2 酒精性肝病相关疾病靶点收集结果
通过以“alcoholic liver disease”为关键词,在五个人类基因综合数据库中检索相关疾病基因靶点。并将收集到的基因靶点信息进行筛选、去重,其结果为GeneCards数据库收集到8 020条有效信息、OMIM数据库收集到200条有效信息、DisGeNET数据库收集到195条有效信息、Therapeutic Target Database(TTD)数据库收集到7条有效信息、PharmGKB数据库收集到2条有效信息。将五个数据库的结果汇总后去重,共获得8 131条有效信息。
2.1.3 黄芩药物靶点与酒精性肝病疾病靶点映射结果
将黄芩有效化合物作用靶点信息与ALD疾病靶点信息输入在线Venny 2.1.0平台取交集后,共获得257个交集靶点(见图1)。

图1 黄芩有效化合物与酒精性肝病基因映射Venn图Fig.1 Venn diagram of effective compounds of Scutellaria Radix and ALD
2.1.4 构建靶点蛋白互作网络结果
将黄芩治疗ALD的257个交集靶点重新绘制PPI网络图,在删除掉八个游离蛋白节点后,其结果见图2。由图2可知,该网络包含了190个节点、1370条边。其中黄芩治疗ALD的关键核心靶点有SRC、AKT1、PIK3R1、STAT3、PIK3CA、MAPK3等。
2.1.5 靶点生物学功能分析结果
在进行KEGG信号通路富集分析后,共获得190条相关通路。将通路按P值从小到大排序并选取前20条作可视化输出,其结果见图3。由图可知,黄芩治疗ALD的主要信号通路包括癌症的途径(pathways in cancer)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、脂质与动脉粥样硬化(lipid and atherosclerosis)、化学致癌-活性氧物种(chemical carcinogenesis-reactive oxygen species)、前列腺癌(prostate cancer)等。ALD的临床病理变化主要是:由前期的肝损伤、肝炎逐步演化为中后期的肝硬化、肝癌[10]。而通过KEGG的富集分析可以推断黄芩治疗ALD可能主要是通过减轻肝炎症和抑制肝癌变。
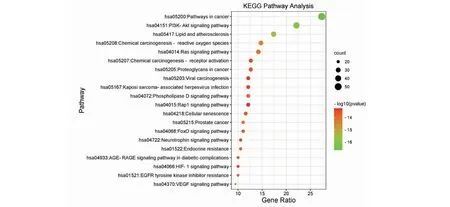
图3 黄芩治疗酒精性肝病的KEGG信号通路富集分析Fig.3 Enrichment analysis of KEGG signal pathway of Scutellaria Radix in the treatment ofALD
在进行基因本位(GO)生物过程富集分析后,BP共获得1 884条结果、CC共获得117条结果和MF共获得209条结果。将各自结果按P值从小到大排序并选取前10条作可视化输出,其结果见图4。由图可知,在BP中可能主要与蛋白质磷酸化(protein phosphorylation)、细胞对氮化合物的反应(cellular response to nitrogen compound)、转移酶活性的正调节(positive regulation of transferase activity)有关;在CC中可能主要与转移酶复合物、转移含磷基团(transferase complex,transferring phosphorus-containing groups)、蛋白激酶复合物(protein kinase complex)、膜筏(membrane raft)有关;在MF中可能主要与磷酸转移酶活性、乙醇组作为受体(phosphotransferase activity,alcohol group as acceptor)、蛋白激酶活性(protein kinase activity)、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)有关。
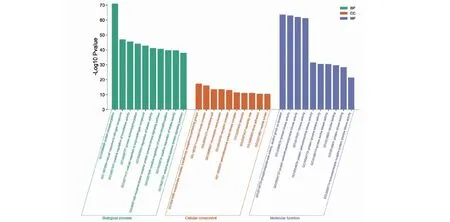
图4 黄芩治疗酒精性肝病的GO富集分析Fig.4 GO enrichment analysis of Scutellaria Radix in the treatment ofALD
2.1.6 “有效成分-靶点-通路”互相作用网络分析
选取KEGG所富集获得的前20条信号通路,利用Cytoscape 3.8.0软件构建“有效成分-靶点-通路”相互作用网络,其结果见图5。由图可知,本网络图中共有165个节点、1 117条边,其中黄芩有效成分27个节点、靶点118个节点、通路20个节点。通过对度值排序后发现,黄芩有效成分的平均度值为22.81,有13个有效成分的度值高于平均度值,其中黄芩治疗ALD度值前5的有效成分分别为山姜素(HQ7)、降穿心莲黄酮(HQ2)、5,7,2,5-四羟基-8,6-二甲氧基黄酮(HQ23)、黄芩素(HQ24)、去甲汉黄芩素(HQ16);靶点的平均度值为9.47,有49个靶点的度值高于平均度值,其中靶点度值前5的有CDK1、EGFR、PIK3R1、CYP1B1、ESR2;通路的平均度值为25.05,有5个通路的度值高于平均度值,度值前5的通路即为图3中基因占比靠前的五条。该实验结果再次验证了黄芩治疗ALD呈现出中药治疗所特有的多成分、多靶点、多途径的特点。
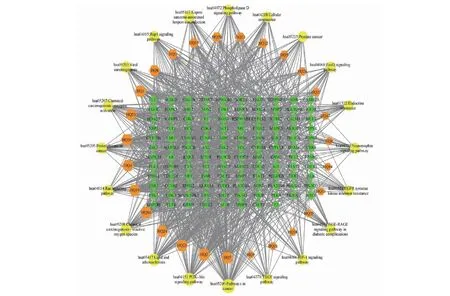
图5 黄芩治疗酒精性肝病的“有效成分-靶点-通路”互作网络图Fig.5 "Effective component-target-pathway" interaction network diagram of Scutellaria Radix in the treatment of ALD注:黄色圆形为通路,橙色正六边形为有效成分,绿色菱形为靶点。Note:The yellow circle is the pathway;The orange regular hexagon is the active ingredient;The green diamond is the target.
2.2 靶点蛋白与黄芩有效化学成分分子对接结果
为了更加全面探究黄芩有效成分是如何对ALD前20条通路关键靶点起到影响的,将筛选过后的13个高于有效成分平均度值的有效成分与度值前5的靶点进行分子对接。5个靶蛋白原始晶体结构的配体构象与对接后的配体构象出现叠合,且对接后5个复合物的最小RMSD值分别为:0.050 4、0.090 9、0.078 7、0.129 9、0.028 0 nm,说明对接方法和参数设置合理可行。本次对接中,结合自由能小于-4.25 kacl/mol有26个,小于-5.0 kacl/mol有24个,小于-7.0 kacl/mol有21个,其具体结果见图6。
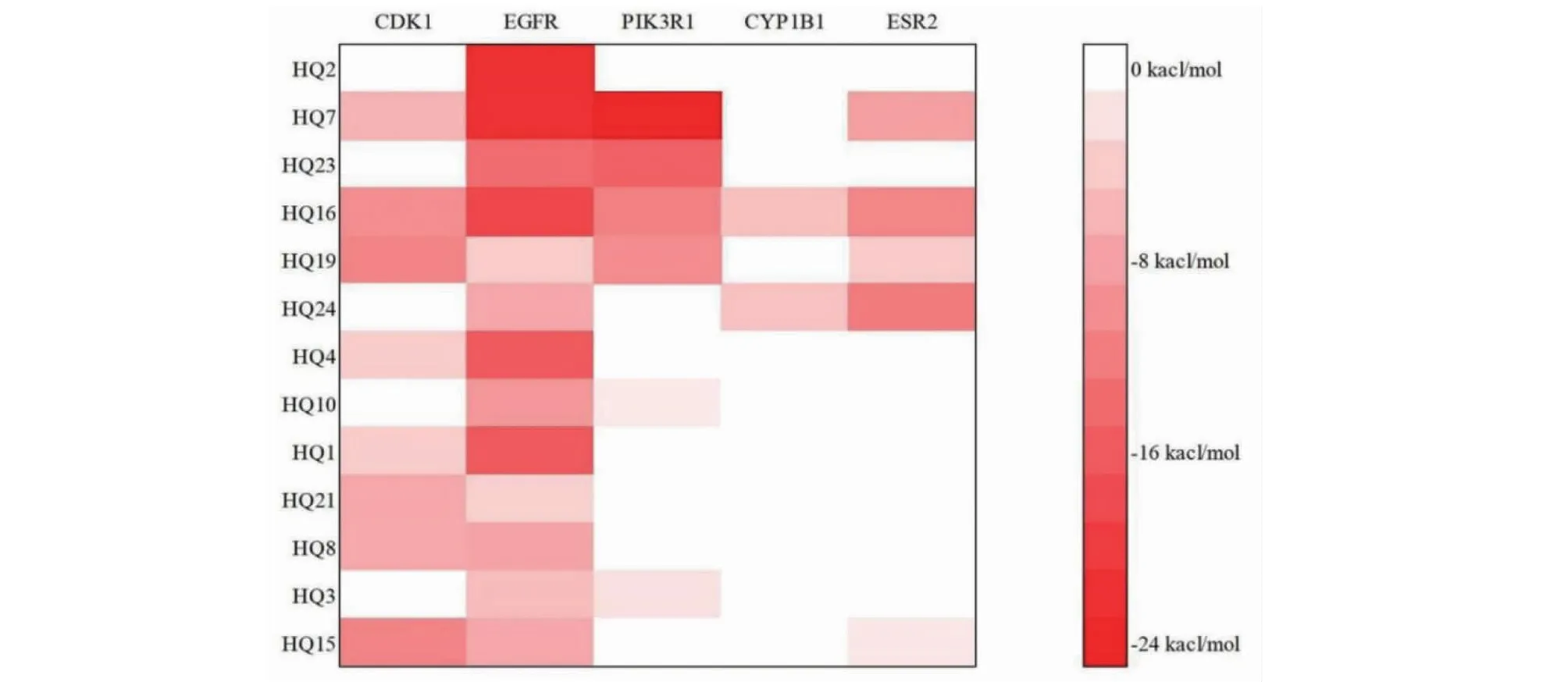
图6 黄芩治疗酒精性肝病分子对接结合自由能热图Fig.6 Molecular docking binding free energy thermogram of Scutellaria Radix in the treatment of ALD注:图中水平方向代表靶点,垂直方向代表成分编号(具体成分信息见表1),两者交汇处颜色越深代表结合能越小。Note:The horizontal direction in the figure represents the target point,and the vertical direction represents the composition number (specific ingredient information is shown in Table 1).The darker the color of the intersection of the two,the smaller the binding energy.
通过进一步对比热图结果可以发现,HQ7与PIK3R1对接最强,其结合自由能为-23.769 5 kacl/mol,主要依赖π-烷基作用与π-阳离子作用进行结合;HQ2与EGFR对接次之,其结合自由能为-21.287 4 kacl/mol,主要依赖氢键互相作用与π-π共轭作用进行结合;HQ7与EGFR对接排第三,其结合自由能为-21.233 1 kacl/mol,其主要依赖氢键互相作用与π-孤对作用进行结合,各对接结果见图7。
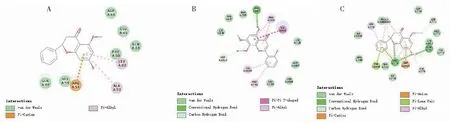
图7 黄芩治疗酒精性肝病分子对接2D图Fig.7 2Ddiagram of molecular docking of Scutellaria Radix in treating ALD注:A:HQ7-PIK3R1;B:HQ2-EGFR;C:HQ7-EGFR。
2.3 山姜素治疗酒精性肝病的细胞实验结果
通过对酒精性肝损伤的大鼠肝细胞给予不同浓度的山姜素治疗后,再利用CCK-8溶液与乳酸脱氢酶(LDH)试剂盒测定其存活率与乳酸脱氢酶释放量。由图8A、8B可知,低、中、高浓度的山姜素均可以对肝损伤细胞起到治疗效果,其细胞存活率较模型组分别提高15.71%、19.72%、22.59%,同时随着山姜素给药浓度的提高乳酸脱氢酶释放量出现显著降低(P<0.05)。
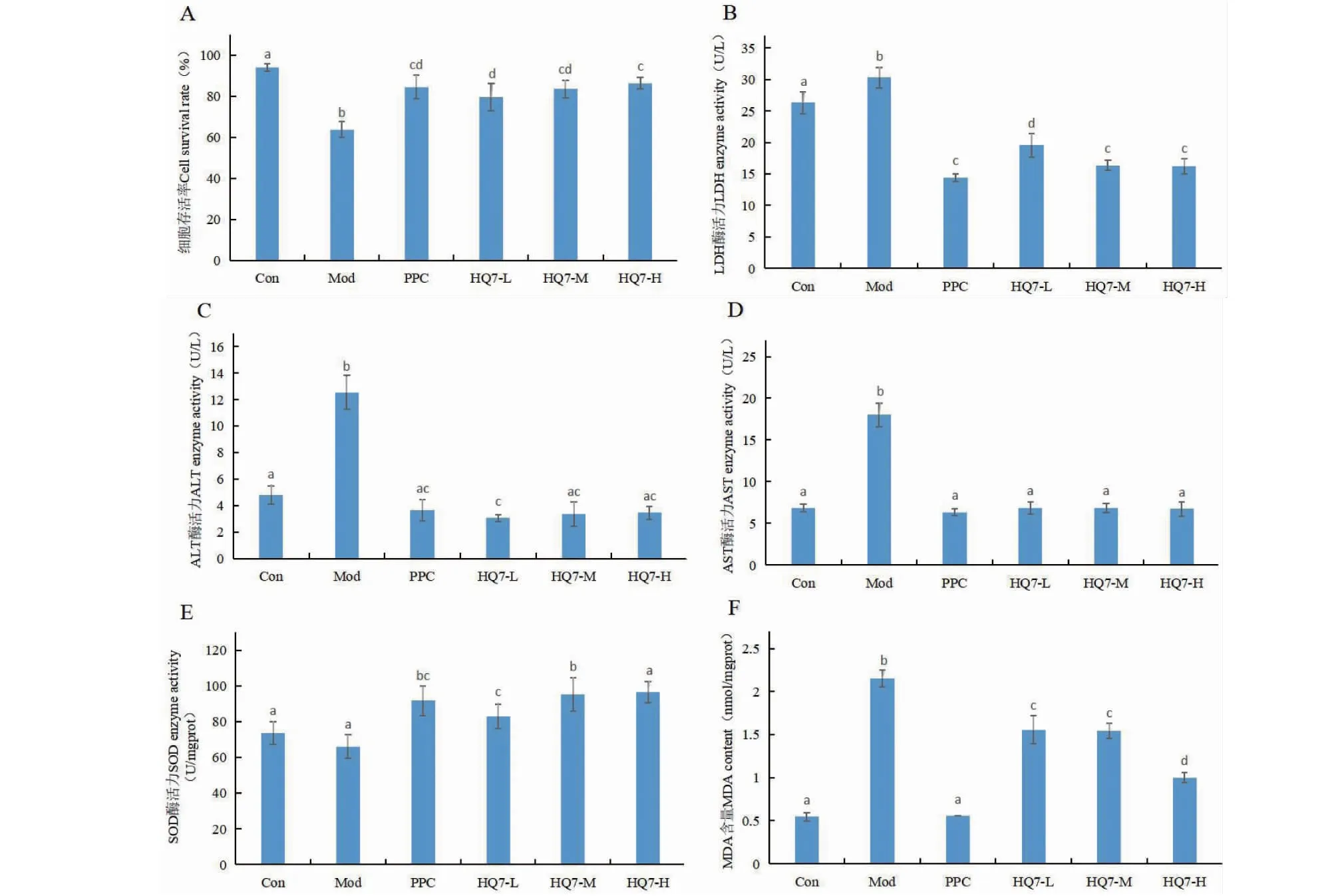
图8 山姜素治疗酒精性肝病的细胞生化指标结果(¯x ± s,n = 3)Fig.8 Results of cell biochemical indexes ofalpinetin in the treatment of ALD(¯x ± s,n = 3)注:Con:空白对照组;Mod:模型组;PPC:多烯磷脂酰胆碱组(阳性对照);HQ7-L:山姜素低剂量组(20 μg/mL);HQ7-M:山姜素中剂量组(40 μg/mL);HQ7-H:山姜素高剂量组(60 μg/mL)。不同的字母表示不同方式处理下的差异有显著性(P<0.05)。Note:Con:Control group;Mod:Model group;PPC:Polyene phosphatidyl choline group (positive control);HQ7-L:Low dose group of alpinetin (20 μg/mL);HQ7-M:Medium dose group of alpinetin (40 μg/mL);HQ7-H:high dose group of alpinetin (60 μg/mL).Different letters indicate significance under different treatment methods (P<0.05).
由图8C、8D可知,在给予山姜素后,肝损伤细胞的ALT、AST指标均呈现改善趋势,且可以恢复到与正常细胞状态一致(P>0.05)。山姜素所起到的治疗效果受给药剂量的影响不大,对比低、中、高剂量组其治疗效果显著性不高(P>0.05),提示低剂量的山姜素亦可以带来较好的治疗效果。
由图8E、8F可知,山姜素可以有效提高已损伤细胞的SOD酶活力(P<0.05),从而积极改善细胞的过氧化状态,抑制肝炎症的发生。对比MDA的结果可以发现,山姜素可以随着给药剂量的增加而逐步降低MDA的含量(P<0.05)。总体而言,阳性药物对细胞MAD的改善作用优于山姜素。
3 讨论与结论
在我国乙型肝炎、丙型肝炎的防治持续取得良好效果的基础上,再加之经济蒸腾发展以及酒文化的广泛普及,由ALD所导致的肝硬化、肝细胞癌甚至患者死亡的病例占比将持续升高[11]。祖国医学体系中并无“酒精性肝病”的术语概念,但根据该病的临床表现、病因病机等进行划分,可与“酒病”“伤酒”“酒癖”“酒疸”等相对应。其治法主要囊括了:健脾益胃法、疏肝利胆法、清热利湿祛浊法等[12]。而中药黄芩正是隶属于清热燥湿类药物,目前黄芩主要是被应用在ALD的前、中期[13],但黄芩防治ALD的药效物质基础、作用途径及机制尚未明确,故存在着一定的研究价值。
通过对网络药理学技术的应用,可以得知在蛋白互作网络中关键核心靶点有SRC、AKT1、PIK3R1,这三种蛋白酶在几乎所有类型的癌症中都可能通过上游信号分子的激活或通路组件的突变而被结构性地激活[14-16]。而其中SRC作为首个被发现的具有致癌性的基因,参与着众多信号通路下游靶蛋白的磷酸化[17]。对细胞生存、粘附、增殖、运动和血管生成均具有不同途径的调节。此外,SRC的构成性活动也可促进和维持炎症、细胞代谢的重新编程,从而与肿瘤微环境的发展同步,积极维持肿瘤的生长[18]。AKT1作为PI3K/ AKT信号通路的中心成员,可被PIK3R1编码磷脂酰肌醇3-激酶(PI3K)调节亚基α(p85-ALPHA)激活[19],结合本研究中的蛋白互作PPI图可以再次证实两者存在着密切的上、下游关系。
在KEGG富集获得的前20条信号通路中,多数也归属于“癌变通路”,提示黄芩治疗ALD主要是通过预防或抑制肝细胞癌变。EGFR作为ErbB家族的一种典型的酪氨酸激酶受体,在肝脏中高度表达。在饮入酒精后,EGFR可在血管紧张素II与其受体AT1R结合的条件下激活,同时EGFR可作为Ras-Raf-1-MAP2K/MEK-MAPK/ERK细胞信号通路的枢纽,刺激PIK3R1蛋白的表达异常,进而影响PI3K/AKT信号通路[20,21]。PI3K/AKT信号通路与众多炎症疾病密切相关,被认为是肿瘤的关键信号通路之一。已有研究证实,黄芩可以通过上调IRS1、PI3K、Akt2和Glut2的mRNA表达,促进p-PI3K、p-Akt和Glut2的磷酸化,从而克服PI3K/Akt胰岛素信号通路的损伤,积极改善肝炎症[22]。对比ALD的致病因素可以发现,其与心血管疾病(cardiovascular disease,CVD)同样都包括:炎症、脂肪因子、肠道菌群失调、氧化应激及心理应激等[23]。亦有研究表明ALD与CVD之间存在着直接的联系,提出了肝-心轴相关概念,再结合本研究筛选获得的脂质与动脉粥样硬化信号通路,提示对于ALD的治疗除关注肝脏自身病变外,同时还需考虑心血管对其的影响[24]。
对比分子对接中的结合能大小可以发现,山姜素可作为黄芩治疗ALD的关键有效成分之一。山姜素广泛存在于姜科植物中,相关药理学实验证实其具有抗癌、抗氧化、抗炎、修复血管内皮等作用[25-27]。人体主要是依赖微粒体CYP2E1进行酒精代谢的,在代谢过程中会大量产生如乙醛、活性氧(reactive oxygen species,ROS)等中间产物。一方面,乙醛可与蛋白及DNA形成加合物,直接发挥致癌毒性。另一方面,由于ROS的积聚也会引起DNA结构和功能发生改变,导致细胞周期紊乱,影响基因的转录、翻译等功能,从而启动或促进细胞癌变[28]。而研究表明山姜素可以作为信号分子,激活相关通路,在清除ROS的同时有效抑制细胞癌变[29]。结合体外细胞实验可以发现,在给予不同浓度的山姜素后,可以有效减轻肝细胞的酒精性损伤,相关的生化学指标ALT、AST也得到显著改善。再结合MAD、SOD的结果,提示山姜素可能可以通过提高SOD酶的酶活性来抑制肝脏的氧化应激反应而发挥作用的,但其抗氧化效果或许远不如其抑癌效果,还需要进一步实验研究。
综上所述,本实验通过网络药理学初步预测出黄芩的27个有效成分,表明单味中药亦可以视作一种小型复方。同时黄芩27个有效成分可以通过257个基因靶点对ALD起到治疗作用,其中关键核心靶点有SRC、AKT1、PIK3R1等。KEGG信号通路富集分析结果提示,黄芩可以通过影响癌症的途径、PI3K-Akt信号通路、脂质与动脉粥样硬化等信号通路对ALD起到作用。通过分子对接技术,在验证网络药理学结果的同时,筛选出黄芩治疗ALD的最佳有效成分为山姜素。通过体外细胞实验,可以发现山姜素的确能够显著改善大鼠肝细胞BRL 3A的酒精性损伤状态。本实验结果可以为黄芩治疗ALD提供部分理论基础,但想要进一步挖掘黄芩治疗ALD的具体作用原理仍需要进行大量的药理机制实验。

