基于PKA/CREB/GLP-1信号通路探讨加味葛根芩连汤对糖尿病db/db小鼠胰腺损伤的影响
柳荣 ,王佳慧 ,杨霞 ,高艳奎 ,刘苗 ,梁永林 ,朱向东
1.甘肃中医药大学基础医学院,甘肃 兰州 730000; 2.宁夏医科大学中医学院,宁夏 银川 750000
糖尿病是常见的代谢紊乱性疾病之一,以血糖升高为主要特征[1]。糖尿病可导致多种并发症,如视网膜病变、周围神经病变、糖尿病肾病、糖尿病足等,给患者造成极大的身体和精神损伤,严重影响生活质量[2]。超过90%糖尿病患者为2型糖尿病(type 2 diabetes mellitus,T2DM),其特征是胰岛β细胞分泌胰岛素减少、胰岛素抵抗和代偿性胰岛素分泌不足[1]。除葡萄糖可调控胰岛素分泌外,许多激素如胰高血糖素样肽-1(GLP-1)可以通过胰岛β细胞上的G蛋白偶联受体影响下游环磷腺苷(cAMP)/蛋白激酶A(PKA)/cAMP效应元件结合蛋白(CREB)通路,调节胰腺功能[3]。
糖尿病属中医学“消渴”范畴,其中肥胖型T2DM属“脾瘅”范畴。“脾瘅”多由过食肥甘厚味,损伤脾胃,积热内蕴所致,其病机为中满内热[4]。葛根芩连汤出自《伤寒论》,由葛根、黄芩、黄连、甘草组成,具有解表清里功效,主治湿热下痢。现代医家使用葛根芩连汤治疗肥胖型T2DM效果明显[4-5]。研究表明,葛根芩连汤可调节T2DM糖脂代谢、恢复胰岛β细胞功能、改善胰岛素抵抗、调节肠道菌群等[6-8]。加味葛根芩连汤是在原方基础上加干姜而成,本课题组前期研究发现,加味葛根芩连汤可通过降低T2DM模型大鼠盲肠组织胆盐水解酶水平、增加血液牛磺-β-鼠胆酸含量调控法尼醇X受体,影响糖尿病肝糖异生[9]。但其是否通过调控G蛋白偶联胆汁酸受体5(TGR5)刺激cAMP/PKA/CREB信号通路,进而调控GLP-1分泌,影响胰腺功能,尚不清楚。基于此,本实验基于PKA/CREB/GLP-1信号通路观察加味葛根芩连汤对肥胖型T2DM模型小鼠胰腺损伤的影响,探讨其治疗T2DM的作用机制。
1 材料与方法
1.1 动物
清洁级7周龄雄性db/db小鼠50只、雄性m/m小鼠10只,常州卡文斯实验动物有限公司提供,动物生产许可证号SCXK(苏)2016-0010。常规饲养于甘肃中医药大学实验动物中心SPF级屏障实验室,12 h/12 h明暗交替,温度21~25 ℃,湿度50%~60%,自由饮水摄食。本实验经甘肃中医药大学动物实验伦理委员会批准(2020-274)。
1.2 药物及制备
加味葛根芩连汤(葛根24 g,黄芩9 g,黄连9 g,炙甘草6 g,干姜1.5 g),饮片购自兰州惠仁堂大药房,由甘肃中医药大学中药鉴定中心鉴定为正品。将饮片加入蒸馏水浸泡30 min,先煎葛根30 min,再加入其余药物共煎30 min,重复1次,合并滤液,制成含原药材2 g/mL药液。盐酸二甲双胍,上海九鼎化学科技有限公司,批号YKCFZOB,100 g/瓶,将盐酸二甲双胍溶于蒸馏水,制成2 g/mL溶液。
1.3 主要试剂与仪器
兔免疫组化试剂盒,中国中杉金桥公司,货号SP-9001;小鼠免疫组化试剂盒,中国中杉金桥公司,货号SP-9002;反转录试剂盒,日本TaKaRa公司,货号RR047A;荧光定量试剂盒,日本TaKaRa公司,货号RR820A;TGR5、PKA、p-PKAThr197、p-CREBSer133、CREB、前蛋白转化酶1/3(PC1/3)、神经源性分化因子1(NeuroD1)抗体,英国Abcam公司,货号分别为ab72608、ab216572、ab59218、ab32096、ab32515、ab220363、ab205300;GLP-1抗体,美国ImmunoWay公司,货号YM6182。
血糖仪(德国罗氏公司,型号Accu-Chek®Performa),糖化血红蛋白仪(中国三诺生物传感股份有限公司,型号A1CNow+),高速冷冻离心机(德国Eppendorf公司,型号5424R),切片机(德国LEICA公司,型号2016),免疫组化分析系统(中国泰盟软件有限公司,型号BI2000),多功能酶标仪(中国美谷分子仪器有限公司,型号SpectraMax®i3x),PCR仪(加拿大枫岭国际有限公司,型号FTC-8000P)。
1.4 分组及给药
db/db小鼠适应性饲养1周后,将2日随机血糖≥16.7 mmol/L的小鼠采用随机数字表法分为模型组、二甲双胍组和加味葛根芩连汤高、中、低剂量组,每组10只。另取10只m/m小鼠作为空白组。加味葛根芩连汤高、中、低剂量组分别予加味葛根芩连汤药液31.9、19.1、6.4 g/kg灌胃(根据小鼠体质量调整灌胃体积),二甲双胍组予盐酸二甲双胍溶液0.2 g/kg灌胃,空白组和模型组灌胃等体积蒸馏水,每日1次,连续12周。
1.5 糖代谢相关指标检测
给药结束后,小鼠禁食不禁水8 h以上,使用血糖仪检测小鼠空腹血糖(FBG)。次日使用糖化血红蛋白仪检测小鼠糖化血红蛋白(HbA1c)含量。小鼠禁食不禁水12 h,进行口服葡萄糖耐量试验:予小鼠50%葡萄糖溶液1 g/kg灌胃,0、15、30、60、90、120 min后尾尖采血检测血糖。
1.6 取材
口服葡萄糖耐量试验后,小鼠禁食不禁水24 h,摘眼球取血,4 ℃、3500 r/min离心10 min,分离血清。麻醉后剖腹,迅速分离胰腺组织,一部分置于4%多聚甲醛中固定,用于免疫组化及免疫荧光染色,另一部分经生理盐水冲洗后冻存,用于RT-qPCR检测。
1.7 TUNEL染色
取出固定的胰腺组织,石蜡包埋并切片,脱蜡,滴加Proteinase K工作液孵育30 min,PBS洗涤,1×平衡缓冲液37 ℃孵育1 h,PBS洗涤,室温避光PI染色,PBS洗涤,荧光显微镜下观察胰腺组织细胞凋亡情况,计算细胞凋亡率(凋亡细胞数÷总细胞数×100%)。
1.8 RT-qPCR检测
Trizol法提取胰腺组织总RNA,检测RNA纯度及浓度,并反转录合成cDNA。PCR反应体系:TB GreenPremix Ex TaqⅡ 10 μL、上下游引物各0.8 μL、cDNA 2 μL、RNase Free ddH2O 6.4 μL。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。以β-actin为内参,用2-ΔΔCt法计算mRNA相对表达量。引物由生工生物工程(上海)股份有限公司设计合成。引物序列见表1。

表1 各基因PCR引物序列
1.9 免疫组化染色
胰腺组织石蜡切片脱蜡水化,热抗原修复,加血清封闭1 h,甩干封闭液,滴加一抗(TGR51∶100、PKA 1∶200、p-PKAThr1971∶100、CREB 1∶500、p-CREBSer1331∶200、PC1/31∶500、GLP-11∶200),4 ℃孵育过夜,滴加生物素标记二抗孵育30 min,滴加链霉菌抗生物素-过氧化物酶溶液孵育30 min,DAB显色,苏木素复染,分化,脱水,透明,封片,显微镜下观察,分析阳性表达的平均光密度。
1.10 免疫荧光染色
胰腺组织石蜡切片滴加枸橼酸修复液进行抗原修复,PBS冲洗,0.2%Triton X-100透膜,PBS冲洗,滴加血清封闭1 h,PBS冲洗,分别滴加TGR5一抗(1∶50)、NeuroD1一抗(1∶200)、GLP-1一抗(1∶200),4 ℃孵育过夜,PBS冲洗,滴加荧光二抗,室温避光孵育1 h,PBS冲洗,加入DAPI避光孵育15 min,PBS冲洗,甘油封片,荧光显微镜下观察TGR5/GLP-1、NeuroD1/GLP-1共表达,分析阳性表达的荧光强度。
1.11 统计学方法
采用SPSS24.0统计软件进行分析。计量资料符合正态分布以±s表示,组间比较采用方差分析,方差齐用LSD检验,方差不齐用Tamhane's T2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 加味葛根芩连汤对模型小鼠糖代谢的影响
与空白组比较,模型组小鼠FBG、HbA1c含量显著升高(P<0.01);与模型组比较,二甲双胍组和葛根芩连汤高、中剂量组小鼠FBG、HbA1c含量显著降低(P<0.01,P<0.05)。见表2。
表2 各组小鼠FBG、HbA1c含量比较(±s)
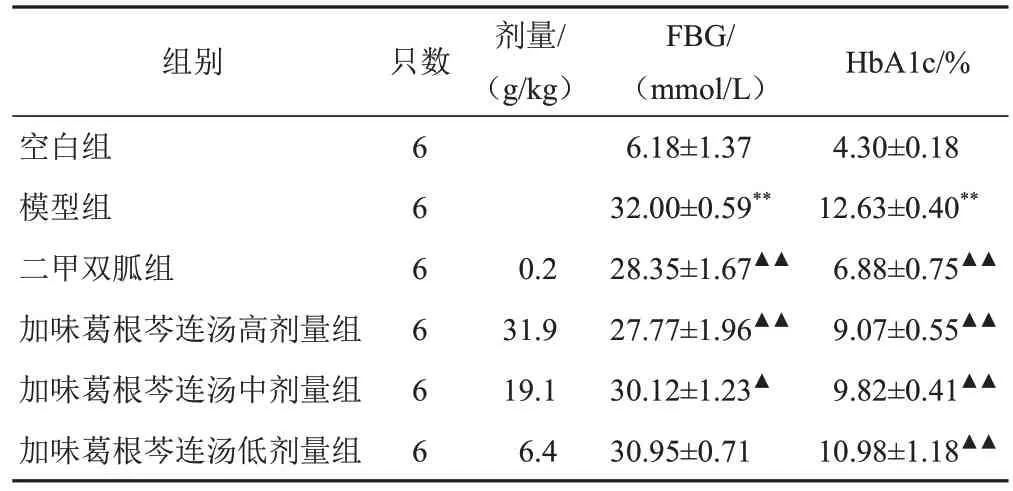
表2 各组小鼠FBG、HbA1c含量比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组HbA1c/%4.30±0.1812.63±0.40**6.88±0.75▲▲9.07±0.55▲▲9.82±0.41▲▲10.98±1.18▲▲只数剂量/(g/kg)6666660.231.919.16.4 FBG/(mmol/L)6.18±1.3732.00±0.59**28.35±1.67▲▲27.77±1.96▲▲30.12±1.23▲30.95±0.71
各组小鼠灌胃葡萄糖溶液后,血糖于15~30 min达到最高值。整个过程中,与空白组比较,模型组小鼠血糖显著升高(P<0.01);与模型组比较,灌胃60、120 min后二甲双胍组和加味葛根芩连汤高、中剂量组小鼠血糖显著降低(P<0.01,P<0.05),且随加味葛根芩连汤剂量增加,血糖有降低趋势。见表3。
表3 各组小鼠口服葡萄糖耐量试验各时点血糖比较(±s,mmol/L)

表3 各组小鼠口服葡萄糖耐量试验各时点血糖比较(±s,mmol/L)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组120 min 4.93±0.2729.75±1.28**21.35±2.72▲▲22.32±3.71▲▲25.50±3.62▲▲29.15±0.55只数剂量/(g/kg)6666660.231.919.16.40 min 3.62±0.6316.12±2.56**15.63±2.0515.72±2.7116.42±2.1315.50±1.6815 min 9.62±1.6529.97±1.19**26.32±4.49▲31.93±0.7931.25±1.6729.75±2.2230 min 8.98±2.3732.27±0.62**30.90±2.0732.25±0.4132.50±0.4332.32±0.6060 min 7.00±0.8631.07±0.48**27.67±2.06▲▲28.25±2.58▲▲29.27±1.10▲30.13±0.67
2.2 加味葛根芩连汤对模型小鼠胰腺组织细胞凋亡的影响
与空白组比较,模型组小鼠胰腺组织细胞凋亡率显著升高(P<0.01);与模型组比较,各给药组小鼠胰腺组织细胞凋亡率显著降低(P<0.01)。见图1、表4。
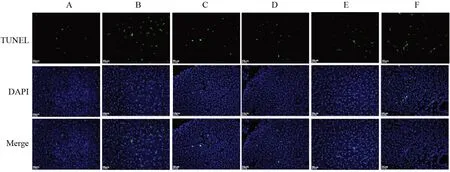
图1 各组小鼠胰腺组织细胞凋亡情况(TUNEL染色,×200)
表4 各组小鼠胰腺组织细胞凋亡率比较(±s,%)
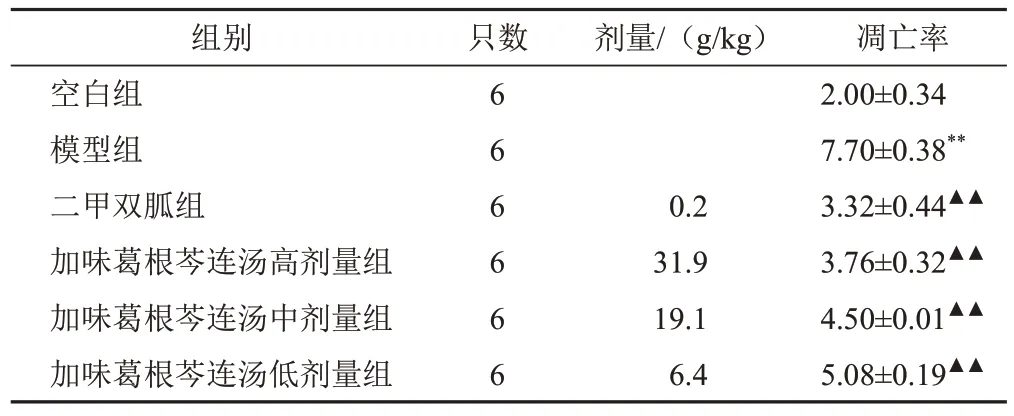
表4 各组小鼠胰腺组织细胞凋亡率比较(±s,%)
注:与空白组比较,**P<0.01;与模型组比较,▲▲P<0.01
凋亡率2.00±0.347.70±0.38**3.32±0.44▲▲3.76±0.32▲▲4.50±0.01▲▲5.08±0.19▲▲组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组只数剂量/(g/kg)6666660.231.919.16.4
2.3 加味葛根芩连汤对模型小鼠胰腺组织G蛋白偶联胆汁酸受体5、蛋白激酶A、环磷腺苷效应元件结合蛋白、激素原转化酶1/3、胰高血糖素样肽-1 mRNA表达的影响
与空白组比较,模型组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达显著降低(P<0.01);与模型组比较,除加味葛根芩连汤低剂量组TGR5 mRNA外,各给药组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达显著升高(P<0.01,P<0.05)。见表5。
表5 各组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达比较(±s)

表5 各组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达比较(±s)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组GLP-11.00±0.060.09±0.02**0.74±0.04▲▲0.46±0.03▲▲0.03±0.05▲▲0.19±0.02▲▲只数剂量/(g/kg)6666660.231.919.16.4 TGR51.00±0.040.10±0.01**0.67±0.04▲▲0.44±0.02▲▲0.20±0.02▲▲0.13±0.02 PKA 1.00±0.030.06±0.01**0.67±0.03▲▲0.41±0.02▲▲0.25±0.02▲▲0.10±0.01▲CREB 1.00±0.020.05±0.01**0.59±0.02▲▲0.37±0.03▲▲0.25±0.02▲▲0.10±0.01▲PC1/31.00±0.030.10±0.01**0.89±0.04▲▲0.59±0.03▲▲0.34±0.03▲▲0.17±0.02▲▲
2.4 加味葛根芩连汤对模型小鼠胰腺组织G蛋白偶联胆汁酸受体5、蛋白激酶A、环磷腺苷效应元件结合蛋白、激素原转化酶1/3、胰高血糖素样肽-1蛋白表达的影响
与空白组比较,模型组小鼠胰腺组织TGR5、PKA、p-PKA、CREB、p-CREB、PC1/3、GLP-1蛋白表达显著降低(P<0.01);与模型组比较,除加味葛根芩连汤中剂量组p-PKA及加味葛根芩连汤低剂量组PKA、p-PKA、CREB、p-CREB蛋白外,各给药组小鼠胰腺组织TGR5、PKA、p-PKA、CREB、p-CREB、PC1/3、GLP-1蛋白表达均显著升高(P<0.01,P<0.05)。见图2、表6。
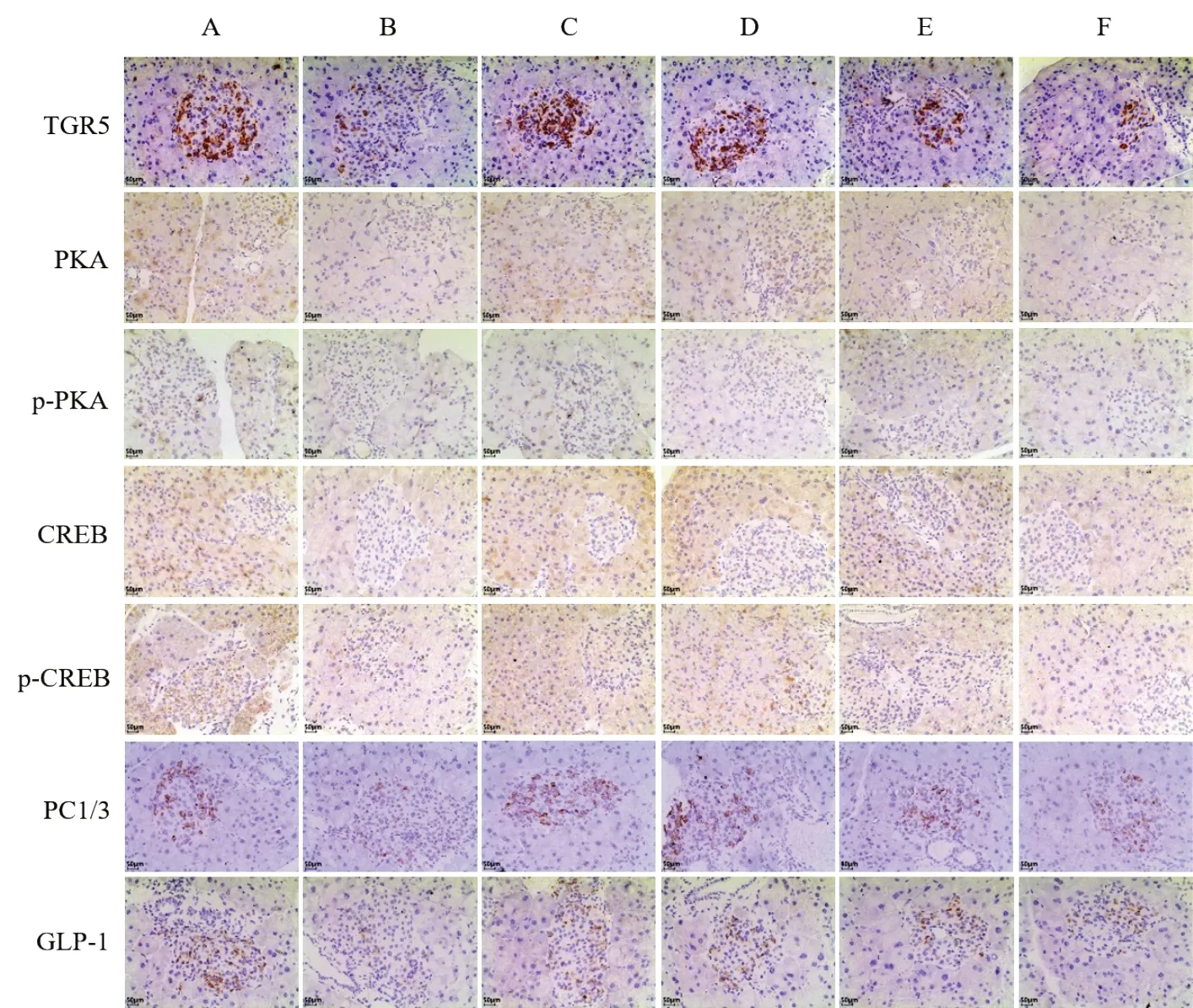
图2 各组小鼠胰腺组织TGR5、PKA、p-PKA、CREB、p-CREB、PC1/3、GLP-1阳性表达(免疫组化染色,×200)
表6 各组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1蛋白表达比较(±s,平均光密度)

表6 各组小鼠胰腺组织TGR5、PKA、CREB、PC1/3、GLP-1蛋白表达比较(±s,平均光密度)
注:与空白组比较,**P<0.01;与模型组比较,▲P<0.05,▲▲P<0.01
组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组GLP-11.00±0.110.20±0.04**0.91±0.09▲▲0.78±0.06▲▲0.51±0.07▲▲0.34±0.05▲只数666666 TGR51.00±0.040.14±0.02**0.88±0.04▲▲0.87±0.04▲▲0.65±0.04▲▲0.48±0.03▲▲PKA 1.00±0.090.23±0.03**0.98±0.05▲▲0.89±0.06▲▲0.51±0.05▲▲0.26±0.02 p-PKA 1.00±0.070.28±0.05**0.85±0.08▲▲0.62±0.06▲▲0.38±0.050.31±0.03 CREB 1.00±0.130.23±0.04**0.91±0.14▲▲0.85±0.13▲▲0.54±0.08▲▲0.32±0.05 p-CREB 1.00±0.100.19±0.02**0.69±0.05▲▲0.57±0.09▲▲0.37±0.03▲▲0.22±0.03 PC1/31.00±0.050.25±0.04**0.92±0.06▲▲0.93±0.06▲▲0.54±0.04▲▲0.39±0.04▲▲
2.5 加味葛根芩连汤对模型小鼠胰腺组织TGR5/GLP-1、NeuroD1/GLP-1共表达的影响
TGR5、NeuroD1阳性表达呈红色荧光,GLP-1阳性表达呈绿色荧光,TGR5/GLP-1、NeuroD1/GLP-1共定位呈黄色荧光。与空白组比较,模型组小鼠胰腺组织TGR5/GLP-1、NeuroD1/GLP-1共表达显著降低(P<0.01);与模型组比较,二甲双胍组和加味葛根芩连汤高、中剂量组小鼠胰腺组织TGR5/GLP-1、NeuroD1/GLP-1共表达显著升高(P<0.01),加味葛根芩连汤低剂量组NeuroD1/GLP-1表达显著升高(P<0.01)。见表7、图3、图4。

图3 各组小鼠胰腺组织TGR5、GLP-1阳性表达(免疫荧光染色,×200)

图4 各组小鼠胰腺组织NeuroD1、GLP-1阳性表达(免疫荧光染色,×200)
表7 各组小鼠胰腺组织TGR5/GLP-1、NeuroD1/GLP-1共表达比较(±s,平均荧光强度)

表7 各组小鼠胰腺组织TGR5/GLP-1、NeuroD1/GLP-1共表达比较(±s,平均荧光强度)
注:与空白组比较,**P<0.01;与模型组比较,▲▲P<0.01
组别空白组模型组二甲双胍组加味葛根芩连汤高剂量组加味葛根芩连汤中剂量组加味葛根芩连汤低剂量组NeuroD1/GLP-11.00±0.060.18±0.02**0.95±0.06▲▲0.61±0.07▲▲0.51±0.04▲▲0.38±0.05▲▲只数666666 TGR5/GLP-11.00±0.080.22±0.03**0.78±0.07▲▲0.71±0.12▲▲0.60±0.07▲▲0.34±0.05
3 讨论
目前,现代医学主要采用二甲双胍、噻唑烷二酮类、α葡萄糖苷酶抑制剂、胰岛素等治疗T2DM,虽能控制症状,但不良反应较多[10]。中医药在防治T2DM及其并发症方面优势明显。中医学认为,糖尿病早期以胰岛素抵抗为主,多为实证;中期开始出现胰岛细胞损伤合并胰岛素抵抗,多为虚实夹杂;末期变化为胰岛细胞衰竭,多为虚证[4]。肥胖型T2DM属于早、中期。研究发现,葛根芩连汤治疗T2DM及其并发症效果明显[11-12]。葛根芩连汤主治表邪未解、邪陷阳明、里热蒸肺迫肠、伤津耗液之证。方中葛根可除阳明内热,升津润燥;黄芩、黄连可清肺、胃肠及肾之湿热,黄连苦燥伤津,与葛根配伍可制其燥性[13];甘草养脾胃、生津液,和中调味。全方共奏清热燥湿、生津润燥之功,切中“脾瘅”中满内热、燥热伤津病机。临床应用葛根芩连汤治疗T2DM时,为避免黄连、黄芩苦寒伤及脾胃,常佐干姜制其苦寒之性[14-15]。药理研究表明,葛根中葛根素具有降血糖、改善胰岛素抵抗、保护胰岛、抑制炎症、减轻氧化应激和晚期糖基化终末产物生成作用[16];黄连主要成分小檗碱可改善胰岛素抵抗、促进胰岛素及GLP-1分泌、抑制肝脏糖异生、减少肠道对糖的摄取吸收、抑制氧化应激及炎性反应、调控肠道菌群等[17];黄芩苷和黄芩素是黄芩的活性成分,具有保肝、抗氧化、调节血脂异常、抗脂肪生成、抗炎和抗糖尿病作用,被认为是治疗肥胖、胰岛素抵抗和炎症性疾病的潜在抗氧化剂和抗炎剂[18];葛根中大豆苷可调节糖脂代谢,通过T2DM巨噬细胞TNF-α/JNK信号通路降低炎症反应[19];甘草中异甘草素可通过沉默信息调节因子1依赖性机制减轻糖尿病肾损伤炎症和氧化应激反应[20]。以上研究为葛根芩连汤治疗T2DM糖脂代谢紊乱、胰岛素抵抗、炎症反应等提供实验依据。
胰岛具有4种内分泌细胞群(α、β、δ和PP细胞),其中胰岛α细胞可分泌胰高血糖素,调控葡萄糖稳态;胰岛β细胞可通过葡萄糖等刺激分泌及储存胰岛素[21],胰岛素分泌异常是T2DM的主要标志。研究表明,T2DM患者胰岛β细胞功能、质量均降低,其中T2DM消瘦患者胰岛β细胞质量减少约41%,而肥胖患者胰岛β细胞质量减少约63%[22]。恢复功能性胰岛β细胞质量、改善胰岛素分泌可治疗T2DM。胰岛α和β细胞均表达TGR5[23],TGR5激活可增加胰岛素分泌,进而影响下游cAMP/PKA途径[24],诱导GLP-1分泌,GLP-1以旁分泌的方式作用于相邻β细胞以控制胰岛素分泌[25]。当TGR5被抑制时,GLP-1分泌减少[26]。GLP-1是由肠道L细胞、胰岛α细胞及中枢神经系统分泌的一种长肽激素,可以调节葡萄糖稳态、抑制胃排空、改善脂质代谢,并可影响胰岛β细胞增殖和分化,改善胰岛β细胞质量,刺激胰岛素分泌[26]。在胰腺中,GLP-1主要通过G蛋白偶联受体影响下游cAMP/PKA/CREB信号途径[27]。TGR5可激活腺苷酸环化酶,刺激ATP转化为cAMP,cAMP进一步激活PKA,从而关闭K+通道并激活Ca2+通道[23],使下游CREB激活,CREB可增加cAMP含量,后者在胰岛素分泌中有重要作用,可影响胰高血糖素原和PC1/3转录,刺激肠道L细胞产生GLP-1[28]。PC1/3对于肠道L细胞产生GLP-1和GLP-2是必不可少的,在胰岛α细胞中也有PC1/3表达。
db/db小鼠为瘦素信号传导受损所致的肥胖型T2DM模型,具有肥胖、糖脂代谢紊乱、胰岛素分泌受损、胆汁酸代谢受损、胰岛素抵抗、脂肪组织炎症等特征,是T2DM疾病研究较理想的动物模型[29]。本研究选取T2DM模型db/db小鼠作为实验对象,实验结果显示,与空白组比较,模型组小鼠FBG、HbA1c显著升高,糖耐量显著降低,表明模型小鼠存在糖代谢紊乱。进一步检测发现,模型小鼠胰腺组织凋亡细胞明显增多,TGR5、PKA、p-PKA、CREB、p-CREB、PC1/3、GLP-1蛋白及TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达显著降低,TGR5/GLP-1共表达显著降低,且二者表达具有一定关联性,提示模型小鼠胰腺损伤后TGR5表达被抑制,进一步抑制PKA/CREB/GLP-1通路,影响胰岛β细胞数量和功能,破坏葡萄糖稳态。NeuroD1对胰腺发育至关重要,NeuroD1缺失可影响胰岛α细胞和β细胞分化及胰岛β细胞增殖,导致功能性胰岛细胞数量减少、胰岛结构紊乱[30]。本实验中,与空白组比较,模型组小鼠胰腺组织NeuroD1/GLP-1共表达显著降低,说明小鼠胰岛细胞功能损伤。经二甲双胍及不同剂量加味葛根芩连汤干预后,各给药组小鼠FBG、HbA1c降低,糖耐量升高,胰腺组织凋亡细胞显著减少,提示加味葛根芩连汤能够改善模型小鼠糖代谢紊乱,减轻胰腺组织损伤;各给药组小鼠胰腺组织TGR5、PKA、p-PKA、CREB、p-CREB、PC1/3、GLP-1蛋白及TGR5、PKA、CREB、PC1/3、GLP-1 mRNA表达不同程度升高,TGR5/GLP-1、NeuroD1/GLP-1共表达升高,其中二甲双胍组和加味葛根芩连汤高、中剂量组差异有统计学意义,表明加味葛根芩连汤可激活TGR5,进而激活PKA/CREB/GLP-1信号通路,恢复db/db小鼠胰岛功能,改善胰腺损伤。

