基于网络药理学探讨葛根芩连汤治疗放射性肠炎的作用机制
朱 旭 张 博 张思萌 夏晓萌 吴登斌*
2017年中国恶性肿瘤流行病学分析,每年至少49.9万例新发盆腔恶性肿瘤[1],其中20%~60%需要放射治疗[2]。由于小肠上皮细胞对放疗高度敏感,放射性肠炎是放射治疗过程中的主要并发症,是小肠和大肠在接受放射治疗过程中出现的放射性损伤炎症反应[3]。其表现为急性或慢性腹泻、便血和里急后重,严重影响肿瘤患者的生命质量。放射性肠炎成为直肠癌等腹部肿瘤放射剂量增加的限制性因素。汉代名医张仲景在《伤寒杂病论》中对葛根芩连汤进行了详细描述,方剂由葛根、黄芩、黄连及甘草4味中药组成,主治太阳表证、协热下利,是治疗湿热所致腹泻和痢疾的经典方。近年来发现其治疗放射性肠炎肠道湿热证疗效较好[4-7]。本研究运用网络药理学方法就葛根芩连汤治疗放射性肠炎的作用机制进行分析。现报道如下。
1 资料与方法
1.1 收集葛根芩连汤活性成分、作用靶点等信息
以“葛根、黄芩、黄连、甘草”为关键词,在中药系统药理学数据库和分析平台(TCMSP)进行检索,以每味中草药的化学成分、类药性(DL)≥0.18、口服生物利用度(OB)≥30%为筛选依据,对药物的有效成分进行筛选。然后在数据库内以有效成分为依据进行检索,对其作用靶点进行确定。然后在Uniprot数据库内导入作用靶点,进行基因标准化处理。
1.2 方法
1.2.1 葛根芩连汤共同作用靶点的筛选 将葛根芩连汤通过基因标准化处理得到的基因名称全部导入Excel表格中,取交集函数,筛出葛根芩连汤共同作用靶点,并对“葛根芩连汤潜在作用靶点”用imageGP工具绘制韦恩图。
1.2.2 收集放射性肠炎靶点信息 以放射性肠炎相关的靶点、"radiation enteritis" "radiation enteropathy"为关键词在GeneCards数据库内进行检索,然后合并两个数据库检索出的靶点,再在Uniprot数据库内导入作用靶点,进行基因标准化处理。
1.2.3 收集葛根芩连汤治疗放射性肠炎靶点及分析 在Excel表格中导入放射性肠炎背景网络及葛根芩连汤的作用靶点,取交集,得到葛根芩连汤治疗放射性肠炎的共同潜在基因靶点。再将共同作用的靶点、靶点所对应的葛根芩连汤活性成分、葛根芩连汤分别导入Cytoscape3.7.2软件中,构建“葛根芩连汤-治疗成分-靶点-放射性肠炎网络图”,对网络节点的重要性通过Cytoscape3.7.2中“NetworkAnalyzer”功能对自由度(Degree)等网络拓扑参数进行分析。
1.2.4 构建靶蛋白质-蛋白质相互作用(PPI)网络及扩充靶蛋白
在String数据库内输入获得的放射性肠炎治疗的作用靶点,物种选择“Home sapiens”,模式选择“multiple proteins”,在默认设置下,得到PPI网络,通过Cytoscape 3.7.2中“NetworkAnalyzer”功能对所获取数据进行Degree等网络拓扑参数分析。
1.2.5 GO富集分析和KEGG通路富集分析
在DAVID 6.8数据库内输入扩充靶点及葛根芩连汤治疗放射性肠炎的共同作用靶点,分别进行GO富集分析、KEGG通路富集分析,将所获得的结果导入Excel表格,筛选设定P≤0.05,根据P值将GO生物过程和KEGG 通路由小到大排序,选取前10位的GO生物过程和KEGG通路,利用imageGP工具绘制葛根芩连汤治疗放射性肠炎主要GO生物过程气泡图和葛根芩连汤治疗放射性肠炎的KEGG通路气泡图。
2 结果
2.1 葛根芩连汤作用靶点信息收集
共筛选出128个有效活性成分,其中葛根、黄芩、黄连、甘草分别为3个、31个、9个、88个,葛根芩连汤的主要活性成分见表1。在TCMSP数据库内输入128个有效成分,得到潜在作用靶点2 191个。通过Excel删除重复值,得到261个基因靶点是葛根芩连汤共同的潜在作用靶点。

表1 葛根芩连汤主要活性成分
2.2 葛根芩连汤治疗放射性肠炎靶点的收集及网络构建和分析
获得人类放射性肠炎相关靶点共41个。取交集后得到相关靶点基因8个,分别为TGFB1,NOS2,EGF,IL-6,MMP1,THBD,SERPINE1,MPO(图1)。
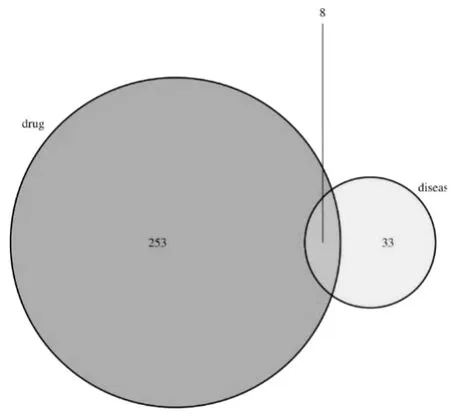
图1 葛根芩连汤与人类放射性肠炎共作用靶点
2.3 靶PPI网络的构建
PPI网络包含78个节点,1 196条边(节点间的相互作用关系),平均Degree值为30.7。此网络中Degree 值大于等于30的从高到低排序依次为IL-6,VEGFA,EGF,TNF,IGF1,CXCL8,SRC,EGFR,MMP9,SERPINE1,TGFB1,TIMP1,STAT3,IL-10,ERBB2,IL-4,PLG,CCL2,HRAS(图2)。

图2 葛根芩连汤关键靶点PPI网络
2.4 GO和KEGG通路分析结果
得到20个生物过程(GO)前10位的分别为细胞迁移的正向调控,MAPK信号通路,细胞黏附,上皮细胞的增殖,白细胞迁移,蛋白转运的正向调节,信号受体活动的正向调节,miRNA基因沉默机制中的产物,调节上皮细胞的凋亡,细胞外基质组织(图3)。得到16条KEGG通路,前5位的分别为细胞分化的负向调控,凋亡信号通路,RNA聚合酶Ⅱ正向调控pri-miRNA转录,多细胞生物的体内平衡,上皮细胞迁移的调节(图4)。
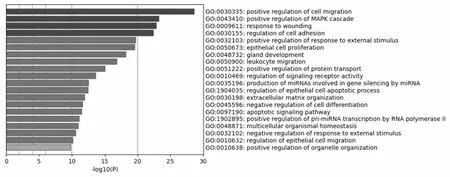
图3 GO生物过程

图4 KEGG通路气泡图
通过GO富集分析显示黏附斑激酶(FAK)及其信号通路,人巨细胞病毒感染,感染性肠道疾病,Th17细胞分化,胃癌,Rap1信号通路,relaxin信号通路,细胞因子-细胞因子受体相互作用,MAPK信号通路,胰腺癌,PI3K-Akt信号通路,foxo信号通路,乙型肝炎病毒,HIF-1信号通路,膀胱癌,AGE-RAGE信号通路在糖尿病并发症中,肿瘤蛋白多糖,EGFR酪氨酸激酶抑制剂等,是葛根芩连汤治疗放射性肠炎的作用机制(图5)。

图5 GO富集分析
3 讨论
近年的研究认为放射性肠炎的发生与肠上皮细胞的直接损伤,肠道微生物黏膜屏障破坏,辐射诱发细胞因子介导的肠道炎症等机制有关[8]。多年的临床实践发现葛根芩连汤对于预防和治疗肠道炎症能够起到一定的作用[9-10]。现代药理研究表明葛根芩连汤能降低血清IL-6、TNF-α的表达,减轻肠道炎症反应[11],调控MMP-9/P38MARK途径减轻肠道黏膜损伤,修复肠道黏膜上皮屏障等[12]。
本研究从网络药理学角度对葛根芩连汤治疗放射性肠炎的作用机制进行探讨,网络分析显示葛根芩连汤共有活性成分128种,GO富集分析以及KEGG通路富集分析结果显示,葛根芩连汤对放射性肠炎损伤修复可能的机制最主要的首先包括FAK及其信号通路,FAK是一种酪氨酸激酶,可以通过刺激胞内PI3K-Akt信号通路影响下游foxo信号通路,调节HIF-1信号通路以及影响Ras/MAPK等信号通路,调控细胞的生长。其次是MAPK信号通路,通过促进上皮细胞的增殖,调节上皮细胞的凋亡、迁移,结合恶性肿瘤的临床分析推测,葛根芩连汤治疗放射性肠炎的机制首先与FAK及其信号通路、MAPK通路相关的促进上皮细胞的损伤修复有关。再次,葛根芩连汤对炎症反应的影响,通过调控Th17细胞分化实现,Th17细胞与Th1/Th2细胞同属免疫调节性T细胞,参与肠道炎症反应,具有促炎症、致炎作用。基于目前的网络药理学分析认为葛根芩连汤可能通过促进上皮细胞的修复,调节免疫细胞分化,治疗放射性肠炎。近年来研究表明,肠道微环境中,肠上皮细胞、免疫细胞与肠道菌群是3个相互影响、密切相关的群体[13],肠道微生物群维持上皮屏障的完整性并构建黏膜免疫系统,上皮细胞通过构建化学和物理屏障将肠道微生物与肠壁分离,从而构建宿主共生关系,肠道免疫细胞参与维持健康的微生物群和加强上皮屏障功能,因此推断,葛根芩连汤在影响了上皮细胞的修复和免疫细胞的分化同时,会对肠道菌群产生影响。作为一种治疗腹泻的经典方剂,研究表明葛根芩连汤可以通过改变肠道内有益菌数量发挥治疗疾病的作用[14]。但对于治疗放射性肠炎是否有影响,还知之甚少,也是未来可以研究的方向。

