雪莲SikCDPK1 基因的表达特征和蛋白激酶活性分析
刘玉玲,朱新霞,吕新华,孙辉
(1. 石河子大学生命科学学院,绿洲城镇与山盆系统生态兵团重点实验室,新疆 石河子 832003;2. 乌鲁木齐职业大学,新疆 乌鲁木齐 830000)
钙依赖蛋白激酶(calcium-dependent protein kinase, CDPKS)是Ca2+信号转导途径中的主要感受器和效应器,目 前 陆 续 在 拟 南 芥(Arabidopsis thaliana)[1]、水 稻(Oryza sativa)[2]、毛 果 杨(Populus trichocarpa)[3]、黄 瓜(Cucumis sativus)[4]、番茄(Lycopersicon esculentum)[5]、甜瓜(Cucumis melo)[6]、辣椒(Capsicum annuum)[7]、山核桃(Carya cathayensis)[8]等多种植物中发现,是植物中研究较多的一类多基因家族蛋白激酶,在植物生长发育和逆境响应中发挥着重要作用。CDPKs在植物多个器官广泛表达。如拟南芥AtCPK12在根、茎、叶、花和成熟果荚中表达,在干种子中不表达[9],而BdCDPK9、BdCDPK18、BdCDPK3、BdCDPK22和BdCDPK10只在种子中表达,BdCDPK8和BdCDPK19在 根 和 种 子 中 表达,BdCDPK2和BdCDPK25在 茎 和 花 中 表达,BdCDPK7和BdCDPK17在根和茎中表达[10]。
脱落酸(abscisic acid,ABA)、赤霉素(gibberellin,GA3)、水杨酸(salicylic acid,SA)、H2O2是逆境防御系统中重要的信号分子,许多植物CDPKS可通过参与信号分子介导的信号转导,在植物防御和发育过程中发挥重要作用。如拟南芥AtCPK4和AtCPK11可通过参与Ca2+介导的ABA 信号通路,调控种子萌发、幼苗生长、气孔保卫细胞调节和植物对盐胁迫的耐受性[11]。AtCPK10通过参与ABA 诱导的气孔关闭响应干旱胁迫[12],AtCPK8及其互作蛋白CATALASE3 参与ABA 和H2O2介导的信号转导,通过维持H2O2稳态在响应干旱胁迫中起重要作用[13]。水稻OsCPK9通过参与SA 介导的信号转导,在抗病防御中起作用[14]。水稻OsCDPK13基因主要在叶鞘和愈伤组织中表达,GA3处理后,该基因表达量和蛋白质大量积累[15]。转AtCPK30基因拟南芥被低浓度GA3诱导后,能促进植株根系生长[16]。
蛋白激酶活性是CDPK 发挥作用的前提,CDPK 激酶区具有典型的Ser/Thr 蛋白激酶序列,位于此区中的Lys 残基极为保守,是ATP 的结合位点。自抑制区富含碱性氨基酸残基,能以底物的形式与激酶域结合,抑制激酶的活性。调控区含有与Ca2+结合的EF 手型结构域,这是CDPK 仅依赖于Ca2+而不依赖钙调素的原因[16]。当胞内Ca2+浓度较低时CDPK 激酶区就和自抑制区相结合,形成自抑制,CDPK 激酶活性很低或没有;当发育和环境信号引发胞内Ca2+浓度升高时,CDPK 调控区EF 手型蛋白就与Ca2+结合,使调控区蛋白结构域构象发生变化,自抑制区与激酶活性结构域分开,自抑制作用解除,恢复蛋白激酶活性,将Ca2+信号向下游传导和级联放大,参与调控植物生长发育、信号传递、逆境响应和免疫应答等[17]。
天山雪莲(Saussurea involucrata)能在极端环境生长和开花,蕴含着丰富的抗逆基因资源。本实验室前期从天山雪莲中克隆获得SikCDPK1基因,发现它可以增强转基因烟草(Nicotiana tabacum)的耐低温、干旱胁迫能力[18],而有关SikCDPK1基因的组织表达、是否参与对逆境信号分子的响应及蛋白激酶活性等未见相关报道。本研究拟通过对天山雪莲SikCDPK1基因在不同组织器官的表达、对信号分子CaCl2、ABA、GA3、SA、H2O2的诱导响应模式、SIKCDPK1 激酶活性分析和 SIKCDPK1 亚细胞定位等研究,揭示SikCDPK1基因的表达特征和蛋白激酶活性,为深入研究SikCDPK1基因的表达机制和功能奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 本试验于2018-2020 年在石河子大学生命科学学院绿洲城镇与山盆系统生态兵团重点实验室开展。天山雪莲种子用1% KMnO4溶液浸泡12 h,蒸馏水冲洗3~4 次。用75%的酒精对种子表面消毒1 min,0.1% HgCl2(w/v) 溶液消毒7 min。无菌水冲洗3~4 次,用无菌滤纸吸去种子表面多余的水分后,将种子均匀散播在1/2 MS 固体培养基(825 mg·L-1NH4NO3、950 mg·L-1KNO3、0.83 mg·L-1KI、27.8 mg·L-1FeSO4·7H2O 和0.5 mg·L-1烟酸等)表面,置于16 ℃光照强度为60 μmol·m-2·s-1,16 h 光照/8 h 黑暗的条件下培养45 d,将长出幼茎与幼叶的幼苗,炼苗驯化后,移栽至营养土中,置于光照培养箱中培养3 个月。分别取生长45 d 天山雪莲组培苗的幼茎、幼叶与生长3 个月大的栽培苗的根、茎、叶于液氮中速冻后,置于-80 ℃冰箱保存。
1.1.2 主要试剂 普通琼脂糖凝胶DNA 回收试剂盒、RNA 提取试剂盒、Revert-Aid First Strand cDNA Synthesis Kit、qPCR 试剂盒、质粒小提试剂盒购自北京天根生物科技有限公司,T4DNA ligase、限制性内切酶KpnⅠ和SalⅠ购自北京全式金生物技术有限公司,植物表达载体pBI121-GFP质粒由本实验室保存。
1.2 试验方法
1.2.1 天山雪莲不同组织器官SikCDPK1基因的表达 分别取-80 ℃冰箱保存的生长45 d 天山雪莲的幼茎、幼叶与生长3 个月后雪莲植株的根、茎、叶,使用TaKaRa 公司RNA 提取试剂盒,按照产品说明书的步骤提取天山雪莲总RNA。按照20 μL 反应体系: RNA(3.5 μL)、Oligo-dT18(1 μL)、dNTP(1 μL)、RNase inhibitor (1 μL)、5×Reverse Transcriptase M-MLV Buffer(4 μL)、RNase-free dd H2O(9.5 μL),42 ℃水浴90 min,迅速转移至70 ℃水浴15 min,完成cDNA 第一链的合成,-20 ℃保存。以表1 中的雪莲内参基因引物GAPGH-F、GAPGH-R与目的基因引物SikCDPK1-qF、SikCDPK1-qR,进行RT-qPCR 反应。反应体系:cDNA(1 μL)、GAPGH-F/SikCDPK1-qF(0.25 μL)、GAPDH-R/SikCDPK1-qR(0.25 μL)、SYBR Green PCR Master Mix(5 μL)、ddH2O(3.5 μL),反应程序:95 ℃预变性10 min;95 ℃ 10 s,62 ℃ 30 s,40 个循环。每个样品设置3 个重复。

表1 引物Table 1 The primers
1.2.2 CaCl2、ABA、GA3、SA、H2O2诱导后基因表达分析 选取生长3 个月,长势一致且生长健康的整株天山雪莲苗,冲洗表面的营养土后,分别置于MS 液体培养基(1650 mg·L-1NH4NO3、1900 mg·L-1KNO3、0.83 mg·L-1KI、27.8 mg·L-1FeSO4·7H2O、0.5 mg·L-1烟酸等)中,生长48 h,使其根系损伤恢复。将苗取出后,分别置于含5 mmol·L-1CaCl2、100 μmol·L-1ABA、100 μmol·L-1GA3、1 mmol·L-1SA、100 μmol·L-1H2O2的MS 培养液中,分别处理: 0、1、3、6、12、24 h 后,提取样品总RNA,反转录后,使用表1 中的SikCDPK1-qF、SikCDPK1-qR 引物进行RT-qPCR 检测SikCDPK1基因表达量,每个样品重复3 次。
1.2.3 SIKCDPK1 蛋白诱导表达与纯化 将含有重组原核表达载体PET28a-SikCDPK1 的菌液以1∶100(v/v)接种到100 mL 新鲜LB 液体培养基(10 g·L-1胰蛋白胨、5 g·L-1酵母提取物、10 g·L-1氯化钠)中活化,培养至OD600达到0.4,加入1 mmol·L-1异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG),37 ℃分别诱导表达4、5、6、7、8、9、10 h 后,4 ℃ 6000 r·min-1离心10 min 富集菌体,向沉淀中加入1 mL 0.01 mmol·L-1预冷的PBS 悬浮后加入1 mL 5×SDS 电泳缓冲液,沸水浴10 min,放至室温12000 r·min-1离心5 min,取上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)。根据优化后的菌株表达条件扩大培养菌液,6000 r·min-1离心10 min,收集菌体,向其中加入5 mL 含有20 mmol·L-1磷酸钠、500 mmol·L-1NaCl、30 mmol·L-1pH 7.4 咪唑的结合缓冲液,在室温下搅拌30 min,超声破碎10 min。将组氨酸标记蛋白纯化柱(Histrap FF Column)与层析装置连接好后,将蒸馏水注入恒流泵的管道,用注射器逐滴地往层析柱中注水,直到蒸馏水从管道的另一个出口流出来。将处理好的样品上柱后,用结合缓冲液冲洗,此时恒流泵的流速为1 mL·min-1。再向柱内加入含有20 mmol·L-1磷酸钠、500 mmol·L-1NaCl 与不同浓度的咪唑洗脱液缓冲洗脱纯化后,取10 μL 纯化蛋白进行电泳检测。
1.2.4 体外激酶活性测定 参照Promega 公司Kinase GLOTMLuminescent Kinase Assay 试剂盒说明书,在离心管中加入含有30 mmol·L-1Tris-HCl(pH 7.5)、0.5 mmol·L-1DTT、100 mmol·L-1NaCl、10 μmol·L-1ATP、100 mmol·L-1CaCl2的酶促反应缓冲液和底物HisⅢ(50 μg·mL-1),再加入10 μL 纯化后的重组蛋白,使反应总体积达到200 μL,置于30 ℃水浴锅开始反应。分别取20 μL 反应0、5、10、15、20、25、30、40、50 min 的反应混合物,沸水浴1 min 终止反应。将反应物冷却至室温后,转移到96 孔酶标板中,并向板中加入20 μL 试剂盒中的Kinase-Glo Reagent,使用酶标仪(LDSY96A,山东)在Luminescent 状态下检测发光强度,每个数值重复读取3 次。将上述酶促反应液中的Ca2+换成2 mmol·L-1EGTA(ethylene glycol tetraacetic acid),相同方法检测发光强度。
使用在线网站http://maxchelator.stanford.edu/CaEGTA-NIST.htm 计算反应液中的Ca2+浓度,在Ca2+浓度为0、8.4、14.0、34.0、51.0、79.0、135.0 nmol·L-1时,分别检测发光强度。在底物HisⅢ浓度为0、10、20、50、100、250、500 μg·L-1时,分别检测发光强度。用不同浓度下样品的发光值与对照的差值来表示酶活性的改变量,使用GraphPad Prism 9.1 软件分析底物为HisⅢ时SIKCDPK1 激酶的米氏常数(michaelis constant,Km)。
1.2.5 亚细胞定位 在NCBI 获得SikCDPK1基因序列,Primer 5.0 设计带有KpnⅠ和SalⅠ为酶切位点的引物(表1)SikCDPK1-GFP-F 与SikCDPK1-GFP-R,扩增出目的基因片段后,连接至pMD19T 载体,将测序成功的质粒命名为pMD19T-SikCDPK1。用KpnI 和SalI 限制性内切酶酶切重组质粒pMD19T-SikCDPK1和PBI121-GFP载体。酶切产物凝胶电泳检测后回收纯化,连接后从含卡那霉素(kanamycin, kan)50 μg·mL-1抗性的培养基中挑单克隆,进行菌液PCR 检测。将检测结果为阳性的pBI121-SikCDPK1-GFP质粒,采用电转法转入农杆菌GV3101 感受态细胞,在含有利福平(rifampicin, Rif)50 μg·mL-1、kan 50 μg·mL-1、庆大霉素(gentamicin,Gen)50 μg·mL-1的LB 固体培养基上筛选后,将PCR 检测为阳性的pBI121-SikCDPK1-GFP的农杆菌菌液,采用Li 等[19]的方法侵染新鲜洋葱(Allium cepa)鳞茎表皮细胞,暗培养2 d 后,制作临时装片,先在光学显微镜(MSD701,广州)下观察,后转移至激光共聚焦显微镜(LSM510,德国)下观察。
1.3 数据处理
使用2-∆∆Ct法[20]计算出天山雪莲SikCDPK1基因在不同组织器官的表达量,使用SPSS 18.0 软件对试验数据进行LSD 多重方差分析,显著性测验设定为P<0.05(显著水平)和P<0.01(极显著水平),使用Excel 和GraphPad Prism 9.1 制作图表。检测蛋白激酶活性过程中,对照与样品在酶标仪检测到光信号强度的差值与激酶活性成正比,差值越大酶活性越大。利用GraphPadprism 中的enzyme kinetics Michaelis-Menten 计算SIKCDPK1 的Km值。
2 结果与分析
2.1 SikCDPK1 基因组织特异性分析
通过RT-qPCR 探究SikCDPK1基因在天山雪莲根、茎、叶、幼叶、幼茎及种子中的表达情况。SikCDPK1 基因在种子中表达量最高,其他依次是叶、茎、根、幼叶,幼茎中表达量最低(图1)。种子、叶、茎、根中的基因表达量和幼茎相比差异极显著,幼叶中的基因表达量和幼茎中的基因表达量相比,达到显著差异。说明SikCDPK1基因在雪莲种子、叶、茎、根中都存在,但在不同器官表达有差异。

图1 SikCDPK1 基因组织特异性表达Fig.1 Tissue specific expression of SikCDPK1 gene
2.2 CaCl2、ABA、GA3、SA 及H2O2 诱导的基因表达分析
CaCl2处 理 后,SikCDPK1基 因 表达 呈 现“上升-快速下降-上升”的趋势(图2),在6 h 达到峰顶,表达量为CK 的17.549 倍,与CK 相比达极显著差异水平。在12 h 达到峰底,峰底的表达量为CK的1.284 倍,24 h 又升高,表达量 为CK 的1.509 倍,达显著差异水平。

图2 SikCDPK1 基因的表达特性Fig.2 Expression characteristics of SikCDPK1
ABA 处 理 后,SikCDPK1基 因 表达 呈 现“上升-下降-慢上升”的趋势(图2),在3 h 达到峰顶,表达量为CK 的2.229 倍,与CK 相比达极显著差异水平,在12 h 达到峰底,峰底的表达量为CK 的1.057 倍,24 h 又升高,表达量为CK 的1.366 倍。
GA3处理后,SikCDPK1基因表达呈现“略微上升-下降-上升”趋势(图2),在6 h 达到峰底,峰底的表达量为CK 的0.816 倍,后面持续上升,12 h 表达量为CK 的1.945 倍,与CK 相比达极显著差异水平。在24 h 达到峰顶,表达量为CK 的3.936 倍,达极显著差异水平。
SA 处理后,基因表达模式整体呈现“上升-下降”的趋势(图2),在3 h 达到峰顶,表达量为CK 的1.414 倍,与CK 相比达显著差异水平。后面持续下降,24 h 表达量最低,为CK 的0.476 倍,达显著差异水平。
H2O2处理后,其基因表达量呈现出“上升-下降-上升-下降”趋势(图2),分别在1 和12 h 达到峰顶,表达量分别为CK 的2.543 和2.719 倍,与CK相比达到极显著差异水平。在6 h 达到第一个峰底,峰底的表达量为CK 的1.045 倍。在24 h 达到第二个峰底,峰底的表达量为CK 的0.785 倍。
以上说明SikCDPK1基因表达除受Ca2+影响外,还受ABA、GA3、SA、H2O2的影响。
2.3 SIKCDPK1 蛋白的表达与纯化
将37 ℃诱导8 h 的高表达蛋白,使用Histrap FF Column 层析柱,进行Ni2+亲和层析纯化,分别用200、500、600 mmol·L-1浓 度 的 咪 唑 液 洗 脱,经SDS-PAGE 检 测 后,发 现500 mmol·L-1咪 唑 洗 脱纯化后的蛋白产物浓度与纯度比较高,获得大小为63.5 KD 的纯化蛋白(图3)。

图3 SIKCDPK1 重组蛋白纯化Fig.3 Purification of SIKCDPK1 recombinant protein
2.4 体外激酶活性分析
ATP 与荧光素酶结合,使反应液由不发光状态转变为发光状态,发光值越大表明ATP 含量越高,随着酶促反应时间的延长,ATP 被消耗,发光值越来越小,因此酶活力与发光值成反比,本研究通过检测不同时间段溶液中的发光值,利用发光值的改变量(对照与样品之间相对光单位RLU 的差值),评估反应液中的ATP 含量,判断激酶的活性。有Ca2+时,随着反应时间的延长,ATP 逐渐被消耗,发光值越来越低(图4)。而换成Ca2+螯合剂EGTA 时,发光值随时间的延长没有发生明显的变化。说明有Ca2+时,SIKCDPK1 具有激酶催化活性,Ca2+被螯合剂EGTA 阻断后,SIKCDPK1 几乎没有激酶活性。

图4 SIKCDPK1 激酶活性Fig.4 Kinase activity of SIKCDPK1
SIKCDPK1 激酶活性随着Ca2+浓度的升高而呈“S”型的变化趋势(图5),当Ca2+浓度为14.0~79.0 nmol·L-1时,SIKCDPK1 激 酶 活 性 快 速 升 高,浓 度 为79.0~135.0 nmol·L-1时,SIKCDPK1 激 酶 活 性 升 高 速 率 减 慢,SIKCDPK1 激酶活性达到最大的1/2 所需要的Ca2+浓度(K0.5)为48.7 nmol·L-1。

图5 Ca2+对SiKCDPK1 活性的激发Fig.5 Trigger action of SIKCDPK1 activity by Ca2+
检测不同浓度HisⅢ发生酶促反应时的发光值,发现当底物HisⅢ浓度为0~100 μg·mL-1时,其酶促反应速率急剧增加(图6),浓度为100~250 μg·mL-1时,反应速率平稳,浓度为250~500 μg·mL-1时,反应速率增加较慢,500 μg·mL-1时达到最大反应速率。用不同浓度HisⅢ发生酶促反应时的发光值与不加HisⅢ时的发光值的差值代表酶活性的改变量,经GraphPad Prism 9.1 软 件 中 的 enzyme kinetics Michaelis-Menten 计 算 得 到SIKCDPK1 的Km值 为43.8 μg·mL-1。
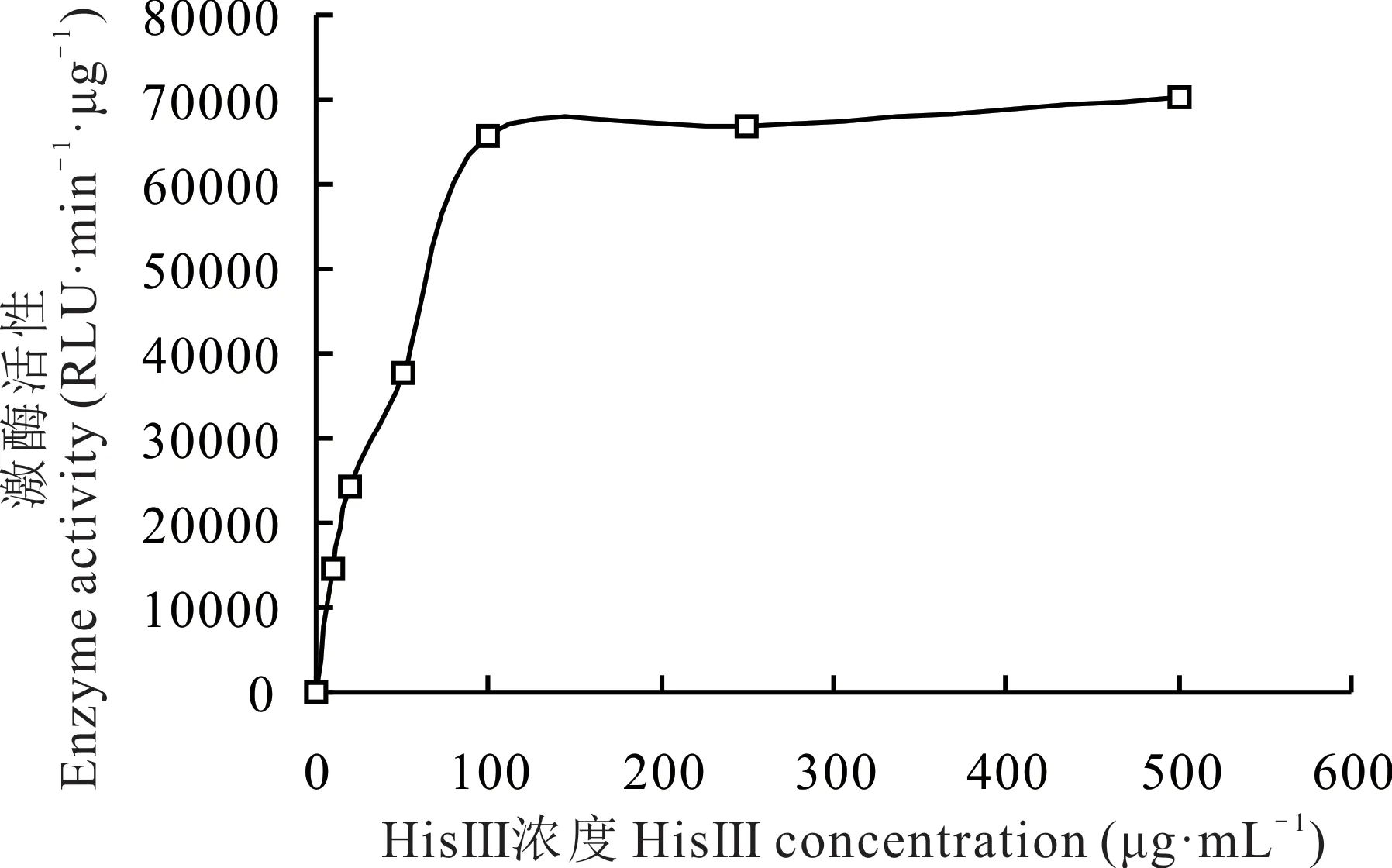
图6 底物HisⅢ的Km值Fig.6 The Km value of substrate HisⅢ
2.5 SIKCDPK1 蛋白亚细胞定位
为探究SIKCDPK1 的亚细胞定位,将SikCDPK1 基因与绿色荧光蛋白基因GFP融合后,构建了植物融合表达载体pBI121-SikCDPK1-GFP,通过农杆菌介导法侵染洋葱鳞茎表皮细胞后,在激光共聚焦显微镜下观察荧光。如图7 所示,侵染后的洋葱表皮细胞能够检测到较强的荧光信号,并且绿色荧光都集中在细胞核上,其余部位并未检测到绿色荧光信号。对照35S-GFP在细胞膜与细胞核内均有绿色荧光分布,而未做侵染的洋葱表皮细胞内检测不到荧光信号,因此判定SIkCDPK1 蛋白主要定位在细胞核。

图7 SikCDPK1-GFP 融合蛋白亚细胞定位Fig.7 Subcellular localization of SikCDPK1-GFP fusion protein
3 讨论
实时荧光定量PCR 结果表明,SikCDPK1基因表达量由高到低依次是种子、叶片、茎、根、幼叶、幼茎,说明天山雪莲种子、叶片、茎、根中都存在SikCDPK1基因,但该基因在各器官表达水平不一样,成熟组织中的基因表达量高于幼嫩组织,叶片中的基因表达量高于茎中的,说明SikCDPK1基因表达没有明显的组织特异性。
本研究发现SikCDPK1基因表达除受Ca2+影响外,还受ABA、GA3、SA、H2O2影响。ABA、GA3、SA、H2O2是逆境防御系统中重要的信号分子,在拟南芥中发现AtCPK3、AtCPK6、AtCPK21、AtCPK23基因参与ABA 诱导的气孔关闭[21],AtCPK10也参与ABA 和Ca2+介导的气孔运动[22],AtCPK8在ABA 和H2O2介导的信号转导中起抗旱作用[13],玉米(Zea mays)ZmCPK1响应 H2O2诱导,参与H2O2信号传导途径[23]。水稻OsCPK21参与ABA 介导的下游逆境基因的表达[24],这些研究表明CDPKS可参与多种信号转导通路并在逆境响应中发挥作用。SikCDPK1基因具体如何参与这些信号分子的信号途径来发挥抗逆作用,需进一步深入研究。
体外激酶活性分析发现Ca2+存在时,SIKCDPK1 具有激酶催化活性,加入Ca2+螯合剂EGTA 后,SIKCDPK1几乎没有激酶活性,这与番茄LeCPK2 蛋白激酶是Ca2+依赖性的研究结果相似[25],证实SIKCDPK1 发挥激酶活性也是需要Ca2+的。冰叶日中花(Mesembryanthemum crystallinum)McCPK1 激酶活性能被K0.5为0.15 μmol·L-1的Ca2+激活[26],烟草NtCPK5 激酶活性能被K0.5为0.04 μmol·L-1的Ca2+激活[27],NtCPK4 激酶活性能被K0.5为0.25 μmol·L-1的Ca2+激活[28]。拟南芥AtCPK11被0.55 μmol·L-1的Ca2+激活[29]。本研究发现SIKCDPK1 激酶活性随Ca2+浓度增加而增加,Ca2+浓度(K0.5)为48.7 nmol·L-1时,SIKCDPK1 激酶活性可达到最大活性的1/2,说明该激酶活性可受nmol·L-1级别Ca2+浓度的激发。以HisⅢ为底物时,SIKCDPK1 的Km值可达43.8 μg·mL-1,说明SIKCDPK1 激酶活性不仅受到Ca2+浓度的影响,还受到底物HisⅢ浓度的影响,推测Ca2+和底物等影响因素可能会在细胞内形成一种复合的环境共同调控SIKCDPK1 的激酶活性,并将Ca2+信号向下游传递,使植物参与逆境响应。
亚细胞定位分析发现SIKCDPK1 蛋白定位于细胞核,采用Prosite 数据库分析发现SikCDPK1在N-端(220~225)(547~552)处有 2 个豆蔻酰化位点。在烟草NtCDPK2亚细胞定位中发现,少量的豆蔻酰化位点不能使蛋白稳定结合在膜结构上,多个豆蔻酰化位点才能使CDPKS稳定结合于膜上[30]。豆蔻酰化位点修饰后,蛋白与膜结合较松散,大多定位于细胞质和细胞核[31]。玉米ZmCK1含有一个豆蔻酰化位点,定位于细胞质与细胞核[32]。棕榈酰化位点修饰可以增强蛋白质疏水性,促进蛋白质与膜结合,使蛋白质在膜间的亚细胞运输过程中发挥重要作用[33]。SikCDPK1豆蔻酰化位点少,又无棕榈酰化位点,这可能是SIKCDPK1 蛋白定位于细胞核而不能定位细胞膜的原因。SIKCDPK1 蛋白定位于细胞核,推测其主要在细胞核里发挥作用。
4 结论
SikCDPK1基因在天山雪莲种子、叶片、茎、根中都表达,无明显组织表达特异性,该基因响应信号分子Ca2+、ABA、GA3、SA、H2O2诱导表达且响应模式有差异。SIKCDPK1 发挥激酶活性需要Ca2+,受nmol·L-1级别Ca2+浓度的激发,SIKCDPK1 主要在细胞核发挥作用。本研究丰富了对雪莲SikCDPK1基因的认知,为进一步深入研究SikCDPK1基因的表达机制奠定了基础。

