基于SSR 标记的河南省假俭草群体遗传多样性研究
吉轶楠,任雪锋,苟甜甜,臧国长,郑轶琦
(河南科技大学园艺与植物保护学院,河南 洛阳 471000)
假俭草(Eremochloa ophiuroides)为禾本科(Gramineae)蜈蚣草属(Eremochloa)的一种多年生草本植物,是世界三大暖季型草坪草之一[1]。假俭草因植株低矮、青绿期长、适应性强而被广泛应用于草坪绿化、建植运动场草坪、边坡防护和库区生态改良等[2]。前人利用DNA 扩增指纹(DNA amplified fingerprints, DAF)、扩增片段长度多态性(amplified fragment length polymorphism, AFLP)、随机扩增多态性DNA(random amplified polymorphic DNA, RAPD)、简单序列间重复序列(inter-simple sequence repeat, ISSR)、相关序列扩增多态性(sequencerelated amplified polymorphism, SRAP)、简单重复序列(simple sequence repeat, SSR)分子标记技术已开展了大量的假俭草遗传多样性研究[3-14],Weaver 等[3]利用DAF 研究美国5 个假俭草种质之间的遗传关系,结果表明多态性水平相对较低,供试种质可能有共同的来源。我国学者利用AFLP 标记[4]、RAPD 标记[5-6]、ISSR 标记[7-8]、SRAP 标记[11]研究我国的假俭草种质资源的遗传多样性,结果均表明假俭草具有较丰富的种质资源遗传多样性。Li 等[14]基于下一代测序技术开发了大量假俭草SSR 引物序列,并研究我国43 个假俭草种质资源遗传多样性,结果显示供试假俭草具有较丰富的遗传多样性。
在全球气候变化的背景下,研究人员越来越关注温度、降水和日照等环境因素对植物种群分布格局的影响。由于气候和环境异质性,种群面临不同程度的选择压力[15],植物种群的位置固定且扩散能力较低,因此在环境异质性中面临的环境选择压力较大,可能导致植物基因型频率的差异[16],产生适应性进化,以不断响应生境的改变[17-18]。Hamasha 等[19]利用AFLP 分子标记研究了来自约旦不同生物气候区4 种针茅(Stipa capillata)种群,结果表明其遗传多样性与温度和降水相关,环境梯度显著影响针茅种群的遗传结构。Wu 等[20]利用SSR 标记研究中国58 个穗状狐尾藻(Myriophyllum spicatum)种群,结果表明环境和地理隔离共同影响狐尾藻种群遗传结构,其中环境的影响较大。Gao 等[21]利用SSR 标记研究中国黄河三角洲的30 个芦苇(Phragmites australis)自然斑块,结果表明环境异质性与芦苇种群遗传结构变异密切相关。在种群历史动态、环境异质性和人类的干扰下,物种生境的片段化和隔离已成为野生种质资源保护中的一个严重问题。这种隔离对种群遗传多样性的影响由于受多种因素干扰一直是研究的热点[22-23]。生境的片段化和隔离通常导致形成分布区核心和边缘居群。边缘居群是指位于物种分布区的边缘区域的居群[24],由于边缘居群生境较核心居群恶劣,对环境变化的响应可能更明显,物种对于环境变化的响应主要取决于边缘居群的响应[25],因此,研究边缘居群的遗传多样性与群体遗传结构对种质资源保护十分重要。关于核心和边缘居群的遗传多样性,有两种不同的观点。第一种观点认为,由于边缘居群数量少、孤立,处于适宜生境的边缘,因此可能会遭受近亲繁殖和遗传漂变,从而导致边缘居群的遗传多样性较低。许多先前的研究表明,核心居群的遗传多样性高于边缘居群[25-26],另一种观点认为,边缘居群经历高度自然选择,强烈的选择压力将筛选出具有优质基因的种质资源并产生新物种的来源,造成边缘居群的遗传多样性较高[27-29]。李霓等[27]利用SSR 分子标记研究肋果沙棘(Hippophae neurocarpa)北缘5 个居群,结果表明肋果沙棘北缘居群遗传多样性丰富,居群内变异较居群间大。Van 等[28]研究来自法国和卢森堡21 个蝇子草(Silene nutans)边缘和核心居群等位酶的变异,结果显示其边缘种群的遗传多样性较高。Liu 等[29]利用SSR 分子标记研究了我国4 个省毛红椿(Toona ciliatavar.pubescens)核心和边缘居群的遗传多样性,结果表明位于云贵高原的边缘种群,在适应高原生境的过程中分化出不同生态型或基因型从而导致其遗传多样性水平高于核心种群。Shi 等[30]利用SSR 分子标记研究我国6 个省12 个核心苦槠(Castanopsis sclerophylla)种群和5 个边缘种群,结果表明边缘苦槠种群遗传多样性更高。假俭草主要分布在长江流域和我国南部地区,包括河南、四川、湖北、湖南、广西和广东等17 个省市[31],根据假俭草的分布及前人对假俭草种质的调查收集研究[10]可知,河南省是假俭草在华中地区分布的北缘,河南省的假俭草种质资源主要分布于大别山和桐柏山[32]。因此探究河南省假俭草种质资源的遗传多样性与影响其分布的因素,对假俭草的开发保护及利用具有重要意义。综上所述,本研究利用SSR 技术研究河南省假俭草种质资源的遗传多样性与群体遗传结构,探究地理距离、环境因子对群体结构的影响,旨在揭示河南省假俭草种质资源的遗传多样性及种群遗传分布格局形成的原因,为假俭草种质资源的收集、开发及保护奠定基础,为今后进一步开展转录组学研究,进行基因功能注释,探讨河南省假俭草适应性进化机制提供理论依据。
1 材料与方法
1.1 试验材料
根据中国数字植物标本馆(https://www.cvh.ac.cn)、《河南植物志》[32]以及相关文献记载[10],结合本课题组前期的实地踏查发现河南省野生假俭草主要分布于河流沿岸,本研究于2021 年4-10 月根据其分布现状选取8个假俭草野生居群(C1~C8),居群内取样间隔大于10 m,采集无病虫害的健康叶片,共采集141 份材料,储存在装有硅胶的密封袋中,以备后期试验。8 个居群分布情况见图1,采样地及样本数量详见表1。部分居群受人为因素破坏,样本取样数量不足20 份,其中C1居群位于水稻(Oryza sativa)田的田埂上,大面积水稻种植使假俭草生境破坏严重,该居群只采集到5 份材料;C6居群位于正在施工的桥梁下,只采集到16 份材料。

表1 假俭草采集地概况Table 1 General situation of collecting areas of centipedegrass

图1 8 个假俭草居群的地理分布Fig.1 Geographic distribution of 8 centipedegrass populations
1.2 气候数据
假俭草采集地气候数据获取自WorldClim 网站(www.worldclim.org),利用Arcgis 10.2 软件根据采集地经纬度提取。从WordClim 网站获取假俭草居群的19 个环境变量,分别是年平均温、年降水量、温度年变化范围、温度季节性、降水季节、等温性、平均日较差、最热月最高温度、最暖季平均气温、最暖季降水、最干旱月份的降水量、最冷季平均气温、最冷月份最低温度、最冷季降水、最干燥季平均气温、最干燥季降水、最湿季平均温度、最湿季月份降水量、最湿季降水。为了避免过高估计环境变量的贡献,剔除12 个Pearson 强相关的环境变量,保留7 个环境变量(表2)。

表2 提取的假俭草居群的环境变量Table 2 Environmental variables extracted from the populations of centipedegrass
1.3 试验方法
利用北京天根生化科技有限公司的DP350-02 植物DNA 提取试剂盒提取供试材料的DNA。分别用1%的琼脂糖凝胶电泳、紫外分光光度计(T6 新世纪,北京普析通用仪器有限责任公司)检测所提取DNA 的质量、浓度及纯度,并将DNA 溶液稀释至30 ng·μL-1,保存在-20 ℃环境。从Li 等[33]的报道中选用30 对多态性信息含量(polymorphism information content, PIC)高的假俭草SSR 引物进行预试验,最终筛选出10 对多态性高且重复性稳定的引物(表3),扩增反应体系和程序参照Li 等[33]的方法。

表3 本研究所采用的 SSR 引物序列Table 3 Sequences of SSR primers used in the study
1.4 数据分析
对扩增得到的带型用GeneMarker 进行判定。用GenAlEx 6.5[34]转换数据格式,进行分子方差分析(analysis of molecular variance, AMOVA)。用POPGENE 1.32[35]分析遗传多样性的相关参数:等位基因数(observed number of alleles, Na)、有 效 等 位 基 因 数(effective number of alleles, Ne)、Shannon’s 遗 传 多 样 性 信 息 指 数(Shannon’s information index,I)、Nei’s 基 因 多 样 性 指 数(Nei’s gene diversity,H)、观 测 杂 合 度(observed heterozygosity, Ho)及期望杂合度(expected heterozygosity, He)。并用Cervus 3.07[36]计算多态性信息含量、等位基因频率。
多态性信息含量(polymorphic information content, PIC)计算公式为:
式中:Pi为第i个等位基因频率。
用NTSYS-pc 2.1 软件[37]的非加权组平均法(unweighted pair-group method with arithmetic means, UPGMA)进行聚类,并对地理距离与遗传距离进行Mantel 检验。根据供试材料的遗传距离用MEGA 6.0[38]得到141 份假俭草的树状聚类图,Bootstrap 的初始值设为1000 来检验发育树的可信度。用Structure 2.3.4[39]分析假俭草的群体遗传结构,为了计算K 值,本研究从1~10 依次测试,对每个K 值独立运行10 次。并将结果导入在线程序Structure harvester(http://taylor0.biology.ucla.edu/structureHarvester/)预测最佳群体数,依据Q 值>0.7[40]来划分不同亚群。用R 语言ade4 工具包[41]进行主坐标分析(principal coordinate analysis,PCoA)。用CANOCO 5.0 进行冗余分析(redundancy analysis, RDA)[42]来检测环境变量对遗传结构的相对贡献。利用软件BayeScan 2.1[43]计算离群位点,将后验概率>0.76,PO>0.5 的log10 值视为异常位点,用ARLEQUIN 3.5 软件[44]中的分层孤岛模型计算异常位点,将等位基因频率>95%的位点判断为异常位点。将两种方法共同检测到的视为最终确定的异常位点。用R 语言包LEA 中的潜在因子混合模型(latent factor mixed model,LFMM)[45]进行环境位点关联分析,将检测结果中|Z|>3,P<0.001 的视为环境关联位点。
2 结果与分析
2.1 SSR 扩增结果
10 对引物共检测到99 个等位基因(表4)。单个位点观测等位基因数为6~12 个,平均为9.90 个。引物多态性信息含量(PIC)为0.53~0.88,引物TJIB.EO-92 和TJIB.EO-51 的PIC 值最高,引物TJIB.EO-40 的PIC 值最低,10 对引物的平均值为0.78。引物TJIB. EO-51 和TJIB. EO-90 检测到的等位基因数量最多(12.00),引物TJIB.EO-40 检测到的等位基因最少(6.00)。有效等位基因数为2.54~8.96,最大的为引物TJIB.EO-92,最小的为引物TJIB.EO-40,平均为6.12。Shannon’s 遗传多样性信息指数为1.11~2.31,最高的是引物TJIB.EO-51,最低的是引物TJIB.EO-40,平均为1.91。Nei’s 基因多样性指数为0.61~0.89,最高的是引物TJIB.EO-92和TJIB.EO-51,最低的是引物TJIB.EO-40,平均为0.81。观测杂合度为0.26~0.99,平均为0.71,期望杂合度为0.61~0.89,平均为0.81。大多数(60.00%)位点的期望杂合度大于观测杂合度。结果表明,本研究所用的引物均具有较高的多态性。

表4 引物扩增结果Table 4 Primers amplification results
2.2 遗传多样性及方差分析
供试假俭草的平均Shannon’s 遗传多样性信息指数和Nei’s 基因多样性指数分别为1.44 和0.69,多态位点百分率为98.75%(表5),表明供试材料的遗传多样性水平较高。各居群观测等位基因数为4.30~7.90,平均值为6.14,其中C4居群最大,C1居群最小。有效等位基因数为3.11~4.97,平均值为3.94,其中C4居群最大,C8居群最小。Shannon’s 遗传多样性信息指数为1.15~1.73,平均值为1.44,其中C4居群最大,C8居群最小。Nei’s 基因多样性指数为0.61~0.77,平均值为0.69,其中C4居群最大,C8居群最小。观测杂合度为0.58~0.79,平均值为0.69,其中C7居群最大,C1居群最小。期望杂合度为0.63~0.79,平均值为0.72,其中C4居群最大,C8居群最小。C4居群的观测等位基因数、Shannon’s 遗传多样性信息指数、期望杂合度、有效等位基因数及Nei’s 基因多样性指数均最大。综上所述,各居群的不同遗传多样性指标存在一定差异,基于Shannon’s 遗传多样性信息指数,居群遗传多样性从大到小依次为C4>C3>C6>C2>C5>C7>C1>C8。

表5 假俭草居群的遗传多样性Table 5 Genetic diversity of centipedegrass populations (mean±SD)
假俭草居群SSR 位点F统计结果(表6)表明,居群间的遗传分化系数(fixation index, Fst)为0.06~0.35,平均值为0.14,说明居群存在中度遗传分化。采用分子方差分析居群间和居群内的遗传分化程度(表7),居群间的遗传分化贡献为13.04%,而居群内的遗传分化贡献为86.96%,表明河南假俭草居群的遗传分化主要发生于居群内。基因流(number of effective migrants, Nm)均值为1.49,表明各居群间存在较频繁的基因交流(表6)。

表6 假俭草居群SSR 位点F 统计Table 6 F-statistics of SSR in populations of centipedegrass

表7 分子方差分析Table 7 Molecular analysis of variance
2.3 聚类分析及Mantel 检验
8 个居群UPGMA 聚类分析结果(图2)表明,在遗传距离为0.15 处,供试材料共分为3 组,第Ⅰ组包含C1和C6居群,第Ⅱ组包含C7和C8居群,第Ⅲ组包含C2、C3、C4和C5居群。结果显示8 个居群没有完全按照地理来源分组,如地理来源较远的C1和C6居群聚为一组。Mantel 检验结果表明遗传距离与地理距离间无相关性(r=0.30,P=0.95>0.05)。

图2 8 个居群间UPGMA 聚类分析Fig.2 UPGMA cluster analysis among 8 populations
聚类分析结果(图3)表明,141 份假俭草材料分为3 组,第Ⅰ组包含C1、C2、C7、C8居群的全部材料,C3居群的6份材料及C6居群的4 份材料;第Ⅱ组包含C5居群的全部材料,C4居群的8 份材料及C6居群的12 份材料;第Ⅲ组包含C3居群的14 份材料和C4居群的12 份材料。结果表明,部分来自同一居群的材料被分到不同组,如来自C3居群的26~30 号材料被聚在第Ⅰ组,而31~45 号材料被聚在第Ⅲ组。

图3 141 份假俭草材料的UPGMA 聚类分析Fig.3 UPGMA cluster analysis of 141 centipedegrass materials
2.4 群体遗传结构分析和主坐标分析
群体遗传结构分析结果表明,当K=3 时,ΔK 达到峰值(图4),表明供试的141 份假俭草材料被分为3 组(图5),第1 个亚群(红色)主要包括C1、C2、C3居群共47 份材料(33.33%),第2 个亚群(蓝色)主要包括C4、C5、C6居群共39 份材料(27.66%),第3 个亚群(绿色)主要包括C7、C8居群共34 份材料(24.11%),其他21 份材料(14.93%)的Q 值<0.7,属于遗传背景复杂的混合型群体。
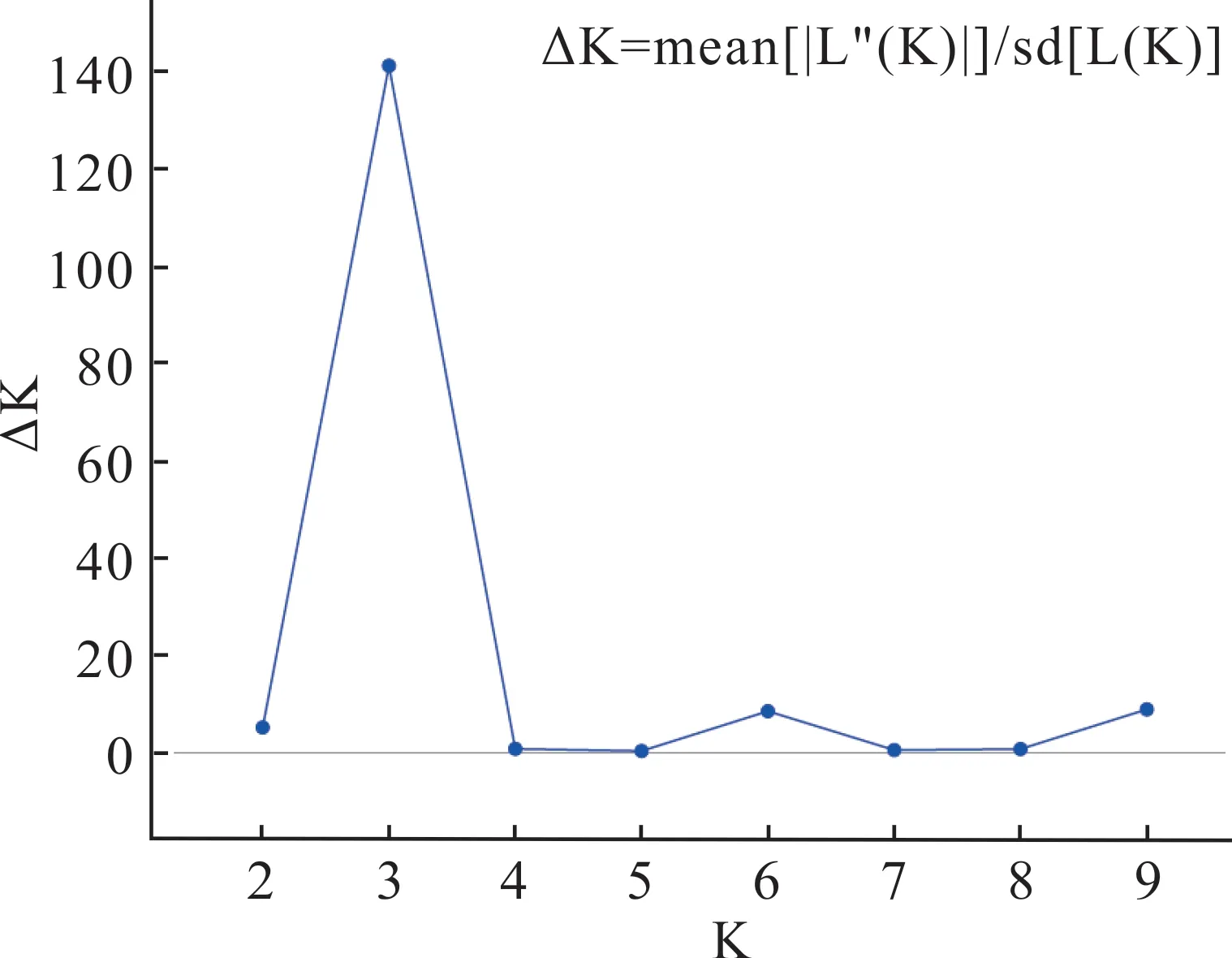
图4 K 与∆K 的变化关系Fig.4 Variation of K and ∆K

图5 基于SSR 标记的K=3 时141 份假俭草群体遗传结构Fig.5 Genetic structure of 141 centipedegrass populations at K=3 based on SSR markers
主坐标分析结果表明,第1 主成分对群体遗传变异的解释为12.04%,第2 主成分为9.25%(图6)。图中材料位置越靠近表明两者亲缘关系越近,反之表明两者亲缘关系较远。PCoA 分析结果显示将材料明显分为3 个亚群,分别是S1(红色)、S2(蓝色)和S3(绿色),混合群(黄色)介于3 个亚群之间,与群体遗传结构分析结果一致。
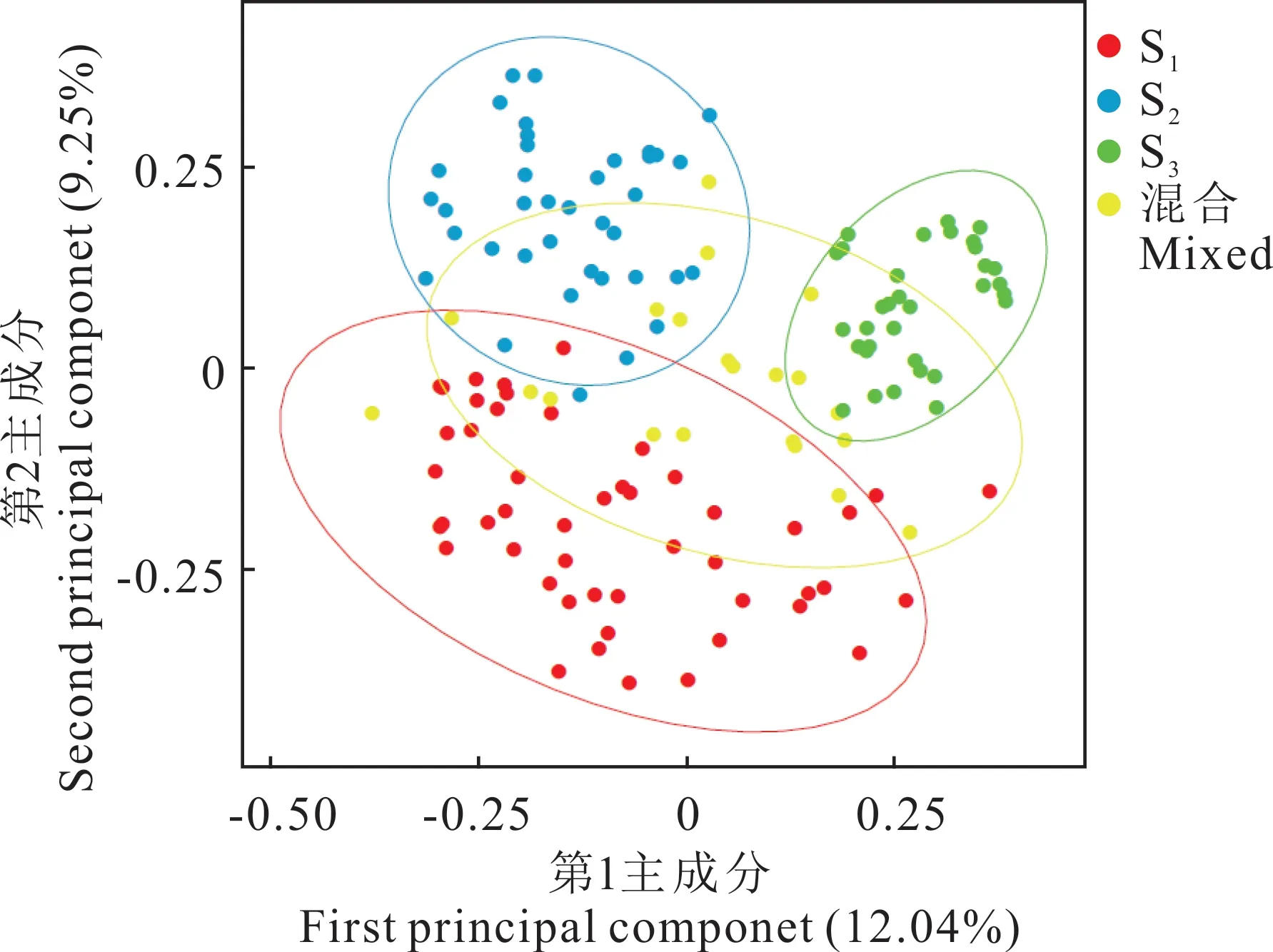
图6 假俭草种质资源的主坐标分析Fig. 6 Principal coordinate analysis of the centipedegrass germplasm resources
2.5 冗余分析
冗余分析(RDA)以遗传变量和经过筛选的7 个环境变量(表2)分别作为响应变量和解释变量,结果表明,轴1 和轴2 的方差百分比分别为14.88%和4.26%(图7)。RDA 结果解释了遗传变量与环境变量之间的关系(表8),各环境因子的贡献度及相关性由大到小依次为最干旱月份的降水量、年平均温、最热月最高温度、最干燥季平均气温、年降水量、温度年变化范围、等温性,其中年平均温、最热月最高温度、最干燥季平均气温、年降水量和最干旱月份的降水量与轴1 呈极显著负相关,等温性和温度年变化范围与轴2 呈显著负相关,最干旱月份的降水量的贡献率及相关性最高,表明最干旱月份的降水量对河南省假俭草的种群遗传结构影响最显著。

表8 各环境变量与排序轴的相关性、解释度及贡献率Table 8 Correlation, degree of explanation and contribution rate of each environmental variables to the ranking axis

图7 RDA 分析环境变量对遗传结构的相对贡献Fig. 7 The relative contribution of environmental variables to genetic structure was analyzed by RDA
2.6 异常位点检测及环境关联分析
用BayeScan 方法共检测到6 个异常位点,占总位点的6.06%,引物TJIB.EO-82 检测到3 个异常位点,引物TJIB. EO-65 检测到2 个异常位点,引物TJIB.EO-29 检测到1 个异常位点。利用Arlequin 的分层岛模型,FDIST2 方法检测到22 个异常位点,占总位点的22.22%,引物TJIB. EO-51 检测到7 个异常位点,引物TJIB. EO-66 检测到4 个异常位点,引物TJIB.EO-90 和TJIB.EO-29 分别检测到3 个异常位点,引物TJIB. EO-31 和TJIB. EO-65 分别检测到2 个异常位点,引物TJIB. EO-82 检测到1 个异常位点。为使结果更真实地代表离群位点,将FDIST2 和BayeScan 两种方法共同检测到的异常位点作为最终确定的异常位点,共有4 个异常位点(图8),占总位点的4.04%。进一步用R 包LEA 中的LFMM 做环境关联分析,4 个共同检测到的异常位点都至少与一个环境变量相关,|Z|得分见表9。位点TJIB.EO-82-3 和TJIB.EO-65-6与1 个环境变量相关,位点TJIB. EO-65-2 和TJIB.EO-29-6 与7 个环境变量显著相关。等温性(Bio 3)和温度年变化范围(Bio 7)相关的环境关联位点数量较多。

表9 |Z|得分确定的环境关联位点Table 9 Environment association site determined by the score |Z|

图8 异常位点的检测结果Fig.8 Detection results of outlier loci
3 讨论
3.1 假俭草的遗传多样性
SSR 标记具有高重复性、高稳定性、操作简单、所需DNA 样品量较少且质量要求不高等优点,被广泛用于分析植物的遗传多样性。本研究选用10 对SSR 引物对采自河南省8 个野生假俭草居群共141 份材料进行了分析,结果表明10 对SSR 引物的平均PIC 值为0.78,Shannon’s 遗传多样性信息指数平均值为1.91。Li等[14]选用50 个SSR 标记评估43 份假俭草种质的遗传多样性,引物PIC 平均值为0.58,Shannon’s 遗传多样性信息指数平均值为1.17。与前人的研究结果相比,本研究所选的SSR 引物PIC 和Shannon’s 遗传多样性信息指数均较高。Susana 等[10]利用SRAP 标记对采自我国7 个省的假俭草居群遗传多样性进行了分析,结果表明供试假俭草的7 个居群中,河南省野生假俭草具有较高的遗传多样性,本研究结果与其一致。河南省是假俭草在华中地区分布的北缘,Thomas 等[17]认为边缘居群处于相对恶劣的条件下,可能面临更大的生存压力,使得居群中营养繁殖机会减少,有性繁殖增加,从而导致遗传多样性较高。不同假俭草居群的遗传多样性存在差异,基于Shannon’s 遗传多样性信息指数居群遗传多样性从大到小依次为C4>C3>C6>C2>C5>C7>C1>C8。穆莹等[46]研究表明居群遗传多样性大小与居群个体数量及人为干扰有关。本研究在前期踏查中发现,C4居群位于人迹罕至的丛林中,居群内假俭草个体数量最多,且该地受人为干扰较少,生境完整。据此推测居群个体数量多、人为干扰较少、生境完整是C4居群遗传多样性高的重要原因。C1居群位于水稻田的田埂上,受人为干扰影响较大,大面积水稻种植使假俭草生境遭到严重破坏,居群个体数量最少,居群内的假俭草个体呈片段化分布状态,造成C1居群的遗传多样性较低。C8居群靠近村庄道路,受人为及动物的干扰,无性繁殖在居群内更占优势,居群内多数假俭草可能来自同一母株,因而C8居群遗传多样性最低。综上所述,C4居群的假俭草种质具有丰富的遗传变异,适应环境变化的能力较强,具有较高的进化潜力,可作为优良种质进行进一步研究。此外受城镇化建设及人类活动的影响,野生假俭草居群的生境遭到不同程度的破坏,今后应重视假俭草种质资源的收集、评价及保护。
3.2 假俭草居群的遗传分化
供试假俭草居群间的遗传分化指数(Fst)为0.14,AMOVA 分析表明河南省假俭草居群的遗传分化主要发生于居群内(86.96%),各居群间存在较频繁的基因交流(Nm=1.49)。宣继萍等[6]利用RAPD研究我国6 个省份50 份假俭草材料,结果表明假俭草居群间遗传分化为30.39%,居群内的遗传分化贡献率为69.61%,基因流(Nm)为1.15。Susana 等[10]利用SRAP 研究我国7 个省49 份假俭草材料,结果表明,居群间遗传分化为6.40%,居群内的遗传分化为93.60%。本研究结果与上述结果基本一致,均表明假俭草居群内遗传分化较高,居群间基因交流较频繁。假俭草为常异交植物,自交不亲和[47]。异交种的遗传变异多发生在居群内导致其遗传分化较高[6]。由于假俭草在河南的分布较局限,主要集中在河南东南部,人、动物的活动,风、水流等自然媒介的传播导致不同居群间花粉、种子及匍匐茎等的交流,造成基因流水平较高。
3.3 地理隔离及基因流对假俭草群体遗传结构的影响
不同居群和141 份材料的聚类分析结果均表明,假俭草没有完全按照地理来源分组,与赵琼玲等[7]、郑轶琦[9]、王婷[12]的研究结果一致,均表明供试材料的地理距离与遗传距离之间无显著相关性。种群遗传结构受自然选择、地理隔离和环境隔离等多种因素的影响[48-51]。Mantel 检验结果表明地理隔离不是影响假俭草种群结构的主要因素,假俭草种群结构的形成可能受环境的影响,因此本研究进一步分析环境因子对假俭草遗传变异的影响,从而揭示假俭草种群遗传分布格局形成的原因。
通过分析种群的遗传结构,可以直观地表明材料之间的遗传关系和基因交流[52]。本研究应用STRUCTURE 软件将141 份假俭草材料分为3 个亚群,分群结果与聚类分析及主坐标分析结果基本一致。大部分材料(85.11%)群体遗传背景单一,基因交流较少,21 份材料属于遗传背景较复杂的混合型群体,基因交流较频繁。由于人为干扰或动物的活动,以及风力或水流的作用,导致不同居群间存在花粉、种子及匍匐茎等的交流,从而导致不同居群间基因交流较频繁,最终形成混合型群体。基因流结果也表明各居群间存在较频繁的基因交流。
3.4 环境因子对假俭草群体遗传结构的影响
为探究环境因子对河南省假俭草群体遗传结构的影响,本研究对假俭草居群的遗传变量与环境变量进行冗余分析,结果表明,5 个环境变量(年平均温、最热月最高温度、最干燥季平均气温、年降水量、最干旱月份的降水量)对供试假俭草群体遗传结构有显著影响,其中3 个环境变量与温度有关,2 个与降水有关,最干旱月份的降水量对河南省假俭草群体遗传结构的影响最大。近年来,国内外学者就环境因素与植物群体遗传结构间的关系进行了诸多研究,部分学者认为温度是影响群体遗传结构的主要因素,如Jiang 等[53]的研究结果表明等温性是影响岭南青冈(Quercus championii)群体遗传结构的最主要环境因素,Shryock 等[54]的研究结果表明年平均气温是影响麻黄(Ephedra nevadensis)和秋葵(Sphaeralcea ambigua)群体遗传结构的主要环境因素,Jia 等[55]认为温度因子是影响侧柏(Platycladus orientalis)群体遗传结构的关键因子。部分研究发现降水是导致群体遗传分化的主要因素,如Miao 等[56]认为最暖季降水是影响黄栌(Cotinus coggygria)群体遗传结构的主要因素,Zhang 等[57]认为年降水量和最湿季降水量是影响白皮松(Pinus bungeana)群体遗传结构的主要因素,Yang 等[58]认为最干旱季降水是影响连翘(Forsythia suspensa)群体遗传结构的主要因素。本研究中由于假俭草在河南省的分布地区较狭窄,供试的8 个采样点气候差异较小,提取的19 个气候因子中仅有7 个不存在极显著相关。8 个居群中C1(22 mm)、C2(24 mm)和C3居群(23 mm)的最干旱月份的降水量较多,C7(14 mm)和C8(14 mm)居群最少,而C4(21 mm)、C5(20 mm)和C6居群(18 mm)居中,群体遗传结构的分群结果将供试材料分为3 组,与最干旱月的降水量的分布情况一致,所以制约假俭草在华中地区北缘分布的最主要因素可能不是温度,而是降水。在前期踏查中也发现,河南省假俭草主要沿河流分布,生境较单一,可能是在长期的自然压力下为了弥补降水不足带来的水分亏缺而选择临河而居。
随着第二代测序技术的广泛应用,更易获得物种基因组信息,可为研究物种适应性基因奠定良好基础[59]。目前,通过筛选环境异常位点进而探究异常位点注释的相应基因功能的方法,被广泛应用到研究物种的局地适应性。Li 等[16]利用简化基因组测序技术研究我国22 个枫杨(Pterocarya stenoptera)居群适应性分化,异常位点检出比例为8.10%,将LFMM 和Samβada 两种方法共同筛选出的异常位点进行功能注释,定位到了与温度、水分和光适应相关的候选基因,阐释了自然选择对枫杨种群局地适应的影响。Yan 等[60]利用RAD-seq 技术分析我国27 个短花针茅(Stipa breviflora)种群遗传分化分子机制,利用Fst 异常值检测的方法共筛选到494 个异常位点,异常位点检出比例为1.92%,28 个异常位点成功比对到转录组序列,反映出高温、干旱、紫外线等环境因素是影响短花针茅种群遗传分化的重要因素。本研究结合FDIST2 和BayeScan 两种方法共同检测到4 个异常位点,异常位点检出比例为4.04%,由于标记技术及位点数量有限,本研究结果虽然检测到部分与环境因子关联的位点,但需要进一步结合第二代测序技术开展与转录组学相结合的研究,进行基因功能注释,系统地揭示假俭草的适应性进化机制。
4 结论
本研究利用SSR 技术对采自河南省8 个野生假俭草居群共141 份材料进行群体遗传结构分析。结果表明河南省假俭草资源遗传多样性较高,居群内的遗传分化较高,居群间基因交流较频繁,揭示了河南省假俭草种群遗传分布格局的形成主要是由最干旱月的降水量决定的。未来可结合第二代测序技术开展与转录组学相结合的研究,进行基因功能注释,系统地揭示假俭草的适应性进化机制。

