外源褪黑素对干旱胁迫下玉米幼苗根系发育及生理生化特性的影响
姜瑛,张辉红,魏畅,徐正阳,赵颖,刘芳,李鸽子,张雪海,柳海涛
(1. 河南农业大学资源与环境学院,河南 郑州 450002;2. 河南农业大学农学院,省部共建小麦玉米作物学国家重点实验室,河南 郑州 450046)
全世界14 多亿hm2耕地中,有43%的区域属于干旱和半干旱,造成作物产量损失约50%,高于其他自然灾害的总和[1-2]。干旱胁迫作为一种多维胁迫,可以引起植物中一系列生理生化反应,甚至导致植物的光合作用停止和细胞代谢的紊乱,造成植物的死亡,限制了植物的生产力[3]。干旱胁迫可导致植物体内过氧化物和活性氧(reactive oxygen species, ROS)含量积累,造成植物体内ROS 的产生和清除失衡,引起细胞膜过氧化、蛋白质氧化、膜通透性改变,使植物丙二醛(malondialdehyde, MDA)含量升高,渗透调节和抗氧化能力下降,影响植物正常发育[4-6]。植物会通过一系列的防御机制缓解干旱胁迫下过度积累的ROS 对自身造成的危害[7]。干旱胁迫下,渗透调节物质(包括可溶性蛋白、可溶性糖等)降低细胞渗透势,从而维持正常的渗透压,促使细胞从外界吸水,防止细胞失水[4],同时还能够保护细胞内大分子结构[8]。植物受到干旱胁迫时,其叶片光合生理会发生明显变化,主要通过净光合速率和蒸腾速率等来反映[9],主要表现为光合作用和光合速率下降,从而导致植物生物量降低[10]。为了降低和消除干旱胁迫下植物体内产生的氧化胁迫,植物细胞体内产生了由超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase, APX)、谷胱甘肽(glutathione, GSH)、抗坏血酸(ascorbate, AsA)等组成的自我防御系统[11]。使用褪黑素(melatonin, MT)、赤霉素(gibberellin, GA)等多种外源植物激素对干旱胁迫下植物的生理过程有着积极的影响[12-15]。
褪黑素又称松果体素,分子式C13N2H16O2,化学名称为N-乙酰基-5-甲氧基色胺,是一种内源性的自由基清除剂和抗氧化剂,能够有效清除过量的活性氧物质(ROS)、刺激抗氧化酶活性进行抗氧化调节、增强抗氧化剂的抗氧化能力、提高线粒体内部氧化磷酸化进行抗氧化调节[16]。研究表明,外源褪黑素能够促进植株生物量积累,改善干旱胁迫对根系构型的抑制作用[17],降低MDA 含量,缓解胁迫对细胞膜的毒害[18],清除过量自由基,提高渗透调节物质含量[19],增加叶片叶绿素含量,提高光合速率[20],促进还原性物质AsA、GSH 含量提高[21],增加抗氧化酶活性和含量[22],缓解干旱胁迫对植株生长发育的抑制作用。褪黑素可以提高植物的耐旱性,但其具体表现以及褪黑素对植物耐旱性影响的潜在机制还需要进一步探究。
玉米(Zea mays)属于禾本科玉蜀黍属,是世界三大主要作物之一,同时也是重要的饲草来源,为高耗水植物,对干旱胁迫反应较为敏感,整个生育期需要充足的水分供应[23],尤其是苗期的干旱逆境对玉米的增产有重要影响[24]。而且,玉米是单株生产力较强的禾谷类作物,拥有极强的根系是其高产的主要原因之一[25]。植物根系是影响产量的重要器官,是连接地上部与土壤水分、养分的桥梁,发挥着固持地上组织和汲取地下水分养分的双重功能,与作物的生长发育及产量密切相关[23]。有研究发现,干旱胁迫会导致玉米叶片内自由基大量产生和积累,从而引发膜脂过氧化作用,细胞膜稳定性下降,导致玉米的生长发育受到阻碍[26]。韩希英等[27]的研究结果表明,干旱会抑制玉米根系生长,减弱根系吸收能力,从而造成玉米减产。马旭辉等[28]研究发现,外源褪黑素可促进干旱条件下玉米根系发育,减轻对氧化系统的损伤,缓解产生的光合抑制,从而提高玉米的抗旱性。
目前应用聚乙二醇(PEG-6000)模拟自然干旱已经成为研究植物幼苗抗旱性的重要手段[29]。本研究主要利用PEG-6000 模拟干旱胁迫环境,通过叶片喷施的方法,探讨不同浓度的褪黑素对玉米幼苗的根系构型及分级特征、生长及光合特性、抗氧化能力和渗透调节物质含量的影响,丰富玉米的抗旱性研究,为探索褪黑素提高植物抗旱性的生理机制提供理论依据。
1 材料与方法
1.1 供试材料
供试玉米品种为郑单985,种子购买于河南秋乐种业科技股份有限公司。霍格兰(Hoagland)营养液配方为:4 mmol·L-1Ca(NO3)2·4H2O、6 mmol·L-1KNO3、2 mmol·L-1MgSO4·7H2O、1 mmol·L-1NaH2PO4·2H2O、46.1 μmol·L-1H3BO3、9.1 μmol·L-1MnCl2·4H2O、0.76 μmol·L-1ZnSO4·7H2O、0.32 μmol·L-1CuSO4·5H2O、0.08 μmol·L-1Na2MoO4·2H2O、100 μmol·L-1EDTA-Fe。褪黑素购自美国Sigma 公司,相对分子质量为232.28,分子式C13H16N2O,纯度为>99%。试验所用模拟干旱胁迫的聚乙二醇购买于索莱宝生物有限公司。
1.2 试验设计
本试验于2021 年10 月在河南农业大学资源与环境学院光照室内进行,温室设置的昼夜条件为16 h/8 h,昼/夜温度26 ℃/20 ℃,光照强度400 μmol·m-2·s-1,湿度75%±5%。
选择健康、大小均匀的玉米种子在5%的H2O2中浸泡消毒15 min,用去离子水充分冲洗以清除种子表面的H2O2,在黑暗、温度为25 ℃的条件下,将清洗过后的种子在育苗盆中浸泡12 h,之后取出种子均匀摆放在浸润的纱布上,保持种子湿润,催芽72 h 后转入温室。在盛有1/4 Hoagland 营养液的体积为2 L 的培养盒中,移栽生长至一心一叶时的玉米幼苗进行培养,每盆种植9 株幼苗,在幼苗生长至两叶一心之前,每2 d 更换1/2 Hoagland 营养液,当玉米生长至两叶一心时,更换全Hoagland 营养液并及时处理。将浓度为15%的聚乙二醇(PEG-6000)加入营养液中模拟干旱胁迫,本试验共设置5 个处理:1)CK:叶面喷施清水为空白对照(喷施以雾状水汽在叶片表面形成水滴自然落下为止);2)MT0:15% PEG 的营养液+叶面喷施清水;3)MT10:15% PEG 的营养液+叶面喷施10 μmol·L-1褪黑素;4)MT50:15% PEG 的营养液+叶面喷施50 μmol·L-1褪黑素;5)MT100:15% PEG 的营养液+叶面喷施100 μmol·L-1褪黑素,每个处理设置3 盆重复,施加处理5 d 后采样。
1.3 测定指标与方法
1.3.1 生物量的测定 每个处理取3 株长势均匀一致的植株样品用干净的剪刀将地上部和根进行分离,去离子水冲洗干净后用吸水纸吸干表面的水分,测定植株的株高、主根长、地上部鲜重和根鲜重,将根系于20 mmol·L-1的 EDTA-Na2溶液中浸泡15 min,用去离子水重复冲洗3 次,用于根系形态测量后,装入信封,和地上部一同于电热恒温鼓风干燥箱(GZX-9420MBE,上海)105 ℃下杀青30 min 后70 ℃累计烘干48 h 至恒重,用分析天平(PTX-FA2,福建)称取植株干重。
1.3.2 根系构型指标的测定 各处理选取3 株完整的根系,将洗净根系放入20 cm×40 cm 根盘中,置于根系扫描仪(V700 PHOTO,Epson,日本)上,根盘中添加高度为5~10 mm 水,使水面恰好全部没过根系,再用仪器遮光板全部覆盖住根盘,使用根系扫描仪进行根系全景扫描。然后利用图像分析软件(WinRHIZO™ 2003b, 加拿大)测定以下指标:总根长(total root length, RL)、根表面积(root surface area, SA)、根体积(root volume, RV)、根平均直径(root average diameter, RD)、根尖数(root tips, RT)和分枝数(root forks, RF)以及根系构型分级参数。根据根系直径(RD, mm)大小对 RL、SA 和 RV 进行区间等级定义:Ⅰ级:RD 0~0.5 mm;Ⅱ级:RD 0.5~1.0 mm;Ⅲ级:RD 1.0~1.5 mm;Ⅳ级:RD>1.5 mm。
1.3.3 光合参数的测定 各处理选取3 株长势一致且完整的植株,使用便携式光合测定仪(Li-6400, LICOR Inc., 美国)测定第一片完全展开叶片的光合速率(photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci)和蒸腾速率(transpiration rate,Tr)。
1.3.4 可溶性蛋白含量的测定 采用考马斯亮蓝G-250 染色法[30]测定可溶性蛋白含量。
1.3.5 丙二醛含量的测定 采用硫代巴比妥酸(TBA)法测定MDA 含量[31]。
1.3.6 抗坏血酸和谷胱甘肽含量的测定 参照Zhang 等[32]的方法测定AsA 含量;参照Guri[33]的方法测定GSH 含量。
1.3.7 抗氧化酶活性测定 参考王学奎等[34]的方法,采用氮蓝四唑(nitro-blue tetrazolium, NBT)光化学还原法测定SOD 活性;采用愈创木酚法[34]测定POD 活性;采用H2O2氧化还原法[34]测定CAT 活性;采用比色法[35]测定APX 活性。
1.4 数据统计分析
采用Microsoft Excel 2019 处理数据,SPSS 25.0 和Metabo Analyst 5.0 软件进行数据分析,通过LSD 检验(P<0.05)进行单因素方差分析(ANOVA)处理间的差异显著性,采用Pearson 法进行指标间的相关性分析,使用Origin 2021 作图。
3) 能解决部分边际油田和短距离必须使用DPST的问题,提高VLCC的作业范围和作业条件,降低原油的装载成本。
应用隶属函数法对不同处理抗旱性进行综合评价。利用隶属函数值公式:
反隶属函数值公式:
式中:Xi为指标的测定值;Xmin和Xmax分别为所有处理的某一指标的最小值和最大值;R(Xi)表示指标Xi的隶属函数值,然后把每个处理的隶属函数值求和求平均值,根据平均隶属函数值的大小确定不同处理的抗旱性,该值越大说明抗旱能力就越强。如果所测指标与干旱胁迫呈正相关就用隶属函数(1)式,呈负相关就用反隶属函数(2)式。
2 结果与分析
2.1 干旱胁迫下不同浓度褪黑素处理对玉米幼苗生长及生物量的影响
干旱胁迫下,玉米幼苗地上部和地下部的生长和发育都受到了不同程度的抑制,与CK 相比,MT0处理下玉米幼苗的株高、地上部鲜重和干重、主根长、地下部鲜重和干重显著降低了24.03%、65.90%、56.96%、24.35%、49.69%和60.59%。相比干旱处理(MT0),喷施50 μmol·L-1的褪黑素,玉米幼苗的株高、地上部鲜重和干重、地下部鲜重和干重、茎耐受指数和根耐受指数显著增加了18.12%、67.16%、114.40%、38.27%、129.62%、113.95% 和130.77%。喷施褪黑素后根冠比进一步提高,在MT10处理达到最大,相比于MT0处理提高了31.25%(表1 和图1)。

图1 干旱胁迫下不同浓度褪黑素处理对玉米幼苗生长表型的影响Fig. 1 Effects of different concentrations of melatonin on growth phenotype of maize seedlings under drought stress
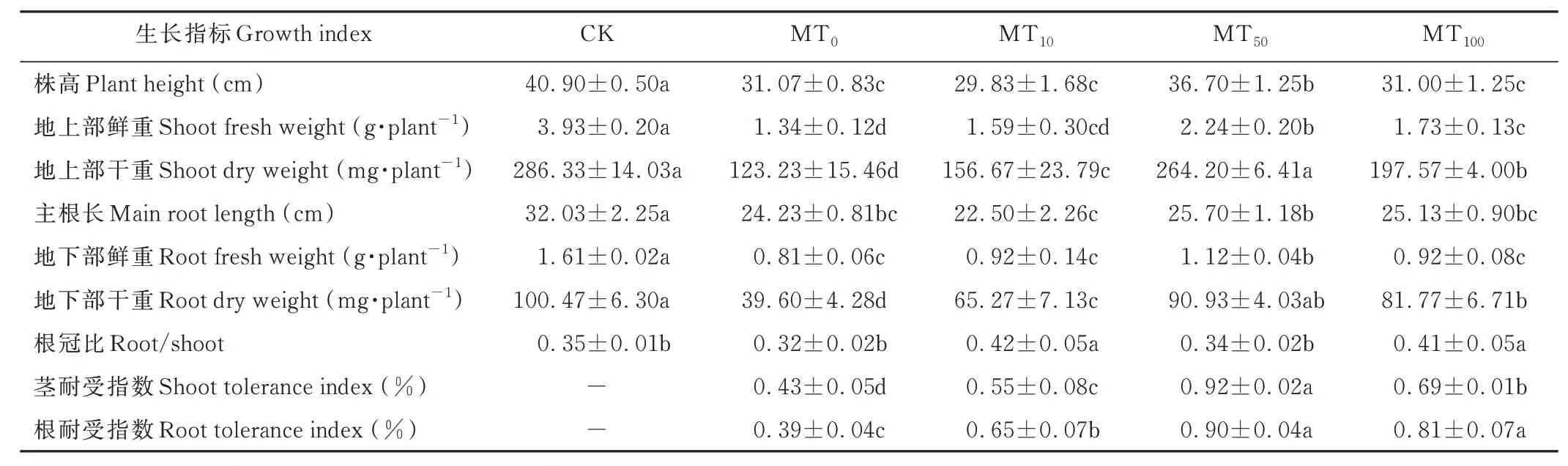
表1 干旱胁迫下不同浓度褪黑素处理对玉米幼苗生长及耐受指数的影响Table 1 Effects of different concentrations of melatonin treatments on the growth and tolerance index of maize seedlings under drought stress (mean±SD)
2.2 干旱胁迫下不同浓度褪黑素处理对玉米幼苗根系构型分级的影响
与CK 相比,在MT0处理下,玉米幼苗的RL、SA、RV 和RT 显著降低,分别降低了67.48%、55.59%、39.13%和73.72%(表2)。并且,干旱胁迫显著抑制了Ⅰ~ Ⅲ径 级 区 间 的RL(73.57%、38.43% 和0.97%)、SA(69.48%、41.38% 和49.37%)和RV(64.00%、43.75%和50.00%)。外源喷施褪黑素明显缓解了干旱胁迫对玉米幼苗的抑制作用,其中当喷施50 μmol·L-1的褪黑素时(MT50),玉米幼苗的RL、SA 和RT 均达到最高,与MT0处理相比,分别增加了83.58%、63.96%和85.11%,RV 和RD 在MT100处理时达到最大,升高了48.21%和2.22%。Ⅰ和Ⅱ级径级区间的RL、SA 和RV 均在MT50处理下达到最高,与MT0处理相比,RL 的Ⅰ级、SA 的Ⅰ级、RV 的Ⅰ和Ⅱ级均显著提高,Ⅳ级径级区间的RL、SA 和RV 有不同程度的变化趋势,但各处理间均无显著性差异。
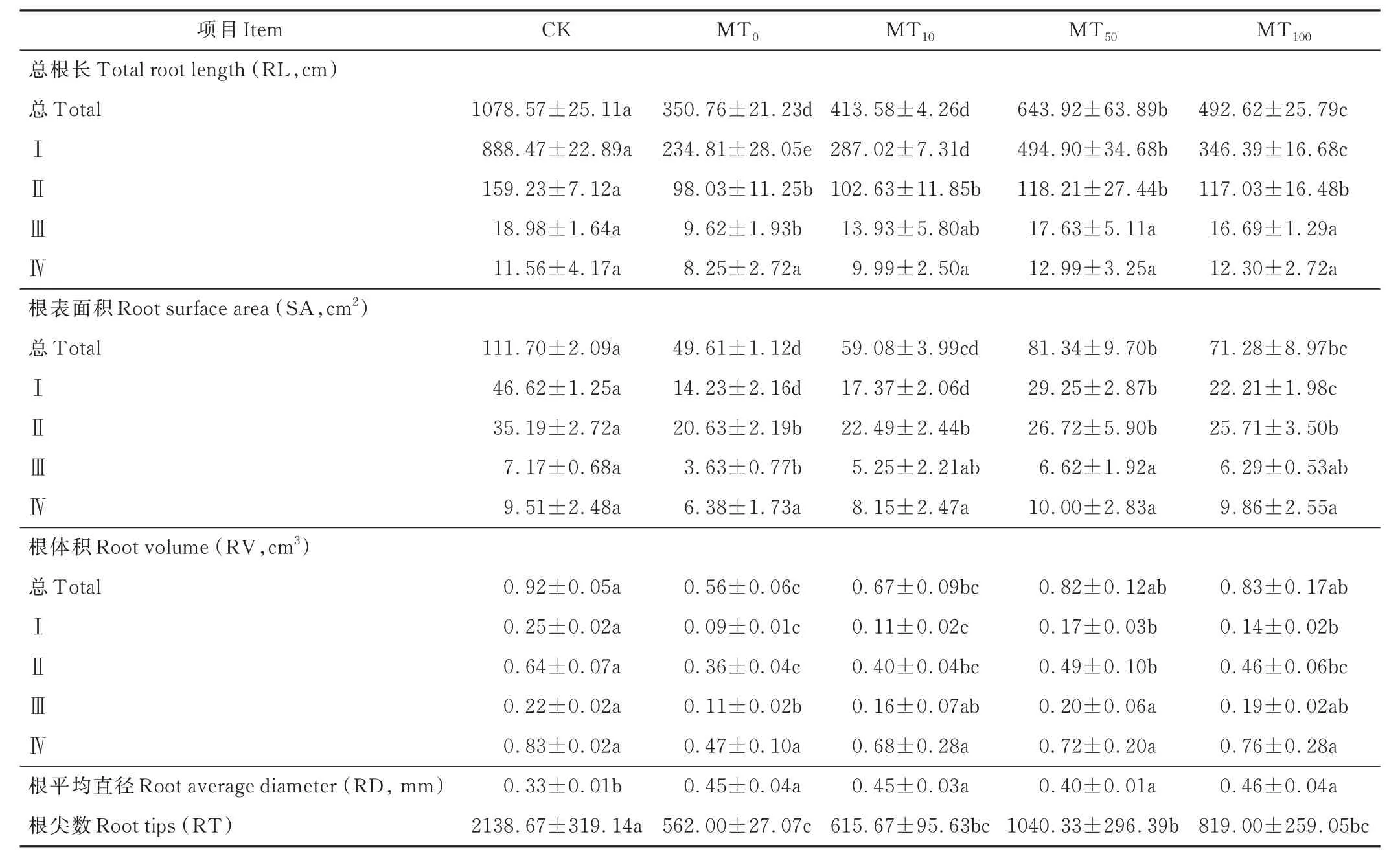
表2 干旱胁迫下不同浓度褪黑素对玉米幼苗根系结构和根系分级的影响Table 2 Effects of different concentrations of melatonin on root structure and grading of maize seedlings under drought stress(mean±SD)
在5 个 处 理 下,RD 0~0.5 mm 径 级 区 间 的RL 和SA 以及RD >1.5 mm 径级区间的RV 占据总根系的比例较大;与MT0处理相比,随着褪黑素浓度的提高,RD 0~0.5 mm 径级区间的RL 和SA 的占比分别增加了3.90%~15.33%和2.81%~28.10%,且RD 0~0.5 mm 径级区间的RL、SA 和RV 的占比均在MT50处理下最高;RD 0.5~1.0 mm 径级区间内的RL、SA 和RV 的占比均有不同程度的降低,分别降低了11.59%~35.09%、7.65%~20.60%和10.29%~13.07%,且RD 0.5~1.0 mm 径级区间内的RL 和SA 的占比在MT50处理降至最低,RV 的占比在MT100处理降至最低(图2)。
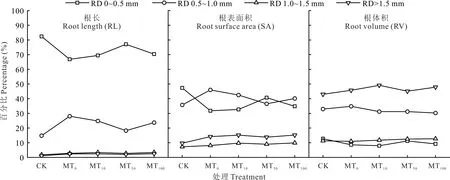
图2 干旱胁迫下不同浓度褪黑素对玉米幼苗根长、根表面积以及根体积在不同径级区间所占百分比Fig. 2 The percentage of different concentrations of melatonin on root length, root surface area and root volume in different diameters of maize seedlings under drought stress
2.3 干旱胁迫下不同浓度褪黑素处理对玉米幼苗组织内MDA 含量的影响
干旱胁迫(MT0)显著增加地上部和地下部MDA 含量,与CK 相比分别增加了54.19%和41.50%。外源褪黑素处理后,与MT0处理相比,MDA 含量显著降低,其中地上部MDA 含量在MT50处理降至最低,下降了20.17%(图3A),地下部MDA 含量在MT10处理降至最低,降低了47.52%(图3B)。
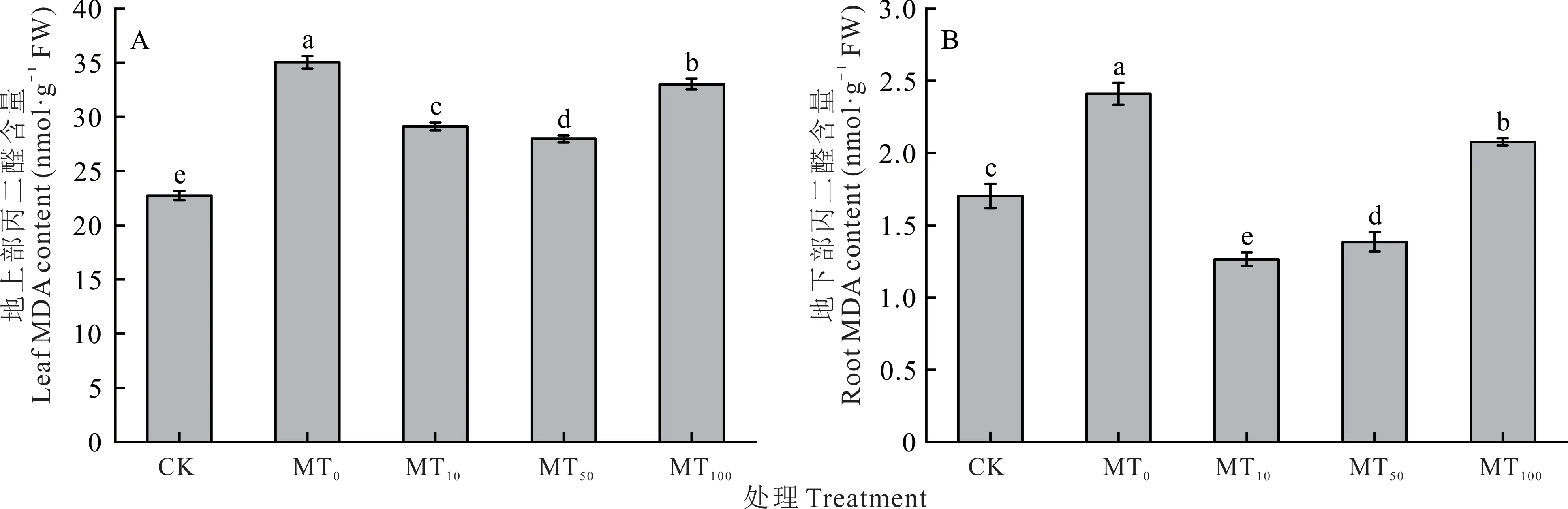
图3 干旱胁迫下不同浓度褪黑素对玉米幼苗组织内MDA 含量的影响Fig.3 Effects of different concentrations of melatonin on MDA content in maize seedlings under drought stress不同小写字母代表干旱胁迫下不同浓度褪黑素处理间差异达到显著水平(P<0.05),下同。Different lowercase letters represent significant difference
2.4 干旱胁迫下不同浓度褪黑素处理对玉米幼苗组织内可溶性蛋白含量的影响
干旱胁迫下,地上部和地下部可溶性蛋白分别增加了2.55%和15.45%。外源褪黑素处理后进一步升高了可溶性蛋白含量,当外源褪黑素浓度为50 μmol·L-1(MT50)时,地上部可溶性蛋白含量增加至最高,与MT0处理相比,增加了32.12%(图4A),当外源褪黑素浓度为10 (MT10)、50 (MT50)和100 μmol·L-1(MT100)时,与MT0处理相比,地下部可溶性蛋白含量均表现出显著性增加,分别升高了45.68%、49.14%和52.30%,在MT100处理增加的最多(图4B)。
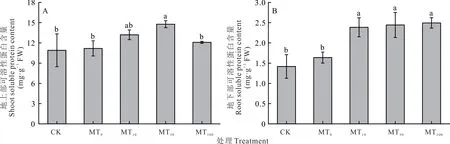
图4 干旱胁迫下不同浓度褪黑素对玉米幼苗组织内可溶性蛋白含量的影响Fig.4 Effects of different concentrations of melatonin on soluble protein content in maize seedling tissues under drought stress
2.5 干旱胁迫下不同浓度褪黑素处理对玉米幼苗光合参数的影响
植物的光合速率能直接反映出干旱胁迫下的生长状态。如图5 所示,干旱胁迫导致玉米幼苗的光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr)出现不同程度的下降,分别下降了53.45%、19.12%和14.11%,其中Pn和Gs的下降均达到了显著性水平。外源褪黑素处理后,Pn、Gs和Tr均表现出先升高再降低的趋势,且均在MT50处理升至最高,与MT0相比,分别增加了85.83%、32.81%和12.46%。当外源褪黑素浓度为100 μmol·L-1(MT100)时,与MT50相比,Pn、Gs和Tr分别降低了31.07%(图5A)、28.22%(图5B)和14.86%(图5D)。当外源施加不同浓度褪黑素时,各处理间玉米幼苗的胞间CO2浓度(Ci)差异不显著(图5C)。
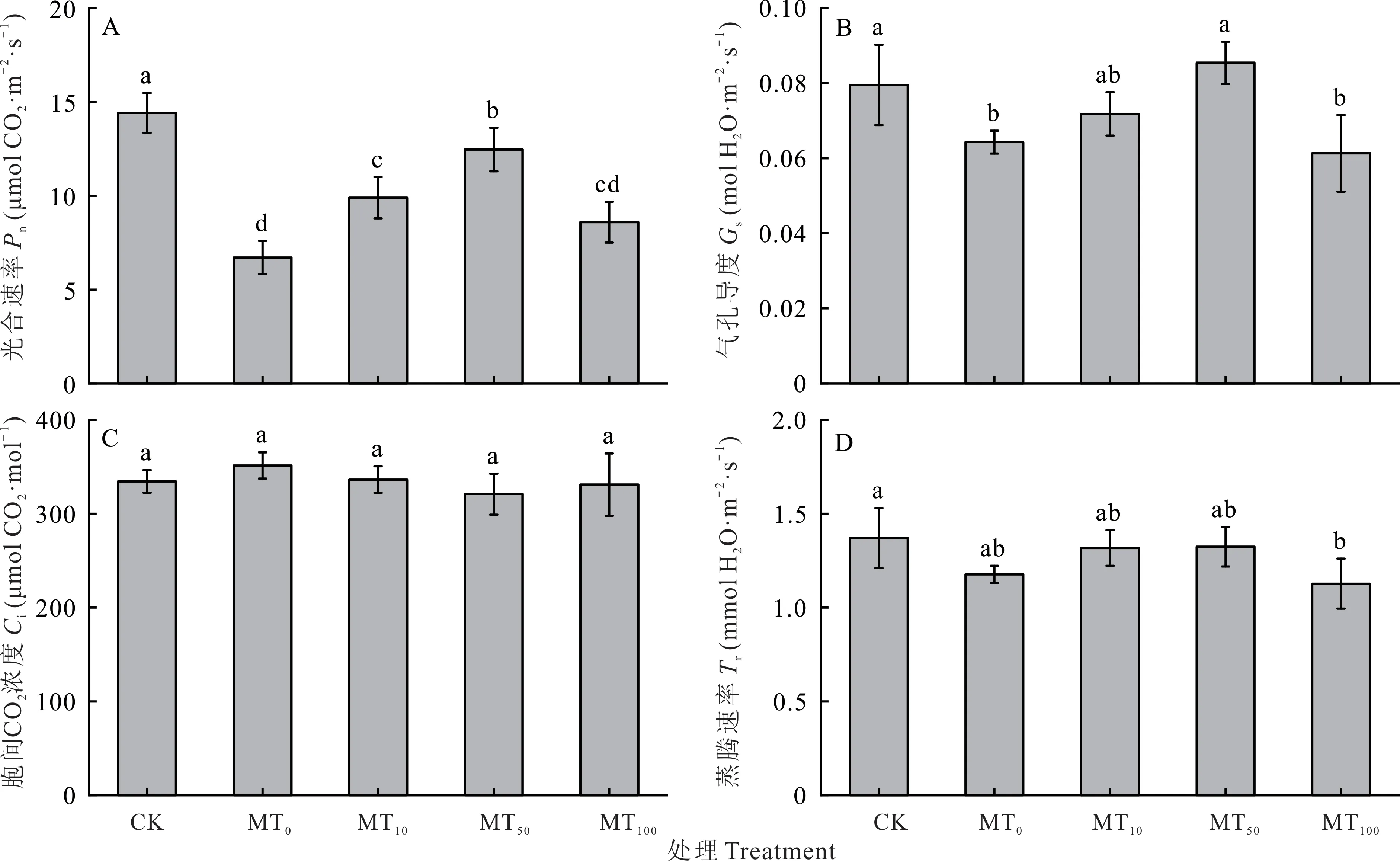
图5 干旱胁迫下不同浓度褪黑素对玉米幼苗光合参数的影响Fig.5 Effects of different concentrations of melatonin on photosynthetic parameters of maize seedlings under drought stress
2.6 干旱胁迫下不同浓度褪黑素处理对玉米幼苗组织内AsA 和GSH 含量的影响
AsA 和GSH 在植物抵抗氧化胁迫方面有着很重要的作用,含量的高低与植物的抗逆性有着密切关系[36]。如图6 所示,干旱胁迫下,玉米幼苗地上部的AsA 含量和地下部的AsA 和GSH 含量均显著升高,分别提高了173.09%、48.74%和60.12%,地上部GSH 含量降低了23.43%,施加外源褪黑素后地上部和地下部的AsA 含量均低于MT0处理,相比于MT0处理分别下降了2.74%~32.24%(图6A)和18.24%~29.15%(图6B),地下部的GSH 含量在MT100处理达到最高,升高了6.55%(图6D)。
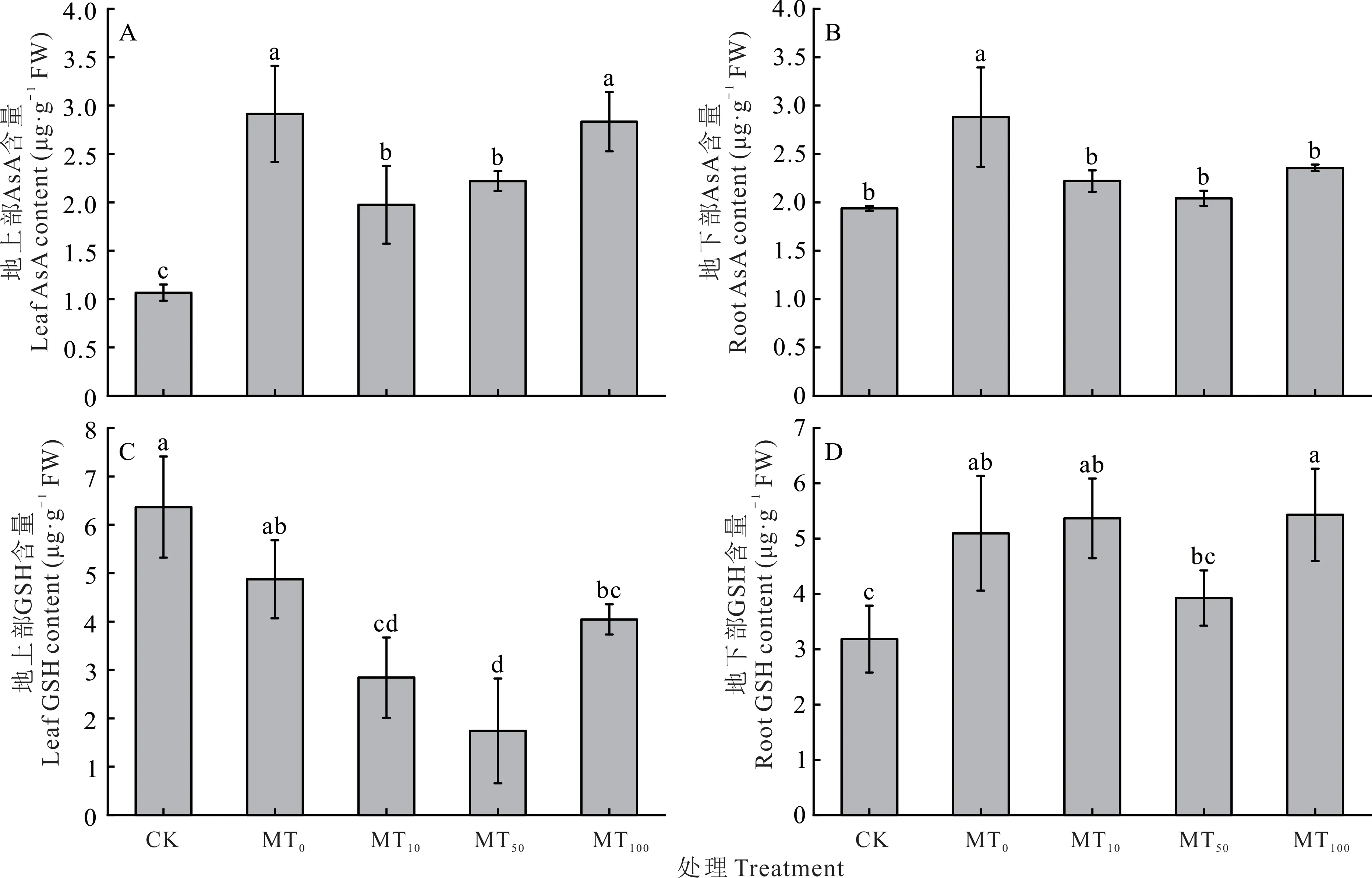
图6 干旱胁迫下不同浓度褪黑素对玉米幼苗组织内AsA 和GSH 含量的影响Fig.6 Effects of different concentrations of melatonin on AsA and GSH contents in maize seedling tissues under drought stress
2.7 干旱胁迫下不同浓度褪黑素处理对玉米幼苗抗氧化酶活性的影响
干旱胁迫下,地上部的SOD 活性显著提高,提高了8.00%,地下部的SOD 活性显著降低,降幅达13.71%。外源褪黑素处理后地上部和地下部的SOD 活性均在褪黑素浓度为50 μmol·L-1(MT50)时升至最高,分别升高了25.13%(图7A)和71.46%(图7B)。干旱胁迫下,玉米幼苗地上部的POD 活性在MT50处理升至最高,相比于MT0处理升高了42.82%(图7C),地下部的POD 活性总体显著升高,在MT100处理升至最高,相比于MT0处理升高了12.86%(图7D)。玉米幼苗地上部的CAT 活性在MT50处理升至最高,相比于MT0处理升高了27.24%(图7E),地下部的CAT 活性在干旱胁迫下总体低于CK,在MT50处理最低,与MT0相比,降低了33.33%(图7F)。干旱胁迫下地上部的APX 活性均显著升高,在MT50处理升至最高,较MT0处理增幅为48.80%(图7G),地下部的APX 活性无明显变化趋势,在褪黑素浓度为100 μmol·L-1(MT100)时最高,较MT0处理增幅为51.77%(图7H)。
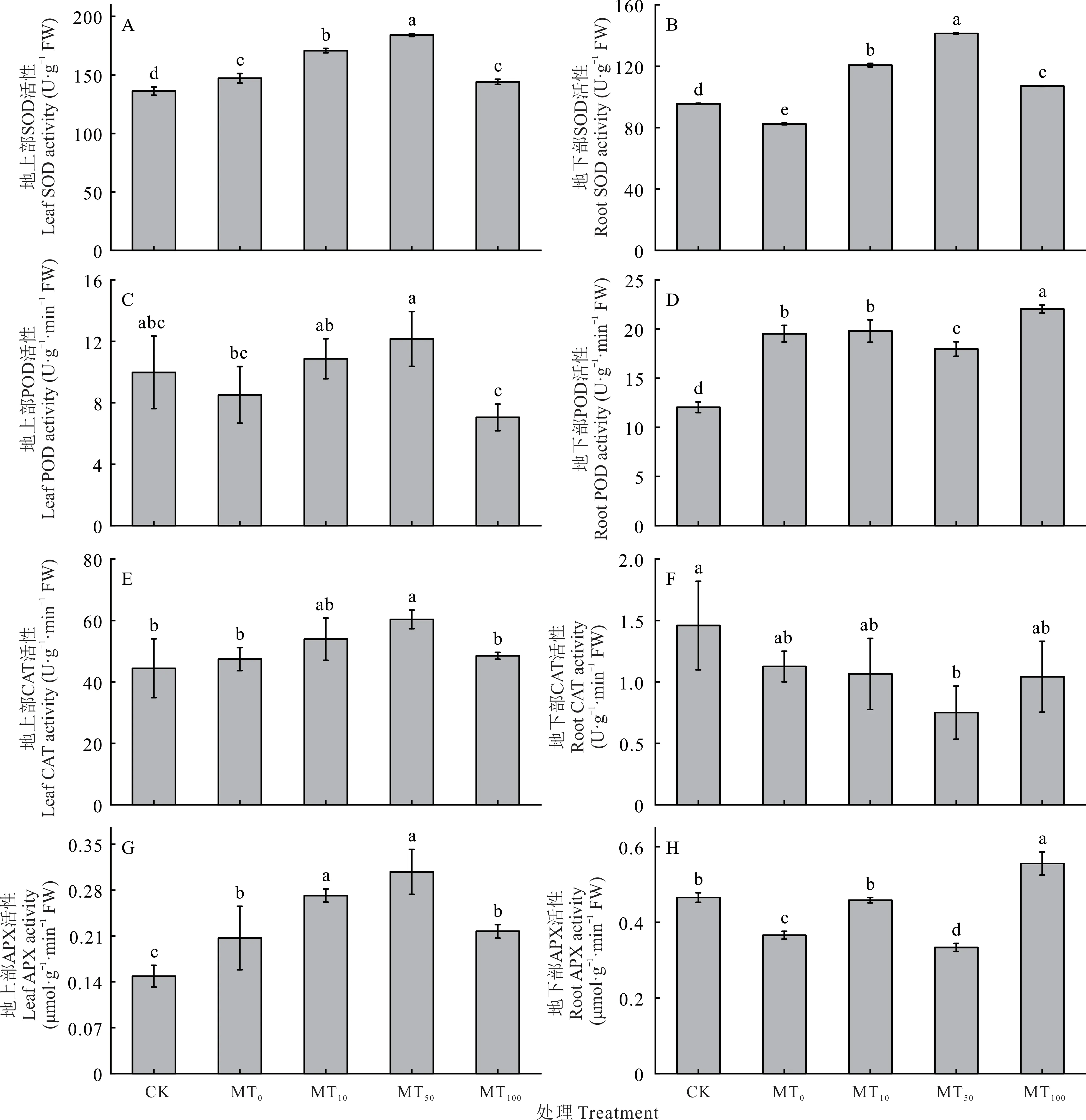
图7 干旱胁迫下不同浓度褪黑素对玉米幼苗组织内抗氧化酶活性的影响Fig.7 Effects of different concentrations of melatonin on antioxidant enzyme activities in maize seedlings under drought stress
2.8 干旱胁迫下不同浓度褪黑素处理诱导玉米幼苗各指标变化的主成分分析、随机森林结果、相关性分析以及热图分析
通过主成分分析(PCA)的方法研究了干旱胁迫下不同浓度褪黑素处理对玉米幼苗的各生理指标的影响,其中PC1 和PC2 分别占据了总方差的59.9%和21.9%(图8A);MT10和MT100没有显著分离,CK、MT0和MT50均显著分离(图8B);PC1 显著影响了地下部MDA 含量、地下部AsA 含量、地上部MDA 含量、地下部GSH 含量、Ci、RD、地上部AsA 含量、地下部POD 活性、根冠比、地上部SOD 活性、地上部可溶性蛋白含量、地上部CAT 活性、地上部APX 活性、地下部可溶性蛋白含量、地上部可溶性蛋白含量、地下部SOD 活性、地上部耐受指数和地下部耐受指数,PC2 显著影响了地上部GSH 含量、地下部CAT 活性、地下部MDA 含量、地下部AsA 含量、地上部MDA 含量、地下部GSH 含量、Ci、地下部APX 活性、RD、地上部AsA 含量(图8C)。随机森林图(图8D)显示,对于生长指标,平均精度下降值由大到小顺序为地下部干重、地上部干重;对于根系指标,平均精度下降值处于Ⅰ级径级区间的RL 位于Ⅰ级径级区间的SA、RV 之前;对于耐性指数,平均精度下降值由大到小顺序为地上部耐受指数、地下部耐受指数;对于抗性物质,平均精度下降值由大到小顺序为地下部MDA 含量、地上部MDA 含量;对于抗性酶活性,平均精度下降值由大到小顺序为地下部SOD 活性、地下部APX 活性、地上部SOD 活性、地下部POD 活性。
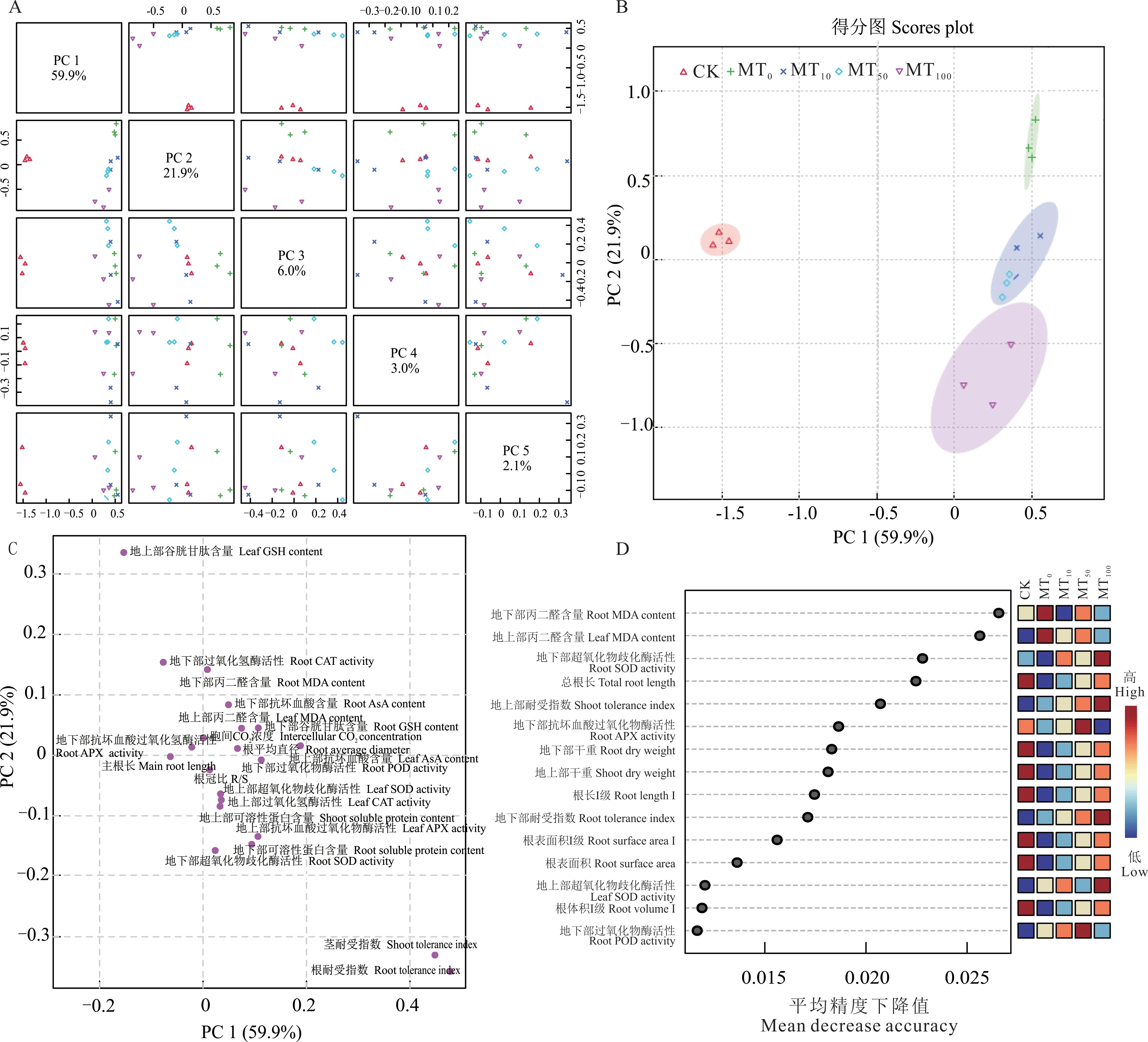
图8 干旱胁迫下不同浓度褪黑素处理诱导玉米幼苗各指标变化的主成分分析和随机森林结果Fig. 8 Principal component analysis and random forest plot of maize seedling index changes induced by different concentrations of melatonin under drought stress
根据图9 和表3 的相关性结果分析可知,玉米幼苗的Pn与RL、SA、RV、RT、株高(plant height, Ph)、主根长(main root length, MRL)、植株鲜重(plant fresh weight, FW)和植株干重(plant drought weight, DW)呈极显著正相关(P<0.01),与RD 呈极显著负相关(P<0.01),显著影响了玉米幼苗的地上部和根系的生长;玉米幼苗的Gs与SA、RV、Ph 和DW 呈显著正相关(P<0.05);玉米幼苗的MDA 含量与RD 呈极显著正相关(P<0.01),与RL、SA、RV、RT、Ph、FW 和DW 呈极显著负相关(P<0.01),与MRL 呈显著负相关(P<0.05),能够显著影响玉米幼苗的生长发育。
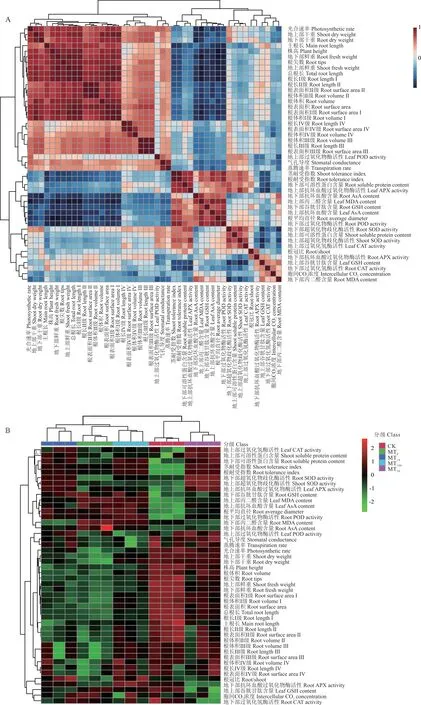
图9 干旱胁迫下不同浓度褪黑素处理玉米幼苗各指标变化的相关性分析和热图Fig. 9 Correlation analysis of various indexes of maize seedlings treated with different concentrations of melatonin under drought stress and heat map
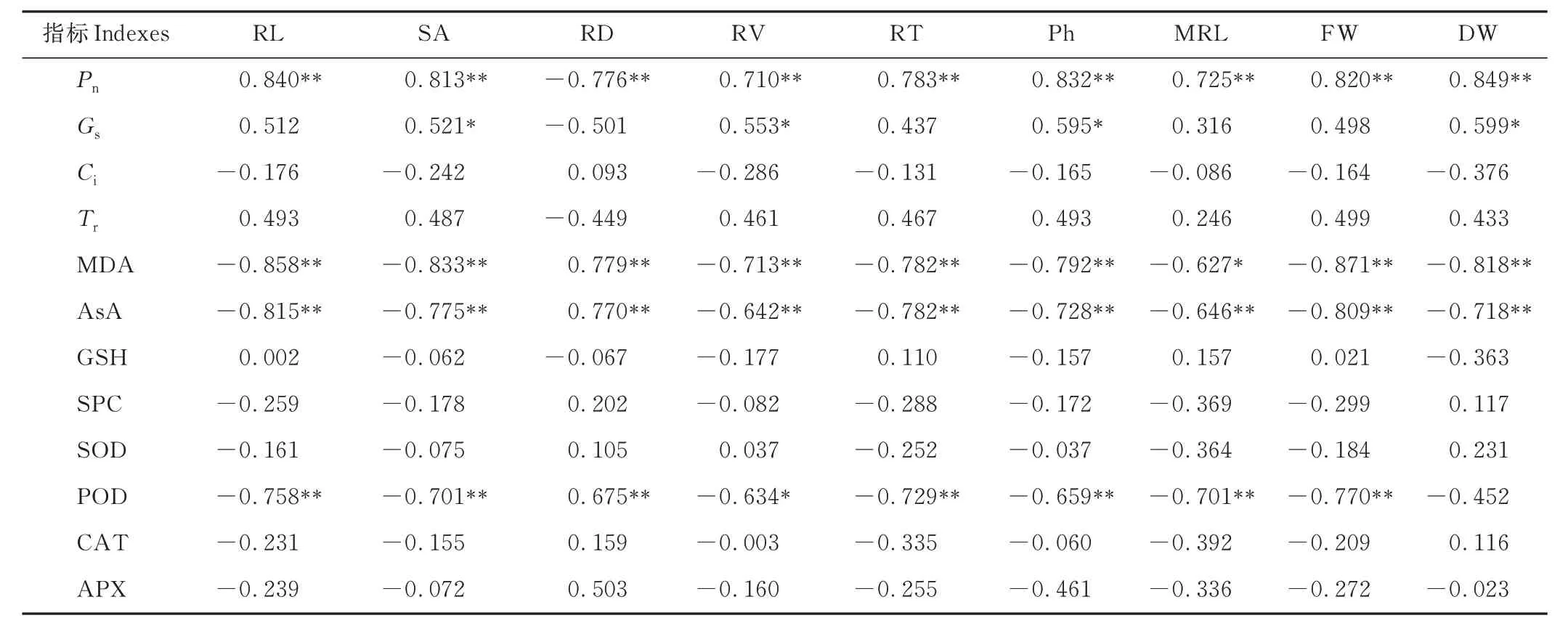
表3 干旱胁迫下不同浓度褪黑素处理的玉米幼苗生长指标和生理指标的相关性分析Table 3 Correlation analysis of growth indexes and physiological indexes of maize seedlings treated with different concentrations of melatonin under drought stress
2.9 干旱胁迫下不同浓度褪黑素处理玉米幼苗的生理指标的平均隶属函数值
4 个干旱胁迫下处理的平均隶属函数值为0.4372~0.6440,不同处理间的差异比较大,MT50处理的MDA、可溶性蛋白、SOD 和CAT 的平均隶属函数值均最大,MT10处理的AsA 的平均隶属函数值最小,MT100处理的APX的平均隶属函数值最大(表4)。根据隶属函数值综合评价,4 个处理的抗旱性强弱排序为MT50>MT10>MT100>MT0,即MT50处理的抗旱性最强,MT10和MT100处理的抗旱性一般。
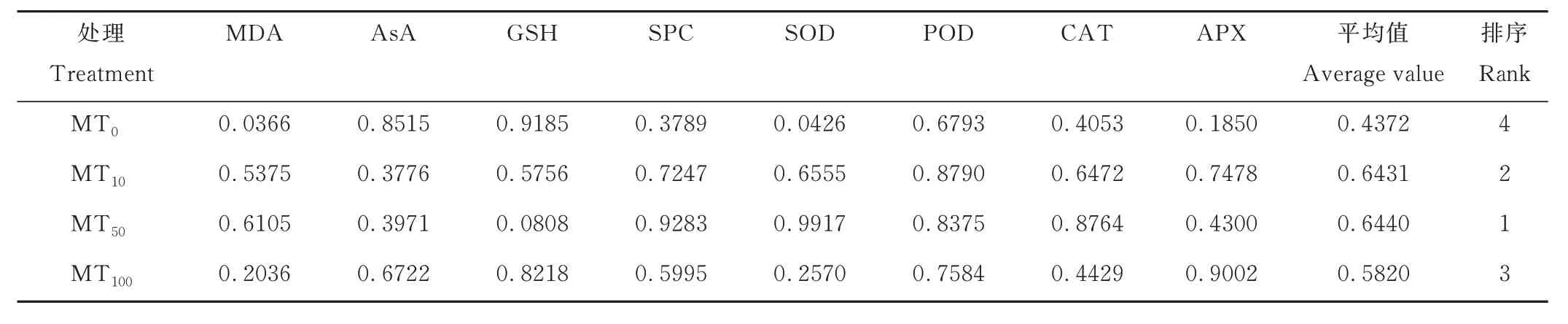
表4 干旱胁迫下不同浓度褪黑素处理玉米幼苗生理指标的平均隶属函数值Table 4 Average membership function values of physiological indexes of maize seedlings treated with different concentrations of melatonin under drought stress
3 讨论
干旱胁迫下,植物的形态和生理生化会发生变化来适应胁迫,生物量的积累和植株形态的变化是植物响应干旱胁迫的最直接表现[37]。本研究结果表明,外源喷施不同浓度的褪黑素均不同程度地缓解了干旱胁迫对玉米幼苗生长发育状况的影响,减轻了干旱胁迫对幼苗株高、主根长、生物量的抑制作用,提高了根长、根体积、根表面积、根尖数、根冠比、茎和根的耐受指数,有利于玉米幼苗对水分的吸收,减轻了干旱胁迫造成的危害;使得Ⅰ级(RD 0~0.5 mm)径级区间的RL 和SA 以及Ⅳ级(RD>1.5 mm)径级区间的RV 占据总根系的较大比例;在干旱胁迫下,随着喷施褪黑素浓度的提高,Ⅰ级径级区间的RL 和SA 在MT50(50 μmol·L-1)处理下最高,随着浓度的升高占比逐渐降低。李冬等[38]在烟草(Nicotiana tabacum)上的研究发现,干旱胁迫下外源喷施褪黑素降低了根冠比;叶君等[39]研究发现,干旱胁迫下根施外源褪黑素显著增加了小麦(Triticum aestivum)根冠比;而马旭辉等[28]采用水培根灌和盆栽浸种褪黑素两种不同施用方式对玉米幼苗根系及抗旱性进行研究,发现褪黑素能够促进玉米幼苗根系发育,提高光合作用,缓解氧化损伤,本试验结果与其基本一致,说明在不同施用方式下,褪黑素均可以不同程度缓解逆境胁迫的抑制作用[40-42]。本试验玉米幼苗生长指标变化可能是由于褪黑素与生长素有着相同的前体物质及部分相似的生理功能,通过诱导生长素的合成来促进玉米幼苗的生理代谢活动[43],进而减轻干旱胁迫所造成的毒害,促进玉米幼苗及其根系的正常生长发育。因此,干旱胁迫条件下施加一定浓度的褪黑素在玉米幼苗根系生长方面起着重要作用。
光合作用是维持植物生存重要的基本功能,干旱胁迫产生的活性氧会对植物的光合作用产生抑制[44]。干旱胁迫条件下,植物主动关闭或收缩气孔来维持体内水分的含量,引起气孔导度的下降,CO2进出细胞受到阻碍,蒸腾速率和光合作用下降,植物有机物质的合成和能量的运输受到抑制,严重影响了植物的正常生长发育[45]。而在干旱胁迫下,施用褪黑素一方面能够显著增加叶片的气孔导度和胞间CO2浓度,显著降低CO2在传递过程中受到的阻力,提高CO2的吸收速率;另一方面,还能提高叶片对光能的利用,减轻光能对光合器官的损伤[46]。在本试验中,干旱胁迫下玉米幼苗的光合速率和气孔导度显著降低,蒸腾速率略有降低,而CO2浓度升高,在喷施50 μmol·L-1的褪黑素处理后,光合速率和气孔导度均达到最高,且达到显著性水平,然后随着褪黑素浓度的提高,叶片的光合速率、气孔导度和蒸腾速率均有不同程度降低,胞间CO2浓度略有升高。干旱胁迫条件下,适宜浓度的褪黑素能够使植物重新打开气孔来改善气孔功能,在小麦[14]、苹果[47](Malus pumila)和黄瓜(Cucumis sativus)[48]等多种植物上都已发现其在气孔调节方面具有积极作用。褪黑素处理后蒸腾速率的增加可能是由于增强的气孔导度驱动以在干旱胁迫下维持光合作用的稳定状态[14,49]。
干旱胁迫下植物会产生较多活性氧自由基,损害原生质膜并影响正常的生理生化代谢,但植株利用抗氧化防护系统等机制抵抗氧化物胁迫[50],其中过氧化产物MDA 可作为膜脂过氧化损害程度和抗旱能力的重要指标[51]。干旱胁迫还会导致细胞渗透势升高,抑制植物从外界吸收水分,造成植物组织缺水,可溶性蛋白是植物体内主要的渗透调节物质,植物可通过增加其含量来缓解干旱胁迫造成的损伤,提高植物的抗旱性[4]。褪黑素本身具有清除活性氧的功能,并能维持活性氧的代谢平衡,降低活性氧对细胞膜系统造成的损伤,增强自身抗氧化酶活性,以清除过量的活性氧[52]。本研究表明,不同浓度的褪黑素处理均表现出抗逆效果,其中施用50 μmol·L-1褪黑素效果最优。在干旱胁迫下喷施50 μmol·L-1褪黑素处理后,玉米幼苗地上部的MDA 含量显著降低,可溶性蛋白含量、SOD 活性、POD 活性、CAT 活性和APX 活性显著增加;地下部的MDA 含量、AsA 含量、POD 活性和APX 活性显著降低,可溶性蛋白含量和SOD 活性显著增加;随机森林结果表明MDA 含量对玉米幼苗的影响最大(图8D);相关性结果分析表明,玉米幼苗的光合速率和MDA 含量与玉米幼苗生物量的积累和根系构型紧密相关(图9 和表3)。喷施50 μmol·L-1褪黑素能够有效提高植株体内抗氧化酶活性和促进可溶性蛋白合成,降低MDA 含量,保持原生质膜正常的生理生化代谢,从而提高玉米幼苗的抗旱能力,与Liu 等[53]对黄瓜幼苗的研究相同,褪黑素可以提高SOD、POD、CAT 的活性,以缓解干旱胁迫的损伤。本试验还发现外源喷施一定浓度的褪黑素有助于植物体内活性氧和过氧化物的清除,维持细胞膜的稳定性,而较高浓度的褪黑素作用不太明显,与杨小龙等[22]的研究结果相似。褪黑素在多种作物中均表现出保护光合器官、提高抗氧化能力和持水能力的特性,显著增强了作物的抗逆能力[14,43,54]。
4 结论
干旱胁迫严重抑制了玉米幼苗的生长发育,外源喷施50 μmol·L-1褪黑素抗旱性最强,能够有效调节玉米幼苗地上部和地下部的抗氧化酶活性和渗透调节能力,降低丙二醛含量;同时还提高了叶片的光合作用能力,缓解了干旱胁迫对玉米幼苗地上部和根系生长发育造成的影响。褪黑素的应用可有效提高玉米幼苗抗旱性,为进一步挖掘可提高作物抗旱性的物质及其作用机理提供了理论依据。

