白前种子质量分级标准及特性研究
张红杨, 刘世红, 张冰冰, 向健华, 陈 诚, 黄必胜, 刘大会, 雷 咪
(1.教育部中药资源和中药复方重点实验室/湖北中医药大学药学院, 武汉 430065;2.中国药科大学中药学院, 南京 210009; 3.武汉市新乡园农业科技发展有限责任公司, 武汉 430065)
白前始载于汉魏《名医别录》,列为中品[1],为萝藦科植物柳叶白前[Cynanchumstauntonii(Decne.)Schltr. ex Levi.]或芫花叶白前[Cynanchumglaucescens(Decne.)Hand.-Mazz.]的干燥根茎和根,性辛、苦,微温,归肺经,具有降气、消痰、止咳的功效,用于肺气壅实,咳嗽痰多,胸满喘急[2]等症状。古代专著文献认为,白前“专主肺家,为治咳嗽降气之要药”[3];为“肺家之要药”[4]。近年来,人们对肺部疾病的治疗和对白前的关注日益增多,白前的临床应用范围、临床使用量和种植规模也逐年扩大,从1984年湖北省武汉市农科院开始在新洲、黄冈等地开展柳叶白前野生转家种试验以后,至2021年年底湖北省柳叶白前的种植面积10万亩,居全国首位[5]。
目前白前的野生种质资源稀少,其主产区武汉新洲区、黄冈团风县主要以种子育苗移栽为主,但不同产地和不同成熟度的白前种子,质量差异较大,其种子出苗率、出苗整齐度和幼苗后期长势等情况也差异明显。相对农作物而言,我国中药材种子市场流通体系不健全,种子生产无统一的质量标准,种子质量决定药材质量,药材质量决定市场价值,因此人工繁育优良白前种子种苗对丰富种质资源和保证药材质量非常关键,而优良种子的生产又依赖于规范化的种子质量标准[7-9]。目前,已有很多关于中药材种子质量分级标准的研究,如射干[10]、北苍术[11]、滇重楼[12]、三七[13]和金银花[14]等,而对柳叶白前种子质量标准的研究还未见报道。本研究参考农作物检验规程以及同属植物种子的相关研究报道[15-23],收集10个不同产地的白前种子,从外观形态来比较其种子差异,并通过对其生活力检测及发芽生物学特性指标的测定,探讨影响白前种子发芽率的因素,在此基础上采用K均值聚类算法(K-means)初步制定白前种子的质量分级标准。这对规范种植白前、提高白前产量和质量,降低生产成本,推动白前GAP基地建设,保护良种资源具有重要的意义。
1 试剂与材料
人工气候培养箱(合肥右科仪器设备有限公司),AUX220型分析天平(日本岛津株式会社)、DHG-9075A型电热恒温鼓风干燥箱(上海一恒科技有限公司)、H2O2(天津市天力化学试剂有限公司)、2,3,5-氯化三苯基四氮唑(上海源叶生物科技有限公司,批号S19026)、磷酸缓冲液(pH值6.5~7.0)。
实验用白前种子于2021年10—12月采自湖北新洲、团风、麻城、黄冈、罗田等五个产区。经湖北中医药大学刘大会教授鉴定为萝藦科植物柳叶白前的干燥成熟种子。具体来源及编号见表1。
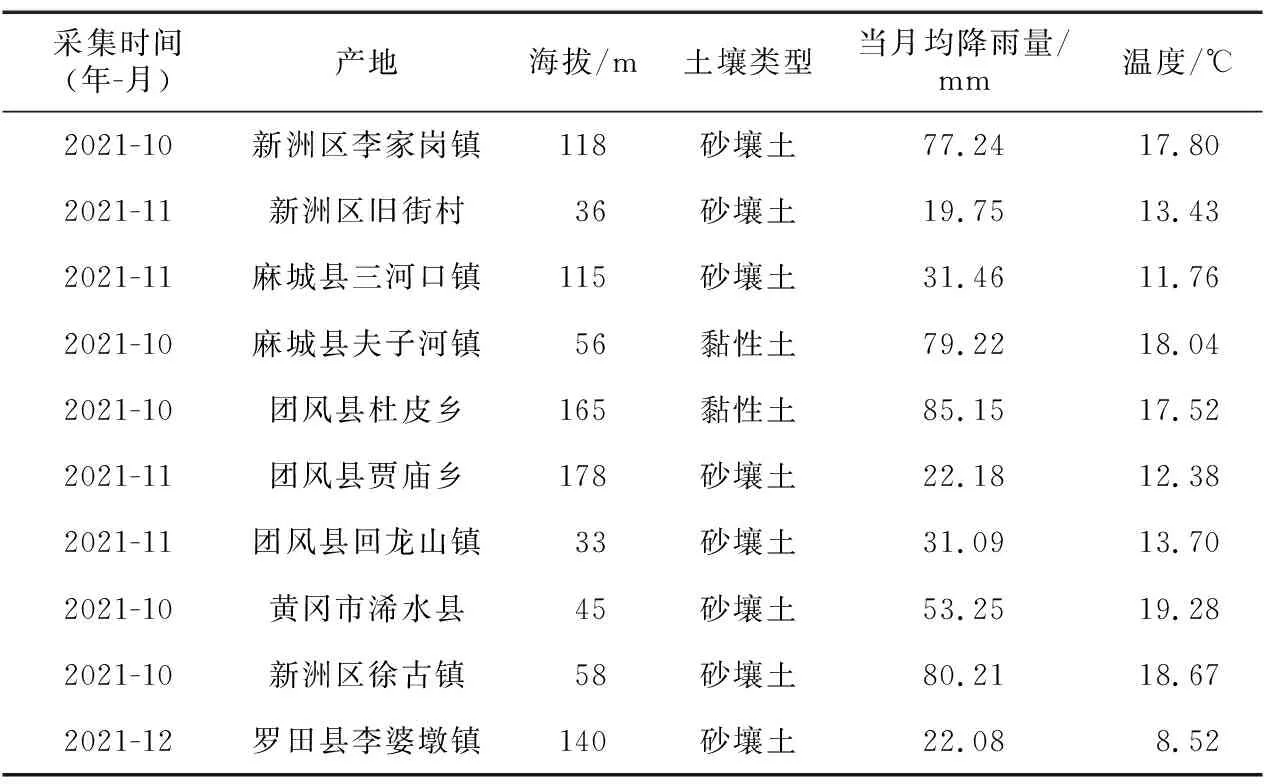
表1 不同产地白前种子信息Table 1 Seed information of Cynanchum stauntonii from different producing areas
2 方 法
2.1 扦 样
将编号1~10的白前种子按GB/T 3543.2—1995《农作物种子检验规程 扦样》[15]要求,采用徒手减半分取法选择试验样品,以试验样品为净度分析样品的10倍量,净度分析样品不少于2 500粒种子的原则选取白前种子的最小取样质量,按不同产地分批装入网袋,置于通风阴凉处保存备用。
2.2 种子形态观察
对10批种子分别进行形态观察。随机挑选各批次成熟种子50粒,观察种子外观形态并采集照片。用游标卡尺测量种子长度、宽度、厚度,精确到0.01 mm。
2.3 净度分析
采用四分法,将编号1~10的白前种子按照GB/T 3543.3—1995《农作物种子检验规程 净度分析》[16],以试验样品为净度分析样品的10倍量,净度分析样品不少于2 500粒为原则(不少于50 g),将抽取的白前种子样品摞成圆锥形,用手掌从上向下将其平铺开,铺成圆形,用镊子将其平均分成四等分扇形,取其中一份做样品,重复上述操作直至获取所需的样品量。分别将净种子、废种子及其他杂质分开[19],称重记录。重复3次。
种子净度/%=[(种子总重量-杂质重理)/种子总重量]×100%。
2.4 千粒重
将净度分析后的纯净样品按四分法取样,参照畅晶等[24]实验过程中采用的五百粒法测定不同产地白前种子的千粒重,重复3次(两平行数据之差与平均值之比在4.0%以内有效)。
2.5 含水量测定
采用(105±2)℃恒温烘干法:用分析天平称取每组白前种子2 g,精确到0.000 1 g,误差小于0.2%,重复3组。首先将洗净的称量瓶放入预热好的105 ℃烘箱中干燥,室温冷却后,将白前种子装入洗净干燥的称量瓶中,在分析天平上称取质量(W1),置于105 ℃烘箱中6 h后,放置硅胶缸中冷却30 min直至室温,称重(W2),计算含水量。
含水量/%=[(W1-W2)/W1]×100%。
2.6 生活力测定
采用TTC染色法[20]测定生活力。选取白前种子25份,采取L25(53)正交试验设计(表2),选择预湿时间、TTC浓度、染色时间3个因素,初步确定各因素对生活力测定的影响。
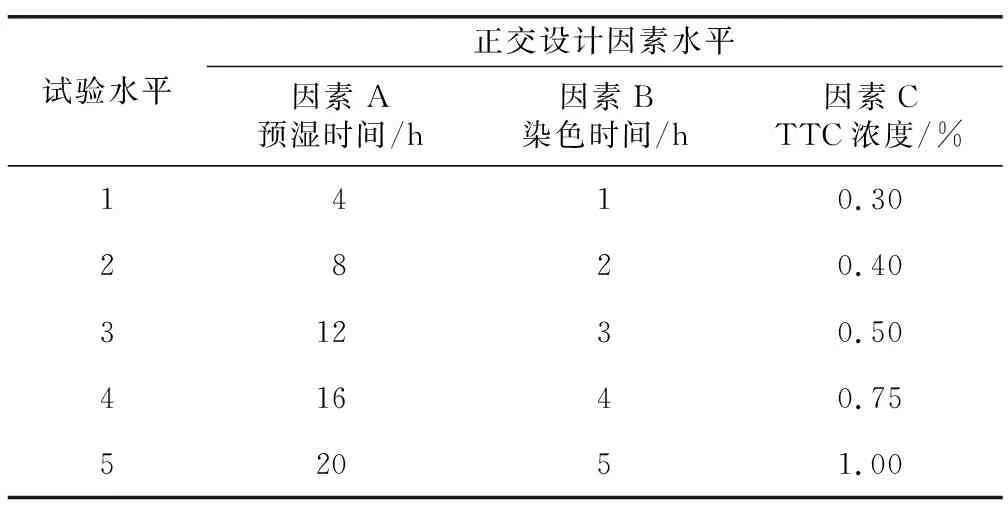
表2 正交试验设计Table 2 Orthogonal experimental design
2.6.1不同浓度的TTC染色组
采用pH值6.5~7.0的磷酸缓冲溶液分别配制成浓度为0.3%,0.4%,0.5%,0.75%,1.0%的TTC溶液,置于棕色瓶中于4 ℃冰箱避光保存备用。
2.6.2不同预湿处理组
将种子置于密封玻璃瓶中,每份加入等量温水(30 ℃)至完全浸没种子,充分振摇让种子完全浸湿。分别预湿4 h、8 h、12 h、16 h、20 h使种子充分吸水完全浸在其中,每个重复随机数取15粒进行后续试验,重复3次。
2.6.3染 色
为了使胚的主要构造和有活性的营养组织充分暴露出来,便于TTC试剂快速而充分地浸入种子,将预湿后软化的种子沿种胚中央横切,取胚保留较好的一半种子,整个操作过程中将种子放于湿润的滤纸上。将每份种子(15粒)放入染色盘内,加入等量的0.3%,0.4%,0.5%,0.75%,1.0% TTC溶液至完全浸没种子,置于25 ℃的恒温箱内,分别避光染色1 h、2 h、3 h、4 h、5 h后取出种子,倒掉培养皿中的药液,用蒸馏水冲洗2次后,吸干种子表面水分。40×解剖镜下观察染色效果,记录染色种子的数量。确定种子是否有活力,一般的鉴定原则为凡是胚的主要构造或有关活的营养组织全部染成有光泽的鲜红色或染色最大面积大于规定且组织状态正常的为正常有生活力的种子,否则为无生活力的种子(图1)。
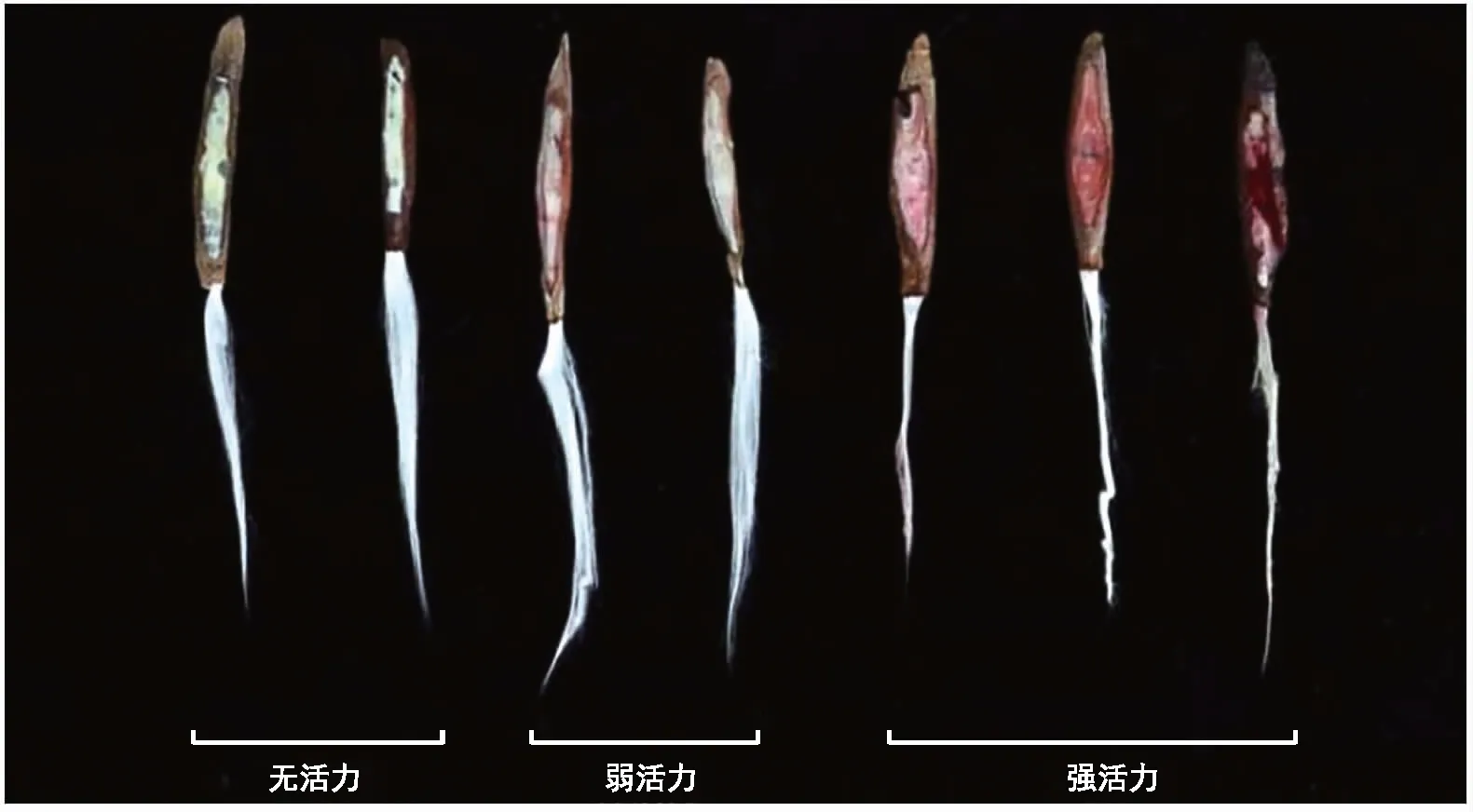
图1 TTC染色法生活力强弱差异 Fig.1 Difference of viability by TTC staining
2.7 种子萌发率测定
参照GB/T 3543.4—1995《农作物种子检验规程 发芽实验》[17]的规定采用纸床法进行预实验。
2.7.1不同浸种条件
选取同批次饱满的白前种子分为3组,每组约200粒种子,分别用自来水、超纯水、1% H2O2浸种,24 h后用蒸馏水冲洗干净备用。各处理组取90粒种子平均分为3组,置于铺有2层滤纸的培养皿中,加入适量超纯水,置于人工气候箱中于25 ℃、湿度75%条件下进行避光萌发试验。适时更换滤纸,以防杂菌滋生,每天观测种子发芽数,30 d后结束发芽率测定。
2.7.2不同光照条件和发芽温度
选取饱满的白前种子约900粒分为3组,采用1% H2O280 mL浸种24 h后,分别进行避光萌发试验(24 h黑暗且种子表面覆盖滤纸)、弱光萌发试验(光照13 h、黑暗11 h且种子表面覆盖滤纸)、LD萌发试验(光照13 h、黑暗11 h,种子表面不覆盖滤纸),各萌发试验组取270粒种子分为3组各采用不同温度(17 ℃、25 ℃、30 ℃)进行培养,每个温度下设置3组重复。每天观测种子发芽数,30 d后结束发芽率测定。
种子发芽率与发芽势按照GB 5520—85《粮食、油料检验 种子发芽试验》[18]方法计算。
发芽率/%=(M1/M)×100%;
发芽势/%=(M2/M)×100%,
式中:M1为全部正常发芽种子粒数;M2为发芽高峰期发芽的种子粒数;M为供试种子粒数。
2.8 新陈种子发芽率测定
取新洲李家岗的白前种子,分别于2020年12月和2021年12月进行种子发芽率的测定。
2.9 数据分析
用Excel2003软件对种子质量各指标进行统计分析和区间估计,其他分析使用SPSS20.0软件进行。
3 结果与分析
3.1 性状分析
白前种子正面为扁卵状披针形,外种皮深棕色或黑褐色,表皮细胞边缘略隆起,表面凹陷呈网状[21]。由图2和表3可以看出,各产地种子长度均值范围在15.89~17.40 mm之间,宽度在2.47~2.83 mm之间,厚度在0.71~1.02 mm之间。经SPSS20.0软件分析,新洲徐古镇产区种子长度较长,罗田李婆墩镇产区长度最短,其他各产区种子长度没有显著差异;麻城三河口镇产区种子宽度最宽,麻城夫子河镇产区种子宽度最窄,其他各产区种子宽度之间无显著差异;团风贾庙乡种子厚度最厚,种子更饱满,新洲徐古镇种子厚度最小,种子普遍干瘪、皱缩。其他各产区种子厚度之间无显著差异。结果可见,麻城夫子河镇和新洲徐古镇种子厚度较小,种子多瘦小干瘪。

图2 10批次白前种子形态 Fig.2 Seed morphology of 10 batches of Cynanchum stauntonii

图3 不同温度下白前种子避光萌发状况 Fig.3 The germination status of seeds of Cynanchum stauntonii under different temperatures in the dark
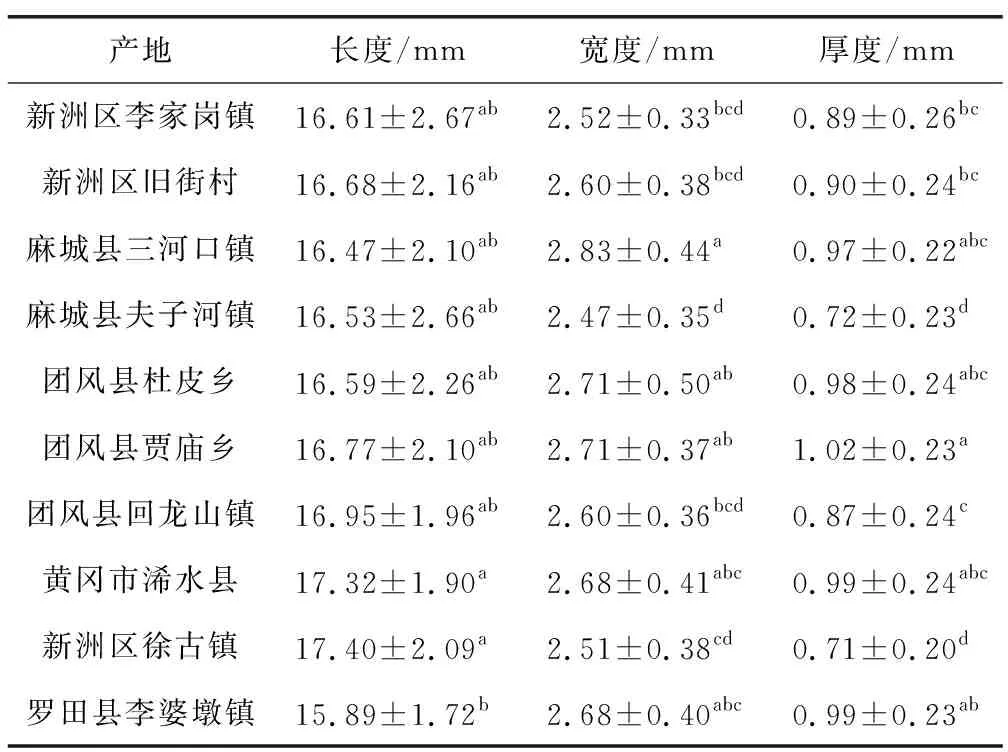
表3 不同产地白前种子形态分析Table 3 Morphological analysis of seeds of Cynanchum stauntonii from different producing areas
经调查走访发现,湖北的白前主要集中在黄冈、新洲、罗田一带,其地理位置较为接近,但土壤性质存在差异。新洲李家岗接近举水河,新洲旧街近沙河,土壤发育于河流冲积物,为潮土土属[25],黄冈、罗田地区气候适宜,土壤透气性较好,结合白前喜阳、忌干旱,多生于溪旁、湖边、渠道、塘边、沟旁以及河滩砂碛的潮湿土地这一生境特点,可知这些地区是白前适宜的生境环境。而麻城地区地处湖北省东北部,土壤为黄棕壤,土层深厚,质地偏黏。据调查,麻城产区种子溯源为新洲所产移种,造成麻城种子形态差异的原因可能是该取样地区的土壤环境不适合种植白前。
3.2 净度分析
由表4可见,除麻城夫子河、新洲徐古镇产区外,其他不同产地的白前种子总体净度均在89%以上,其中新洲李家岗种子净度最高,为98.09%;团风贾庙乡产区净度次之。不同产地白前种子净度差异可能与种子自身成熟度、当地气候环境、采集时间和方式及采集后储存方法有关。
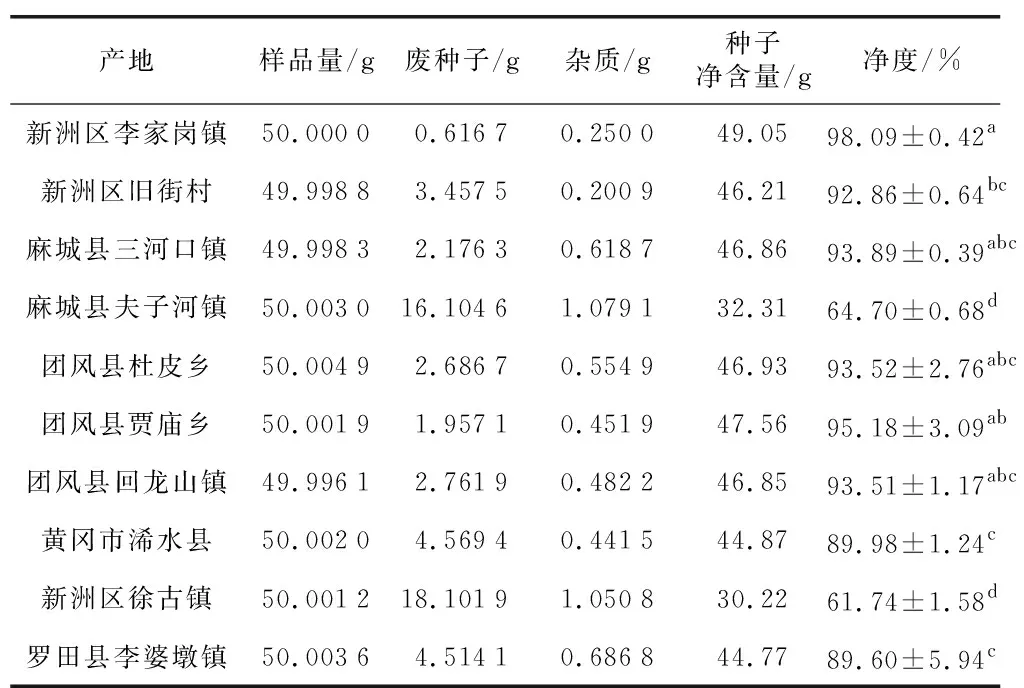
表4 不同产地白前种子净度分析Table 4 Purity analysis of seeds of Cynanchum stauntoniifrom different producing areas
3.3 千粒重及含水量分析
由表5可见,各产地白前种子的千粒重均值在13.49~22.09 g之间,其中团风杜皮乡、黄冈浠水县产区种子千粒重较重,种子饱满,形态较大。而麻城夫子河镇和新洲徐古镇的两个产区种子千粒重明显低于其他产区,且净度值也很低,观察发现该两个产区的种子多瘦小干瘪、种子外表皮多皱缩。特别是新洲徐古镇种子果荚细长,颜色偏黄,种子多无胚乳,仅由上下表皮组成,外表皮呈浅黄棕色,多有黄褐色斑点。

表5 不同产地白前种子千粒重及含水量分析Table 5 Analysis of 1 thousand-grain weigh and water content of seeds of Cynanchum stauntonii from different producing areas
不同产地白前种子的含水量均值在7.56%~11.10%之间,各产区之间含水量存在显著性差异。特别是同在新洲的3个产区含水量差异明显,据调查,当地农户采摘被果荚包裹的种子后采用晾晒干燥再储存的方式保存种子,新洲旧街产区的种子采摘时间较早,且因气候原因导致晾晒不充分,而后便直接装袋贮藏,造成果荚潮湿,种子内部含水量高。而新洲李家岗2021年年均降水量较低,年均气温比其他两地皆高,采收时节更为适宜。其他产区的含水量均有一定的差异。
结合千粒重的数据,考虑到气候因素是造成种子繁衍的一个重要因素[26],不同产地白前种子千粒重及含水量差异与其采收时间过早、当地气候环境有关。在净度结果基础上结合外观性状可知,2021年团风贾庙乡的种子千粒重较重,含水量较低,种子大小均一且饱满,商品性较好。
3.4 生活力测定分析
正交试验结果表明,采用TTC定量法测定白前种子活力较好处理组为A2B5C1、A3B5C2、A4B5C3,白前种子染色4 h、5 h时染色情况较好,二者无显著差异(表6)。且染色时间、TTC浓度、浸种时间3个因素对白前种子活力具显著性影响。影响白前种子生活力的因素依次为染色时间>TTC浓度>浸种时间,见表7。白前种子生活力与染色时间呈正相关,染色时间越久,强活力种子着色数量越多,着色越深,着色面积越大。当TTC浓度逐渐升高时,白前种子生活力增强,但当浓度超过0.5%时,白前种子生活力下降。综上所述,白前种子的TTC生活力测定最佳方案为:TTC浓度0.3%~0.4%,浸种时间8~16 h,染色时间4~5 h。

表6 白前种子TTC测定正交试验结果Table 6 Orthogonal test results of TTC determination of seeds of Cynanchum stauntonii
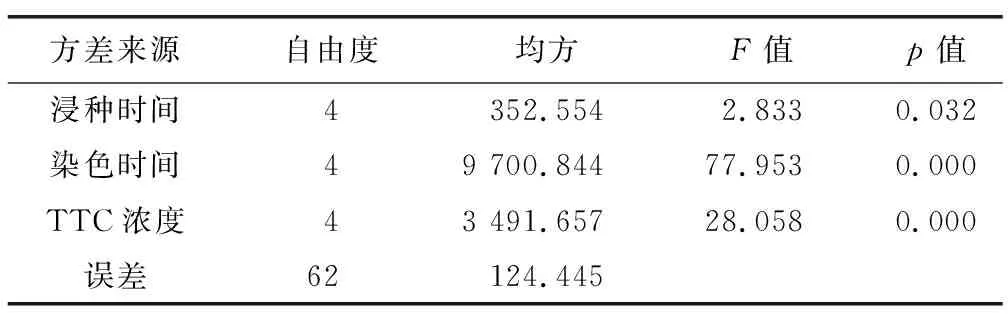
表7 白前种子方差分析结果Table 7 Results of variance analysis of seeds of Cynanchum stauntonii
3.5 发芽率结果分析
3.5.1浸种预处理溶济的确定
由表8可见,进行浸种预处理试验有利于提高白前种子发芽率,各预处理溶剂浸种24 h后白前种子发芽率从高到低为:1% H2O2、超纯水、自来水,采用1% H2O2浸种预处理的发芽率较高,可能是1% H2O2浸种预处理具有一定的除菌作用,能改善种子发芽过程中的霉变现象,有利于种子正常发芽,提高种子的发芽率。

表8 浸种条件试验Table 8 Soaking condition test
3.5.2光照条件和发芽温度的确定
由表9可知,温度对白前种子的发芽影响显著,低温(17 ℃)不利于白前种子的萌发,且导致萌发率下降明显,使种子难发芽或不发芽。随着温度逐渐升高,白前种子发芽率逐渐增大,高温(30 ℃)条件下萌发率最高,另外光照对白前种子发芽率也有影响,较温度的影响小。对比避光萌发、弱光萌发、LD萌发3组试验结果,发现光照对白前生长周期有一定影响。充足的光照有利于白前种子的平均萌发时间提前0~1 d,使白前种子的发芽持续周期平均缩短5.67~6.00 d。
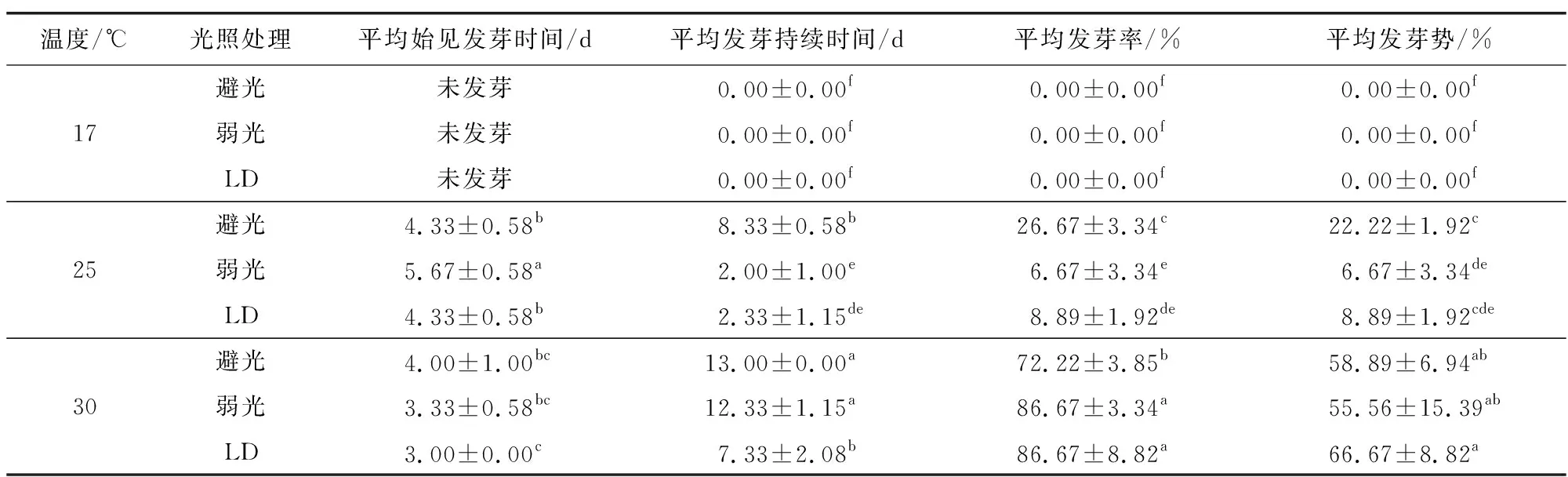
表9 不同温度和光照条件对白前种子发芽率的影响Table 9 Effects of different temperature and light conditions on germination rate of Cynanchum stauntonii seeds
3.5.3不同产区白前种子的发芽率结果
白前种子经1% H2O2浸泡24 h预处理,高温(30 ℃)条件下光照、不盖滤纸处理组发芽率最高,在此基础上考察不同产地白前的发芽率情况。白前种子萌发过程见图5,结果见表10,由此可见,不同产地的白前种子发芽率存在显著差异,其中,团风回龙山镇、麻城三河口镇、贾庙乡、新洲旧街区的种子发芽率高于其他产区。麻城夫子河镇、新洲徐古镇产区发芽率低于其他产区,且与其他大部分产区存在显著差异。这与前文中麻城夫子河镇、新洲徐古镇种子形态多干瘪皱缩;净度、千粒重过低有关。黄冈浠水县产区的白前种子发芽率最低是因为种子未完全成熟,农户收割后产区当月降雨天气居多,储存过程中种子容易霉变。
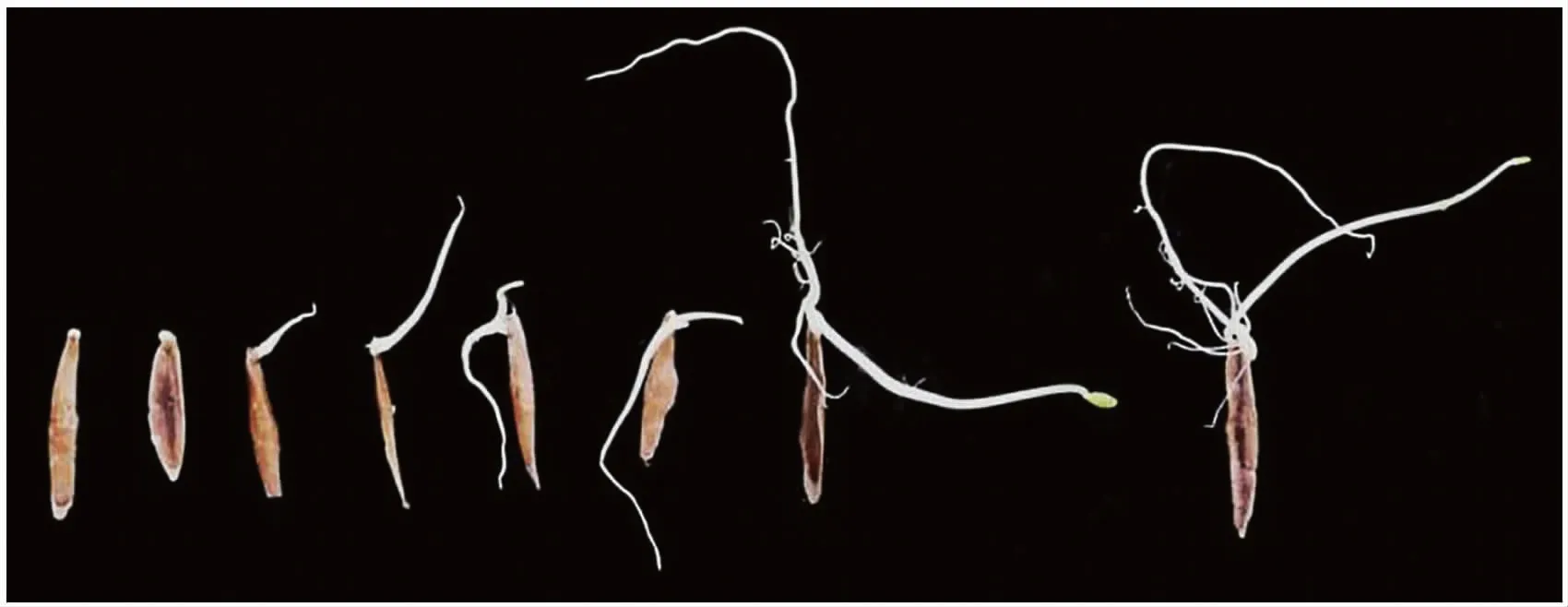
图5 白前种子萌发生长动态模拟 Fig.5 Dynamic simulation of seed germination and growth of Cynanchum stauntonii

表10 不同产地白前种子发芽率比较Table 10 Comparison of germination rate of Cynanchum stauntonii seeds from different producing areas
3.6 新陈白前种子发芽率比较
通过对不同储藏年限的白前种子进行发芽率测定,发现新种子的发芽率在86.67%左右,高于陈种子发芽率(77.78%)。原因可能是随着种子储存时间的延长,种子生活力下降。罗倩等[27]研究不同储藏条件对独活种子发芽率影响时便发现种子贮藏时间延长会导致种子活力下降甚至衰老死亡。
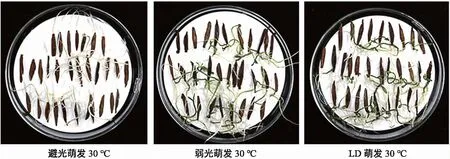
图4 30 ℃不同萌发方案下白前种子萌发状况 Fig.4 Germination status of seeds of Cynanchum stauntonii under different germination schemes at 30 °C
3.7 白前种子质量分级标准的初步制定
用 SPSS20.0 软件对6项指标检测数据进行分析,结果见表11。可知种子宽度大小可以作为衡量白前种子质量标准的指标之一。团风杜皮乡、黄冈浠水县的白前种子形态、净度正常,但在处理过程中发现种子果荚霉变现象严重且发芽率过低,是因为农户采摘种子时间过早,采摘后由于当月降雨天气居多,导致种子多受潮变质。为避免影响种子质量分级,故将二者去除。对其他8个产地的样品进行K-means聚类分析,初始聚类中心值见表12。结合表5不同产地的白前种子由于采收后储存方式导致含水量差异显著的结果,为避免分级出现偏差,故除去含水量这一指标,以白前种子宽度、厚度、千粒重、强生活力及发芽率这5项指标的最终聚类中心值作为白前种子的质量分级参考值,结合不同产地白前种子净度,制定了白前种子质量分级标准,分级方法采用最低定级原则,任何一项指标不符合规定标准都不能作为相应等级的合格种子,见表13。
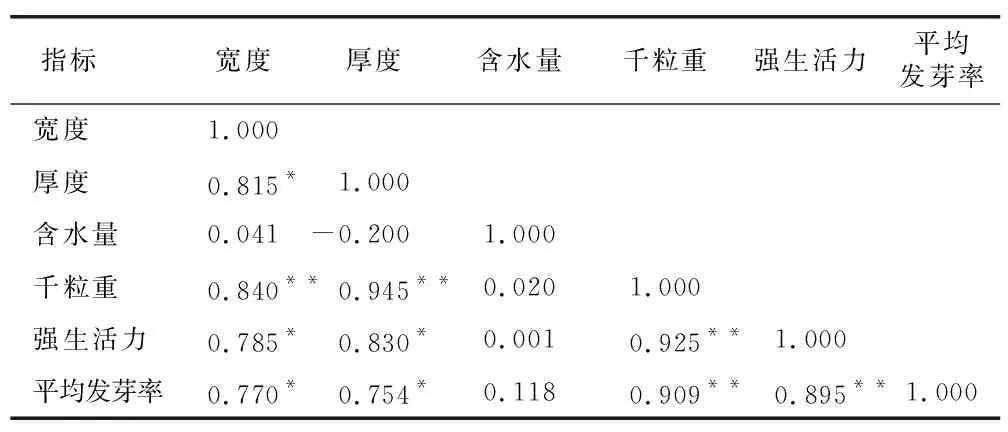
表11 各指标之间的相关性分析Table 11 Correlation analysis between various indices
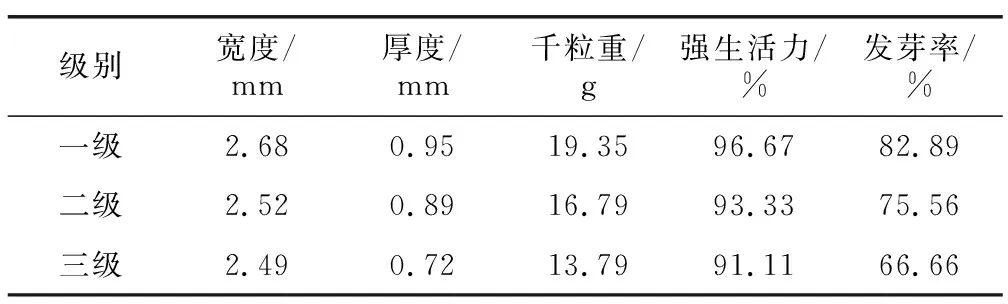
表12 K类中心聚类的最终聚类中心值Table 12 Final cluster center value of K-class center cluster
4 讨 论
中药材种子的优劣情况直接影响中药材的生长状态和后期质量,影响其质量差异的因素有很多,包括海拔、气候、土壤肥力、种子采收时间、采收后的储存方法及种子本身成熟度[10]。从本实验可知,不同产地的白前种子质量差异明显,主要表现在种子形态、千粒重和萌发状态等方面。种子的净度问题最能反映各个地区种子采收时的真实情况。麻城夫子河镇、新洲徐古镇产区的种子净度普遍低于其他产区,且种子成熟度也不如其他产区,废种子较多。在药用牡丹[28]种子的收集过程中发现,由于存在提前抢收的问题导致部分产区牡丹种子净度降低,种胚霉烂。本研究中麻城夫子河镇、新洲徐古镇产区的种子净度、成熟度普遍低于其他产区,不排除当地农户采摘时出现抢收、以次充好和采收时节不合时宜等情况。新洲3个产地的种子含水量差异较大,新洲旧街种子含水量高是因当地农户采摘后没有及时晒干处理而直接储存至阴凉处,导致果荚偏绿,种子潮湿含水量偏高。同时种子成熟度对发芽率影响较大。除去黄冈浠水县产区种子或存在质量问题外,麻城夫子河镇、新洲徐古镇产区种子成熟度不如其他产区,种子外表皮多皱缩干瘪,种子霉烂情况较多,故其发芽率较低。团风贾庙乡产区的白前种子成熟度较好,大小均一且饱满,因此发芽率较高。表明白前种子产地、采摘时间、种子成熟度的不同,使得种子质量差异较大,后续可继续对不同产地的白前苗整齐度、后期长势及品质进行分析对比。本试验可知,从白前种子宽度、厚度、千粒重、强生活力及发芽率综合因素考虑,团风贾庙乡、新洲旧街产区的种子质量优于其他产区。
韩金龙等[19]对白前同属植物徐长卿种子品质检验及其质量分级标准研究中发现,TTC染色法适用于徐长卿种子生活力的测定,同时,种子生活力的测定受到浸种时间、染色时间及TTC浓度的影响。因此,在本研究中亦比较了浸种时间、染色时间及TTC浓度对种子生活力的影响,并得出了较合适的TTC生活力测试方案,为其他同属植物的生活力测试提供参考。萌发试验发现,白前种子易发生霉变,种子表皮出现黑色或白色霉菌菌丝,底部铺盖滤纸上出现黄褐色或粉红色霉斑,不利于种子的正常萌发,而白前的采收期集中在12月,湖北属湿润地区,12月温度较低且湿度大,白前种子如果保存不当易发生霉变从而影响发芽率。本研究发现,采用1% H2O2溶液浸种预处理能很好地提高种子的发芽率,同时温度和光照对种子的发芽生物学特征影响明显,其中温度对白前种子的发芽率影响尤其显著。周义峰等[22]对徐长卿种子生活力检测及发芽生物学特性观察的研究发现,采用1% H2O2浸种预处理的徐长卿种子发芽率高于对照组,随着温度的升高,徐长卿种子的发芽率也随之增加,与本研究结果趋势一致。并且温度和光照对种子生长周期也有一定影响,光照对白前种子发芽率的影响较温度对白前种子发芽率的影响小。在25 ℃条件下,白前种子进行避光萌发的发芽率高于弱光萌发的发芽率,与李龙等[23]对萝藦种子萌发检验标准化研究中的结果趋势一致。结果表明,充足的光照更有利于缩短白前种子的出芽时间和和发芽持续时间,使种子出芽更快,出芽时间更集中。同时对比同一批白前种子不同储藏年限的发芽率可知,新种子发芽率高于陈种子。与周义峰等[22]对徐长卿种子生活力检测及发芽生物学特性观察的研究结果一致。综上所述,在白前种子实际育苗生产中,选择一年生白前种子进行1% H2O2浸种处理并在高温(30 ℃左右)及充足光照的条件下进行种子育苗能得到更高的出苗率并缩短白前种子的萌发周期,更快出苗。这对白前种子优选和育苗具有重要意义,也为研究开发新的白前育苗方式提供指导作用。
本实验以白前种子为对象,研究了不同产地种子的净度、千粒重、含水率、生活力及发芽率,初步制定了以宽度、厚度、千粒重、生活力、发芽率、净度为指标的白前种子质量分级标准。为白前种子的质量评价和优化选种育苗提供了科学可行的参考依据;白前种子质量分级标准的制定为其作为湖北地道药材申请地方标准乃至国家标准提供了科学有利的依据。
—— 以SI 级钻石的净度分级为例

