玉米穗部性状QTL定位与候选基因分析
聂 蕾, 何 玥, 郭 爽, 王 栋, 涂 亮,刘鹏飞, 王安贵, 祝云芳, 吴 迅,3, 陈泽辉, 郭向阳
(1.贵州大学农学院, 贵阳 550025; 2.贵州省农业科学院旱粮研究所, 贵阳 550006;3.农业农村部喀斯特山区作物基因资源与种质创新重点实验室, 贵阳 550006)
粮食安全已经成为世界各国普遍关注的问题,玉米是主要粮食作物之一,提高玉米产量对保障粮食安全起着至关重要的作用[1]。穗部性状作为玉米产量的重要构成因子,包括穗长、穗粗、穗行数、穗重等,具有较产量性状高的配合力和受环境影响程度小的优势,在深度解析玉米产量性状变异的遗传基础方面发挥着重要作用[2]。探讨穗部性状变异的遗传基础,对指导玉米育种、提高玉米产量具有十分重要的意义。例如,穗部性状能够预测玉米的产量,以便更好地利用种植期间的资源,最终达到高产的目的[3]。近年来,有关玉米穗部性状QTL定位的研究取得了显著进展,王辉等[4]以郑58和HD568为亲本构建的220份重组自交系群体为供试材料,在3个不同种植密度下共检测到42个QTL,其中包括8个穗长、14个穗粗、14个穗行数和6个行粒数,单个QTL可解释4.20%~14.07%的表型变异。宋晓恒等[5]通过豫82和豫87-1杂交构建的重组近交系(RIL),对玉米穗长、穗粗和籽粒深度进行QTL定位分析,共检测到7个QTL,分布在1号、2号、4号、5号、8号染色体上。Shi等[6]以杂交种Xianyu335开发的240个优良品系所组成DH群体为构图群体,基于964个SNP构建遗传图谱,在3种不同的生长条件下共鉴定出4个穗粗QTL,分别位于1号、3号、4号染色体上,可解释表型变异率在4.7%~28.3%之间。白娜等[7]采用地方品种四路糯经作为供体亲本,穗行数可达18~22行的农531作为轮回亲本,通过完备区间作图法(Inclusive composite interval mapping,ICIM)对穗行数QTL进行定位解析,在第5染色体136.3~140.0 Mb之间,定位到穗行数主效位点qKRN5.04,解释了21.76%表型变异。赵强等[8]以T32和齐319为亲本构建的双亲分离群体为材料,利用高密度SNP标记对5个玉米穗部相关性状进行QTL定位,检测到16个QTL,筛选出4个控制穗部的候选基因。Yan等[9]利用266份F2∶3家系为材料及150个SSR和26个RFLP分子标记进行QTL定位,共测得29个和单穗产量,百粒重、穗行数与行粒数相关QTL,单个位点可以解释3.70%~16.80%的表型变异,其中11个位点在多环境中被检测到。谭巍巍等[10]以黄早四为共同亲本,分别以掖478和齐319杂交构建两套F2∶3群体为试验材料,在3个不同环境下,两个群体分别检测到33个和46个穗部相关性状QTL。这些研究为深入揭示玉米产量性状变异的遗传基础提供了丰富的科学支撑,但比较发现,不同研究者因为所用群体类型不同、大小差异以及标记等的不同,其研究结果也不尽相同。因此,本研究以两个热带玉米骨干自交系(T32和QR273)为亲本构建的F2、F2∶3家系为试验材料,结合高通量的GBS测序技术和多环境下的穗部性状评价结果,鉴定控制玉米穗部性状相关遗传区段,揭示其遗传效应并开发功能性标记。在此基础上,利用生物信息学分析方法分析控制穗部性状变异的候选基因,为初步解析玉米穗部性状变异的遗传基础提供更丰富的理论支撑,也为后续的精细定位、候选基因图位克隆和分子标记辅助育种提供科学依据。
1 材料与方法
1.1 试验材料
本研究使用的试验材料选择热带种质的玉米骨干玉米自交系QR273和T32,由贵州省农业科学院旱粮研究所提供。其中,QR273表现出配合力高、籽粒宽短,T32则表现为穗粗大,籽粒长厚,以这两个自交系为亲本构建的150份F2、F2∶3家系为作图群体,后代的穗部性状表现出显著差异。
1.2 试验方法
1.2.1田间试验及性状考察
2021年在海南种植150份F2分离后代,5叶期单株取样提取基因组DNA,用于基因型鉴定,同时自交获得F2∶3家系。2022年在贵州省贵阳市贵州省农业科学研究院试验基地、甘肃省张掖市农业科学研究院试验基地各栽植150个F2∶3家系及2个亲本。试验按随机区组设计,重复2次,行长4 m,行距0.64 m,每行18株,田间管理按照当地玉米种植和管理方法执行。
玉米成熟期,每行连续采收所有果穗,自然风干至恒重,进行室内考种,每个材料随机选取5株进行穗长、穗粗、穗行数、行粒数、秃尖长等穗部性状的调查,参考石云素等[11]制定的《玉米种质资源描述规范与数据标准》。
1.2.2表型数据分析
应用 Microsoft Excel2010 软件整理表型数据,采用SAS9.0软件进行统计分析、方差分析、相关性分析及广义遗传力[12],遗传力公式如下:
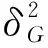
1.2.3基因型鉴定
DNA质量检测和GBS测序委托北京康普生生物有限公司完成,具体操作依据吴迅等[13]描述的方法执行。即玉米F2植株5叶时期时,取各单株的幼嫩叶,采用改良CTAB法提取基因组DNA[14];利用简化基因组测序技术(GBS)对每个单株的基因型进行鉴定。
1.2.4QTL分析
利用IciMapping4.1软件中的完备区间作图法对5个穗部性状进行QTL检测,随机抽样1 000例,QTL定位中阈值定为3。QTL命名格式为 q+性状英文缩写字母+染色体+序号。参考Stuber等[15]方法,对基因作用模式进行了估计,|d/a|=|显性效应值/加性效应值|、A(加性方式):|d/a|=0.00-0.20;PD(部分显性):|d/a|=0.21-0.80;D(显性方式):|d/a|=0.81-1.20;OD(超显性方式):|d/a|>1.20。
1.2.5候选基因预测
基于两个环境下玉米穗部相关性状的QTL定位结果,结合玉米B73参考基因组中的物理位置(Ref Gen_v4(https://www.maizeGDB.org/),综合分析不同QTL的遗传背景和效应,鉴定控制目标性状的基因位点所在染色体区段,与公共数据库和已发表的文献QTL定位信息进行比较,寻找“一致性”QTL,并对该区段内的基因进行分析,预测候选基因。
2 结果与分析
2.1 穗部性状表型分析
在两个环境条件下,根据双亲(T32和QR273)与150个F2∶3家系5个穗部性状表型的平均值,可以看出双亲在不同环境中的穗部性状表现存在显著差异。亲本QR273在两种环境中的穗长、行粒数的表现显著大于亲本T32,在贵阳单一环境下5个性状表现均高于T32;而对张掖环境中的穗粗、穗行数和秃尖长而言,亲本T32的表现优于QR273。F2∶3家系的穗长、穗行数和行粒数的均值介于双亲之间,为中亲优势;穗粗在两个环境中的表现都较高,其均值大于双亲为超亲优势。5个穗部性状偏度和峰度的绝对值均小于1,符合正态分布,可实现QTL定位分析。从遗传力的研究结果中可看出,该群体遗传力在不同环境中存在差异,如贵阳环境下5个穗部相关性状的遗传力高于张掖环境下,在贵阳穗粗遗传力是61.87%,而在张掖遗传力为11.11%(表1)。
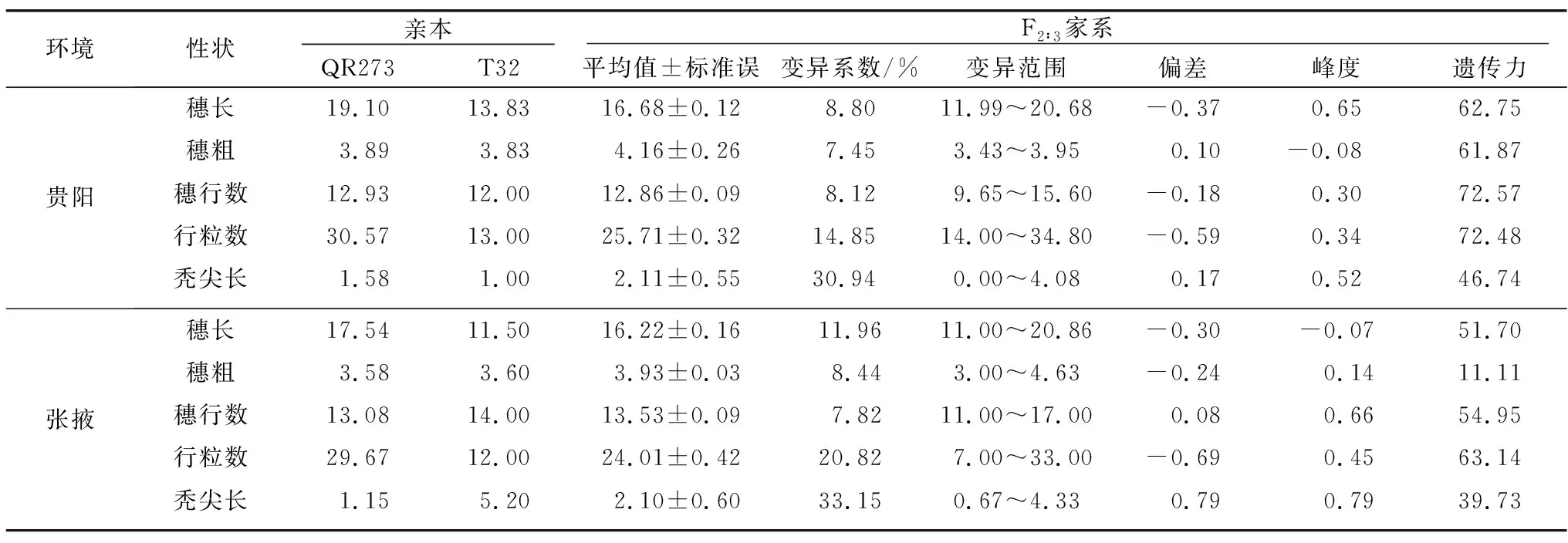
表1 亲本和 F2∶3群体的穗部性状表现Table 1 Performance of ear traits in parents and F2∶3 population
2.2 穗部性状相关性分析
表2为穗部各个性状之间相关分析。结果表明,在不同环境条件中,穗长和穗粗、行粒数、秃尖长都表现出显著的正相关,穗长和穗行数在两个环境中均表现为显著负相关。穗粗除秃尖长外,与其他穗部性状在两个环境中呈显著正相关。行粒数与贵阳环境中秃尖长之间存在极显著的负相关,与张掖呈负相关。
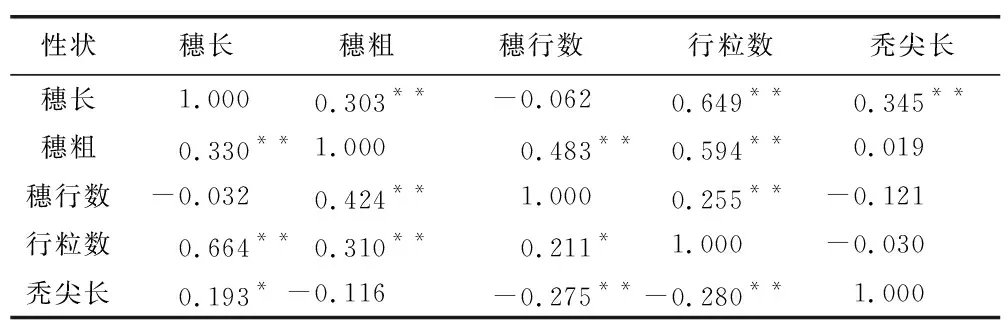
表2 穗部之间的相关性分析Table 2 Correlation analysis between ears
2.3 高密度物理图谱构建
按照缺失率小于0.05,具有确定物理图距为标准对获得的10万个SNPs进行过滤,最后获得68 994个高质量SNPs,均匀地分布在10条染色体上(图1)。各染色体上的标记数量大小依次表现为Ch4、Ch2、Ch1、Ch3、Ch5、Ch8、Ch9、Ch7、Ch6、Ch10,其数量分别为8 901个、8 824个、8 725个、7 623个、7 174个、6 407个、5 782个、5 592个、5 432个、4 534个。

注:每一行代表一个SNP标记,不同的颜色显示不同的标记密度。浅色表示标记的密度较低,深色表示标记的密度较高。图1 物理图谱Fig.1 Physical map
2.4 穗部性状QTL分析
由表3可知,两个环境下共检测到46个穗部相关性状QTL,分布在10条染色体上,单个QTL可解释表型变异范围为1.89%~17.18%,其中,解释表型变异大于10%的有6个,分别为qEL1-3、qED6-1、qED6-2、qERN3-1、qERN7和qEBT8-1。检测到与穗长相关的QTL共有10个,分布在1号、2号、3号、4号、6号染色体上,单个QTL可解释的表型变异3.35%~11.80%。在张掖环境下,位于1号染色体上的qEL1-3解释的表型变异最大,其贡献率为11.80%;穗粗在两环境下共检测到4个QTL,分布于1号、5号、6号染色体上,单个QTL可解释的表型变异范围为5.92%~11.03%;检测到与穗行数有关的QTL共19个,分布在除了第1号和第9号染色体外的其他8条染色体上,单个QTL可解释的表型变异范围为1.89%~17.18%;检测到与行粒数相关QTL共12个,分布在1号、2号、3号、5号、7号、9号、10号染色体上,单个可解释表型变异范围为3.50%~8.71%;检测到与秃尖长相关QTL共5个,主要分布1号、2号和8号染色体上,单个QTL可解释的表型变异范围为2.16%~10.36%,qEBT8-1解释的表型变异最大,为10.36%。就基因作用方式而言,5个穗部相关性状的QTL表现不尽一致。其中4个QTL基因作用方式表现为加性效应;10个呈部分显性;4个呈显性;28个为超显性。本研究多数与穗部性状有关的QTL为部分显性及超显性,与Xiang等[16]、兰进好等[17]的研究结果一致。在46个QTL中,增效等位基因来源于QR273的有17个,来自T32的有29个。
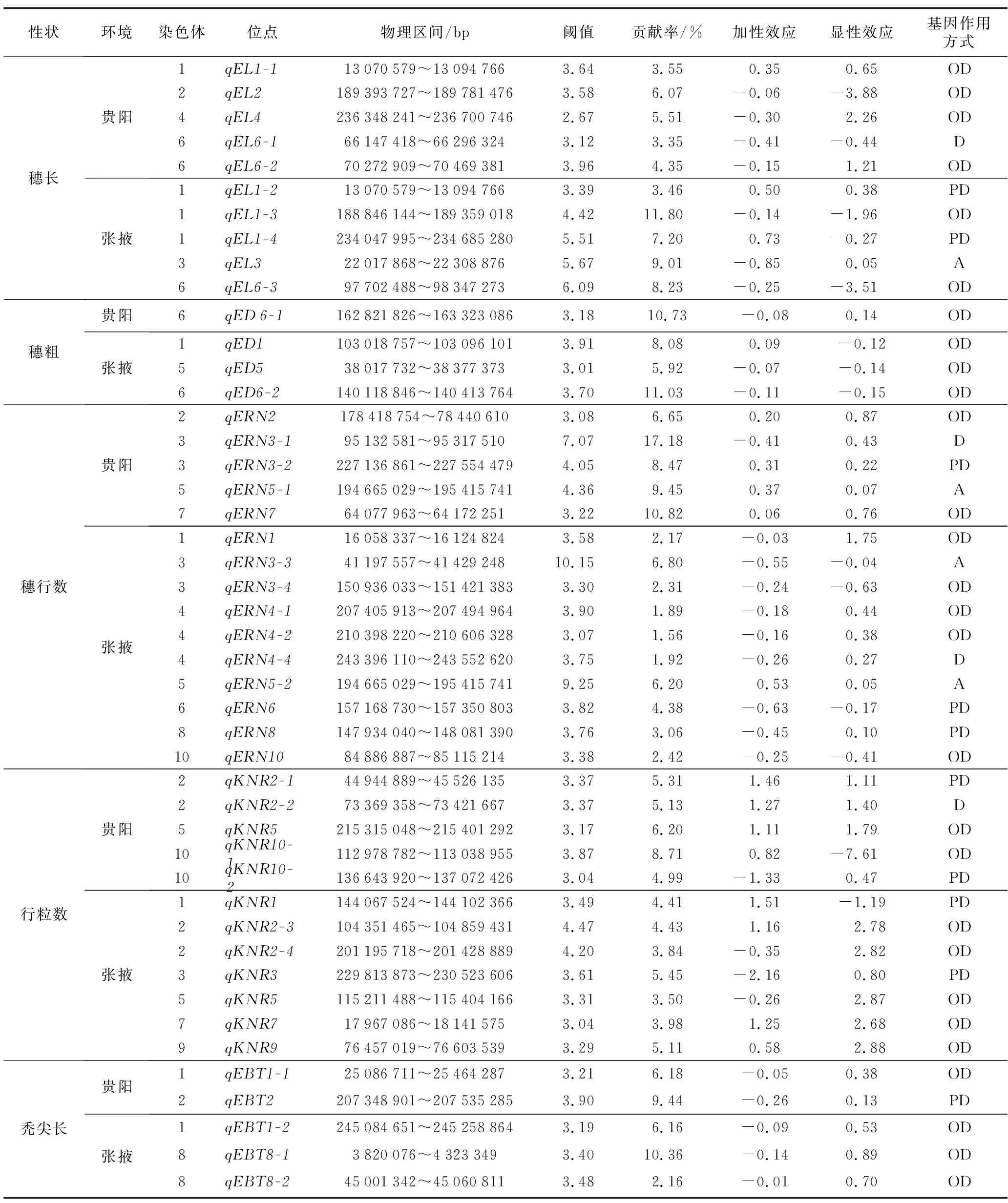
表3 5个穗部相关性状QTL定位结果Table 3 QTL mapping results of 5 ear-related traits
2.5 一致性QTL
Tuberosa等[18]研究表明,对同一性状QTL进行不同环境中的检测,若其标记区间一致、增效等位基因起源一致则视为同一QTL。本研究通过对两环境条件下的初步定位结果比较发现,qEL1-1和qEL1-2都在1号染色体13.07~13.09 Mb区间内被检测到,增效等位基因来源于QR273;qERN5-1和qERN5-2都在5号染色体194.67~195.42 Mb区间内被检测到,增效等位基因来源于QR273,这两个在不同环境下均被检测到的“一致性QTL”受环境影响较小,能够稳定表达对于玉米产量的形成具有重要意义(表4)。
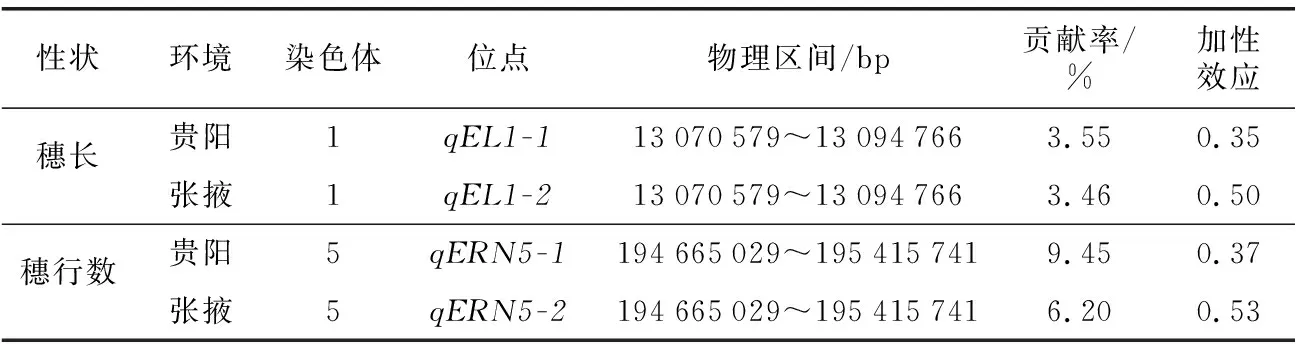
表4 一致性QTLTable 4 Consistency QTL
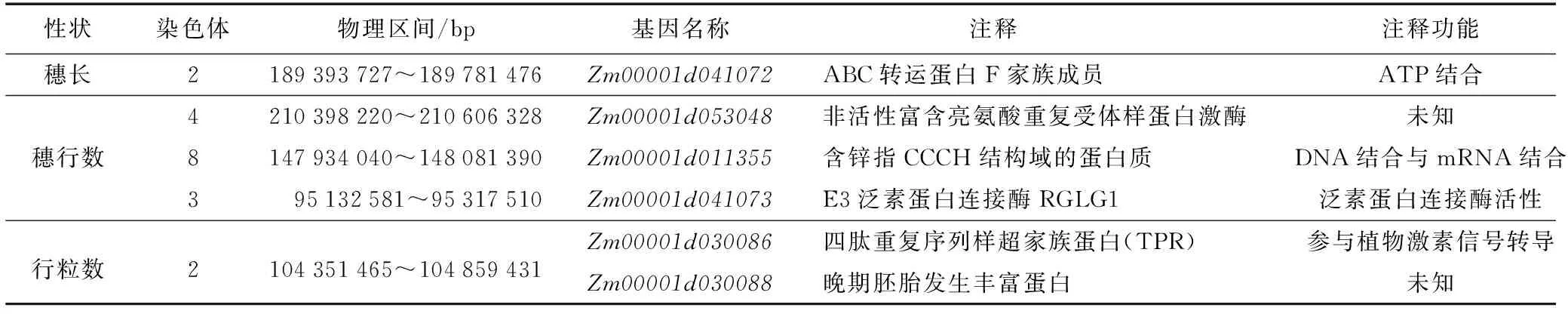
表5 基因位置及功能注释Table 5 The gene location and functional annotation
2.6 候选基因分析
结合两环境下的定位结果与已公开QTL数据库对比发现,本研究检测到46个QTL中有8个QTL与前人定位结果重叠,以筛选出的8个一致性QTL为目标,基于Gramene 网站数据库(http://www.gramene.org)对目标候选基因进行分析,结合前人的研究报道,初步预测得到Zm00001d041072、Zm00001d053048、Zm00001d011355、Zm00001d041073、Zm00001d030086、Zm00001d030088等6个与穗部相关的候选基因。其中,Zm00001d041072是从控制穗长QTL区间发现,它编码的ABC转运蛋白在植物生长发育中发挥作用,因为植物生长发育需要多种信号分子来响应和沟通,这些信号分子跨膜转运时需要ABC转运蛋白[19];Zm00001d053048位于穗行数QTL区间内,其编码的富含亮氨酸重复序列的类受体激酶为植物最大跨膜类受体激酶亚族,对植物发育及抗病反应具有广泛的调控作用[20]。这些受体蛋白激酶是胁迫表达相关基因中的一部分,参与植物体对逆境的应答及防御相关过程;Zm00001d011355编码的含锌指CCCH结构域的蛋白质,CCCH型锌指蛋白对植物生长发育及生物与非生物胁迫响应具有重要的调控作用。RNA能被该蛋白识别并结合[21];Zm00001d041073编码的E3泛素蛋白连接酶RGLG1,2012年Cheng等[22]发现RGLG1、RGLG2对拟南芥对干旱胁迫的反应具有负调控作用,二者通过泛素化修饰ERF53,促进了它被26S蛋白酶体的降解,削弱植物对干旱的抗性等[22]。RGLG1,RGLG2也涉及生长素信号途径、生长素信号转导障碍,生长发育缺陷,对生长素转运蛋白如PIN的含量有影响,对生长素的分配也有一定的影响[23]。Zm00001d030086是从控制行粒数的QTL区间内找到的,它所编码的四肽重复序列样超家族蛋白(TPR)是一类广泛存在于植物体内的转录共抑制因子,参与多种植物激素信号转导途径,生物胁迫和非生物胁迫相关基因的转录抑制调控。拟南芥 TPR 除了参与激素信号转导外,还参与调控植物的花期等生命过程[24];Zm00001d030088编码的晚期胚胎发生丰富蛋白,该蛋白是一类较常见的当植物遭受干旱胁迫时产生的具有保护功能的蛋白[25]。有研究结果表明,LEA蛋白基因的表达能够提高植物的耐旱性和抗寒性[26]。
3 讨 论
玉米穗部性状受到复杂基因网络的调控,容易受到环境的影响。通过与前人研究结果分析比较,共发现8个控制玉米穗部相关性状的一致性QTL。Zhou等[27]利用四交群体在1号染色体184.92~209.86 Mb(B73Ref-Gen_v4)区间内定位到1个穗长QTL,本研究在1号染色体189.39~189.78 Mb和188.85~189.35 Mb区间内定位到2个控制穗长的QTL,分别为qEL2和qEL1-3;谭巍巍等[10]在3号染色体94.27~141.39 Mb和10号染色体60.38~90.58 Mb区间内分别定位到控制穗行数的qKRE2-3-2和qKRE1-10-1,本研究在相邻位置95.13~95.31 Mb和83.88~85.11 Mb区间内分别定位到控制穗行数的qERN3-1和qERN10;张君[28]在8号染色体137.81~148.01 Mb区间内定位到控制穗行数的qERN8b,本研究在相邻位置147.93~148.08 Mb区间内定位到控制穗行数的qERN8;王辉等[4]在4号染色体215.09~205.41 Mb区间内定位到一个控制穗行数的QTL为qERN4,本研究在4号染色体207.41~210.61 Mb区间内定位到两个控制穗行数的QTL,分别为qERN4-1和qERN4-2;王辉等[4]在2号染色体105.71~103.87 Mb区间内定位到一个控制行粒数的QTL为qKNR4,本研究在2号染色体104.35~104.85 Mb区间内定位到控制行粒数的QTL为qKNR2-3。除此之外,本研究在1号染色体上检测到的QTL较多,与刘琳[29]的研究结果一致,在5号、6号、7号、9号染色体上定位到一些新的穗部性状QTL。
随着分子生物学的日益发展,愈来愈多的研究者发现植物激素合成以及一些重要转录因子和蛋白激酶对玉米生长发育发挥重要作用[30]。赵强等[8]基于高密度SNP标记对玉米穗部相关性状的候选基因分析,在穗长、穗行数和秃尖长区间内预测出4个候选基因,与穗行数qERN1位点关联的候选基因Zm00001d027721,其编码的高亲和力镍转运家族蛋白具有运输功能,本研究与行粒数qKNR2-3位点关联的候选基因Zm00001d030086也具有参与植物激素信号转导的功能。Zhou等[27]通过QTL定位与全基因组关联分析(GWAS)确定了3个控制穗长QTL的候选基因,其编码的蛋白与植物生长素运输、细胞增殖和发育调节有关。本研究从控制穗长、穗行数和行粒数的QTL区间内预测了6个可能影响穗部性状的基因,其编码的蛋白具有合成激素,运输和信号传导的功能,发挥的具体作用在拟南芥等植物中得到了验证。
4 结 论
本研究以热带种质自交系为亲本构建双亲分离群体作为试验材料,通过QTL定位与候选基因分析,共定位到46个穗部性状QTL。与已发表文献及公开QTL数据库进行对比,发现8个与前人研究结果重合,分别控制穗长、穗行数和行粒数的变异,其中1个穗长QTL和1个穗行数QTL在多环境下均被检测到,且区间完全重叠。研究结果在前人定位结果的基础上,进一步减小QTL置信区间,为进一步的精细定位提供候选靶标。本研究共预测得到6个候选基因,分别是:Zm00001d041072、Zm00001d053048、Zm00001d011355、Zm00001d041073、Zm00001d030086、Zm00001d030088,其编码的蛋白具有合成激素等生物学功能,可作为后续基因图位克隆和分子辅助育种的候选靶标。

