鹤顶兰种子的真菌共生萌发研究
汪 雨, 高鑫祯, 邵士成, 王晓静, 罗 艳, 马长乐
(1.西南林业大学园林园艺学院, 昆明 650224; 2.中国科学院西双版纳热带植物园, 云南 勐腊 666303;3.国家林业和草原局西南风景园林工程技术研究中心, 昆明 650224; 4.中国科学院大学, 北京 100049)
鹤顶兰属(Phaius)植物为地生兰,属于兰科吻兰族,全球约有40种,分布于非洲热带地区、亚洲热带和亚热带地区至大洋洲[1-2]。鹤顶兰属植物植株高大,花大且艳丽多姿,很多种类具有优良的园艺观赏特征。该属中应用最为广泛的物种是鹤顶兰[Phaiustancarvilleae(L'Hér.) Blume],花朵靓丽,优雅欣然,古人称其为“鹤兰”,具有极高的观赏价值,已应用在鲜切花、园林植物配置、园艺美化及园艺品种育种等领域[3]。鹤顶兰的假鳞茎粗壮,内用具有祛痰止咳、活血止血的作用,外用可治疗跌打肿痛、外伤出血等[4]。由于生境破坏和人为过度采挖,加之其自然结实率低,自然更新能力较弱,致使其野生资源已濒临枯竭。探索鹤顶兰保育的技术方法已成为加强鹤顶兰资源保护和可持续利用中亟待解决的重要问题。
自然环境中,兰科植物种子必须依赖共生真菌提供营养进行萌发[5-8]。近年来,多种兰科物种都筛选到了可促进种子萌发的共生真菌,例如地生兰类的龙头兰[Pecteilissusannae(L.) Raf.][9]、手参[Gymnadeniaconopsea(L.) R. Br.][10],附生兰类的硬叶兰(CymbidiummanniiRchb. f.)[11]、铁皮石斛(DendrobiumofficinaleKimura &Migo)[12]等。徐锦堂等[13]从腐生兰科植物天麻(GastrodiaelataBlume)的原球茎中分离得到一株促进天麻种子萌发的共生真菌,已广泛应用于天麻的人工繁殖和生产栽培中。Shao等[14-15]建立了原地共生萌发的野外回归技术,采用共生真菌与种子混合进行播种,成功实现了齿瓣石斛(DendrobiumdevonianumPaxton)的野外回归。这些研究均表明,兰科种子的真菌共生萌发是进行兰科资源保护和可持续利用最为有效的方法。
目前,鹤顶兰的栽培繁殖方式主要采用分株和无菌播种。分株繁殖通常在休眠期结合换盆进行,分株后的新株需带有两个以上的假鳞茎和芽,这种分株方式当年即可开花[16]。但分株繁殖的繁殖系数低,不适用于大规模生产。现阶段在生产实践中已实现了基于种子无菌萌发的组织培养技术,可以进行鹤顶兰种苗的规模化生产。如兰芹英等[17]对鹤顶兰快繁技术的研究中筛选得到萌发率可达100%的培养基。姚绍嫦等[18]主要对组培过程中原球茎的增殖进行了研究,得到一种培养基配方,在培养30 d时增殖倍数可达6.67倍,培养60 d后超过30倍。但组织培养方式耗费巨大的人力物力,不能完全解决生产和保护实践的应用,同时容易过度纵容幼苗获得营养和理想的生长条件[19],使幼苗在进行驯化时,可能面临气候变化和病虫害等在实验室培养中不存在的问题。
在中国科学院西双版纳热带植物园(以下简称版纳园)保育的鹤顶兰的栽培养护过程中发现,其种子可以在栽培基质中自然萌发,深圳仙湖植物园的研究人员也开发了利用腐熟处理的栽培基质促进鹤顶兰种子萌发的技术[20],这些发现表明,促进鹤顶兰种子萌发的真菌可能广泛存在,但目前仍不清楚是何种真菌可促进鹤顶兰的种子萌发。本研究采用兰科种子原地共生萌发的方法,从鹤顶兰栽培基质中采集自然萌发的原球茎,从原球茎中分离菌株,筛选促进鹤顶兰种子萌发和原球茎发育的真菌,以期为鹤顶兰的生物技术育种、种质资源保存、快速繁殖提供理论依据和技术支持。
1 材料与方法
1.1 研究地点和研究材料
鹤顶兰(图1A)为地生兰,广泛分布于我国台湾、福建、香港、海南、广西、云南和西藏东南部,生长于亚热带和热带常绿阔叶林的林下潮湿处。鹤顶兰在版纳园已成功实现迁地保护。本研究的研究地点位于版纳园的保育苗圃(21°54′N,101°46′E)。2021年4月,对栽培于保育苗圃的鹤顶兰进行人工异交授粉,于2021年9月采集果荚变软但尚未完全开裂的成熟蒴果(图1B)。

注:A为花序;B为蒴果;C为TTC染色的种子;D为原地萌发诱导形成的原球茎。图1 鹤顶兰Fig.1 Phaius tancarvilleae
1.2 种子收集保存及原地共生萌发
用脱脂棉沾取75%的乙醇清洗果荚表面,再用无菌水冲洗3次。用无菌刀将果实剖开,轻拍果皮,将种子抖落。短期保存:用无菌的滤纸包好种子,在22 ℃条件下,用无水氯化钙干燥3 d后装入密闭离心管中,在4 ℃的条件下储存。长期保存:将种子干燥3 d后存于灭菌的密闭离心管中,置于20 ℃条件下储存。
采用TTC(氯化三苯基四氮唑)法进行鹤顶兰种子活力的检测,使用磷酸缓冲液作为溶剂配制浓度为1%的TTC作为染液。将种子置入1 mL离心管中,加入纯水浸泡24 h后再加入预先配置的TCC染液,放置于37 ℃恒温箱在黑暗条件下染色24 h后,在体式显微镜(Nikon SMZ800N)下随机观察种子的染色情况,统计视野中的种子总数和着色种胚的种子数。
2021年10月将成熟的鹤顶兰种子直接撒播在成年鹤顶兰植株(共计5盆)附近的土壤基质中。每隔一个月对土样进行监测观察。
1.3 原球茎内共生真菌的分离
将马铃薯葡萄糖培养基(PDA,马铃薯200 g/L+葡萄糖20 g/L+琼脂15 g/L)配制好后在121 ℃高压灭菌20 min,分装于无菌培养皿中。将在苗圃中收获的原地萌发的鹤顶兰原球茎在自来水下清洗,用软毛笔去除原球茎表面的土壤及杂质。在超净工作台上,将洗净的原球茎浸入0.1%次氯酸钠溶液中消毒10 min,用无菌水冲洗3~4次,用无菌刀将原球茎切成薄片,切口面贴于PDA培养基上,用封口膜将培养皿封好后放入霉菌培养箱内,(25±2)℃避光培养。每隔3 d观察一次。
待原球茎切口附近长出菌丝时,在超净工作台用无菌接种针在长出真菌菌落的原球茎切片边缘处挑取菌丝,接种到新的PDA培养基上进行纯化培养,纯化后的菌株以PDA试管斜面4 ℃保存备用。
1.4 菌株的分子鉴定及系统位置分析
将保存在PDA培养基中的真菌菌株,在无菌条件下接入盛有液体PDA培养基的锥形瓶中,置于摇床(SPH-310A,上海百典仪器设备有限责任公司,中国)(25±2)℃下震荡培养。培养时间视真菌的生长速度而定,一般为3~6 d。抽滤约100 mg的菌丝用于真菌基因组DNA的提取,提取方法按照DNeasy plant mini kit(Qiagen69104)说明书上的方法步骤进行。参照常用的真菌分子鉴定方法,使用正向引物ITS1(5′TCCGTAGGTGAACCTGCGG 3′)和反向引物ITS4(5′TCCTCCGCTTATTGATATGC 3′)对核糖体DNA上大约650 bp的ITS区域进行PCR扩增反应[21]。扩增产物送至生工生物工程(上海)股份有限公司进行纯化和双向测序。扩增所得rDNA-ITS序列拼接后使用Geneious prime2022.0.2软件进行手工校对。测序序列使用GenBank(https://www.ncbi.nlm.nih.gov/genbank/)上的BLAST工具进行序列比对,当rDNA-ITS序列相似性超过95%时,属于同一个属,当相似性超过97%时,属于同一种[22]。
为了确定从鹤顶兰原球茎中分离得到的真菌的系统发育位置,本研究将分离得到的真菌的ITS序列与从NCBI中获得的近缘种序列构建系统发育树。以Armillaria sinapina(FJ495039)为外类群,通过PhyloSuite v1.2.2平台查找最适模型后使用IQ-TREE构建Maximum Likelihood(ML)系统发育树[23],通过FigTree v1.4.0软件进行系统发育树的编辑。
1.5 真菌对种子萌发的有效性检测
将保存的供试菌株(编号为HDL-2)在PDA培养基上进行活化,在(25±2)℃黑暗条件下培养8~10 d,待菌丝长满培养皿。采用燕麦琼脂培养基(OMA,燕麦5 g/L+琼脂10 g/L,调节pH值为5.6~5.8)作为种子和真菌共培养的培养基。将保存的鹤顶兰种子经1% NaClO溶液消毒12 min,于无菌水中漂洗3~5次,然后浸于0.1%的琼脂溶液中制成无菌种子悬浮液,采用移液枪吸取1 mL(约含580粒种子)均匀播种在培养基表面。用移液枪枪头将在PDA培养基上的菌丝打孔制成菌饼,取3个菌饼成三点状放置于距培养皿边缘约1 cm处。另取相同大小的未接菌的空白PDA培养基打孔制成饼状放置于OMA培养基中作为阴性对照。另外,将鹤顶兰种子放置在改良的1/2MS培养基(1/2MS+10%椰汁+蔗糖30 g/L+琼脂5.5 g/L+活性炭1.0 g/L,调节pH值为5.6~5.8)上进行播种作为无菌萌发的对照培养。播种方法与前述一致。每组播种实验设置6个重复。将播种后的培养皿放置于组培间进行培养,培养条件:温度为(25±2)℃光照强度为1 800~2 500 lx,光照周期为光照12 h/黑暗12 h。每周监测种子的萌发情况,记录和观测种子萌发及原球茎发育的情况。按照表1划分的种子萌发阶段的标准,在体视显微镜下统计处于各萌发阶段的种子、原球茎、幼苗数量,计算种子萌发率(G)及各阶段的种子、原球茎或幼苗的比率(C)。即G=g/t;C=c/t,其中,g为培养皿中已萌发的种子数,c为培养皿中各阶段的种子、原球茎或幼苗的数,t为播种的种子总数。利用SPSS23.0软件,对不同处理的种子萌发率及各阶段的萌发种子、原球茎或幼苗比率进行显著性差异分析。

表1 鹤顶兰种子萌发的不同发育阶段Table 1 Developmental stages of seed germination of Phaius tancarvilleae
1.6 原球茎被真菌侵染情况的观察
为检测鹤顶兰种子与共培养的真菌的共生关系是否成功建立,培养至60 d时,用台盼蓝染色法观察鹤顶兰种子及原球茎被真菌侵染的情况。将不同发育阶段的鹤顶兰种子/原球茎用10% KOH在90 ℃下透明处理3 h,用0.3%过氧化氢洗涤3次,再用30%过氧化氢进行漂白处理40~60 min(视材料大小决定漂白时间),最后在0.05%台盼蓝醋酸甘油溶液中染色10 min,经醋酸甘油溶液脱色后在光学显微镜下观察并拍照。
2 结果与分析
2.1 种子活力及种子原地共生萌发
鹤顶兰种子经TTC染色后观察发现,绝大部分种子种胚发育良好,绝大部分能被染为浅橙色,极个别种子未被染色,少数种子染色较深(图1C)。以种子被染色计为具有活力。结果表明,本研究所用种子95.62%都具有活力。
将鹤顶兰种子直接撒播在成年植株附近,至第6个月,土壤中开始有肉眼可见的原球茎产生,大小为(1~1.5)mm×(2~4)mm,黄白色,不规则的长圆锥形(图1D)。
2.2 原球茎真菌的分离与鉴定
采用组织块分离法从鹤顶兰原球茎中共计分得5株真菌菌株。形态学和ITS分子鉴定的结果(表2)显示,5株真菌菌株分别为镰刀菌属(Fusarium)2种Fusariumsolani(HDL-1,图2A)和Fusariumoxysporum(HDL-3,图2B)、球壳菌属1种(Plectosphaerellacucumerina,HDL-4,图2C)、裸囊菌属1种(Gymnoascusdankaliensis,HDL-5,图2D)和胶膜菌属1种[24](Tulasnellasp.,HDL-2,图2E)。将分离获得的真菌与鹤顶兰种子进行共培养,仅HDL-2可以促进鹤顶兰种子萌发,而其他真菌均未能促进种子萌发。菌株HDL-2在PDA培养基上的菌落呈淡黄色至透明状(图2E),菌丝呈圆柱状,具隔膜和分枝,有厚垣孢子产生(图2F),生长速度约为2 mm/d。
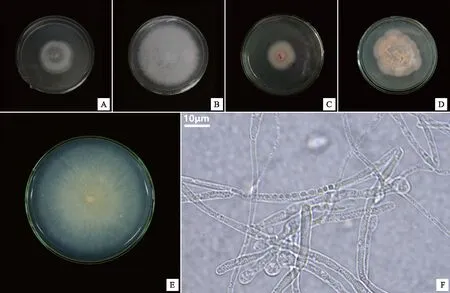
注:A~E分别为菌株HDL-1、HDL-3、HDL-4、HDL-5、HDL-2菌落形态,F为菌株HDL-2菌丝结构。图2 鹤顶兰原球茎中分离得到的菌株Fig.2 Fungi strains isolated from protocorms of Phaius tancarvilleae

表2 鹤顶兰原球茎中分离得到的真菌菌株的分子鉴定结果Table 2 Molecular identification of fungal strains isolated from protocorms of Phaius tancarvilleae
根据该菌株的ITS序列与GenBank上的比对结果,下载了相似性较高的兰科菌根真菌的ITS序列构建系统发育树。系统发育分析结果(图3)显示,从鹤顶兰原球茎中分离所得的真菌菌株HDL-2与Uncul tured Tulasnellaceae(JX545212)聚为一支,支持率为99%,与其他胶膜菌属菌株聚成一支较大的分支,支持率为95%,表明该菌株属于胶膜菌属。
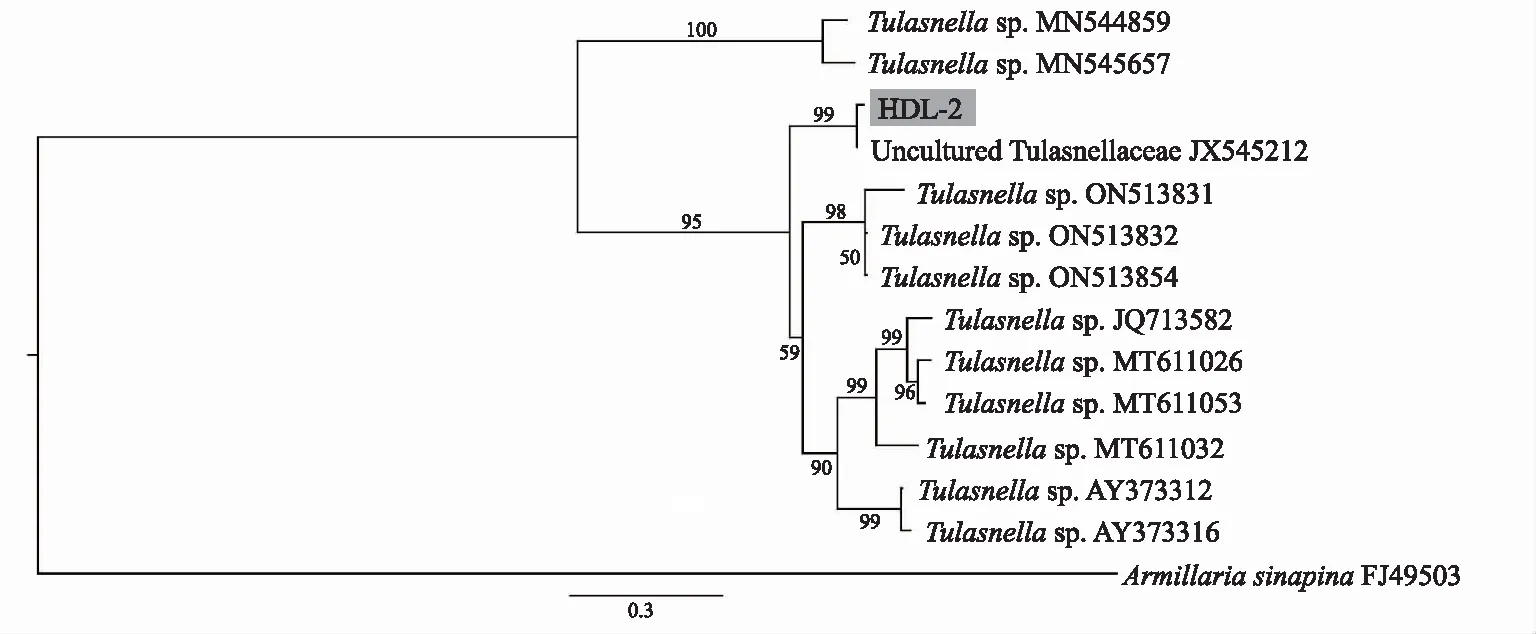
注:节点上的数字表示支持率,以Armillaria sinapina为外类群。图3 基于核糖体ITS序列的最大似然法系统发育树 Fig.3 Maximum-likelihood tree constructed based on rDNA-ITS sequences
2.3 鹤顶兰种子共生萌发的发育过程
将HDL-2菌株与鹤顶兰种子在OMA培养基上进行共培养试验,观察发现,HDL-2菌株可以有效促进鹤顶兰种子萌发。不接菌的对照组种子未见萌发迹象。种子接菌共培养20 d之前无明显变化,保持未萌发状态(图4A);共培养20~30 d时,可以明显观察到种胚吸水膨胀,种皮仍然包裹在种胚周围,达到萌发的第1阶段(图4B);30~40 d之后,种胚继续膨胀和增大,种皮在一侧破裂,顶端逐渐转绿,形成原球茎,到达发育的第2阶段(图4C);40~60 d后,原球茎继续长大,明显呈现极性分化,发育形成顶部宽圆基部细尖的锥形原球茎,同时在原球茎除顶部外的位置生出细长绒毛状的假根(图4D);80~100 d后,原球茎顶部出现突起(图4E),此时处于萌发的第3阶段;100~120 d后,顶端的突起继续伸长发育,形成叶芽,逐步发育形成第一片幼叶(图4F),随着顶端继续生长,形成了茎及多数叶(图4G),此时均处于萌发的第4阶段;150~180 d后,从茎基部形成幼根(图4H),到达萌发的第5阶段,形成幼苗(图4I)。
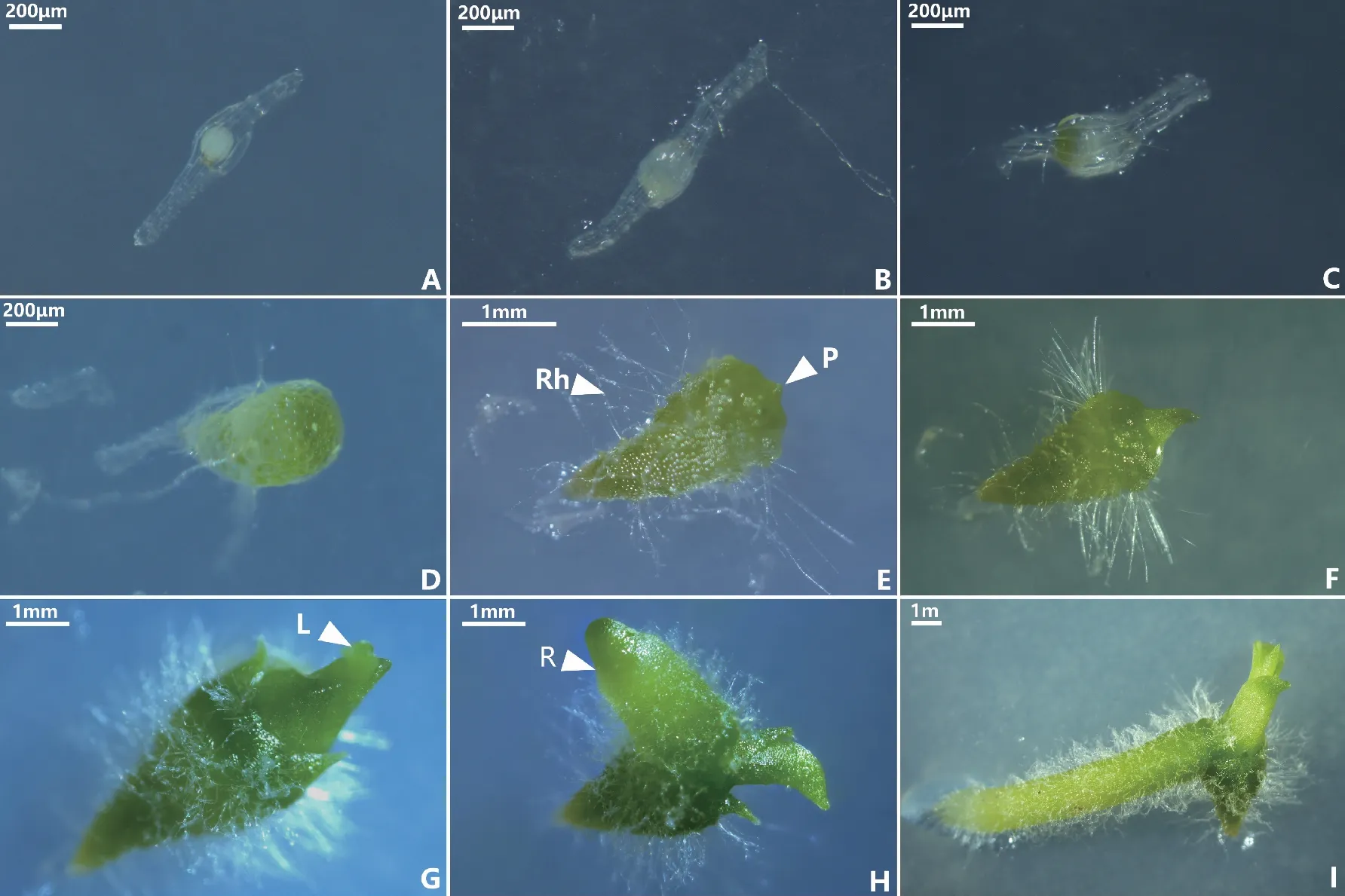
注:A为萌发第0阶段,未萌发的种子;B为萌发第1阶段,种胚吸水膨胀;C为萌发第2阶段,种胚变绿,一侧突破种皮; D为萌发第3阶段,锥形原球茎;E为萌发第3阶段,假根(Rh)和突起(P)产生;F为萌发第4阶段,形成叶芽; G为萌发第4阶段,茎及多数叶形成;H为萌发第5阶段,幼根形成;I为幼苗形成。图4 鹤顶兰种子共生萌发过程 Fig.4 Symbiotic seed germination process of Phaius tancarvilleae
2.4 真菌侵染情况的观察
将与HDL-2共培养的不同发育阶段的种子或原球茎采用台盼蓝染色进行观察,发现未萌发的种子真菌从种孔进入,聚集在胚柄端,但未侵入种胚(图5A),说明此时共生关系尚未建成,而萌发的不同发育阶段的种子或原球茎均被台盼蓝染色。处于吸水膨胀期间的种子可见种胚内基部细胞被染为蓝色,说明鹤顶兰种子在萌发的第1阶段,真菌就开始侵入定殖(图5B)。种胚突破种皮时(第2阶段),原球茎细胞内可见大量被染为蓝色的菌丝团(图5C)。随着原球茎体积不断膨大、长出根毛(第3阶段),原球茎细胞中仍存在大量菌丝团(图5D)。台盼蓝染色结果表明,HDL-2菌株的菌丝在种子萌发阶段可成功定植在种子及原球茎细胞内,表明共生关系已成功建立。
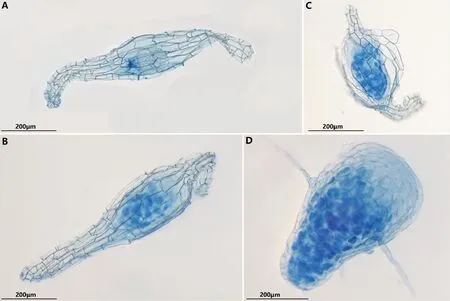
注:A为种子未萌发,真菌聚集在胚柄端,尚未侵染胚;B为萌发第1阶段,膨大的胚中已有真菌侵染; C为萌发第2阶段,原球茎被菌丝团侵染;D为萌发第3阶段,锥形原球茎中下部被菌丝团侵染。图5 台盼蓝染色显示鹤顶兰种子不同萌发阶段真菌侵染情况 Fig.5 Trypan Blue Staining showed fungal infection in different stages of seed germination of Phaius tancarvilleae
2.5 HDL-2促进鹤顶兰种子萌发的效率
本研究的3组种子不同处理间的种子萌发效率存在显著差异(表3,图6)。不接菌的阴性对照组没有观察到种胚明显膨胀,所有种子均在第0阶段(图7C)。培养30 d时,种子在接种HDL-2的OMA培养基上的萌发率为22.09%,19.51%处于第1阶段,有2.59%进入第2阶段,种子在不含真菌的改良1/2MS培养基上的萌发率为17.18%,均处于第1阶段,两者之间差异不显著(图7A)。60 d时,共生培养和无菌培养的萌发率差异显著,接菌的OMA培养基的种子总萌发率为38.56%,并且有13.64%的种子发育到第3阶段,少数种子进入到第4阶段,1/2MS培养基中种子的总萌发率为29.56%,种子的发育仅处于第1、第2阶段。80 d时,接菌的OMA培养基上种子萌发率达到(58.33±3.48)%,有25.96%的种子处于第3阶段,改良的1/2MS培养基中种子的总萌发率为40.90%,到达第3阶段的种子仅为1.83%,两者之间差异极显著。110 d时,接菌培养的OMA培养基的种子总萌发率为86.69%,已有5.57%的原球茎发育成幼苗,到达第4阶段(图7A),此时改良的1/2 MS培养基上种子的总萌发率为52.04%,仅有(0.55±0.34)%的种子发育到第4阶段,大部分种子停留在第2阶段或第3阶段(图7B),共生萌发和无菌萌发存在极显著差异。

注:A为与菌株HDL-2共培养的OMA培养基;B为1/2MS培养基;C为无真菌参与的OMA培养基。图7 培养110 d时,不同处理下的鹤顶兰原球茎发育Fig.7 At culture of 110 days, protocorm development of Phaius tancarvilleae under different treatments
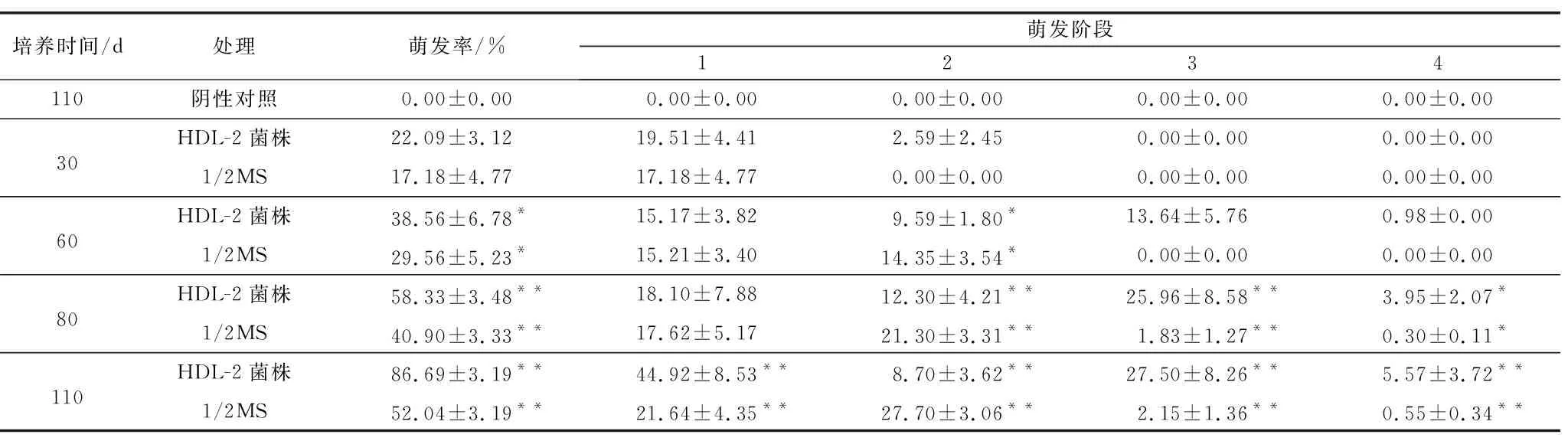
表3 不同处理下鹤顶兰种子的萌发率、萌发各阶段的比率Table 3 The seed germination rate and the ratio of germination stages of Phaius tancarvilleae under different treatments
3 讨 论
在自然条件下,兰科植物的种子必须与真菌产生共生关系,必须依赖共生真菌提供营养才能萌发[5-8]。在没有共生真菌协助的情况下,兰科种子基本无法完成萌发过程,多数只能吸水膨胀至种皮破裂阶段[25]。筛选可促进兰科种子萌发的有效共生真菌,在兰花资源的保护和可持续利用上具有重要的意义。鹤顶兰是广泛应用的园艺观赏花卉,规模化生产技术并不成熟。Cheng等[26]从台湾本土兰科植物中分离出4种丝核菌属(Rhizoctonia)真菌,分别接种于鹤顶兰的组培幼苗,发现菌株R15可提高幼苗的成活率、增加植物高度和叶片长度,菌株R19可促进鹤顶兰开花,菌株R02则可显著增强光合作用的速率。这些研究均是基于鹤顶兰的幼苗展开的,而关于鹤顶兰种子的真菌共生萌发目前未见报道。本研究通过原地共生萌发技术,首次从鹤顶兰的原球茎中分离获得的真菌HDL-2,可成功实现鹤顶兰种子的共生萌发,该真菌属于胶膜菌科胶膜菌属真菌,属于典型的兰科菌根真菌。目前已报道的对兰科植物种子有促萌发作用的真菌主要集中在丝核类真菌,包括蜡壳菌属(Sebacina)、胶膜菌属和角担菌属(Ceratobasidium)[27-28]。胶膜菌属真菌是最常见的兰科植物菌根真菌[29-31],可以有效促进兰科植物种子萌发。如Youm等[32]从虾脊兰(CalanthediscolorLindl.)的根中分离出了来自胶膜菌属的促萌发真菌;Zi等[33]从兜唇石斛[Dendrobiumaphyllum(Roxb.) C. E. Fishc.]原球茎中分离出有效促进种子萌发的胶膜菌属真菌(Tulasnellasp.)FDaI7;Shao等[34]从鼓槌石斛(DendrobiumchrysotoxumLindl.)原球茎中分离出的胶膜菌可以促进鼓槌石斛种子萌发。除此之外,小菇属(Mycena)、瘤菌根菌属(Epulorhiza)、鬼伞属(Coprinellus)等其他属真菌也有报道。如徐锦堂和郭顺星[13]从天麻的原球茎中分离出了促萌发真菌紫萁小菇(Mycenaosmundicola);孙晓颖等[35]从带叶兜兰的原球茎及小幼苗中分离出的共生真菌属于瘤菌根菌属;Gao等[36]从杜鹃兰[Cremastraappendiculata(D. Don) Makino]根中分离出的共生真菌属于鬼伞属。
大量研究表明,从成年植株根中分离获得的真菌种类多样,但往往未必能够促进种子萌发或形成幼苗。现在普遍认为最有效的手段是采用原地诱捕法获得兰科植物的共生萌发真菌[11,27]。Zi等[33]、孙晓颖等[35]、孟元元[37]均使用了该方法,在不同石斛属兰花的原生地埋下种子,当种子萌发形成原球茎后,从原球茎中成功分离获得促进种子萌发的有效真菌。本研究也采用了原地共生萌发的技术,但诱导鹤顶兰种子萌发的环境基质并非从野外环境获得,而是使用了人工栽培的基质。从鹤顶兰的人工栽培基质中获得了原球茎,从中分离到了胶膜菌属真菌能促进鹤顶兰种子萌发,表明该真菌可能在自然环境中广泛存在。而该菌株是否也存在于鹤顶兰的野生环境中,自然环境中的鹤顶兰种子萌发机制还需进一步的研究探明。
共生萌发通常具有较高的萌发效率[38]。陈娅娅等[39]使用了21株菌根真菌对鹅毛玉凤花[Habenariadentata(Sw.) Schltr.]种子进行了共生萌发研究,发现其中有8株可以显著提高种子的萌发效率。对幽灵兰[Dendrophylaxlindenii(Lindl.) Benth. ex Rolfe]种子萌发的研究中,Dlin-394菌株(角担菌属)可以显著提高种子萌发率,在真菌浸染9周后种子萌发率最高,为84%,而使用改良的1/4MS培养基进行无菌萌发的种子萌发率仅为40%左右,且共生萌发的种子形成幼苗的速率也较无菌萌发的高[40]。Zhou和Gao[41]的研究发现,在相同培养时间下,凤蝶兰[Papilionantheteres(Roxb.) Schltr.]和Epa-01(瘤菌根菌属)共培养时的种子萌发率要显著高于在AGS培养基上进行无菌培养的种子萌发率,且所处的萌发阶段也更高,分别在15,30,45 d时,共生培养的原球茎的鲜重均极显著高于无菌培养。Gao等[36]研究发现,杜鹃兰在与DJF-10(鬼伞属)菌株共生培养6周后的种子萌发率超过80%,相比之下,在无菌的MS培养基上种子萌发率仅9.68%,远低于共生培养,且共生萌发条件下13周后就能形成幼苗,但在MS培养基上无菌萌发的原球茎需要5个多月才能发育成幼苗。与前人的研究相似,本研究中鹤顶兰种子与HDL-2菌株(胶膜菌属)共生萌发的效率要显著高于无菌萌发。鹤顶兰种子在无菌萌发培养基上培养110 d后萌发率为(52.04±3.19)%,大部分种子处于0,1,2阶段;在接种了HDL-2菌株的OMA培养基上,110 d时萌发率可达(86.69±3.19)%,大部分种子处于第3阶段。在不加激素和其他物质的情况下,鹤顶兰种子在MS、Kyato、KC三种基本培养基中的萌发率为20%~30%[42]。由此可见,HDL-2真菌对鹤顶兰种子萌发的促进作用明显,且效率显著高于无菌萌发培养基。本研究建立的共生萌发手段为鹤顶兰作为园艺资源在生产实践中的开发和利用提供了新的技术和方法。
兰科植物种子的共生萌发机制极其复杂,相关的研究具有挑战性。缺乏高效的促萌发真菌限制了对兰科植物资源的保护和利用。本研究通过原地萌发技术获得的一种胶膜菌属真菌对鹤顶兰的种子萌发和幼苗形成有促进作用,可用于鹤顶兰的人工繁育生产和野外回归的保护实践,并可为真菌与兰科植物的互作关系研究提供科学资料。

