乙型肝炎病毒相关肝病患者血清铁代谢与脂质代谢的关系
程百成,刘梦娜
1 广东药科大学临床医学院,广州511436;2 中山大学附属第七医院检验科
乙型肝炎病毒(HBV)感染引起的慢性乙型肝炎(CHB)是肆虐全球的重要传染病之一,也是发生肝硬化、肝癌的主要危险因素之一。在慢性肝炎发展为肝纤维化、肝硬化、原发性肝癌的不同阶段中,均出现铁代谢紊乱和脂质过氧化物集聚等特征。CHB患者肝细胞中持续的铁沉积可促进铁死亡、胶原酶与多种纤维因子的分泌及活性氧的产生,增加CHB发展为肝纤维化、肝硬化甚至肝癌的风险[1]。研究显示,HBV的X蛋白可上调脂质合成所需酶的基因表达与转录活性,同时抑制载脂蛋白分泌,促进甘油三酯(TG)、胆固醇及磷脂的合成,诱发脂肪肝[2]。与此同时,铁在脂质代谢中也发挥一定作用,铁参与脂质代谢过程一些酶和脂质转运蛋白的构成,可直接影响肝脏脂质负荷、代谢与分泌;铁稳态紊乱影响胆酸合成及清除、胆固醇的排出、多种酶的组成及细胞氧化还原反应,从而影响脂质的吸收和利用;铁蓄积时可通过Fenton反应和Haber-Weiss反应催化生成不稳定的活性氧,引起质膜氧化,间接影响脂质代谢[3]。目前,关于铁代谢和脂质代谢在HBV相关性肝病进展中的作用鲜有报道。本研究通过观察CHB、乙型肝炎肝硬化、乙型肝炎肝癌患者的铁代谢与脂质代谢差异,探讨HBV相关性肝病进展过程中铁代谢与脂质代谢的关系。
1 资料与方法
1.1 临床资料 收集2021年9月—2022年4月中山大学附属第七医院收治的CHB患者53例(CHB组)、乙型肝炎肝硬化患者37例(LC组)、乙型肝炎肝癌患者50例(HCC组)。纳入标准:符合CHB防治指南(2019年版)[4]、病毒性肝炎防治方案(2000年版)[5]、肝脏储备功能分级标准、原发性肝癌的临床诊断与分期标准(2001年版)[6],健康组应符合乙型肝炎表面抗原、丙型肝炎抗体均阴性,肝功转氨酶、血脂及腹部彩超均正常。排除标准:甲、丙、戊型肝炎病毒急慢性感染;酒精性肝病、单纯脂肪肝及药物性肝炎;有血液系统疾病史;与铁过载相关的其他疾病;冠状动脉粥样硬化心脏病等血清脂质代谢紊乱疾病。健康体检组男24例、女19例,年龄(41.9 ±11.6)岁;CHB组男30例、女23例,年龄(42.2 ±11.3)岁;LC组男21例、女16例,年龄(45.7 ± 11.9)岁;HCC组男28例、女22例,年龄(46.4 ± 12.5)岁。四组性别、年龄比较差异无统计学意义(P均>0.05),具有可比性。本研究经中山大学附属第七医院伦理委员会审批(批号:KY-2022-064-02),在中国临床实验注册中心注册(注册号:ChiCTR2200065853)。
1.2 血清铁代谢指标和脂质代谢指标检测 收集患者经检验后剩余的静脉血清,采用雅培C16000全自动生化分析仪及配套试剂检测血清铁代谢指标铁(Fe)、铁蛋白(Fer)、转铁蛋白(Tf)和脂质代谢指标总胆固醇(TC)、TG、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)。
1.3 统计学方法 采用SPSS24.0和GraphPad Prism9.0统计软件。计量资料采用Shapiro-Wilk法进行正态性分布检验,符合正态分布的数据以表示,多组间比较采用单因素ANOVA分析,组间两两比较采用LSD法;非正态分布的数据用M(P25,P75)表示,多组间比较采用Kruskal-Wallis法,两组间比较采用Bonferroni法。非正态分布数据和正态分布数据的相关性分析分别采用Spearman和Pearson相关分析法。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清铁代谢指标比较 与正常组比较,CHB组、LC组各项铁代谢指标差异无统计学意义(P均>0.05),HCC组Fer水平升高、Tf水平降低(P均<0.05);与CHB组相比,LC组各项铁代谢指标比较差异无统计学意义(P均>0.05),HCC组Fer水平升高、Tf水平降低(P均<0.05);HCC组与LC组比较差异无统计学意义(P均>0.05)。见表1。

表1 各组血清铁代谢指标比较[M(P25,P75)]
2.2 各组血清脂质代谢指标比较 与正常组相比,CHB组、LC组、HCC组各项血清脂质代谢指标差异均无统计学意义(P均>0.05);与CHB组相比,LC组各项指标比较差异无统计学意义(P均>0.05),HCC组TC、HDL、LDL水平降低(P均<0.05);LC组与HCC组比较差异均无统计学意义(P均>0.05)。见表2。
表2 各组血清脂质代谢指标比较[mmol/L,/M(P25,P75)]
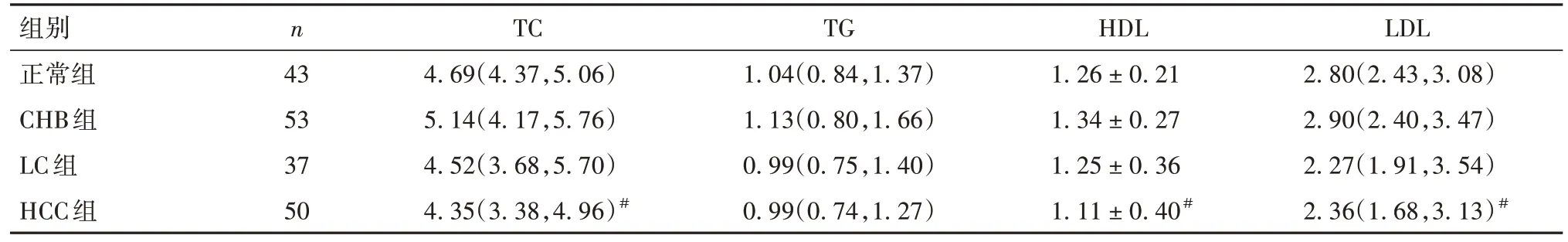
表2 各组血清脂质代谢指标比较[mmol/L,/M(P25,P75)]
注:与CHB组比较,#P<0.05。
组别正常组CHB组LC组HCC组LDL 2.80(2.43,3.08)2.90(2.40,3.47)2.27(1.91,3.54)2.36(1.68,3.13)#n 43 53 37 50 TC 4.69(4.37,5.06)5.14(4.17,5.76)4.52(3.68,5.70)4.35(3.38,4.96)#TG 1.04(0.84,1.37)1.13(0.80,1.66)0.99(0.75,1.40)0.99(0.74,1.27)HDL 1.26 ± 0.21 1.34 ± 0.27 1.25 ± 0.36 1.11 ± 0.40#
2.3 血铁代谢与脂质代谢指标的相关性 正常组血清Fer与血清TC、TG、LDL水平均呈正相关(r分别为0.396、0.352、0.505,P均<0.05);CHB组血清Fer与血清TC、LDL水平均呈正相关(r分别为0.320、0.332,P均<0.05);LC组血清铁代谢与脂质代谢指标无明显相关性(P均>0.05);HCC组血清Fer与血清HDL水平呈负相关(r=-0.488,P均<0.05)。见表3。
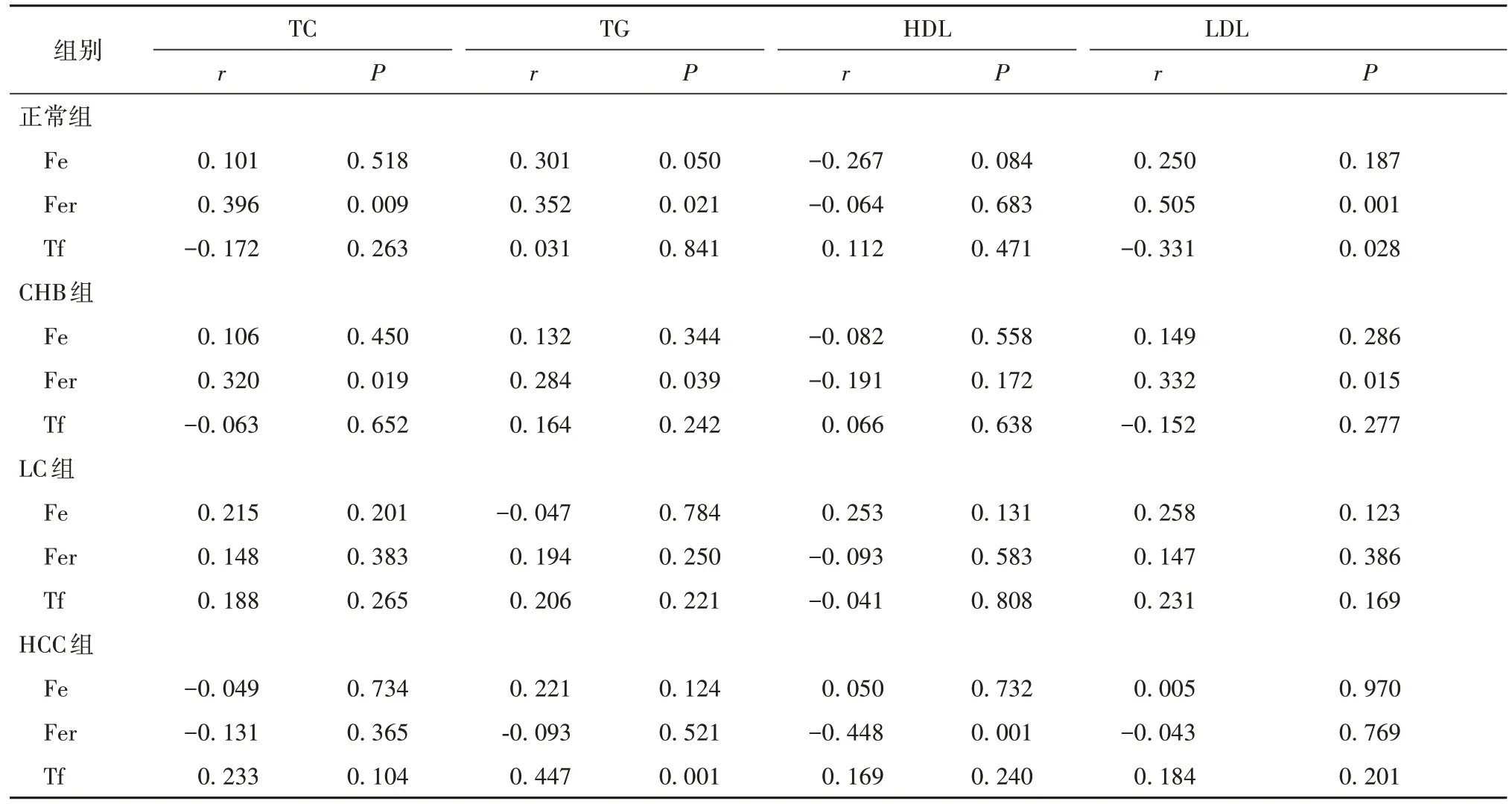
表3 各组铁代谢指标与脂质代谢指标的相关性
3 讨论
据统计,截至2017年全球HBV感染人数达到2.57亿,我国感染人数高达7 000万,对于实现2030年消除乙型肝炎的目标仍然有一定挑战。HBV感染是肝硬化、肝癌的危险因素之一,肝硬化在CHB的发生率为10%~20%,其中6%~15%可进展为肝癌[7]。肝脏是贮存铁和维持机体铁稳态的重要器官,其负责合成大部分参与铁代谢的蛋白质,比如Tf及调节铁稳态关键激素铁调素。研究显示,肝炎发展为肝纤维化、肝硬化甚至原发性肝癌的不同阶段中均出现铁代谢紊乱和脂质过氧化物集聚等特征。肝脏在铁过载时很容易被HBV感染,更利于HBV的生存,引起细胞和组织损伤,最终发展为代偿期和失代偿期肝硬化,甚至是肝癌[8-9]。另外,脂质代谢紊乱也与HBV相关肝病的病程发展关系密切。XIAO等[10]发现,合并HBV感染的肝癌患者脂质代谢相关酶表达异常,进而影响脂质代谢。近年研究发现,部分铁代谢或脂质代谢指标可作为预测慢性乙型肝炎进展的重要血清学标志物。MAIWALL等[11]研究发现,血清Fer能作为肝脏坏死性炎症的独立危险因素,也能预测肝硬化失代偿期患者早期病死率。GUPTA[12]报道,Fer能为HCC早期诊断提供帮助。研究显示,Tf可作为评价肝纤维化及肝炎症活动度的代谢指标,能够预测肝硬化患者的预后[13-14]。血清HDL-C可作为评估肝衰竭严重程度及预后的重要指标[15]。总之,铁代谢及脂质代谢与HBV相关肝病的发展关系密切,铁代谢与脂质代谢指标或许能作为肝脏疾病进程中的重要评估指标。
铁是人体正常代谢必不可少的微量金属元素之一,具有运输氧气、参与DNA合成及多种催化反应、宿主防御、信号转导等功能。肝脏是贮存铁和维持机体铁稳态的重要器官,负责合成大部分参与铁代谢的蛋白质,包括Fer、Tf及铁调素。铁蓄积参与酒精性肝病、非酒精性脂肪肝等肝病的进展,常见特征是以肝脏储存铁、血清Fer水平升高为主要表现的铁代谢紊乱[16]。此外,程丹等[17]研究发现,Fer在肝脏受损时高表达且能被恶性肿瘤细胞合成和分泌。本研究结果显示,HCC组Fer水平高于CHB组和正常组,Tf水平低于CHB组和正常组。我们推测,随着肝脏疾病的进展,肝细胞合成Tf的能力减退;且肝脏发生炎症时,Tf参与调节单核巨噬细胞系统清除炎症介质的过程T f被大量消耗,多种因素共同导致血清Tf水平降低。在正常生理情况下,血清Fer、Tf水平随着血清Fe水平而变化,但本研究中四组血清Fe水平比较无统计学差异,推测可能是随着肝脏的严重程度增加,肝脏代谢能力趋向降低,Fe无法从肝脏排出而大量蓄积于肝脏。
脂类是人体细胞组织的组成成分,负责供给机体所需的能量和必需脂肪酸。动物实验显示,在HBV转基因小鼠中,HBV感染后参与脂质合成的脂肪酸结合蛋白5、乙酰辅酶A结合蛋白表达明显上调,而保护机体免受过氧化物损伤的谷胱甘肽过氧化酶1表达水平显著下降,同时DNA损伤代谢标志物8-羟基鸟嘌呤浓度明显升高,提示HBV感染干扰脂质代谢并激活氧化应激诱导的DNA损伤[18]。本研究结果显示,正常组与CHB、LC、HCC组血清脂质代谢指标比较差异均无统计学意义;与CHB组相比,LC组血清脂质代谢指标无明显变化,HCC组TC、HDL、LDL水平降低;LC组与HCC组各项血清脂质代谢指标比较差异均无统计学意义。血清脂质代谢指标在CHB与正常组、LC组与其他各组之间差异不明显,推测可能与患者使用抗HBV药物有关。孙涛等[19]报道,恩替卡韦、富马酸替诺福韦酯和富马酸丙酚替诺福韦对CHB患者的血脂均有一定的影响。HCC组TC、HDL、LDL水平较CHB组降低,提示在HBV相关肝病的进展过程中,肝脏脂质代谢发生紊乱,合成胆固醇和组装脂蛋白能力降低,尤其是HCC阶段。
铁代谢与脂质代谢稳态对机体发挥正常生理功能有重要作用。铁代谢紊乱可以影响胆固醇代谢核心酶7α-羟化酶活性,导致胆固醇清除障碍,进而影响脂质代谢。铁缺失还可以影响脂蛋白脂肪酶合成以及与脂肪合成相关酶,导致脂质代谢紊乱。此外,脂质代谢紊乱也可以导致铁代谢异常,如高胆固醇饮食的兔出现铁沉积[20]。本研究对正常组及CHB、LC、HCC组的血清铁代谢与脂质代谢指标进行相关性分析,发现CHB组、LC组血清Fer与TC、LDL呈正相关;HCC组血清Fer与TC、HDL、LDL呈负相关,尤其是Fer与HDL的负相关性较显著。这提示在HBV相关肝病进展过程中,肝脏的铁代谢及脂质代谢可以互相影响。在进展到HCC前,CHB组与LC组血清Fer与胆固醇的变化趋势是一致的。而进展到HCC阶段时,铁代谢与脂质代谢的相互作用发生变化;此时肝脏出现铁的堆积,表现为Fer过载,而合成胆固醇和组装脂蛋白的能力降低。因此,进一步探究铁代谢与脂质代谢潜在的关系是必要的,对于避免由HBV相关肝病引发的如因铁过载或脂质代谢紊乱而加重的肝脏损伤具有重要的指导意义。
综上所述,在CHB进展至肝硬化、肝癌的过程中,肝脏铁代谢及脂质代谢紊乱,合成功能趋向降低,同时肝脏Fer的降低伴随胆固醇的降低;当疾病发生到HCC阶段时,患者Fer高表达,肝脏出现铁过载。目前尚不明确在HBV相关肝病中是铁代谢紊乱对脂质代谢产生影响,还是异常的脂质代谢导致铁稳态紊乱,其具体过程涉及到某些未知的信号通路,如在HBV相关肝病患者中铁过载通过何种机制与脂质代谢酶类相互作用,仍需进一步深入探讨。

