静脉注射咪达唑仑对蛛网膜下腔出血大鼠脑神经炎症和损伤的改善作用及其机制
孟元元,刘艳,张华强,周民,姚玲玲
1 武汉科技大学附属普仁医院麻醉科,武汉430000;2 湖北文理学院附属医院 襄阳市中心医院疼痛科
研究表明,蛛网膜下腔出血(SAH)发病后72 h内发生的早期脑损伤是导致患者高病死率和高致残率的主要原因,其发生与多种病理机制相关,而神经炎症被认为在SAH后早期脑损伤中发挥重要作用[1-2]。环腺苷酸(cAMP)作为重要的第二信使,介导许多细胞内信号级联反应,包括蛋白激酶A(PKA)/环腺苷酸应答元件结合蛋白(CREB)信号通路。动物实验表明,cAMP/PKA/CREB信号通路与抑郁症及认知功能障碍的发病机制密切相关[3]。已有研究发现,TGR5激动剂INT-777通过激活cAMP/PKA信号通路减弱SAH发病后脑损伤中神经炎症,改善SAH后的短期神经行为功能[4]。咪达唑仑(MDZ)作为一种常用的麻醉剂,具有水溶性、起效快、作用时间短等特点,并对人脑的神经基础产生药理学作用[5],但目前尚无研究报道MDZ对SAH发病后的神经保护作用。2022年3月—12月,我们对SAH大鼠给予MDZ进行干预,观察其对神经炎症的影响,探讨其作用机制与cAMP/PKA/CREB信号通路的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄健康雄性Wistar大鼠65只,体质量280~320 g,购自广州检验检测认证集团有限公司,许可证号:SYXK(粤)2022-0299。饲养条件:室温(22 ± 1)℃,湿度60% ± 5%,12 h昼夜循环。自由饮食饮水。本研究经动物护理和使用委员会批准,并按照《实验动物护理和使用指南》进行。
1.1.2 主要试剂与仪器 MDZ购自浙江恩华药业股份有限公司;PKA抑制剂H-89购自美国MedChemexpress公司;肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β、IL-6蛋白质提取试剂盒购自上海碧云天生物科技有限公司;ECL试剂购自美国Amersham Biosciences公司;cAMP、p-PKA、p-CREB、PKA、CREB一抗购自英国Abcam公司。Synergy LX多功能酶标仪购自美国BioTek公司;BX61光学显微镜购自日本Olympus公司。
1.2 动物分组与SAH模型制备 将大鼠随机分为假手术组10只和造模组55只,参照文献[6]方法制备SAH模型。腹腔注射4%戊巴比妥钠麻醉大鼠,俯卧位固定。在枕外隆凸附近切开,剪开浅层肌肉,显露颈夹肌间隙,对环枕膜、枕骨进行初步定位。抽取股动脉血3.5 mL,在2 min内注入枕大池,注入后保持30°低头30 min,使血液沉积在脑底血管。间隔48 h后,同样方法抽取另一侧股动脉血注入枕大池。当观察到大鼠脑底基底池部位有明显的血液存在,并有脑脊液漏出,表明SAH造模成功。假手术组进行上述同样操作,向枕大池注入等体积生理盐水。
1.3 药物干预方法 取SAH造模成功的50只大鼠,随机分为SAH组、MDZ低剂量组、MDZ中剂量组、MDZ高剂量组、MDZ高剂量+H-89组,每组各10只。MDZ高、中、低剂量组分别经颈静脉注射0.30、0.15、0.05 mg/kg MDZ,同时腹腔注射等体积生理盐水;MDZ高剂量+H-89组经颈静脉注射0.3 mg/kg MDZ,同时腹腔注射5 mg/kg H-89;SAH组、假手术组颈静脉及腹腔注射等体积生理盐水。每天1次,连续3 d。
1.4 神经功能评估 末次给药2 h后,参照改良的Garcia神经功能评分系统[7],从自主活动、四肢运动对称性、前肢伸展、攀爬抓握、双侧躯干触觉反应、触角反应6个方面评估各组大鼠的神经功能,最低3分,最高18分,评分越低表示神经功能损伤越严重。
1.5 血清炎症因子检测 采用ELISA法。采集大鼠静脉血,使用ELISA试剂盒检测IL-1β、TNF-α、IL-6含量,具体步骤按照试剂盒说明。
1.6 脑含水量检测 采用干/湿法。各组随机取3只大鼠,在深度麻醉下将大鼠斩首,摘除大脑,取出同侧脑组织,立即使用电子天平称取湿重。将脑组织置于100 ℃恒温烘箱中48 h至恒重,使用电子天平称取干重。以(湿重-干重)/湿重×100%计算脑含水量。
1.7 SAH等级评分 取各组剩余的7只大鼠,对大脑基底表面的6个区域进行SAH等级评估。0级:无蛛网膜下腔血液;1级:少量蛛网膜下腔血液;2级:具有肉眼可见的中度血块;3级:血块阻塞了所有动脉。
1.8 脑组织形态学观察 采用HE染色。SAH等级评分结束后,取部分海马区脑组织,加入4%多聚甲醛固定,脱水、石蜡包埋、切成4 μm厚的切片。石蜡切片脱蜡、复水、苏木精染色60 s,1%盐酸乙醇染色3 s,最后伊红染色1 min。使用中性树胶将切片密封到载玻片上,光学显微镜400倍视野下观察组织形态学损伤情况。
1.9 脑组织cAMP/PKA/CREB通路相关蛋白检测 采用Western blotting法。取剩余部分脑组织,使用蛋白质提取试剂盒提取蛋白质。通过SDSPAGE分离样品中的蛋白质,湿转移至PVDF膜,5%脱脂牛奶封闭,4 ℃下与cAMP、p-PKA、p-CREB、PKA、CREB一抗(稀释浓度均为1∶1 000)孵育24 h。用Tris缓冲盐水洗涤后,加入二抗,室温孵育1 h。加入ECL试剂使印迹条带可视化,用Image J软件进行定量分析。
1.10 统计学方法 采用SPSS27.0统计软件。数据分布的正态性通过Kolmogorov-Smirnov检验进行分析,呈正态分布的计量资料以表示,两组间比较采用t检验;多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分比较 假手术组、SAH组、MDZ低剂量组、MDZ中剂量组、MDZ高剂量组、MDZ高剂量+H-89组神经功能评分分别为(21.23 ±2.14)、(5.55 ± 0.56)、(8.92 ± 0.90)、(14.24 ±1.44)、(18.42 ± 1.85)、(9.25 ± 0.93)分。与假手术组比较,SAH组神经功能评分降低(P<0.05);与SAH组比较,MDZ低、中、高剂量组评分均升高,其中高剂量组高于中、低剂量组,中剂量组高于低剂量组(P均<0.05);MDZ高剂量+H-89组评分较MDZ高剂量组降低(P<0.05)。
2.2 各组大鼠血清IL-1β、TNF-α、IL-6水平比较与假手术组比较,SAH组血清IL-1β、TNF-α、IL-6水平升高(P均<0.05);与SAH组比较,MDZ低、中、高剂量组IL-1β、TNF-α、IL-6水平降低,且高剂量组低于中、低剂量组,中剂量组低于低剂量组(P均<0.05);MDZ高剂量+H-89组血清IL-1β、TNF-α、IL-6水平较MDZ高剂量组升高(P均<0.05)。见表1。
表1 各组大鼠血清炎症因子水平比较(ng/mL,)

表1 各组大鼠血清炎症因子水平比较(ng/mL,)
注:与假手术组比较,aP<0.05;与SAH组比较,bP<0.05;与MDZ低剂量组比较,cP<0.05;与MDZ中剂量组比较,dP<0.05;与MDZ高剂量组比较,eP<0.05。
TNF-α 0.72 ± 0.08 6.72 ± 0.68a 4.21 ± 0.43b 2.16 ± 0.23bc 1.15 ± 0.12bcd 4.33 ± 0.45e组别假手术组SAH组MDZ低剂量组MDZ中剂量组MDZ高剂量组MDZ高剂量+H-89组n 10 10 10 10 10 10 IL-1β 0.88 ± 0.09 6.82 ± 0.69a 4.62 ± 0.47b 2.55 ± 0.26bc 1.04 ± 0.11bcd 4.72 ± 0.48e IL-6 0.38 ± 0.04 42.15 ± 4.23a 27.82 ± 2.79b 12.35 ± 1.24bc 4.62 ± 0.48bcd 25.46 ± 2.55e
2.3 各组大鼠脑含水量比较 假手术组、SAH组、MDZ低剂量组、MDZ中剂量组、MDZ高剂量组、MDZ高剂量+H-89组脑含水量分别为58.15% ± 2.06%、82.77% ± 3.11%、72.88% ± 2.61%、67.88% ±2.39%、60.21% ± 2.09%、76.08% ± 2.47%。与假手术组比较,SAH组脑含水量升高(P<0.05);与SAH组比较,MDZ低、中、高剂量组脑含水量降低,且高剂量组低于中、低剂量组,中剂量组低于低剂量组(P均<0.05);MDZ高剂量+H-89组脑含水量较MDZ高剂量组增加(P<0.05)。
2.4 各组大鼠SAH等级评分比较 假手术组、SAH组、MDZ低剂量组、MDZ中剂量组、MDZ高剂量组、MDZ高剂量+H-89组大鼠SAH等级评分分别为(0.00 ± 0.00)、(17.11 ± 1.72)、(11.34 ± 1.14)、(7.24 ± 0.73)、(4.26 ± 0.43)、(11.83 ± 1.19)分。与假手术组比较,SAH组评分升高(P<0.05);与SAH组比较,MDZ低、中、高剂量组评分均降低,且高剂量组低于中、低剂量组,中剂量组低于低剂量组(P均<0.05);MDZ高剂量+H-89组评分较MDZ高剂量组增加(P<0.05)。
2.5 各组大鼠脑组织海马区形态学变化 假手术组海马组织神经细胞排列整齐,结构正常;SAH组神经元细胞核碎裂,出现细胞坏死现象,MDZ低剂量组、MDZ中剂量组、MDZ高剂量组神经元细胞损伤逐渐减轻,MDZ高剂量组趋于正常化;MDZ高剂量+H-89组较MDZ高剂量组神经元细胞损伤加重。见OSID码图1。
2.6 各组大鼠脑组织cAMP/PKA/CREB通路相关蛋白表达水平比较 SAH组cAMP、p-PKA/PKA、p-CREB/CREB表达水平较假手术组降低(P均<0.05);MDZ低、中、高剂量组较SAH组增加(P均<0.05);MDZ高剂量+H-89组较MDZ高剂量降低(P均<0.05)。见表2。
表2 各组大鼠脑组织cAMP、p-PKA/PKA、p-CREB/CREB蛋白表达比较()
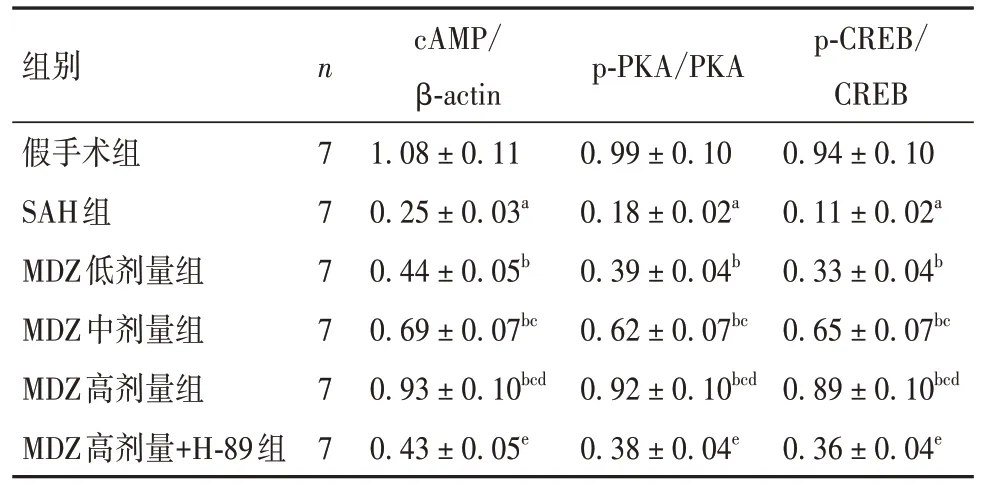
表2 各组大鼠脑组织cAMP、p-PKA/PKA、p-CREB/CREB蛋白表达比较()
注:与假手术组比较,aP<0.05;与SAH组比较,bP<0.05;与MDZ低剂量组比较,cP<0.05;与MDZ中剂量组比较,dP<0.05;与MDZ高剂量组比较,eP<0.05。
p-CREB/CREB 0.94 ± 0.10 0.11 ± 0.02a 0.33 ± 0.04b 0.65 ± 0.07bc 0.89 ± 0.10bcd 0.36 ± 0.04e组别p-PKA/PKA假手术组SAH组MDZ低剂量组MDZ中剂量组MDZ高剂量组MDZ高剂量+H-89组n7 7 7 7 7 7 cAMP/β-actin 1.08 ± 0.11 0.25 ± 0.03a 0.44 ± 0.05b 0.69 ± 0.07bc 0.93 ± 0.10bcd 0.43 ± 0.05e 0.99 ± 0.10 0.18 ± 0.02a 0.39 ± 0.04b 0.62 ± 0.07bc 0.92 ± 0.10bcd 0.38 ± 0.04e
3 讨论
早期脑损伤是SAH后不良结局的主要原因,包括SAH后脑水肿、血脑屏障破坏、神经细胞的凋亡等病理变化[8]。神经炎症是SAH诱导的早期脑损伤中关键的病理过程之一[9]。研究显示,抑制神经炎症可减轻大鼠SAH后的脑水肿和神经元损伤,缓解早期脑损伤,进而改善SAH的预后[10-11]。因此,在SAH的情况下,针对神经炎症的治疗将减弱早期脑损伤并有利于改善神经系统预后。MDZ是一种苯二氮䓬类药物,主要通过苯二氮䓬受体作用于脑干和边缘系统,属于新型神经毒剂抗惊厥药。除了抗癫痫作用外,MDZ还具有抗炎作用,可以抑制神经炎症因子释放[12]。研究发现,MDZ可通过减少BV-3小胶质细胞中的NLRP3炎症小体活化和促炎细胞因子释放来发挥神经保护作用[13]。TANG等[14]报道,MDZ对缺氧/复氧引起的脑损伤具有神经保护作用。此外,临床研究显示,咪达唑仑联合芬太尼的镇静镇痛能够改善重症SAH患者的脑代谢,具有较好的治疗效果[15]。二次枕大池注血是目前构建SAH模型较为理想且最为认可的造模方式,具有操作简单、成功率高、动物病死率低等优点。脑水肿是SAH后的重要早期病理生理改变,也是导致SAH患者神经功能障碍的重要因素;神经炎症反应可导致神经元细胞功能损伤和线粒体功能异常,是SAH后脑水肿发生发展的关键机制。本研究采用二次枕大池注血法构建SAH大鼠模型,通过Garcia评分、脑含水量、SAH等级评分等评估MDZ对大鼠神经功能及早期脑损伤的影响。结果显示,SAH大鼠神经功能评分降低,脑含水量、SAH等级评分以及神经炎症因子均增加,表明SAH大鼠神经功能受损;MDZ干预能够降低SAH大鼠脑含水量、SAH等级评分以及神经炎症因子水平,减轻SAH后的神经功能损伤,改善脑水肿,表明MDZ是一种有效的抗SAH后早期脑损伤的神经保护药物。
cAMP作为重要的第二信使,参与学习记忆过程和突触长期可塑性的改变;CREB是cAMP胞核内核蛋白,海马区磷酸化的CREB是调节中枢神经系统的重要核内转录因子,具有多种生物学功能,包括参与调节学习、记忆能力、改善认知功能等,是多种信号转导通路的关键调节成分[16]。CREB主要对PKA等信号发生应答反应,cAMP激活PKA后,活化的PKA进入细胞核,可磷酸化激活CREB[17]。JIN等[18]报道,在脓毒症大鼠模型中,激活cAMP/PKA/CREB信号轴可通过减少海马体内小胶质细胞的数量、中性粒细胞浸润和炎症因子(如IL-1β、IL-6和TNF-α)的表达,抑制神经炎症来预防认知障碍。XIN等[19]报道,抑制SAH后的cAMP-CREB途径可诱导少突胶质细胞分化和髓磷脂损伤。HU等[4]报道,在SAH大鼠模型中,INT-777可通过激活cAMP/PKA信号通路,抑制神经炎症,减轻脑水肿和SAH后的神经功能缺损;而PKA抑制剂H-89可逆转INT-777对SAH后神经行为结局的神经保护作用。以上研究表明cAMP/PKA/CREB通路是改善SAH后脑损伤和神经功能障碍的重要治疗靶点。本研究结果显示,SAH后大鼠脑组织cAMP、p-PKA/PKA、p-CREB/CREB表达显著下降,说明cAMP/PKA/CREB信号通路被抑制;伴随着神经炎症因子水平IL-1β、TNF-α、IL-6和脑组织含水量的增加以及严重的神经元损伤,再次证实cAMP/PKA/CREB信号通路抑制与SAH后早期脑损伤的发生发展有关。给予不同剂量MDZ干预后,大鼠海马组织中cAMP、p-PKA/PKA、p-CREB/CREB表达上调,神经炎症因子水平降低,神经元损伤得到缓解,推测MDZ可以通过激活cAMP/PKA/CREB通路抑制炎症反应,改善SAH大鼠神经元损伤。为验证该实验推测,本研究在MDZ干预的基础上应用PKA抑制剂H-89进行实验,结果发现H-89明显减弱了MDZ对SAH大鼠的神经保护作用,提示MDZ抑制神经炎症、缓解早期脑损伤的作用可能是通过激活cAMP/PKA/CREB通路实现的。
综上所述,MDZ能够抑制神经炎症,减轻SAH大鼠早期脑损伤,改善其神经功能,其机制可能与激活cAMP/PKA/CREB通路有关。本研究仅从动物水平进行了初步探究,后续可考虑从体外细胞水平进行深入研究。此外,SAH的发病机制复杂,MDZ能否通过其他信号通路对SAH发挥神经保护作用仍需进一步探讨。

