葛根素治疗冠状动脉支架内再狭窄的核心靶点筛选与细胞学验证
孙云雷,曹月娟,赵振营
1 天津中医药大学研究生院,天津300000;2 天津市人民医院心内二科;3 天津市人民医院药学部
经皮穿刺冠状动脉介入是冠心病患者血运重建的重要手段,然而冠脉支架内再狭窄(ISR)以及由此引发的再次靶血管血运重建严重影响介入治疗的长期预后。血管平滑肌细胞(VSMC)迁移和增殖在ISR的病理生理学中发挥关键作用。介入操作对血管壁的机械刺激和血管壁内皮损伤后,可诱发表达多种炎症介质和细胞因子,促使血管中层VSMC发生表型转化并获得增殖能力,VSMC增殖并向内膜移行,伴有细胞外基质的改变,导致新生内膜形成并增厚,发生不良的血管结构重塑,从而使血管腔缩小甚至完全闭塞[1]。抑制VSMC迁移和增殖能够有效减少ISR发生。研究显示,血管紧张素Ⅱ(AngⅡ)能够促进VSMC迁移和增殖,加快ISR的发生,其机制可能与NF-κB、PI3K/AKT、MAPK等炎症信号通路有关[2]。葛根素是从中药葛根中提取的一种黄酮苷,主要用于治疗心脑血管疾病、糖尿病周围血管疾病、颈椎病、肺心病等。现代药理学研究发现,葛根素能够扩张血管,降低心肌耗氧指数,改善心肌缺血,在心脑血管疾病中发挥良好的临床疗效;葛根素还能抑制二磷酸腺苷、提高高密度脂蛋白水平,降低血栓形成风险[3]。葛根素在心脑血管疾病中的作用可能与其调控炎症因子和炎症通路的作用有关[4]。2022年3月—2023年2月,我们基于网络药理学和分子对接技术,筛选葛根素治疗ISR的核心靶点,并通过细胞学实验验证相关靶点的作用及其机制,旨在为临床预防和治疗ISR提供新的思路。
1 材料与方法
1.1 葛根素治疗ISR核心靶点的筛选
1.1.1 ISR疾病靶基因的筛选 在NCBI公共数据平台基因表达综合数据库(GEO)(https://www.ncbi.nlm.nih.gov/geo/)中下载基因表达谱芯片数据GSE46560,使用R4.2.1软件对该芯片数据进行分析,将差异倍数logFC绝对值≥1和P≤0.05的基因作为ISR的差异表达基因,即ISR潜在治疗靶点,结果以火山图形式展示。另外,在GeneCards数据库(https://www.genecards.org/)中输入“in-stentrestenosis”进行检索,下载并收集获得的ISR相关基因。将两个数据库收集的ISR疾病相关靶基因汇总、去重,获得ISR疾病靶基因。
1.1.2 葛根素作用靶点的筛选 在TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)中输入“葛根”,然后点击“puerarin”,下载葛根素相关靶点。在SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/)中输入葛根素化学式,物种选择“Homo sapiens”,下载葛根素相关靶点。将两个数据库收集的葛根素靶点汇总、去重,获得葛根素作用靶点。
1.1.3 疾病—药物关键靶点的筛选 通过Uniprot网站(https://www.uniprot.org/)对收集到的ISR、葛根素靶点进行名称标准化校正,再将ISR、葛根素靶点输入Venn Diagrams在线网站(https://bioinformatics.psb.ugent.be/webtools/Venn/)获得交集靶点,即疾病—药物关键靶点。
1.1.4 疾病—药物核心靶点的筛选 将获得的疾病—药物关键靶点输入String11.5网站,选择物种为“Homo sapiens”,设置“highest confidence”为0.4,删除无相互作用节点,构建蛋白—蛋白相互作用网络(PPI)图,并运用Cytoscape3.9.1软件分析PPI图,计算各个靶点的Betweenness值,取Betweenness值>100的靶点作为疾病—药物核心靶点,绘制可视化图。
1.1.5 疾病—药物核心靶点的分子对接 将“1.1.4”筛选获得的核心靶点输入PCSBPDB网站(https://www.rcsb.org/),同时将葛根素结构输入Chem 3D 20.0软件,获得各靶点与葛根素的三维核心活性成分结构。使用Pymol软件去除靶点的小分子配体和水分子,使用AutoDockTools1.5.7软件加氢,使用Gridbox包裹整个靶点,再使用AutoDockvina软件进行分子对接,使用Pymol绘制可视化图片。分子对接核能值<-5.0 kcal/mol表明配体分子与受体蛋白有较好的对接活性,<-7.0 kcal/mol表明二者间有强烈的对接活性。
1.2 葛根素抑制VSMC增殖机制的细胞学验证
1.2.1 材料 大鼠胸主动脉VSMC(天津市胸科医院)、葛根素(Sigma)、AngⅡ(Med Chem Express)、过氧化物酶体增殖物激活受体γ(PPARγ)一抗(Abcam)、GAPDH一抗(Abcam)、HRP标记的山羊抗小鼠/兔IgG二抗(雅酶)、蛋白制胶电泳与转膜系统(碧云天)、倒置显微镜(OLYMPUS)、酶标仪(Thermofisher)。
1.2.2 细胞培养与传代 将细胞加入含有10%胎牛血清和1%抗生素的完全培养基,置于T25细胞培养瓶中,在37 ℃、5% CO2培养箱中培养。每2~3 d换液。待细胞生长至培养瓶底80%~90%时,按照1∶2或1∶3进行细胞传代,取第3~10代细胞用于后续实验。
1.2.3 细胞分组与给药 将细胞按5×104/孔接种到6孔板,分为空白对照组、AngⅡ组、AngⅡ+葛根素组。加入完全培养基培养1 d,待细胞铺满板底后,以无血清培养基饥饿处理12 h。AngⅡ组加入含1 μmol/L AngⅡ的无血清培养基3 mL,AngⅡ+葛根素组加入含1 μmol/L AngⅡ与200 μmol/L葛根素的无血清培养基3 mL,空白对照组加入3 mL无血清培养基。
1.2.4 细胞增殖能力观察 采用细胞划痕实验。取各组细胞,使用200 μL枪头在各组板底划横线,拍照记录0、6、12、24 h照片,使用Image J软件计算划痕空白面积,计算各组6、12、24 h细胞迁移率。细胞迁移率=(0 h空白面积-某一时间点空白面积)/0 h空白面积×100%。
1.2.5 细胞PPARγ蛋白检测 采用Western blotting法。各组加入相应药物培养24 h后,加入RIPA裂解液及蛋白酶抑制剂,充分混匀后置于冰上裂解30 min。4 ℃下10 000 r/min离心,取上清液。使用BCA法将各组蛋白浓度配平,加入蛋白上样缓冲液,煮沸使蛋白变性。使用PAGE凝胶进行电泳分离,将蛋白以湿转法转移至PVDF膜,5%脱脂牛奶封闭。加入PPARγ、GAPDH一抗(稀释浓度均为1∶5 000),4 ℃孵育过夜。TBST洗膜,加入二抗室温孵育30 min,ECL显影曝光蛋白。使用Image J软件对蛋白条带进行灰度值分析,计算PPARγ蛋白的相对表达量。
1.2.6 细胞肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)检测 采用ELISA法。各组培养24 h后,取上清,使用ELISA试剂盒检测TNF-α、IL-6含量。
1.3 统计学方法 采用GraphPad Prism 9.3.1软件进行数据处理与绘图。符合正态分布的数据以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,重复测量数据比较采用重复测量方差分析;非正态分布的数据以频次或百分比表示,使用秩和检验进行多组间比较。P<0.05为差异有统计学意义。
2 结果
2.1 葛根素治疗ISR核心靶点的筛选结果
2.1.1 疾病—药物关键靶点筛选结果 在GEO数据库的GSE46560数据集中共获得差异基因87个,其中上调43个、下调44个;在Genecards网站获得451个疾病相关靶点;将两个数据库收集的相关靶点汇总、去重,获得528个ISR疾病相关靶点。将TCMSP、SwissTargetPrediction网站收集的葛根素作用靶点汇总、去重,获得142个葛根素作用靶点。通过Uniprot网站对上述疾病和药物靶点名称进行校正,绘制Venn图,最终获得疾病—药物关键靶点56个,见OSID码图1。
2.1.2 疾病—药物核心靶点筛选结果 将56个疾病—药物关键靶点输入String11.5网站后,获得疾病—药物靶点PPI图。取Betweenness值>100的靶点TNF、AKT1、SOD1、VEGFA、ABCB1、CASP3、PTGS2、PPARγ,将其设为核心靶点,绘制可视化图,见OSID码图2。
2.1.3 葛根素与核心靶点分子对接结果 核心靶点TNF、AKT1、SOD1、VEGFA、ABCB1、CASP3、PTGS2、PPARγ与葛根素的分子对接核能值分别为-7.2、-7.8、-9.1、-7.8、-6.8、-7.7、-9.8、-7.9 kcal/mol。使用Pymol软件将对接核能值<-7.0 kcal/mol的结果进行可视化,见OSID码图3。
2.2 葛根素抑制VSMC增殖机制的细胞学验证结果
2.2.1 葛根素对细胞增殖能力的影响 给药12、24 h时,AngⅡ组细胞迁移率较空白组升高(P均<0.05)。给药24 h时葛根素组细胞迁移率较AngⅡ组降低(P<0.05)。见表1。
表1 各组不同时间点细胞迁移率比较(%,)
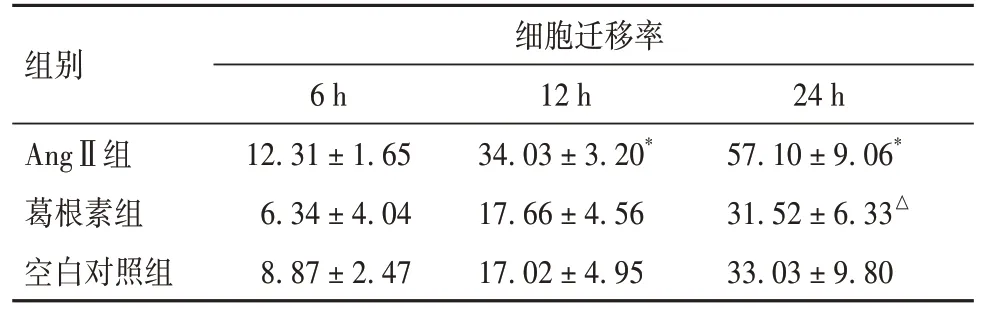
表1 各组不同时间点细胞迁移率比较(%,)
注:与空白对照组比较,*P<0.05;与AngⅡ组比较,△P<0.05。
组别细胞迁移率6 h 12.31 ± 1.65 6.34 ± 4.04 8.87 ± 2.47 AngⅡ组葛根素组空白对照组24 h 57.10 ± 9.06*31.52 ± 6.33△33.03 ± 9.80 12 h 34.03 ± 3.20*17.66 ± 4.56 17.02 ± 4.95
2.2.2 葛根素对细胞PPARγ蛋白表达的影响 空白对照组、AngⅡ组、AngⅡ+葛根素组PPARγ蛋白表达水平分别为1.00 ± 0.17、0.56 ± 0.18、0.96 ±0.16。AngⅡ组PPARγ表达较空白对照组降低,AngⅡ+葛根素组PPARγ表达较AngⅡ组升高(P均<0.05)。
2.2.3 葛根素对细胞炎症因子表达的影响 AngⅡ组TNF-α、IL-6表达较空白对照组升高,AngⅡ+葛根素组TNF-α、IL-6表达较AngⅡ组降低(P均<0.05)。见表2。
表2 各组细胞TNF-α、IL-6表达比较(ng/L,)
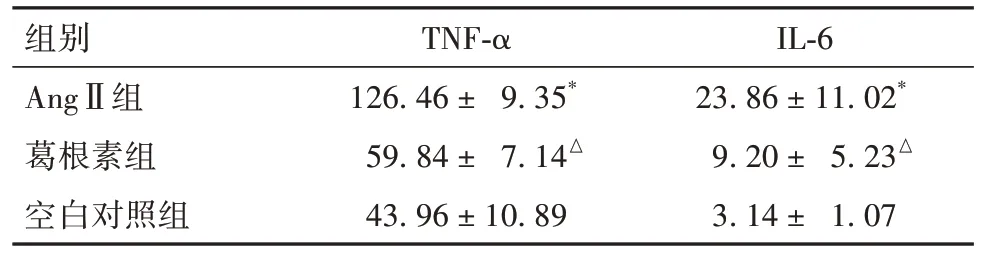
表2 各组细胞TNF-α、IL-6表达比较(ng/L,)
注:与空白对照组比较,*P<0.05;与AngⅡ组比较,△P<0.05。
组别AngⅡ组葛根素组空白对照组IL-6 23.86 ± 11.02*9.20 ± 5.23△3.14 ± 1.07 TNF-α 126.46 ± 9.35*59.84 ± 7.14△43.96 ± 10.89
3 讨论
ISR的形成机制复杂,虽然支架置入有效防止了动脉血管的弹性回缩,强化的抗凝、抗血小板药物治疗极大控制了血栓的形成,但这些措施仍难以有效抑制ISR。中医认为,ISR的发病机制为气血不通,不通则痛,而发为再狭窄。葛根属于解表类中药,具有发表解肌、透疹、解热生津、升阳止泻的功效,常用于治疗外感表证发热、头痛项强、烦热消渴、泄泻、痢疾、麻疹不透等疾病。葛根始载于《神农本草经》:“味甘,平,主消渴,身大热,呕吐,诸痹,起阴气,解诸毒”。《本草经集注》记载葛根:“味甘,平,无毒。主治消渴,身大热,呕吐,诸痹,起阴气,解诸毒。治伤寒中风头痛,解肌发表出汗,开腠理,治金疮,止痛,胁风痛。生根汁,大寒,治消渴,伤寒壮热”。葛根素是从葛根藤、野葛的干燥根中提取的一种黄酮苷,主要用于治疗心脑血管疾病,包括动脉粥样硬化、心力衰竭、心肌梗死、中风和高血压。研究表明,葛根素在心脑血管疾病中的作用可能与NF-κB、PI3K/AKT、Bcl-2/Bax信号通路有关[4]。
本研究通过网络药理学分析获得528个ISR疾病靶点和142个葛根素作用靶点,得到56个药物—疾病作用靶点。通过计算葛根素-ISR靶点的PPI相互作用网络中的Betweeness值,我们发现TNF、AKT1、SOD1、VEGFA、ABCB1、CASP3、PTGS2、PPARγ的Betweeness值均大于100,说明这8个靶点可能是葛根素治疗ISR的关键核心靶点。利用AutoDockvina软件计算配体分子和受体蛋白之间的分子对接核能值,分数均<-5.0 kcal/mol,表明二者间有较好的对接活性。结合Betweeness值与分子对接核能值,预测葛根素可能通过与TNF、AKT1、SOD1、VEGFA、CASP3、PTGS2、PPARγ结合,从而抑制ISR发生。
TNF作为炎症因子的一种,参与动脉粥样硬化与VSMC增殖,是预测ISR的血清标志物之一[5]。AKT1通过细胞代谢、转录调控、细胞周期调控等途径参与癌症、炎症、糖尿病及心血管疾病的发生发展。CHE等[6]发现,含有AKT1 siRNA的支架能够减少ISR发生。SOD1是超氧化物歧化酶(SOD)一种亚型,SOD通过催化超氧阴离子自由基歧化成氧和过氧化氢来发挥抗氧化的作用,调节机体氧化与抗氧化之间的平衡。BRÄSEN等[7]对置入支架的兔子进行高脂喂养,发现接受体外SOD治疗能够明显减少ISR的发生,这也表明细胞内氧化敏感信号通路在ISR中具有重要的病理生理作用。VEGFA参与了血管损伤后的内膜新生,是ISR的重要标志物之一[8]。CASP3是半胱氨酸蛋白酶家族的一种亚型,线粒体内的细胞色素在线粒体收到损伤时被动释放到细胞外,激活CASP3,诱导细胞凋亡。动物实验显示,CASP3能够抑制VSMC增殖,从而减少ISR的发生[9]。PTSG2也称为环加氧酶2,同时充当双加氧酶和过氧化物酶,在前列腺素合成中发挥关键作用,而前列腺素的合成与ISR发生有密切联系[10]。PPARγ属于配体激活的转录因子核受体家族成员,在脂肪细胞、骨骼肌、心脏、肾VSMC等细胞中广泛表达[11]。PPARγ能够抑制由AngⅡ、生长因子等激活的ERK和MAPK信号通道,减少炎症反应,减轻血管损伤,抑制VSMC异常增殖[12];同时,AngⅡ诱导的血管炎症反应可下调PPARγ表达,诱导其核输出信号和蛋白质损失。PPARγ的两种改变都伴随着PPARγ与DNA结合活性的降低,诱导PPARγ从细胞核到细胞质重新分布;同时相关炎症通道又增加PPARγ的多泛素化/蛋白酶活性,诱导PPARγ降解[13]。研究表明,PPARγ激动剂吡格列酮能够有效抑制VSMC增殖,减少ISR发生[14]。本研究的细胞学验证以PPARγ作为靶点,药理研究表明,木犀草苷、淫羊藿苷等黄酮类药物均能上调PPARγ表达,从而发挥抑制炎症的作用[15],同属黄酮类药物的葛根素也有可能发挥相似的作用。
VSMC具有收缩型和合成型两种主要表型,在正常生理条件下,VSMC主要是收缩表型,合成表型较少。在血管损伤、血流动力学改变、细胞炎症因子的刺激下,VSMC从收缩性表型转变为合成表型,促使VSMC异常增殖,迁移并增厚血管壁,最终导致动脉粥样硬化和内膜增生[16]。研究表明,AngⅡ能够促使血管由收缩型转换成合成型,同时AngⅡ激活丝裂原活化蛋白激酶(MAPK)等炎症信号通路,诱导体内炎症反应,促使VSMC异常增殖[17]。PPARγ能够作用于单核细胞,减少血管黏附分子分泌,减少细胞炎症反应,促进胆固醇逆向转运加强,阻止动脉粥样硬化形成;减少间质金属蛋白酶产生,降低纤溶酶激活物抑制剂和生长反应因子1含量,发挥抗动脉粥样硬化作用;由AngⅡ、生长因子、高血糖等激活的ERK和MAPK信号通路,减少炎症反应,减轻血管损伤,抑制VSMC异常增殖[12]。本研究结果显示,与空白对照组比较,AngⅡ组能够诱导VSMC增殖,激活相关炎症通路,促使细胞产生TNF-α、IL-6等炎症因子;与AngⅡ组比较,加入葛根素能够在24 h内有效抑制AngⅡ诱导的细胞增殖。这表明葛根素能够激活PPARγ表达,抑制相关炎症通路,减少炎症因子分泌,从而抑制VSMC异常增殖。
综上所述,本研究通过网络药理学及分子对接对葛根素-ISR靶点的筛选及计算发现葛根素是治疗ISR的潜在药物,预测葛根素可能通过PI3K/AKT等信号通路发挥降脂、抗炎、抑制VSMC增殖等途径来减少ISR的发生,其中可能涉及TNF、AKT1、SOD1、VEGFA、CASP3、PTGS2、PPARγ等相关靶点。细胞实验表明,葛根素能够抑制AngⅡ诱导的VSMC增殖,其机制可能是通过上调PPARγ、抑制下游炎症因子表达来发挥作用。这为葛根素用于临床治疗ISR提供了新的思路。

